毒死蜱对斑马鱼胚胎氧化应激效应研究
2016-04-20张家禹刘丽丽李国超余凯敏闫艳春中国农业科学院研究生院北京100081
张家禹,刘丽丽,李国超,余凯敏,吕 鹏,闫艳春(中国农业科学院研究生院,北京 100081)
毒死蜱对斑马鱼胚胎氧化应激效应研究
张家禹,刘丽丽,李国超,余凯敏,吕鹏,闫艳春*(中国农业科学院研究生院,北京 100081)
摘要:以斑马鱼为模型,研究了毒死蜱对斑马鱼胚胎形态学的影响,及其对胚胎的氧化应激和氧化损伤作用.将斑马鱼胚胎暴露在梯度浓度的毒死蜱溶液中96h后,发现毒死蜱会造成斑马鱼胚胎严重畸形甚至死亡,其96h半致死浓度为1.18mg/L.对氧化应激相关基因的表达及抗氧化酶活性和丙二醛(MDA)含量进行检测,结果表明,在毒死蜱胁迫下抗氧化酶(SOD、CAT)活性降低,并且其编码基因(Cu/Zn-sod、Mn-sod、cat)的表达受到抑制;但在低浓度毒死蜱胁迫下,抗氧化酶活性并没有受到显著影响,而抗氧化酶基因的表达对毒死蜱更加敏感.毒死蜱能引起gstp2的表达上调,但GST活性与gstp2的表达变化并不一致.处理组胚胎中nrf2表达上调,从而上调抗氧化蛋白和II相解毒酶基因的表达.毒死蜱胁迫下,基因ucp2、cox1表达下调,能够减少呼吸链ROS的产生.同时基因bcl2表达下调,表明凋亡的平衡受到破坏.毒死蜱处理组中MDA含量显著升高,说明毒死蜱能造成斑马鱼胚胎氧化损伤.
关键词:毒死蜱;斑马鱼胚胎;氧化应激;氧化损伤
* 责任作者, 教授, yanyanchun@caas.cn
毒死蜱是一种高效、广谱、中等毒性的有机磷类杀虫杀螨剂,对害虫具有触杀、胃毒和熏蒸作用.自从国家对高毒农药的禁限用政策出台后,毒死蜱作为主要替代品种之一,广泛应用于农业和城市害虫的防治[1-2].毒死蜱的大量使用对生态环境已产生了负面影响,研究显示可在多种水体中检测到其残留[3-4],在农作物种植区附近的水域中其残留量往往更高,水稻田出水中毒死蜱残留最高达26.07μg/L[5].毒死蜱对于多数水生生物属于高毒性物质,并且可以通过生物富集和生物放大作用对水体食物链产生影响,最终威胁人类的健康[6-7].
斑马鱼(Danio rerio)具有体型小、易于管理、产卵量大、早期胚胎便于观察等特点,已成为毒理学研究领域的模式生物[8-10].目前斑马鱼被广泛应用于发育毒理学、内分泌干扰和生殖毒理学、神经毒理学、纳米毒理学等毒理学研究中,成为揭示化学品对人类健康和环境的影响及其机制的重要模式生物,并促进了新技术和新分析方法的发展[11].
环境污染物能够破坏机体氧化与抗氧化之间的平衡,从而导致机体内活性氧(ROS)等自由基产生过多,细胞自身无法及时清除,并产生大量氧化中间产物,进而导致机体氧化损伤[12-15].机体内抗氧化系统包括酶促系统(CAT、SOD、GSH 等) 和非酶促系统(维生素类、生物碱类等)[16].已有研究报道,毒死蜱会引起鲤鱼肝脏损伤及抗氧化系统的异常[17].高剂量毒死蜱能诱导小鼠肺组织细胞的抗氧化能力下降,造成肺组织的病理损伤[18].毒死蜱对蚯蚓SOD和CAT活性具有显著抑制作用,同时会造成脂质过氧化[19].本研究通过对氧化应激相关基因的表达量及酶活性的检测,探究毒死蜱对斑马鱼胚胎的毒性作用机制.
1 材料与方法
1.1材料
AB品系斑马鱼购自国家斑马鱼资源中心(CZRC,China Zebrafish Resource Center).
毒死蜱(Chlorpyrifos,CPF)购自于成都化夏化学试剂有限公司,其纯度≥97%;谷胱甘肽—S转移酶(GST)测定试剂盒(比色法)、过氧化氢酶(CAT)测定试剂盒(可见光法)、丙二醛(MDA)测定试剂盒(TBA法)、总超氧化物歧化酶(T-SOD)测试盒(羟胺法)、总蛋白(TP)测定试剂盒(带标准:考马斯亮蓝法)购自南京建成生物研究所.反转录试剂盒 PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)(Takara);SYBR Premix Ex Taq II试剂盒(Takara).
1.2斑马鱼的养殖
AB品系野生型斑马鱼在独立养殖系统中进行养殖,自来水经过活性炭过滤,紫外灯灭菌,在系统中自动循环,水温控制在(28±0.5)℃,光周期14(光):10(暗).每天喂食2~3,食物为丰年虫幼虫.
胚胎收集方法.提前一个晚上将成年种鱼按照雌雄2:1的比例装入交配盒中,并用隔板将雌雄鱼分开,第2d早上光照开始时(10h后)将隔板抽出,半个小时后收集胚胎.挑选发育正常的0.5~ 1.0hpf(孵化后小时)的胚胎,随机分装于6孔塑料板中(10个胚胎/孔),每孔培养液体积为10mL.
1.3暴露方法
选用甲醇作为助溶剂.在处理液中,甲醇的浓度为0.025%.前期的研究表明,毒死蜱处理液中低浓度(<0.1%)的甲醇不会影响实验结果(数据未给出).设置6个毒死蜱暴露浓度,分别为0.25、0.50、0.75、1.00、1.25和1.50mg/L,每个浓度组中有20个胚胎,并设置3个生物学重复.6孔板的每个孔中加入10个发育正常的3hpf胚胎,加入10mL处理液.将胚胎置于恒温培养箱中,温度(28±0.5)℃,光周期14(光):10(暗).采用半静态的试验方法,暴露总时间为96h,每24h更换一次溶液,并及时挑出死卵.
1.4斑马鱼胚胎形态学观察
进行CPF暴露处理后,每24h对斑马鱼胚胎进行一次镜检观察.统计分析胚胎畸形率和死亡率,并计算96h半致死浓度(96h-LC50).
1.5氧化应激相关基因的表达分析
根据预试验设立3个CPF浓度组,分别是0.24、0.47、0.94mg/L (1/5LC50、2/5LC50、4/5LC50).毒死蜱暴露96h后,每个浓度的胚胎分别取20枚保存,各3份.收集胚胎,液氮速冻,-80℃保存.
使用TRIzol试剂提取总RNA,260nm下估算总RNA浓度,质量则通过260/280比率评估.使用1.2%琼脂糖凝胶电泳对RNA的质量进行进一步验证.
样品总RNA经反转录得到cDNA.各目标基因引物由上海生工公司合成(表1),经验证所有引物扩增效率均良好(90%~110%).qRT-PCR程序为:95℃ 30s、95℃ 5s、60℃ 45s、55℃ 10s.基因表达的差异倍数通过2-ΔΔCt方法计算.每个浓度组3个生物学重复.

表1 氧化应激相关基因和β-actin的引物Table 1 Primer sequences of antioxidant response-related genes and β-actin
1.6氧化应激相关生化指标检测
设立3个CPF浓度组,分别是0.24、0.47、0.94mg/L (1/5LC50、2/5LC50、4/5LC50),每个浓度组3个平行,每个平行60个胚胎.CPF暴露96h 后,收集胚胎,液氮速冻,-80℃保存.
5%组织匀浆液的制备.按照重量(g):体积(mL)=1:19的比例加入19倍生理盐水,首先使用超声破碎仪冰水浴破碎斑马鱼胚胎,离心取上清,得到5%组织匀浆液.
使用南京建成生物研究所酶活检测试剂盒,检测各项生化指标,包括总超氧化物歧化酶(T-SOD)活力、过氧化氢酶(CAT)活力、谷胱甘肽-S转移酶(GST)活力、丙二醛(MDA)含量和总蛋白(TP)含量.
1.7统计分析
使用SPSS20.0通过Levene检验方法检测数据的方差齐性,并进行one-way ANOVA数据分析.P<0.05作为统计显著性的标准,所有值表示方法均为平均值±标准误(SE).
2 结果与讨论
2.1结果

图1 毒死蜱暴露96h对胚胎的致畸作用Fig.1 Teratogenetic effect of CPF on embryos after a 96exposure

图2 毒死蜱暴露96h胚胎死亡率Fig.2 Effects of CPF on embryonic mortality after a 96exposure
2.1.1毒死蜱对斑马鱼胚胎发育影响本研究中,采用梯度浓度的毒死蜱(0.25、0.50、0.75、1.00、1.25和1.50mg/L)对斑马鱼胚胎进行处理. 在96h观察到的主要的幼鱼畸形包括心包水肿、尾部弯曲和卵黄囊畸形(图1b、c),并统计了这三种常见的畸形在毒死蜱0.25、0.50、0.75、1.00 和1.25mg/L处理组中的比例(图1d),1.5mg/L处理组胚胎死亡率过高,没有进行畸形率的统计.通过非线性曲线拟合得到毒死蜱96h半致死浓度为1.18mg/L (图2).
2.1.2毒死蜱对斑马鱼胚胎氧化应激相关基因的影响农药污染物可以改变机体抗氧化防御系统中相关基因的表达量,因此本研究选取斑马鱼的9个抗氧化相关基因作为参考,从转录水平揭示毒死蜱对斑马鱼胚胎氧化应激效应的发生机制.荧光定量PCR结果显示(图3),相对于空白对照组,0.24mg/L和0.47mg/L CPF处理组中基因Cu/Zn-sod表达显著下调(0.54、0.22倍),并且呈现剂量-效应关系(图3a).Mn-sod的表达量在高浓度CPF处理组中同样显著下调,并呈现剂量-效应关系(图3b).cat的表达在0.47mg/L和0.94mg/L CPF处理组中显著下调(0.51、0.12倍),并且呈现剂量-效应关系(图3c).gstp2表达在0.24mg/L和0.47mg/L CPF处理组中显著上调(1.58、1.88倍),但在最高浓度组与对照组相比并无显著差异,呈现倒“U”形的剂量-效应关系(图3d).在3个CPF处理组中,nrf2基因表达显著上调(6.18、7.72、11.55倍),并且呈现剂量-效应关系(图3e).keap1基因的表达在CPF处理组与对照组中无显著差异(图3f).ucp2的表达在0.47mg/L和0.94mg/L CPF处理组中显著下调(0.68、0.34倍),并且呈现剂量-效应关系(图3g).在0.47mg/L和0.94mg/L CPF处理组中,cox1显著下调(0.65、0.38倍),并且呈现剂量-效应关系(图3h).bcl2的表达在0.47mg/L和0.94mg/L CPF处理组中显著下调(0.7、0.31倍),并且呈现剂量-效应关系(图3i).
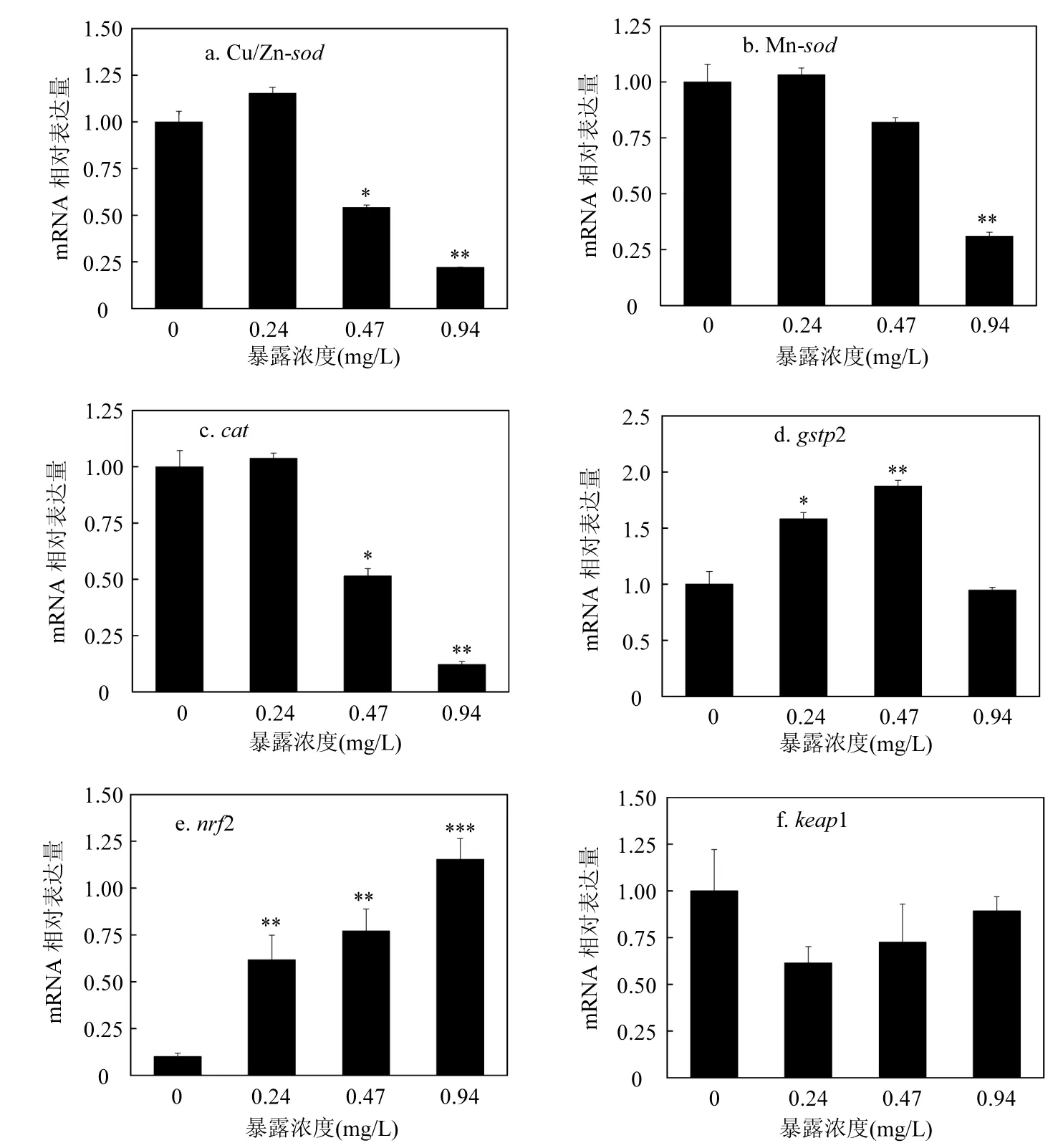

图3 毒死蜱对氧化应激相关基因mRNA表达量的影响Fig.3 Effects of CPF on relative mRNA levels of antioxidant response-related genes与对照相比,*P<0.05,**P<0.01,***P<0.001
2.1.3毒死蜱对氧化应激酶活性的影响农药污染物可以改变机体抗氧化防御系统中相关基因的表达量,进而改变机体内抗氧化酶的活性,同时也会造成脂质过氧化.由图4可见,经0.24、0.47、0.94mg/L CPF处理后,胚胎总SOD活力分别是对照组的102%、81.3%、71.8%,0.94mg/L CPF处理组总SOD活力与对照组相比显著降低,并呈现剂量-效应关系;处理组CAT活力分别是对照组的86.8%、76.7%、56.5%,CPF处理组CAT活力与对照组相比显著降低,并呈现剂量-效应关系;处理组GST活力分别是对照组的136.7%、140.1%、119.5%;0.24、0.47、0.94mg/L CPF处理组MDA含量分别是对照组的305.4%、461.9%、558.1%,3个处理组与对照组相比显著升高,并呈现剂量-效应关系.
2.2讨论
本研究中,采用梯度浓度的毒死蜱对斑马鱼胚胎进行处理,毒死蜱暴露96h后可以观察到,毒死蜱诱导胚胎产生了3种常见畸形心包水肿、尾部弯曲和卵黄囊畸形(图1b、图1c).经统计,3种畸形的畸形率的比例都随着处理浓度的提高而显著升高,呈现剂量-效应关系.由图1d可看出,高浓度毒死蜱对斑马鱼胚胎有严重的致畸作用.同时毒死蜱也会对胚胎产生致死作用,致死率随着处理浓度的提高而升高(图2).
本研究通过检测毒死蜱暴露96h斑马鱼胚胎抗氧化酶相关基因的表达及酶活力来研究毒死蜱对斑马鱼胚胎氧化应激的影响.SOD和CAT是抵御氧化损伤的第一道防线,其中Cu/Zn-sod 和Mn-sod是编码超氧化物歧化酶(SOD)的基因,SOD的主要功能是清除氧自由基生成 H2O2和O2[20-22].过氧化氢酶(CAT)能够清除体内产生的过多的H2O2,将其分解成O2和H2O,编码基因是cat[20].在本研究中,高浓度毒死蜱暴露96h能够下调Cu/Zn-sod、Mn-sod和cat的表达,并呈现剂量-效应关系(图3a、图3b、图3c),这说明高浓度的毒死蜱会诱导胚胎产生氧化应激,导致胚胎体内产生过多的ROS无法及时清除,抑制了这3个基因的表达.酶活检测的结果也显示,高浓度毒死蜱能够显著抑制SOD和CAT活力,并呈现剂量-效应关系(图4a、图4b).
谷胱甘肽S-转移酶(GST)具有Ⅱ相解毒酶和抗氧化酶的双重功能,能够保护机体免受环境污染物的损害,已被广泛用作检测环境污染物的生物指示物[23-26].在本研究中,毒死蜱能够提高GST活力(图4c),GST的编码基因gstp2的表达检测结果显示,低浓度毒死蜱能够显著上调的表达,表明毒死蜱诱导胚胎产生解毒反应,但最高浓度毒死蜱并没有显著诱导gstp2的表达(图3d),这可能是由于毒死蜱浓度过高,超过了胚胎的解毒能力,诱导机体产生过多的ROS,抑制了基因的表达.但在本研究中GST的活力在处理组与对照组中差异并不显著,说明其对CPF胁迫并不敏感,但基因gstp2却可作为CPF污染的潜在生物指示物.

图4 毒死蜱对抗氧化酶活性和MDA含量的影响Fig.4 Effects of CPF on antioxidant enzyme activities and MDA content与对照相比,*P<0.05,**P<0.01,***P<0.001
转录因子NF-E2相关因子(nrf2),是细胞氧化应激反应中的关键因子,受胞质接头蛋白(keap1)的调控,通过与抗氧化反应元件ARE相互作用,能够上调抗氧化蛋白和II相解毒酶的表达,keap1-nrf2/ARE通路是细胞抗氧化反应的中枢调节者[27-28].在毒死蜱胁迫下,斑马鱼胚胎体内nrf2表达量显著提高,同时keap1下调,能够诱导nrf2的积聚及活性增强(图3e、图3f),从而上调抗氧化蛋白和II相解毒酶(GST等)的表达,诱导斑马鱼胚胎产生抗氧化反应.
过量ROS可侵害生物膜中的不饱和脂肪酸,引起脂质过氧化反应.丙二醛是膜脂过氧化最重要的产物之一,它的高低间接反映了机体细胞受自由基攻击的程度[29].毒死蜱处理组胚胎MDA含量显著高于对照组,并呈现剂量-效应关系(图4d),说明毒死蜱诱导机体产生过多的ROS,引起脂质过氧化,侵害机体细胞,可能引起细胞凋亡.
cox1是细胞色素c氧化酶亚基I基因,细胞色素氧化酶是线粒体内呼吸链电子传递的终末复合物,是线粒体氧化能力的关键调节物质[30].毒死蜱能够显著下调其表达(图3h),对细胞色素c 氧化酶产生抑制作用,说明毒死蜱可以抑制呼吸链,能够减少ROS的产生和ATP的生成,同时电子传递和氧化磷酸化障碍能够引起细胞凋亡.ucp2是解偶联蛋白2的编码基因,解偶联蛋白2可以使氧化磷酸化过程解偶联,从而使ATP合成减少,这可导致细胞功能下降,降低机体对损伤的耐受性;同时也能抑制呼吸链ROS的产生.而在机体正常生理条件下,90% ROS来自线粒体呼吸链,因此可保护组织和细胞,避免产生过多ROS对机体造成损伤.所以它对机体的作用既有利也有弊[31].毒死蜱能够诱导ucp2显著下调(图3g),从而促进氧化磷酸化过程,有利于机体抵抗毒死蜱的氧化损伤作用.
bcl2编码蛋白主要功能是抑制细胞凋亡[32],在毒死蜱胁迫下,其表达量显著下调(图3i),由此可见,毒死蜱破坏了机体内细胞凋亡的平衡.正常的细胞凋亡可以清除体内受损或者已经完成特定使命的细胞,是对机体的保护.而在毒死蜱胁迫下,斑马鱼胚胎体内MDA显著上升,引起脂质过氧化,并且cox1下调,造成电子传递和氧化磷酸化障碍,在这些凋亡信号的刺激下,抑制凋亡基因bcl2的表达下调,凋亡平衡机制遭到破坏,可能会引起斑马鱼胚胎细胞凋亡过度,从而对胚胎造成损伤.
根据本研究结果,抗氧化酶SOD和CAT及抗氧化相关基因Cu/Zn-sod、Mn-sod、cat等都可成为CPF胁迫下斑马鱼胚胎氧化应激检测的潜在生物指示物.但是在低浓度CPF胁迫下, SOD、CAT和GST的活性差异并不显著.由此可见,在CPF胁迫下抗氧化酶活性及其相关基因的表达的改变并不完全一致,显然抗氧化相关基因的表达对CPF胁迫更加敏感.MDA作为氧化损伤的指示物,在本研究中其在斑马鱼胚胎中的含量受CPF浓度的影响,并具有浓度-效应关系.
3 结论
通过对毒死蜱胁迫下斑马鱼胚胎形态学的观察,以及氧化应激相关基因的表达和抗氧化酶含量的检测,发现较高浓度的毒死蜱对斑马鱼胚胎有严重致畸和致死作用,并且毒死蜱能够诱导斑马鱼胚胎产生氧化应激,诱导nrf2高表达,从而促进gstp2的表达.同时高浓度毒死蜱能够抑制部分抗氧化酶(SOD、CAT)的活性及其相关基因(Cu/Zn-sod、Mn-sod、cat)的表达,引起MDA含量升高,造成脂质过氧化.CPF也能够诱导呼吸链相关基因cox1、氧化磷酸化相关基因ucp2和抗凋亡基因bcl2表达显著下调.结果表明毒死蜱会诱导斑马鱼胚胎产生氧化应激,造成脂质过氧化,导致斑马鱼胚胎氧化损伤.
参考文献:
[1] 刘占山,黄安辉,肖明山.毒死蜱的研究应用现状及产业发展前景 [J]. 世界农药, 2009,31(S1):59-61.
[2] 汪家铭.毒死蜱市场竞争优势及发展建议 [J]. 化工科技市场, 2010,33(6):11-15.
[3] 徐迎春,王松松,徐建军,等.烟台市农村饮用水水源地农药残留监测分析 [J]. 现代预防医学, 2015,42(9):1704-1707.
[4] 吴长兴,赵学平,吴声敢,等.丘陵地区水稻田使用毒死蜱对水体的污染及其生态风险 [J]. 生态与农村环境学报, 2011,27(3): 108-112.
[5] 郭强,田慧,毛潇萱,等.珠江河口水域有机磷农药水生生态系统风险评价 [J]. 环境科学, 2014,35(3):1029-1034.
[6] Varó I, Serrano R, Pitarch E, et al. Navarro. Bioaccumulation of chlorpyrifos through an experimental food chain: study of protein HSP70as biomarker of sublethal stress in fish [J]. Archives of Environmental Contamination and Toxicology, 2002,42(2):229-235.
[7] Michiel A, Paul J Van den Brink, António J A. Impact of single and repeated applications of the insecticide chlorpyrifos on tropical freshwater plankton communities. Ecotoxicology, 2008, 17(8):756-771.
[8] 王佳佳,徐超,屠云杰,等.斑马鱼及其胚胎在毒理学中的实验研究与应用进展 [J]. 生态毒理学报, 2007,2(2):123-135.
[9] 端正花,陈晓欧,刘灵丽,等.苯并三唑和镉对斑马鱼肝脏的联合毒性效应 [J]. 中国环境科学, 2015,35(1):1872-1876.
[10] 林琎,王红艳,王开运,等.氟吡菌胺对斑马鱼的毒性效应 [J].中国环境科学, 2014,34(12):3230-3236.
[11] Bugel S M, Tanguay R L, Planchart A. Zebrafish: A marvel of high-throughput biology for 21st century toxicology [J]. Current Environmental Health Reports, 2014,1(4):341-352.
[12] Dong M, Zhu L S, Zhu S Y, et al. Toxic effects of 1-decyl-3-methylimidazolium bromide ionic liquid on the antioxidant enzyme system and DNA in zebrafish (Danio rerio) livers [J]. Chemosphere, 2013,91(8):1107-1112.
[13] 田文静,白伟,赵春禄,等.纳米ZnO对斑马鱼胚胎抗氧化酶系统的影响 [J]. 中国环境科学, 2010,30(5):705-709.
[14] Valavanidis A, Vlahogianni T, Dassenakis M, et al. Molecular biomarkers of oxidative stress in aquatic organisms in relation to toxic environmental pollutants [J]. Ecotoxicology andEnvironmental Safety, 2006,64(2):178-189.
[15] 黄权,苏琳.动物体内氧化应激与抗氧化剂应用研究进展[J]. 中国兽药杂志, 2013,47(5):66-69.
[16] 胡文琴,王恬,孟庆利.动物中活性氧的产生及清除机制 [J].家畜生态, 2004,25(3):64-67.
[17] 韩英,郝其睿,魏菁等.毒死蜱和阿特拉津对鲤肝脏的影响[J]. 东北农业大学学报, 2015,40(3):67-73.
[18] 焦铭,廖文莉,孙雪等.毒死蜱致小鼠肺细胞氧化损伤及维生素E的拮抗 [J]. 环境与健康杂志, 2014,31(2):134-136+189.
[19] 周世萍,段昌群,刘守庆,等.土壤中亚致死剂量毒死蜱对蚯蚓抗氧化防御系统酶活性的影响 [J]. 土壤学报, 2014,51(2):389-393.
[20] 张宝,周玫,陈瑗,等.细胞外超氧化物歧化酶(EcSOD) [J].医学综述, 2000,6(8):340-341.
[21] Jin Y X, Zheng S S, Pu Y, et al. Cypermethrin has the potential to induce hepatic oxidative stress, DNA damage and apoptosis in adult zebrafish (Danio rerio) [J]. Chemosphere, 2011,82(3):398-404.
[22] 赵飞,王摆,张晓娜,等.久效磷农药对金鱼肝细胞DNA的损伤及其机制研究 [J]. 中国环境科学, 2015,35(5):1563-1569.
[23] Matos P, Fontaı´nhas-Fernandesa A, Peixotoa F, et al. Biochemical and histological hepatic changes of Nile tilapia Oreochromis niloticus exposed to carbaryl [J]. Pesticide Biochemistry and Physiology, 2007,89(1):73-80.
[24] Glisic B, Mihaljevic I, Popovic M, et al. Characterization of glutathione-S-transferases in zebrafish (Danio rerio) [J]. Aquatic Toxicology, 2015,158:50-62.
[25] 雷安平,陈欢,黎双飞,等.谷胱甘肽S-转移酶的功能、应用及克隆表达 [J]. 环境科学与技术, 2009,32(12):85-91.
[26] Garner L V, Di Giulio R T. Glutathione transferase pi class 2 (GSTp2) protects against the cardiac deformities caused by exposure to PAHs but not PCB-126in zebrafish embryos [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2012,155(4):573-579.
[27] Wang L, Gallagher E P. Role of Nrf2 antioxidant defense in mitigating cadmium-induced oxidative stress in the olfactory system of zebrafish [J]. Toxicology and Applied Pharmacology, 2013,266(2):177-186.
[28] 李煌元.Keap1-Nrf2/ARE通路在分子毒理学中的研究进展 [J].国外医学(卫生学分册), 2006,33(3):129-135.
[29] 李红,王克跃,石修权.锌对镉所致大鼠肝脏脂质过氧化损伤的保护作用研究 [J]. 遵义医学院学报, 2004,27(4):322-323.
[30] 史华,张洪波,陈波.丹参对肾缺血再灌注损伤细胞色素C氧化酶活性的影响 [J]. 黑龙江医药科学, 2003,26(2):11-12.
[31] 贾晓丽.UCP2的研究进展 [J]. 赤峰学院学报(自然科学版), 2011,27(7):39-41.
[32] Yu K M, Li G C, Feng W M, et al. Chlorpyrifos is estrogenic and alters embryonic hatching, cell proliferation and apoptosis in zebrafish [J]. Chemico-Biological Interactions, 2015,239:26-33.
Oxidative stress effects of chlorpyrifos on zebrafish embryos.
ZHANG Jia-yu, LIU Li-li, LI Guo-chao, YU Kai-min, LV Peng, YAN Yan-chun*(Graduate School, Chinese Academy of Agricultural Sciences, Beijing 100081, China). China Environmental Science, 2016,36(3):927~934
Abstract:We elucidated the effects of chlorpyrifos exposure on the morphology, oxidative stress and oxidative damage in zebrafish (Danio rerio) embryos. After exposed to concentration gradient of chlorpyrifos solution for 96hours, the rates of deformities and death were dramatically higher than those in the control groups, and the median lethal concentration of CPF was calculated to be 1.18mg/L after a 96h exposure. The expression levels of oxidative stress-related genes, antioxidant enzyme activities and malondialdehyde (MDA) content were investigated. In CPF treatment groups, the antioxidant enzyme (SOD, CAT) activities and the expression levels of their encoding genes (Cu/Zn-sod, Mn-sod, cat) significantly decreased, compared with the control groups. At low concentrations of chlorpyrifos, antioxidant enzyme activities were not affected significantly, while the expression levels of their encoding genes were more sensitive to chlorpyrifos. Chlorpyrifos could induce the expression of nrf2, which played an important role in increased expression of a group of genes encoding antioxidant and phaseⅡdetoxification enzymes, but the kinetics of GST and gstp2 were not consistent with each other. The down-regulation of expression levels of ucp2 and cox1 made contributions to reducing ROS generated by the respiratory chain in CPF treatment groups. Meanwhile, in CPF treatment groups, the expression level of bcl2 was significantly down-regulated, suggesting that the balance of apoptosis was destroyed. MDA content was significantly higher in CPF treatment groups than that in control, indicating that chlorpyrifos could cause oxidative damage in zebrafish embryos.
Key words:chlorpyrifos;zebrafish embryo;oxidative stress;oxidative damage
作者简介:张家禹(1990-),男,辽宁大连人,硕士研究生,主要从事微生物分子生物学与基因工程研究.
基金项目:国家自然科学基金项目(31170119),中国农科科学院基础研究基金项目(0042014006,0042012003,0042011006)
收稿日期:2015-06-25
中图分类号:X171.5
文献标识码:A
文章编号:1000-6923(2016)03-0927-08
