人自身抗原52-kDRo/SSA,rRNP,Jo-1,SmD1,Scl-70,SSB-La的原核表达及纯化鉴定
2016-04-20吴淡娟李海侠裘宇容
李 欣,吴淡娟,李海侠,褚 帅,康 霞,裘宇容
(南方医科大学南方医院 检验科,广东 广州510515)
人自身抗原52-kDRo/SSA,rRNP,Jo-1,SmD1,Scl-70,SSB-La的原核表达及纯化鉴定
李欣※,吴淡娟※,李海侠,褚帅,康霞,裘宇容*
(南方医科大学南方医院 检验科,广东 广州510515)
摘要:目的制备重组人自身抗原52-kDRo/SSA,rRNP,Jo-1,SmD1,Scl-70以及SSB-La,为建立自制抗核抗体荧光免疫层析快速检测试剂盒奠定基础。 方法在NCBI上查询人52-kDRo/SSA,rRNP,Jo-1,SmD1,Scl-70,SSB-La的碱基序列和氨基酸序列,运用软件预测抗原表位,选择抗原表位并对密码子进行偏嗜性改造,采用人工合成方法合成抗原表位序列并插入至原核表达载体pET30a中。将重组质粒导入大肠杆菌BL21经IPTG诱导表达,表达的重组蛋白用镍离子亲和层析柱纯化,用荧光免疫法测定重组蛋白活性。 结果重组人自身抗原SSB-La是可溶性表达,52-kDRo/SSA,rRNP,Jo-1,SmD1以及Scl-70是包涵体形式表达;纯化产物经荧光免疫法测定活性,结果显示:SSB-La,Scl-70 以及Jo-1具有较高的抗原活性,52-kDRo/SSA,rRNP以及SmD1抗原活性较弱。 结论成功制备了重组人自身抗原52-KDRoSSA,rRNP,Jo-1,SmD1,Scl-70以及SSB-La,为下一步研究开发自制抗核抗体荧光免疫层析快速检测试剂盒奠定了基础。
关键词:重组人自身抗原;抗核抗体;抗原表位;荧光免疫法
(ChinJLabDiagn,2016,20:0364)
自身免疫性疾病(Autoimmune Diseases,AID)是泛指机体免疫效应细胞或免疫效应分子,针对自身组织或细胞出现异常免疫应答反应,导致组织损坏或功能障碍的疾病,是一类发病率高、致残率高、致死率高,可侵袭全身系统,严重危害人类健康的疾病。AID 疾病的种类很多,比如系统性红斑狼疮(SLE),类风湿性关节炎(RA),干燥综合征(SS),硬皮病等,这类疾病特点之一便是病人血液中存在高效价的自身抗体。
抗核抗体(antinuclear antibody,ANA)是一组将自身真核细胞的各种细胞成分为靶抗原的自身抗体总称。ANA在大多数AID疾病中呈阳性,系统性红斑狼疮患者的ANA的阳性率约为90%-100%,干燥综合征患者阳性率约为60%-80%,类风湿性关节炎患者的ANA阳性率为30%-50%。ANA在AID疾病出现明显临床症状之前就可存在,且病情稳定后其滴度逐渐下降,因此ANA检测对于AID疾病的早期筛查,诊断以及治疗效果的观察和指导临床用药等方面具有重要意义,是临床上一项极其重要的AID筛查试验。结合临床表现,ANA阳性可疑者进一步检测明确抗体类型,如抗U1RNP抗体是混合性结缔组织病的标志性抗体[1],抗Sm抗体是系统性红斑狼疮的标志性抗体[2],而抗SS-A(Ro)抗体和抗SS-B(La)抗体则多出现于干燥综合征患者等。
目前常用的检测ANA方法主要有两种:间接免疫荧光法(IIF)和ELISA法。IIF法一直是临床常规的筛选试验方法,该方法检测灵敏度高。EILSA法,可进行半定量检测,临床经常根据其浓度的变化判定病人的好转与否,从而制定下一步的治疗方案。但IIF法和EILSA法,均存在出报告时间长,耽误病人即时就医,从而影响疾病诊治情况。针对上述临床存在问题,本课题在当今检验医学发展提出的POCT(Point Of Care Testing),即即时检验新领域背景下,致力于开发一种新的检测试剂即荧光免疫层析快速检测试剂盒,使用小型荧光免疫分析仪进行检测,花费时间在15 分钟左右,因此简单、便捷,标本即到即检,既能解决病人等待时间长之问题,又能解决临床医生执行自身免疫性疾病临床诊断的路径问题,可以在临床推广使用,以提高自身免疫疾病的诊治水平。
ANA荧光免疫层析快速检测试剂盒需要利用人自身抗原作为检测底物来完成检测过程,为大量获得人自身抗原,本文采用基因工程方法,利用原核表达系统,制备临床常见的人自身抗原52-kDRo/SSA,rRNP,Jo-1,SmD1,Scl-70以及SSB-La。
1材料和方法
1.1材料
大肠杆菌BL21(DE3)本实验室保存,电泳仪购自北京六一仪器厂,扫描仪购自上海中晶科技有限公司,高速冷冻离心机购自日本HITACHI公司,多功能微孔板荧光检测仪Infinite F200购自瑞士TECAN公司。
1.2方法
1.2.1抗原表位的选择以及重组表达质粒的构建
抗原表位的选择:
1)从NCBI上查询出人自身抗原52-kDRo/SSA,rRNP,Jo-1,SmD1,Scl-70以及SSB-La的碱基序列和氨基酸序列。
2)通过ABCpred Prediction Server,BcePred Prediction Server,BepiPred 1.0b Server,DNASTAR等软件对上述六个人自身抗原的抗原表位进行综合预测分析
3)结合有关文献[3-9],选择抗原性较好的表位肽,并将表位肽集中区域的氨基酸序列截取出来拼接成一条多肽链,总共构成了六条多肽链即每个人自身抗原一条多肽链。
4)结合抗原表位多肽链的分子量以及等电点情况,将分子量较小且等电点接近的两条多肽链52-kDRo/SSA和rRNP,Jo-1和SmD1拼接成一条多肽链。总共形成了四条多肽链:52-kDRo/SSA +rRNP,Jo-1+SmD1,Scl-70以及SSB-La。
重组表达质粒的构建:
从人自身抗原的碱基序列中找出上述四条多肽链对应的碱基编码序列,对密码子进行偏嗜性改造,用人工合成方法合成基因片段,之后连入pET30a载体,构建了四个重组表达质粒:pET30a-52-kDRo/SSA +rRNP,pET30a- Jo-1+SmD1,pET30a- Scl-70以及pET30a-SSB-La。
1.2.2重组自身抗原的诱导表达
将重组表达质粒导入大肠杆菌BL21感受态细胞,挑选阳性转化子接种于LB液体培养基(含卡那霉素)中,37℃培养过夜。次日按1∶100接种于300 ml新鲜的同种培养基中,37℃摇床培养至A600为0.5-0.6时,将菌液冰浴0.5 h,然后加入IPTG至终浓度为1 mmol/L,同时设不加IPTG的阴性对照,20℃过夜诱导表达。4℃,12 000 g离心收集菌体细胞,置于冰浴中超声破碎,破碎完全后,取细胞破碎液,沉淀以及上清进行15%的SDS-PAGE。
1.2.3重组自身抗原的纯化
将诱导表达后的菌体细胞用适量缓冲液重悬,细胞置于冰浴中超声破碎,破碎完全后,4℃,12 000 g离心收集上清,将上清通过镍离子亲和层析柱提纯,步骤具体如下:
1)向层析柱中加入3倍柱体积的0.1 mol/L NiCl2溶液,滴净后加入5倍柱体积双蒸水冲洗,再加入5倍柱体积缓冲液平衡镍离子亲和层析柱。
2)将收集的上清加入到亲和层析柱中,待上清滴净后再加入5倍柱体积的缓冲液,然后加入含50 mmol/L咪唑的缓冲液洗脱未结合的杂蛋白至洗脱干净,再用含500 mmol/L咪唑的缓冲液洗脱收集,得到提纯的目的蛋白。
3)将提纯的目的蛋白溶液装入透析袋中,用夹子夹紧透析袋两端后放入透析液中,4℃透析8-10 h,中间更换新鲜透析液3-4次。透析完毕后,4℃,12 000 g离心30 min,获得透析后的蛋白溶液,备用。
1.2.4重组自身抗原的活性检测
获得提纯的重组自身抗原后,用荧光免疫技术检测其抗原活性,步骤具体如下:
1)用荧光微孔板包被抗原
每孔加入100 μL抗原溶液,并设置空白对照(包被PBS缓冲液)和阳性对照(包被质控抗体),在4℃条件下过夜吸附。吸附结束后倒去孔内液体并甩干,然后用PBST缓冲液清洗4次。
2)封闭
每孔加入200 μl封闭液,在37℃条件下孵育2 h,倒去孔内液体并甩干,然后用PBST缓冲液清洗4次。
3)孵一抗
每孔加入100 μl质控抗体,在37℃条件下孵育1.5 h,倒去孔内液体并甩干,用PBST缓冲液清洗4次。
4)加二抗
每孔加入100 μl生物素标记的鼠抗人IgG,在37℃条件下孵育1.5 h,倒去孔内液体并甩干,用PBST缓冲液清洗4次。
5)加荧光蛋白
每孔加入 100 μl荧光蛋白(CSAPEB)溶液,在37℃条件下孵育1.5 h,倒去孔内液体并甩干,用PBST缓冲液清洗4次。
6)测定结果
每孔加入100 μl PBS缓冲液,将荧光微孔板置于多功能微孔板荧光检测仪内,以540 nm波长光源激发,在590 nm滤镜下检测荧光,同时测量荧光微孔板的背景值。
2结果
2.1重组表达质粒DNA序列测定
DNA序列测定结果表明重组表达质粒中所含的目的基因片段同我们所选择的抗原表位序列(优化后序列)一致,证明目的基因片段已经成功插入到表达质粒中。
2.2表达产物的鉴定
表达的重组自身抗原进行15%SDS-PAGE分析:从图1A可知,在相对分子质量约为45 KD处出现了目的条带,大小与52-kDRo/SSA +rRNP相符,重组蛋白以包涵体形式表达,上清无表达;从图1B可知,在相对分子质量约为35KD处出现了目的条带,大小与Jo-1+SmD1相符,重组蛋白以包涵体形式表达,上清无表达;从图1C可知,在相对分子质量约为55 KD处出现了目的条带,大小与Scl-70相符,重组蛋白以包涵体形式表达,上清无表达;从图1D可知,在相对分子质量约为40 KD处出现了目的条带,大小与SSB-La相符,重组蛋白以可溶性和包涵体两种形式表达,上清和沉淀中均有重组蛋白出现。
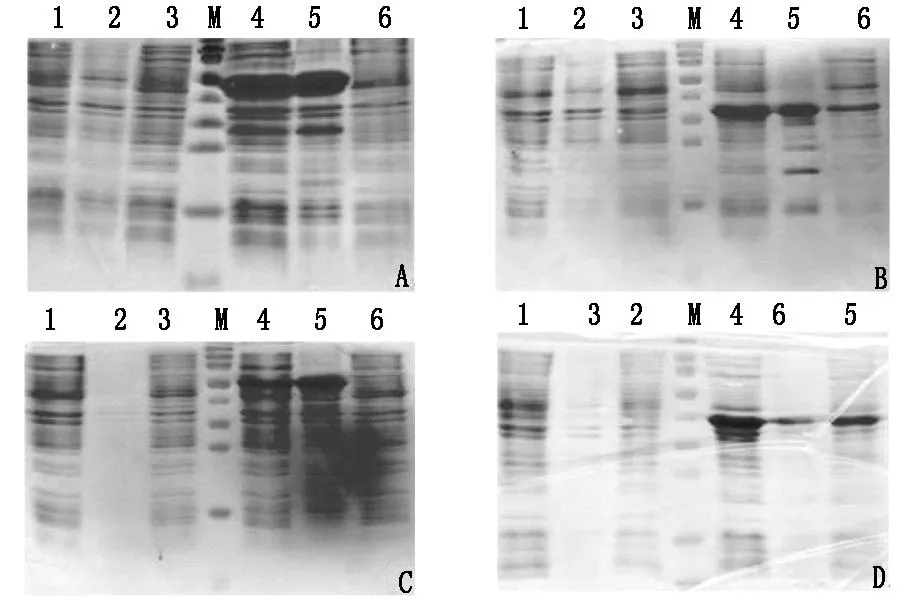
A:52-kDRo/SSA +rRNP,B:Jo-1+SmD1,C:Scl-70,D:SSB-La,1:不诱导的细胞破碎液,2:不诱导的细胞破碎后沉淀,3:不诱导的细胞破碎后上清,4:IPTG诱导的细胞破碎液,5:IPTG诱导的细胞破碎后沉淀,6:IPTG诱导的细胞破碎后上清,M:蛋白Marker,从上到下的大小依次为130 KD,95 KD,72 KD,55 KD,43 KD,34 KD,26 KD,17 KD,10 KD
图1重组自身抗原表达产物的鉴定
2.3纯化产物的鉴定
重组自身抗原52-kDRo/SSA +rRNP,Jo-1+SmD1以及Scl-70由于是包涵体形式表达,所以采用包涵体变性方式通过镍离子亲和层析柱纯化,然后透析复性。重组自身抗原SSB-La由于能够以可溶性方式存于上清液中,则直接用上清液通过镍离子亲和层析柱纯化。
纯化的重组自身抗原进行15%SDS-PAGE分析:从图2 A,B,C可知,采用包涵体变性纯化方式,提纯到了目的蛋白52-kDRo/SSA +rRNP,Jo-1+SmD1和Scl-70;从图2D可知,可溶性的SSB-La用上清液直接纯化同样提纯到了目的蛋白。
2.4重组自身抗原活性的鉴定
将提纯的重组自身抗原利用荧光免疫法检测活性,SSB-La浓度为0.5 mg/ml,Scl-70浓度为0.5 mg/ml,Jo-1+SmD1浓度为1.0 mg/ml,52-kDRo/SSA +rRNP浓度为1.0 mg/ml。检测结果如表1所示:重组自身抗原SSB-La,Scl-70以及Jo-1具有较高的抗原活性,SmD1,52-kDRo/SSA以及rRNP抗原活性较弱。
3讨论
ANA检测作为自身免疫性疾病的筛选检测项目一直是临床上的首选项目,其阳性为判断AID疾病可能性提供了重要的支持性证据。
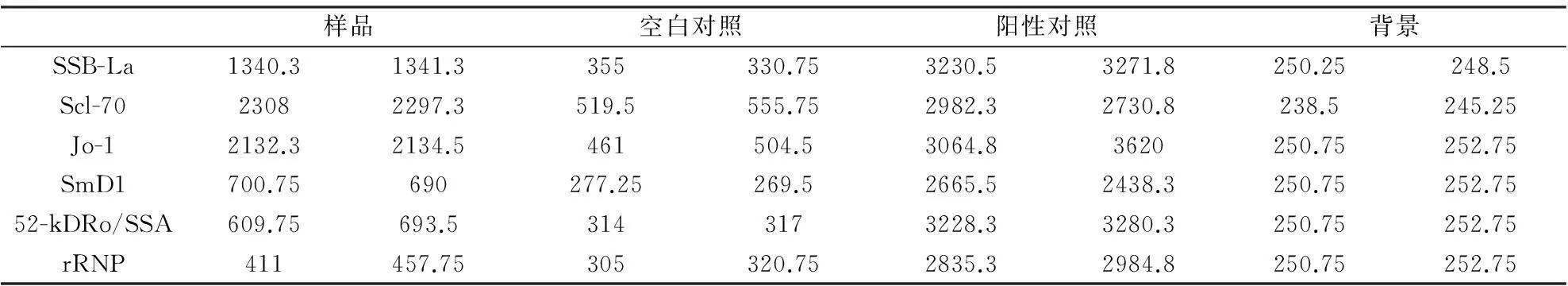
表1 重组自身抗原荧光免疫检测结果
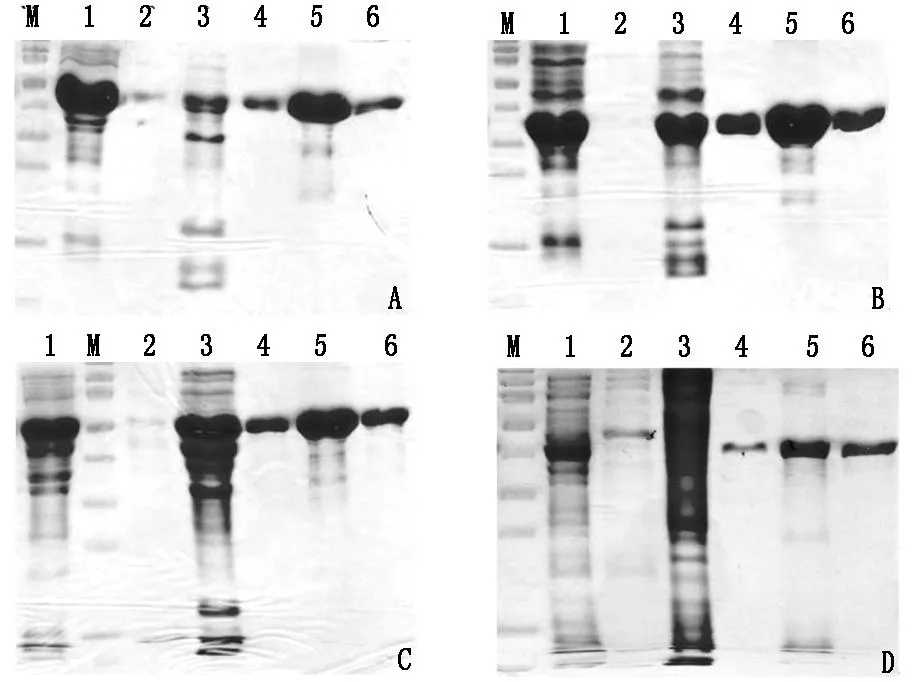
A:52-kDRo/SSA +rRNP,B:Jo-1+SmD1,C:Scl-70,D:SSB-La
1:上清,2:用缓冲液洗脱一倍柱体积后的收集液,3:用50 mM咪唑洗脱一倍柱体积后的收集液,4:用500 mM咪唑洗脱,收集的纯化样品a,5:用500 mM咪唑洗脱,收集的纯化样品b,6:用500 mM咪唑洗脱,收集的纯化样品c,M:蛋白Marker,从上到下大小依次为130 KD,95 KD,72 KD,55 KD,43 KD,34 KD,26 KD,17 KD,10 KD
图2重组自身抗原纯化产物的鉴定
自1957年首次应用IIF检测ANA以来,许多研究者对ANA检测方法进行大量的研究。目前国际上通常采用Hep-2细胞作为ANA检测底物(因为它具有广泛的抗原),作为间接免疫荧光法的抗原底物,进行ANA筛查。国外应用间接免疫荧光法检测ANA的试剂厂家主要是来自德国欧盟(EUROIMMUN)公司,美国科医(SCIMEDX)公司;以酶联免疫法检测ANA 的试剂盒有来自德国(HUMAN)IMTEC公司,美国SCIMEDX公司,西班牙BioSystems公司,美国Calibiotech公司,美国Cusabio公司等。目前国内医院大多采用的是进口试剂盒进行ANA筛查实验,但是价格昂贵,使用成本较高。国内研究者针对该项目也开发了相应的诊断试剂盒,例如北京和杰创新公司已成功研制出了利用间接免疫荧光法检测ANA的试剂盒,并已在临床上使用,深圳市安群生物工程有限公司也已开发出应用酶联免疫法定量检测ANA的试剂盒,上海信然生物技术有限公司以及福建蓝天波海有限公司则利用胶体金法定性检测ANA等。国产试剂盒虽然有价格上的优势,但是产品稳定性差,灵敏度低,因而临床的使用率很低。
我们研发的ANA荧光免疫层析快速检测试剂盒,首次将荧光法与免疫层析相结合,利用荧光免疫分析仪进行检测。不仅检测方法操作简便、快速,若制备开发出标准品还可进行定量检测。此外,荧光蛋白与链霉亲和素-生物素放大系统的结合应用使得该试剂盒稳定性好,灵敏度高。检测方法的成本相较国外试剂也低,有望在临床上得到广泛应用。
研发ANA荧光免疫层析快速检测试剂盒的 第一要务是获得高纯度的人自身抗原,利用基因重组技术是实现这一目的的有效手段,本文利用原核表达系统,成功表达了人自身抗原52抗抗原活性很好,足以满足ANA荧光免疫层析快速检测试剂盒的需要。而52-kDRo/SSA,rRNP,SmD1抗原活性相对较弱,还需要进一步提高其活性,抗原活性的强弱可能同重组自身抗原的可溶性,抗原的表位选择,以及蛋白表达系统有关,下一步准备通过实验来一一验证,力求获得高活性的重组自身抗原,为开发ANA荧光免疫层析快速检测试剂盒奠定坚实的基础。
参考文献:
[1]陈虹,郑捷.RNP抗原及其抗体[J].临床皮肤科杂志,2002,31(6):397.
[2]Gray W,Zieve,Permanan R,Khusial.The anti-Sm immune response in autoimmunity and cell biology[J].Autoimmunity Reviews,2003,235.
[3]邓安梅,仲人前,陈孙孝,等.自身抗原SSA/RoKD抗原优势表位分析[J].基础医学与临床,2000,26(5):46.
[4]Dorner T,Feist E,Wagenmann A,et al.Anti-52KDa Ro(SSA) autoantibodies in different autoimmune diseases preferentially recognize epitopes on the central region of the antigen[J].J Rheumatol,1996,23(3):462.
[5]Ricchiuti V,Briand JP,Meyer O,et al.Epitpoe mapping with synthetic peptides of 52KD SSA/Ro protein reveals heterogeneous antibody profiles in human autoimmune sera[J].Clin Exp Immunol,1994,95:397.
[6]James JA,Marnula MJ,Harley JB.Sequential autoantigenic determinants of the small nuclear ribonucleoprotein SmD shared by human lupus autoantibodies and MRL 1pr/1pr antibodies[J].Clin Exp Immunol,1994,98:419.
[7]Rivkin E,Vella MJ,Lahita RG.A heterogeneous immune response to an SmD-like epitope by systemic lupus erythematosus patients[J].J Autoimmune,1994,7:119.
[8]Kato T,Yamamoto K,Takeuchi H,et al.Identification of a universal B cell epitope on DNA topoisomerase I,an autoantigen associated with scleroderma[J].Arthritis Rheum,1993,36:1580.
[9]Kuwana M,Kaburaki J,Medsger TA,et al.An immunodominant epitope on DNA topoisomerase I is conformantional in nature:heterogeneity in its recognition by systemic sclerosis sera[J].Arthritis Rheum,1999,42:1179.
Prokaryotic expression and purification identification of human auto-antigen 52-kDRo/SSA,rRNP,Jo-1,SmD1,Scl-70,SSB-La
LIXin,WUDan-juan,LIHai-xia,etal.
(DepartmentofClinicalLaboratory,TheSouthHospitalofSoutherMedicalUniversity,Guangzhou510515,China)
Abstract:ObjectiveTo obtain recombinant human autoantigen 52-kDRo/SSA,rRNP,Jo-1,SmD1,Scl-70 and SSB-La,for the preparation of antinuclear antibody immunofluorescence chromatography rapid detection kit.MethodsNucleotide and amino acid sequences of 52-kDRo/SSA,rRNP,Jo-1,SmD1,Scl-70 and SSB-La were found on NCBI.After codon optimization,the epitope sequences selected by using epitope prediction software were linked into prokaryotic expression vector pET-30a to get recombinant vectors which then were transformed into BL21.The recombinant proteins were got by IPTG induction.After nickel column purification,Recombinant protein activity was measured by fluorescence immunoassay assay.ResultsSSB-La is a soluble protein,the others are insoluble proteins.Fluorescence immunoassay assay results show:SSB-La,Jo-1 and Scl-70 have high activity,but the activity of 52-kDRo/SSA,rRNP,Jo-1 and SmD1 is low.ConclusionRecombinant human autoantigen 52-kDRo/SSA,rRNP,Jo-1,SmD1,Scl-70 and SSB-La are successfully obtained in this study,which lays the foundation for ntinuclear antibody immunofluorescence chromatography rapid detection kit.
Key words:ecombinant human autoantigen;antinuclear antibody;epitope;fluorescence immunoassay assay
(收稿日期:2015-08-06)
作者简介:李欣,30岁,女,硕士,初级技师,主要从事自身抗体检测在临床上的应用方面的研究。
文献标识码:A
中图分类号:R392.11
文章编号:1007-4287(2016)03-0364-05
*通讯作者;※并列第一作者
基金项目:广东省教育部产学研结合项目(2012B091100461)
