可再生型有机胺脱除SO2的实验研究
2016-04-19徐宏建金吉钊孙雅萍王美霞潘卫国
徐宏建, 金吉钊, 孙雅萍, 王美霞, 潘卫国
(1. 上海电力学院 环境与化学工程学院, 上海 200090; 2. 华能山东石岛湾核电有限
公司运行部, 山东荣成 264300; 3. 上海发电环保工程技术研究中心, 上海 200090)
可再生型有机胺脱除SO2的实验研究
徐宏建1,3,金吉钊1,孙雅萍2,王美霞1,潘卫国3
(1. 上海电力学院 环境与化学工程学院, 上海 200090; 2. 华能山东石岛湾核电有限
公司运行部, 山东荣成 264300; 3. 上海发电环保工程技术研究中心, 上海 200090)
摘要:采用静态鼓泡吸收法,对4种有机胺吸收模拟烟气中SO2的脱硫性能进行了实验研究,并采用油浴加热装置,对4种有机胺的解吸性能进行了研究.结果表明:有机胺溶液脱硫效率随时间变化逐渐降低,不同有机胺吸收性能排序依次为哌嗪>乙二胺>DEA>MDEA;在相同解吸温度下,解吸率随反应进行逐渐升高;不同有机胺解吸性能优劣排序为MDEA>乙二胺>DEA>哌嗪;通过热力学参数计算得到MDEA吸收SO2的吉布斯自由能比石灰石吸收SO2的吉布斯自由能更小,说明MDEA吸收SO2的能力比石灰石更好,理论上是一种更合适的脱硫剂.
关键词:有机胺; 烟气脱硫; 解吸; 热力学
为了保护环境,减少SO2的排放,石灰石石膏法脱硫是目前最为成熟的电厂烟气脱硫工艺,但该工艺吸收剂原料消耗大,运行费用高,脱硫副产品利用率低,存在设备易积垢、堵塞、腐蚀和磨损等缺点[1].因此,寻求性能更优越的脱硫剂替代品成为研究热点.与传统石灰石石膏法脱硫技术相比,有机胺脱硫技术可再生使用脱硫剂,回收高浓度SO2,且脱硫效率高,不产生二次污染,从环保和经济角度考虑都具有广泛的应用前景[2-3].
国内外学者针对有机胺脱硫的合适条件及相关动力学特征展开研究.Zahiri等[4]进行了有机胺吸收液选择性吸收混合烟气中SO2的实验,研究了脱硫率随pH、液气比和进口SO2浓度的变化规律,确定了合适的反应条件;Tailor等[5]研究发现,N,N-二甲基丙胺对SO2有着很好的吸收和解吸效果,且多次吸收和解吸之后性能仍然不变;Oh等[6]研究了1,8-二氨基-对-薄荷烷(DAM)对SO2的吸收动力学特征,测得其反应速率,发现该反应为瞬时反应,且在气液相界面上,气体的摩尔通量受溶解度和增强因子的影响.在工业上,加拿大联合碳化公司已进行了Cansolv系统脱除SO2的技术开发[7],并将该技术运用于部分火力发电厂的SO2脱硫系统中,取得了良好的效果[8].
笔者采用静态鼓泡吸收实验装置,针对不同有机胺吸收SO2的亚硫酸根浓度c(SO32-)、pH缓冲性能、吸收速率、脱硫效率和解吸效率等指标进行模拟研究,并结合解吸性能实验对有机胺脱硫剂进行综合评价.
1实验部分
1.1有机胺脱硫原理[9]
在液相中,SO2会发生以下反应:
(1)
(2)
此时溶液中的有机胺可与SO2反应,使SO2在溶液中的溶解量增大,反应如下:
(3)
二元胺反应如下:
R1R2N—R3—NR4R5+2SO2+2H2O←→
(4)
对吸收液采用油浴控温的方式加热再生,可使反应式(3)和式(4)向逆方向进行,有机胺吸收剂从富液变回贫液,并得到高浓度的SO2气体.
1.2实验装置与流程
1.2.1有机胺脱除SO2的吸收实验装置
有机胺脱除SO2的吸收实验装置如图1所示.SO2的吸收流程为:将100 mL已配好的0.005 mol/L的吸收液放入水浴锅内,待温度保持在50 ℃时,将模拟烟气(SO2、N2混合气)通入到吸收液中.模拟烟气的体积流量为0.2 L/min,间隔一定时间,使用气相色谱法测量出口烟气中的SO2浓度,计算吸收率.

1-减压阀; 2-质量流量计; 3-鼓泡吸收器; 4-三通阀; 5-气相色谱仪; 6-气体干燥瓶; 7-尾气吸收瓶.
图1吸收实验装置
Fig.1Experimental setup for the absorption test
1.2.2有机胺脱除SO2的解吸实验装置
图2为有机胺脱除SO2的解吸实验装置.SO2的解吸流程为:将有机胺富液转移到烧瓶内,通过油浴锅控制温度.解吸过程中从溶液蒸发出的水蒸气经过球形冷凝管时被冷却成水滴,流回烧瓶内,解吸出的SO2被尾气吸收瓶吸收,每隔几分钟,采用碘量法测定溶液中的c(SO32-),算得解吸率.

1-三口圆底烧瓶; 2-冷凝管; 3-油浴锅; 4-尾气吸收瓶.
1.2.3气相色谱仪的使用
尾气中SO2浓度的分析可以采用气相色谱仪检测,其型号为岛津GC-2014,色谱柱为毛细管聚硅酮色谱柱,N2作为载气,柱温控制在170 ℃,检测器是氢火焰离子化检测器,测定样品峰高通过外标法进行定量,最小检测限为1×10-6.
1.2.4溶液中SO42-浓度的测定
溶液中的SO42-浓度采用戴安公司的ICS-90型离子色谱仪(DIONEX)进行检测,其色谱工作站为Chrmeleon 6.5色谱工作站,抑制器为MMSⅢ型,色谱柱为分析柱AS14A,检测器为DS5型电导检测器.色谱中淋洗液体积流量为1.2 mL/min,进样体积为10 μL,背景电导为20~24 μS,检测限为0.1~200 mg/L.
1.3吸收和解吸评价指标
吸收和解吸评价主要有以下4个指标.
(1) 使用碘量法测定c(SO32-),按下式计算:
(5)
式中:V1为蒸馏水消耗的硫代硫酸钠标准溶液量,mL;V2为试样消耗的硫代硫酸钠标准溶液量,mL;c(S2O32-)为滴定所用硫代硫酸钠溶液浓度,mol/L;V(SO32-)为滴定所取试样体积,mL.
根据离子色谱测得溶液中SO42-浓度.
(2) 吸收率NA的计算公式如下:
(6)
式中:NA为单位时间单位溶剂体积吸收气相中SO2的量,mol/(m3·s);p为烟气压力,Pa;V为气体体积流量,m3/s;R为理想气体常数,8.314 J/(mol·K);T为烟气温度,K ;φ1为进口气体中的SO2体积分数;φ0为出口气体中SO2体积分数;V吸收液为吸收液体积,L.
(3) 出口尾气中SO2的含量用气相色谱仪测定,按下式计算脱硫率ηa:
(7)
(4) 液相中的SO2浓度使用碘量法测定,按下式计算解吸率ηd:
(8)
式中:c(SO32-)0为解吸前溶液中的亚硫酸根浓度,mol/L;c(SO32-)1为解吸后溶液中的亚硫酸根浓度,mol/L.
2结果与讨论
2.1不同浓度二乙醇胺(DEA)的脱硫性能比较
反应条件如下:模拟烟气量为0.2 L/min,φ(SO2)为0.1%,N2作为平衡气,吸收温度为50 ℃.探讨不同浓度DEA对SO2的吸收性能.
2.1.1不同浓度DEA溶液pH随吸收时间的变化
图3给出了不同浓度DEA溶液pH随吸收时间t的变化规律.从图3可以看出,不同浓度DEA溶液的pH值都是随吸收时间的增加而下降的,在浓度为0.002 mol/L和0.005 mol/L时,pH值随吸收时间增加呈现逐阶段下降趋势,初始反应时pH值下降较快,吸收后期趋于平缓.其原因是在反应开始阶段,吸收液中水解的OH-被SO2消耗造成pH值急剧下降;反应一段时间后,溶液中的DEA被消耗殆尽,无法水解产生OH-与SO2反应,SO2的吸收得到抑制,溶液pH值下降趋缓.当DEA浓度为0.010 mol/L时,反应初期pH值下降缓慢,70 min后迅速下降,之后下降趋势又变得缓慢.当DEA浓度为0.020 mol/L时,pH值下降缓慢.对比4条曲线可知,DEA溶液的浓度越高,pH曲线变化越为平缓,这是因为DEA溶液的浓度越高,水解产生的OH-量较多,就能越快补充被SO2消耗的有效活性组分,缓冲性能越好.

图3 不同浓度DEA溶液pH随吸收时间的变化
Fig.3pH values of DEA of different concentrations vs. absorption time
2.1.2不同浓度DEA溶液中c(SO32-)和c(SO42-)随吸收时间的变化
从文献[10]可知,高浓度的DEA溶液有着更好的吸收效果.图4中,观察c(SO32-)随吸收时间变化的4条曲线可以发现,在进行吸收反应的初始阶段,在0.002~0.020 mol/L浓度范围,c(SO32-)变化不大,这说明在这段时间内,DEA溶液对SO2的吸收率是相近的.随着反应的进行,浓度较高(≥0.010 mol/L)的DEA溶液能持续吸收,吸收容量呈线性增加.而当DEA浓度<0.010 mol/L时,反应40 min后,c(SO32-)的增长趋于平缓,表明低浓度DEA溶液吸收容量有限.
吸收反应过程中,SO2被吸收后在溶液中生成SO32-,其中少量SO32-被溶液中的余氧氧化成SO42-.从图4可以看出,溶液中的SO42-浓度大致随吸收时间的增加呈上升趋势,但90 min内上升趋势不大.这是因为随着吸收时间的增加,c(SO32-)上升,从而使c(SO42-)上升,但溶液中溶解氧的含量有限,随着吸收的进行SO32-转化为SO42-的上升趋势不大.以0.020 mol/L的DEA溶液为例,90 min时溶液中c(SO42-)为0.000 99 mol/L,c(SO32-)为0.013 41 mol/L,c(SO42-)占总硫含量的6.9%,可见溶液中的硫是以SO32-为主要存在形式的.
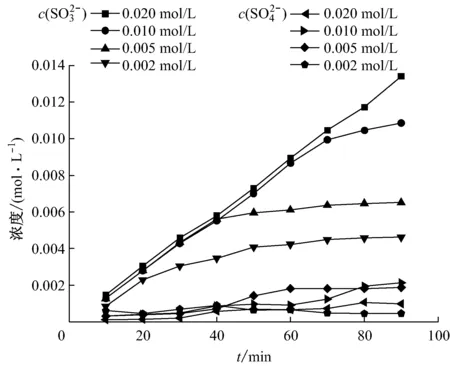
图4 不同浓度DEA溶液中c(SO32-)和c(SO42-)随吸收时间的变化
Fig.4c(SO32-) andc(SO42-) in DEA of different concentrations vs. absorption time
2.1.3不同浓度DEA溶液吸收率随吸收时间的变化
图5给出了不同浓度DEA溶液吸收率随吸收时间的变化规律.从图5可以看出,高浓度的DEA溶液可以更长时间地维持较高的吸收率.0.002 mol/L DEA溶液吸收SO2的速率从10 min开始低于其他3种浓度DEA溶液,为1.052 68×10-6mol/(L·s),至反应90min时的吸收率更是低至5.332 66×10-8mol/(L·s).而其他3种浓度DEA溶液在反应初始阶段,吸收SO2的速率一直维持在1.257 13×10-6mol/(L·s).随着反应的进行,低浓度的DEA溶液吸收率先开始下降,而高浓度溶液可以维持更长时间的高吸收率.这是因为反应开始阶段溶液中OH-浓度远高于SO2浓度,此时吸收率维持在较高水平,随着反应的进行,OH-浓度降低,不能及时与SO2反应,表现为吸收率降低.
2.1.4不同浓度DEA溶液脱硫效率随吸收时间的变化
图6给出了不同浓度DEA溶液脱硫效率随吸收时间的变化规律.与图5类似,高浓度的DEA溶液可以更长时间地维持较高的脱硫效率.0.002 mol/L的DEA溶液在反应初期,其脱硫效率明显低于其他3种DEA溶液的脱硫效率.反应至30 min时,其脱硫效率已低于50%.而其他3种浓度DEA溶液在反应初期的脱硫效率接近100%,但是随着反应的进行,有机胺浓度不断被消耗,且溶液pH亦下降较快,故脱硫效率迅速降低.由双膜理论可知,初始吸收时,DEA在界面处具有较高浓度,其在界面处水解产生的OH-浓度远高于SO2溶解浓度,使脱硫效率能保持在较高水平.但随着吸收时间的增加,有机胺在界面处不断被消耗,不能及时补充活性组分(即DEA水解产生OH-),从而脱硫效率又急剧下降.结果表明,浓度高的DEA溶液脱硫效率高,但浓度过高,脱硫剂原料成本消耗过大,整个系统的经济运行成本太大.因此,合理的吸收剂浓度选择为0.005 mol/L.

图5 不同浓度DEA溶液吸收率随吸收时间的变化
Fig.5Absorption rate of DEA of different concentrations vs. absorption time

图6 不同浓度DEA溶液脱硫效率随吸收时间的变化
Fig.6Desulfurization rate of DEA of different concentrations vs. absorption time
2.2不同种类有机胺对烟气中SO2吸收性能的比较
反应条件如下:模拟烟气量为0.2 L/min,φ(SO2)为0.1%,N2作为平衡气,吸收温度为50 ℃.探讨0.005 mol/L不同有机胺(如DEA、N-甲基二乙醇胺(MDEA)、乙二胺和哌嗪)对SO2的吸收性能.
2.2.1不同有机胺溶液pH随反应时间的变化
图7给出了不同有机胺溶液pH随反应时间的变化曲线.从图7可以看出,4种有机胺反应初期pH值下降较迅速,后期下降趋势变缓.这是因为吸收反应开始阶段,有机胺水解产生的OH-被SO2消耗造成pH值下降,一段时间后,溶液中的有机胺被消耗殆尽,无法水解产生OH-与SO2反应,使得溶液pH值急剧下降,此后SO2的吸收受到抑制,溶液pH值下降趋缓.哌嗪的pH值随反应时间下降较匀速,其缓冲性能更好.pH缓冲性能排序依次为哌嗪>乙二胺>DEA>MDEA,这是因为多元胺的碱性较强,且与SO2的络合吸收反应能力较强,故pH缓冲性能较好.

图7 不同有机胺溶液pH随反应时间的变化
Fig.7pH values of organic amine of different concentrations vs. reaction time
2.2.2不同有机胺溶液中c(SO32-)和c(SO42-)随反应时间的变化
图8给出了不同有机胺溶液中c(SO32-)和c(SO42-)随反应时间的变化曲线.由图8可知,4种吸收剂中c(SO32-)的变化趋势基本相同,反应初期均表现为线性上升,反应后期上升趋势减缓.对SO2的吸收能力从大到小为:哌嗪>乙二胺>DEA>MDEA.因此选择乙二胺或哌嗪作为吸收剂.
乙二胺和哌嗪是二元胺,与一元胺相比,在相同浓度下可以水解出更多的OH-与溶液中的SO2反应,使吸收的SO2更多,因此脱硫容量更大.由于乙二胺挥发性较强,实验中会有溶质损失,所以其吸收容量略小于哌嗪.DEA和MDEA都是一元胺,所以对SO2的吸收容量小.MDEA是叔胺,DEA是仲胺,所以MDEA空间位阻大于DEA,导致其吸收性能不如DEA,DEA的脱硫容量更大.
从图8可以看出,溶液中的c(SO42-)随反应时间的增加呈上升趋势,但90 min内变化不大,且远远低于c(SO32-).这是因为随着反应时间的增加,c(SO32-)上升,从而c(SO42-)上升,但溶液中的含氧量是一定的,故90 min内c(SO42-)上升趋势不大.以哌嗪溶液为例,90 min时溶液中c(SO42-)为0.001 87 mol/L,c(SO32-)为0.010 71 mol/L,c(SO42-)占总硫含量的14.9%,可见溶液中的硫是以SO32-为主要存在形式的.这也说明了在工业应用中,如果有机胺溶液中有大量余氧,会使溶液中的c(SO32-)降低,产生大量SO42-,而SO42-不可再生,不利于解吸反应的进行,使得有机胺溶液再生效率下降.因此在实际生产中,要注意控制溶液中的含氧量.

图8 不同有机胺溶液中c(SO32-)和c(SO42-)随反应时间的变化
Fig.8c(SO32-) andc(SO42-) in different organic amines vs. reaction time

图9 不同有机胺溶液吸收率随反应时间的变化
2.2.3不同有机胺溶液吸收率随反应时间的变化
图9给出了不同有机胺溶液吸收率随反应时间的变化曲线.从图9可以看出,4种有机胺溶液吸收率都是先维持在较高的水平,随着反应的进行,吸收率下降.反应开始阶段,4种有机胺溶液吸收率都达到了1.257 13×10-6mol/(L·s),但随着反应的进行,30~70 min阶段,MDEA和DEA溶液吸收率迅速下降,而乙二胺和哌嗪在70 min后吸收率才有明显的下降.这是因为反应开始阶段溶液中的OH-浓度远高于溶液中SO2浓度,此时吸收率维持在较高水平,随着反应的进行,OH-浓度降低,不能及时与SO2反应,表现为吸收率降低.乙二胺和哌嗪是二元胺,DEA和MDEA是一元胺,因此乙二胺和哌嗪能水解出更多的OH-,其溶液中OH-浓度远大于被吸收的SO2浓度,表现为哌嗪和乙二胺能维持更长时间的高吸收率.
2.2.4不同有机胺溶液脱硫效率随反应时间的变化
图10给出了不同有机胺溶液脱硫效率随反应时间的变化曲线.从图10可以看出,4条脱硫效率随反应时间的变化曲线是相似的.在吸收反应的前20 min,4种有机胺溶液脱硫效率几乎达到100%.但随着反应的进行,50 min时,MDEA和DEA脱硫效率迅速下降至50%以下.乙二胺在40~60 min内脱硫效率高于哌嗪,二者脱硫效率均在95%以上.但此后乙二胺脱硫效率下降较快,低于相同时间内哌嗪的脱硫效率.哌嗪脱硫效率自40 min时开始下降,但直至70 min,仍保持着较高的脱硫效率,出口气体体积分数仍在3×10-4以内,直到100 min后出口气体体积分数才稍稍超过3×10-4.因此,4种有机胺吸收性能排序为:哌嗪>乙二胺>DEA>MDEA.

图10 不同有机胺溶液脱硫效率随反应时间的变化
Fig.10Desulfurization rate of different organic amines vs. reaction time
在哌嗪吸收SO2的初始阶段,其脱硫效率一直维持在较高的水平.由双膜理论可知,此时在气液两相界面处哌嗪水解产生了足够的OH-,其浓度远高于水中溶解的SO2浓度,使得溶解于水中的SO2绝大部分被吸收,此时吸收反应受气膜控制.在40~70 min内,哌嗪的脱硫效率依然维持在较高的水平,但比之前已有所下降,这是因为此时该反应虽然仍主要受气膜控制,但液膜的影响也开始显现,界面处的OH-浓度与此处的SO2浓度差距逐渐减小,此时会在尾气中检测到少量的SO2,表现为脱硫效率下降,但仍在排放标准的范围内,因此可继续实验.在反应后期,溶液中的哌嗪已快被消耗完,无法水解产生足够的OH-与SO2反应,使得溶液pH值急剧下降,酸性环境使得吸收反应得到抑制,进气中的SO2大部分无法被吸收,此时的吸收率主要受液膜一方控制,表现为脱硫效率急剧下降.其他3种有机胺与SO2的反应也类似,一开始是受气膜控制,直至溶液中有机胺被消耗殆尽,无法继续水解生成OH-与SO2反应,反应变为主要受液膜控制,表现为脱硫效率一开始维持在较高水平,一段时间之后很快下降.
对比哌嗪和其他3种有机胺,虽然其他3种有机胺也能较长时间接近100%的脱硫效率,但相同浓度下哌嗪能够维持更长的反应时间,使得排出烟气浓度一直在标准排放范围内,且保持脱硫效率缓慢下降,而不至于在实际运用中致使脱硫剂瞬间失效,造成不良后果.其缓冲性能更为优越,易在实际运用中掌控失效终点.此外,相同浓度下哌嗪具有较高的吸收容量,故从吸收角度来看,最适宜的脱硫剂是哌嗪溶液.
2.3不同有机胺解吸性能比较
反应条件如下:反应温度为100 ℃.探讨已吸收饱和的4种0.005 mol/L有机胺溶液对SO2的解吸性能.
图11为不同有机胺溶液解吸率随解吸时间的变化曲线.图11中,反应进行到90 min时,对4种有机胺溶液解吸率进行排序:MDEA>乙二胺>DEA>哌嗪.由此可知,在一定解吸能耗下MDEA的解吸性能最好,其解吸率为38.7%.
SO2与有机胺水解产物不稳定,受热会分解.该解吸反应是吸热反应,随着反应的进行,反应吸收的热量增加,解吸的程度也会升高,表现为溶液中的c(SO32-)越来越低.乙二胺和哌嗪的2个胺基碱性不同,碱性较弱的胺基结合SO2的产物不稳定,更容易解吸.乙二胺是一种碱性较强的二元胺,但其吸收能力弱于哌嗪,所以其解吸能力强于哌嗪弱于MDEA.DEA的胺基碱性强,其与SO2的结合产物更稳定,更难解吸.MDEA的解吸性能强于DEA,从分子结构分析,MDEA的空间位阻更大,其与SO2水解产生的H+络合产物在受热时反应向逆方向进行,表现为更容易解吸.

图11 不同有机胺溶液解吸率随解吸时间的变化
Fig.11Desorption rate of different organic amines vs. desorption time
综上所述,从吸收角度来看,哌嗪的吸收性能最好,但在反应的前40 min,4种有机胺溶液的脱硫效率都接近于100%,有着极佳的吸收率.从解吸角度来看,相同反应时间内,MDEA的解吸率最高,即在外界提供相同多能量时,其解吸量最大.综合考虑,最终选择MDEA为吸收剂.
3热力学分析
SO2吸收热力学的研究对吸收剂的选择、工艺过程的设计和优化以及节能降耗具有重要意义.其中吸收反应的吉布斯自由能是评价吸收剂性能的重要参数.
3.1MDEA吸收SO2的热力学分析
3.1.1MDEA吸收SO2的化学反应
由上述实验与文献[11]可知,亚硫酸一级解离形成亚硫酸氢盐为主要反应,即一个醇胺分子吸收一个SO2分子.MDEA吸收SO2的反应为

(9)
3.1.2MDEA吸收SO2反应的热力学参数
MDEA吸收SO2反应中部分物质的热力学参数见表1.

表1 反应体系中部分物质的热力学参数[12]
3.1.3MDEA吸收SO2的焓变估算
已知在MDEA吸收CO2反应中,液相中阴离子以HCO3-为主,MDEA吸收CO2的焓变为-55 kJ/mol[13].计算式如下:

(10)
SO2与MDEA反应焓变计算式为

(11)
从上述计算可以看出,标准状态下MDEA吸收SO2为放热反应,低温有利于吸收.一般来说,焓变越大,吸收能力越高,反之焓变越小,吸收能力越小.
3.1.4MDEA吸收SO2反应的熵变估算
MDEA的标准熵可由下式算得:
(12)
其中,
(13)
式中:A,B为经验常数,根据文献[14]可知MDEA沸点为520.15 K,胺类有机物A=43.17,B=-85.06;Tb为物质常压下沸点.
运用基团加合法估算MDEA溶液的标准熵:
(14)

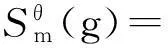
2Sθ[C-(N)(C)(H)2]+
2Sθ[C-(O)(C)(H)2]+
2Sθ[O-(C)(H)]-RlnNis+
RlnNoi=25.71 J/(mol·K).
MDEAH+的标准熵可由下式算得[13]:

19.5p1+26.5p2
(15)
式中:n为环以外的碳原子数;p1为苯基数;p2为饱和环(环戊烷或环己烷)数;r为直链上的支链数或脂肪链任何碳原子上的烃基数减2.

表2 各种基团对(g)的贡献值[14]

3.1.5MDEA吸收SO2的吉布斯自由能和反应平衡常数的计算

反应的吉布斯自由能为
(16)
化学反应平衡常数K为
(17)
标准状态下(T=298.15 K)反应的吉布斯自由能为-12.616 kJ/mol,K=162.31,吉布斯自由能为负值,这说明反应是向正方向进行的.由式(16)可
知,若升高温度,则会增加熵因素的影响,因此可以认为反应的吉布斯自由能随温度的升高而增大.从化学热力学角度来看,升高温度不利于SO2的吸收,有利于反应向逆方向进行,即解吸反应的发生.但实际生产中,吸收温度过低需增加冷热烟气热交换负荷;而且解吸过程所需能量是由蒸汽加热提供的,因此过高的解吸温度将使得系统能耗加剧.在实际生产中,需要确定合适的反应温度.
3.2石灰石吸收SO2的热力学分析
3.2.1化学反应机理
吸收反应:
(18)
溶解反应:
(19)
中和反应:

(20)
将以上反应式加和可得

(21)
3.2.2石灰石吸收SO2反应的热力学参数及计算
石灰石吸收SO2反应的热力学参数见表3.

表3 反应体系中部分物质的热力学参数[13]
与MDEA吸收SO2反应的分析步骤类似,石灰石吸收SO2的计算式如下:

(22)

(23)

3.3MDEA脱硫与传统石灰石石膏法脱硫的热力学比较

表4MDEA与石灰石吸收SO2热力学参数的比较
Tab.4Comparison of thermodynamic parameters between MDEA and limestone in absorbing SO2

参数MDEA吸收SO2反应石灰石吸收SO2反应标准生成焓ΔrHθm/(kJ·mol-1)-85.916-67.974标准熵ΔrSθm/(J·mol-1·K-1)-245.848-205.556标准生成吉布斯自由能ΔrGθm/(kJ·mol-1)-12.616-6.687反应平衡常数K162.3114.84
4结论
(1) 通过不同浓度DEA溶液的对比实验,确定了实验所需有机胺溶液浓度为0.005 mol/L.
(2) 通过对不同吸收剂的筛选,发现哌嗪的吸收性能最好,MDEA的解吸性能最好,目前工业上MDEA吸收CO2技术比较成熟,MDEA吸收SO2与之类似,具有吸收容量大,最终解吸率高,且MDEA较易再生,综合脱硫性能较好等优点.
(3) 通过热力学计算,比较了MDEA与石灰石吸收SO2的反应吉布斯自由能,发现MDEA吸收SO2反应体系的吉布斯自由能更小,说明其反应自发进行的程度更大,吸收性能更好.
参考文献:
[1]潘卫国,郭瑞堂,冷雪峰,等.大型燃煤电站锅炉脱硫塔脱硫效率的数值模拟[J].动力工程学报,2011,31(4): 306-311.
PAN Weiguo, GUO Ruitang, LENG Xuefeng,etal. Numerical simulation on desulfurization efficiency of WFGD tower in a large coal-fired power plant boiler[J].Journal of Chinese Society of Power Engineering,2011,31(4):306-311.
[2]崔鹏,刘建芳,王琪,等.酸性组分对N,N′-二(2-羟丙基)哌嗪吸收/解吸SO2性能的影响[J].高校化学工程学报,2013,27(3): 399-405.
CUI Peng, LIU Jianfang, WANG Qi,etal. Effects of acidic compounds on SO2absorption and desorption property of 1,4-bis(2-hydroxypropy1)piperazine aqueous solution[J].Journal of Chemical Engineering of Chinese Universities,2013,27(3):399-405.
[3]CUI P, WANG T, CHEN Y,etal. Density, viscosity, and surface tension of aqueous solution of 1, 4-bis-(2-hydroxypropyl)-piperazine sulfate[J]. Journal of Chemical & Engineering Data,2013,58(12):3327-3331.
[4]ZAHIRI M R, MEHRARA H, ROUZBEHANI B. Investigation of parameters affecting a selective flue gas desulfurization with an amine base absorbent[J].Science International,2013,25(2):225-228.
[5]TAILOR R, AHMADALINEZHAD A, SAYARI A. Selective removal of SO2over tertiary amine-containing materials[J].Chemical Engineering Journal,2014, 240(6):462-468.
[6]OH K-J, MIN B-M, KIM S-W,etal. Simultaneous absorption of carbon dioxide,sulfur dioxide,and nitrogen dioxide into aqueous 1, 8-diamino-p-menthane[J].Korean Journal of Chemical Engineering,2011, 28(8): 1754-1760.
[7]HAKKA. Removal and recovery of sulphur dioxide from gas streams: USA, 5019361[P].1991-05-28.
[8]邱正秋,黎建明,任艳丽,等.烟气脱硫溶液中硫酸根的去除[J].化工环保,2014,34(2):133-136.
QIU Zhengqiu,LI Jianming,REN Yanli,etal.Removal of SO42-from flue gas desulphurization solution[J].Environmental Protection of Chemical Industry,2014,34(2):133-136.
[9]HEYDARI-GORJI A, BELMABKHOUT Y, SAYARI A. Polyethylenimine-impregnated mesoporous silica:effect of amine loading and surface alkyl chains on CO2adsorption[J].Langmuir,2011,27(20): 12411-12416.
[10]许贤,蔡振云,梁坤.哌嗪水溶液脱硫性能的研究[J].环境化学,2010, 29(3): 450-454.
XU Xian, CAI Zhenyun, LIANG Kun. A study on flue gas desulfurization using aqueous piperazine[J].Environmental Chemistry,2010,29(3):450-454.
[11]陈健,罗伟亮,李晗.有机胺吸收二氧化碳的热力学和动力学研究进展[J].化工学报,2014, 65(1):12-21.
CHEN Jian, LUO Weiliang, LI Han. A review for research on thermodynamics and kinetics of carbon dioxide absorption with organic amines[J].CIESC Journal,2014,65(1): 12-21.
[12]迪安,尚久方,辛无名.等.兰氏化学手册[M].北京:科学出版社,1991.
[13]SVENSSON H, HULTEBERG C, KARLSSON H T. Heat of absorption of CO2in aqueous solutions of N-methyldiethanolamine and piperazine[J].International Journal of Greenhouse Gas Control,2013,17(9): 89-98.
[14]POLING B E, PRAUSNITZ J M, JOHN P O C,etal.The properties of gases and liquids[M].New York,USA: McGraw-Hill,2001.
Experimental Study on SO2Removal with Renewable Organic Amines
XUHongjian1,3,JINJizhao1,SUNYaping2,WANGMeixia1,PANWeiguo3
(1. Department of Environmental and Chemical Engineering, Shanghai University of Electric Power,Shanghai 200090, China; 2. Operation Department, Huaneng Shandong Shidao Bay Nuclear Power Co., Ltd., Rongcheng 264300, Shandong Province, China; 3. Shanghai Power Environmental Protection Engineering Technology Research Center, Shanghai 200090, China)
Abstract:Absorption experiments were performed in a bubbling system to study the effects of four different organic amines on the wet flue gas desulfurization, while desorption experiments were conducted in an oil-bath heating device to analyze the desorption effects of the four organic amines. Results show that the desulfurization rate of above organic amines declines with the variation of time following the order below: piperazine>ethylenediamine>DEA>MDEA; whereas their desorption rate at same desorption temperatures increases with the variation of time, showing the desorption performance from strong to weak as follows: MDEA>ethylenediamine>DEA>piperazine. Through calculation with thermodynamic parameters, it is found that the Gibbs free energy of MDEA for absorption of SO2 is less than that of limestone, indicating that MDEA is a better desulfurizing agent, with stronger capability in SO2 absorption than limestone.
Key words:organic amine; flue gas desulfurization; desorption; thermodynamics
文章编号:1674-7607(2016)03-0227-09
中图分类号:X701
文献标志码:A学科分类号:610.30
作者简介:徐宏建(1971-),男,河南南阳人,副教授,博士,研究方向为电厂脱硫、工艺气体净化、气液反应与反应器.
基金项目:上海发电环保工程技术研究中心资助项目(11dz2281700);上海研发基地资助项目(11DZ2281700);火电厂脱硫脱硝节能增效关键技术研究与应用资助项目(13dz1202703);基于高效脱硝、除尘和脱硫的燃煤电站锅炉环保岛集成技术开发与示范资助项目(14dz1200200)
收稿日期:2015-04-13
修订日期:2015-06-30
电话(Tel.):021-35303902;E-mail: hongjian_xu@sina.com.
