VEGF、HIF-1α、COX-2在非小细胞肺癌中的表达及意义
2016-04-19石国一刘玉玲河北省赞皇县医院外科河北赞皇0530河北省赞皇县医院内镜室河北赞皇0530
石国一,刘玉玲,王 敏(.河北省赞皇县医院外科,河北 赞皇 0530;.河北省赞皇县医院内镜室,河北 赞皇 0530)
·论著·
VEGF、HIF-1α、COX-2在非小细胞肺癌中的表达及意义
石国一1,刘玉玲2,王敏1(1.河北省赞皇县医院外科,河北 赞皇 051230;2.河北省赞皇县医院内镜室,河北 赞皇 051230)
[摘要]目的探讨血管内皮生长因子(vascular endothelial growth factor,VEGF)、缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)及环氧合酶2(cyclooxygenase-2,COX-2)在非小细胞肺癌(non-small cell lung cancer,NSCLC)中的表达及与临床病理的关系。方法采用免疫组织化学方法检测89例NSCLC组织和17例正常肺组织(对照组)VEGF、HIF-1α及COX-2的表达情况,并分析其临床病理意义。结果VEGF、HIF-1α、COX-2在NSCLC中的阳性表达率分别为71.9%、47.2%、57.3%,分别显著高于对照组阳性表达率29.4%(P=0.001)、17.6%(P=0.024)、23.5%(P=0.011)。有淋巴结转移的患者较无淋巴结转移的患者VEGF、HIF-1α和COX-2的表达阳性率高(P<0.05);在TNM分期中,Ⅲ+Ⅳ期的患者较Ⅰ+Ⅱ期患者VEGF、HIF-1α表达阳性率高(P<0.05)。结论VEGF、HIF-1α及COX-2在NSCLC组织中的表达显著增高,提示三者在NSCLC的发生中发挥重要作用。
[关键词]癌,非小细胞肺;血管内皮生长因子类;缺氧诱导因子1
doi:10.3969/j.issn.1007-3205.2016.03.003
肺癌是我国常见的恶性肿瘤之一,发病率及病死率逐年上升。非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的80%左右[1],其发生发展机制是目前研究的热点。血管内皮生长因子(vascular endothelial growth factor,VEGF)是已知最重要的血管生成促进因子之一,与许多肿瘤密切相关[2]。缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)可以促进肿瘤组织生长,并对VEGF具有调节作用[3]。环氧合酶2(cyclooxygenase-2,COX-2)在多种肿瘤中的表达与VEGF密切相关。鉴于此,本研究采用免疫组织化学方法检测89例NSCLC患者肿瘤标本中VEGF、HIF-1α、COX-2的表达,并分析其与临床病理特征的关系。
1资料与方法
1.1标本收集收集2010年3月—2014年3月河北省赞皇县人民医院外科NSCLC福尔马林固定石蜡包埋组织89例,男性56例,女性33例,年龄42~78岁,平均(58.4±6.1)岁,其中腺癌49例,鳞癌40例。随机选取同时手术的正常肺组织17例作为对照组,男性11例,女性6例,年龄48~72岁,平均(56.2±7.2)岁。病理切片由2位高年资病理医生复诊。2组性别、年龄差异无统计学意义(P>0.05),具有可比性。
1.2检验试剂VEGF鼠抗人单克隆抗体、HIF-1α鼠抗人单克隆抗体、COX-2兔抗人单克隆抗体、链霉菌抗生物素蛋白-过氧化物酶连接法(sptreptavidin-perosidasease,SP)免疫组织化学试剂盒以及二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒均购自福州迈新生物技术开发公司。
1.3免疫组织化学检测切片常规脱蜡至水,3% H2O2室温孵育15 min去除内源性过氧化物酶活性,然后选用枸橼酸盐缓冲液高压抗原修复,室温自然冷却。滴加血清封闭液室温15 min后,直接加一抗(VEGF:1∶100;HIF-1α:1∶100;COX-2:1∶100)于切片上,湿盒内4℃冰箱过夜。PBS冲洗5 min 3次,按照SP试剂盒说明书操作。DAB显色,苏木精复染,中性树胶封片。用0.01 mol/L PBS代替一抗作为阴性对照,其余步骤同上。
1.4结果判断以细胞质或细胞核内出现棕黄色颗粒或棕黄色团块为阳性细胞。根据阳性细胞百分比制定如下判定标准:COX-2染色位于细胞浆,肿瘤细胞数>10%为阳性;VEGF阳性染色位于细胞浆,肿瘤细胞染色数>25% 为阳性;HIF-1α染色位于细胞核,肿瘤细胞数>10%为阳性。
1.5统计学方法应用SPSS 21.0统计软件进行数据分析,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2结果
2.1VEGF、HIF-1α、COX-2在NSCLC中的表达VEGF、COX-2免疫组织化学染色以细胞浆内出现棕黄色颗粒为阳性,HIF-1α染色以细胞核内出现棕黄色颗粒为阳性(图1)。VEGF在NSCLC肿瘤组织中阳性表达率明显高于对照组(P=0.001);HIF-1α在NSCLC肿瘤组织中阳性表达率明显高于对照组(P=0.024);COX-2在NSCLC肿瘤组织中阳性表达率明显高于对照组(P=0.011)。见表1。

表1 VEGF、HIF-1α、COX-2在NSCLC组织中的表达
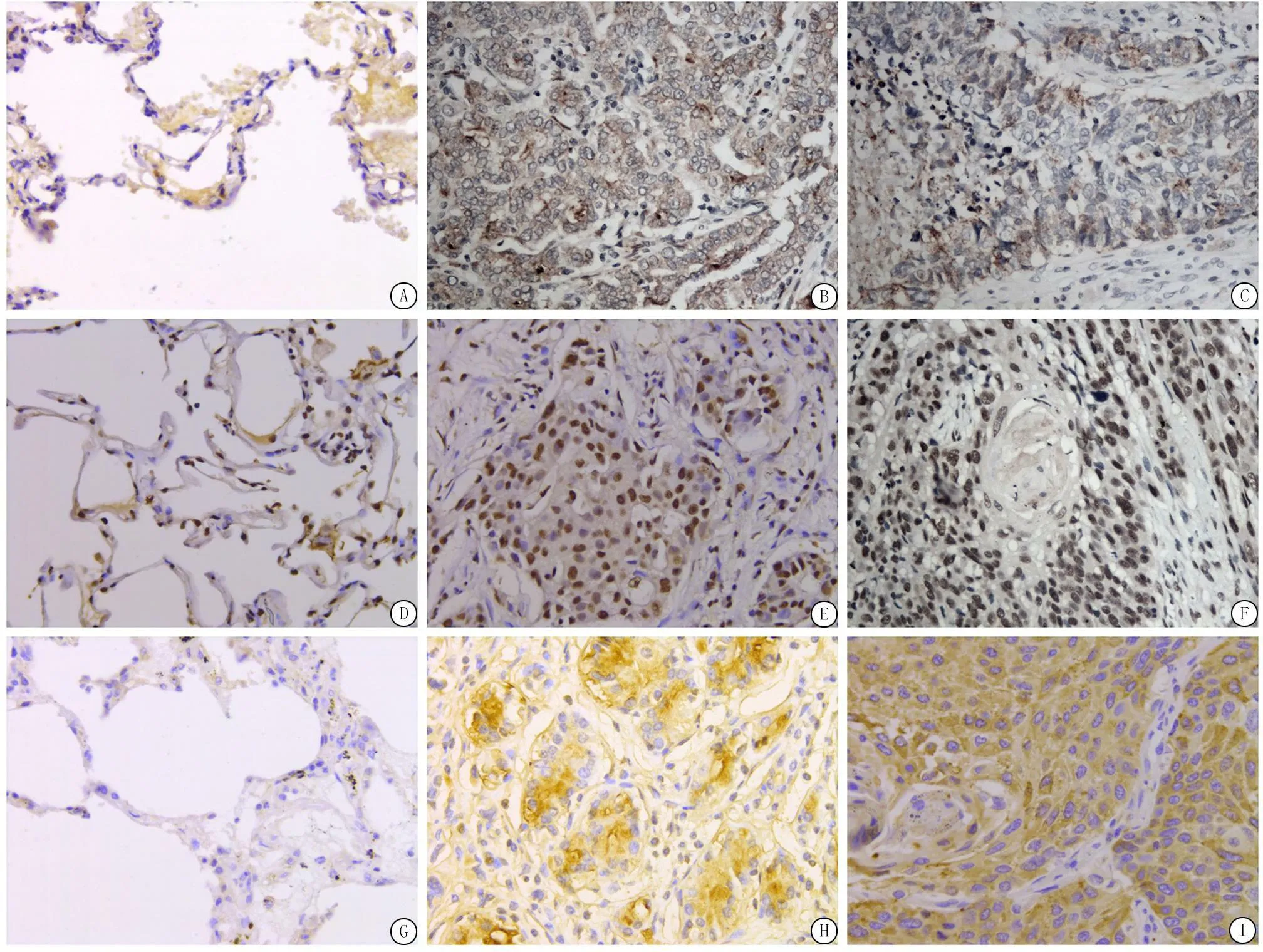
图1VEGF、HIF-1α及COX-2在NSCLC组织中的表达 (IHC ×400)
A.对照组中VEGF的表达;B.腺癌中VEGF的表达;C.鳞状细胞癌中VEGF的表达;D.对照组中HIF-1α的表达;E.腺癌中HIF-1α的表达;F.鳞状细胞癌中HIF-1α的表达;G.对照组中COX-2的表达;H.腺癌中COX-2的表达;I.鳞状细胞癌中COX-2的表达
Figure 1The expression of VEGF,HIF-1α and COX-2 in NSCLC(IHC ×400)2.2VEGF、HIF-1α、COX-2表达与临床病理特征的关系在NSCLC中,有淋巴结转移的患者较无淋巴结转移的患者VEGF、HIF-1α和COX-2的表达阳性率高(P<0.05);在TNM分期中,Ⅲ+Ⅳ期的患者较Ⅰ+Ⅱ期患者VEGF、HIF-1α表达阳性率高(P<0.05),COX-2阳性率表达在Ⅰ+Ⅱ期与Ⅲ+Ⅳ期患者之间差异无统计学意义(P>0.05);而在不同年龄、性别、病理类型和分化程度患者之间VEGF、HIF-1α和COX-2的表达阳性率差异均无统计学意义(P>0.05)。见表2。
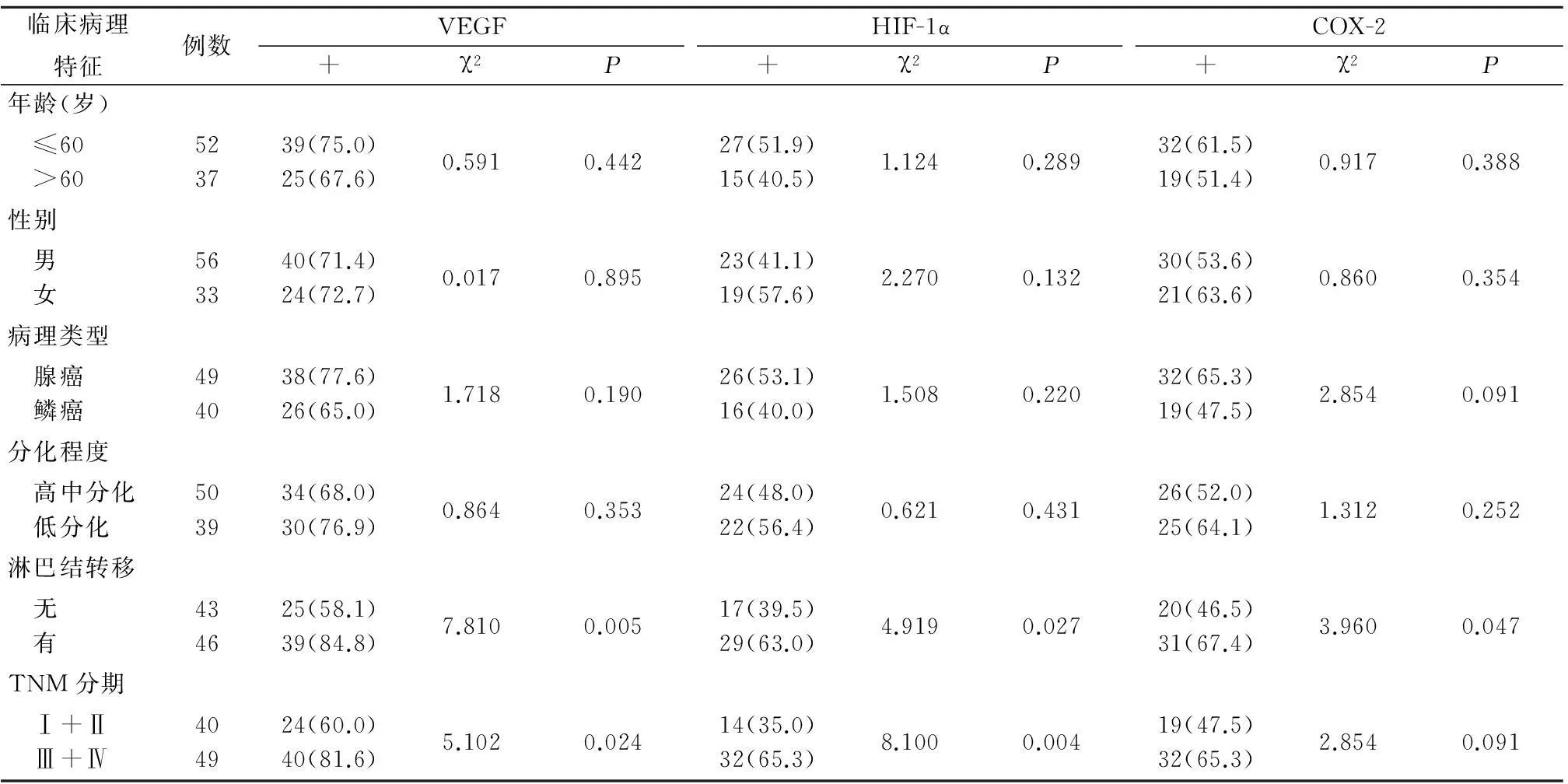
表2 VEGF、HIF-1α、COX-2表达与NSCLC临床病理特征的关系
3讨论
VEGF是一种内皮细胞特异性致分裂原,与其受体结合后,可特异性促进内皮细胞分裂增殖,促进血管生成,增加血管的通透性,有助于肿瘤侵袭转移,是目前诱导肿瘤血管形成特异性最高的血管生长因子之一[4]。本研究结果显示,NSCLC患者VEGF表达明显增高,且有淋巴结转移及TNM分期Ⅲ+Ⅳ期的患者VEGF表达阳性率高。提示VEGF可能参与NSCLC的发病,同时具有一定预后判断意义。
HIF-1是由HIF-1α和HIF-1β组成的异源二聚体,其中HIF-1α是主要的氧调节亚基。有研究表明,HIF-1α是一种重要的转录因子,可在缺氧状态下对包括VEGF在内的多种基因发挥调节作用,有利于肿瘤的生存及转移等[5]。以往研究发现在NSCLC组织中,肿瘤迅速增殖引起的局部缺氧或抑癌基因突变均可使肿瘤组织中HIF-1α蛋白的表达增多[6]。本研究结果显示,HIF-1α在NSCLC肿瘤组织中的表达明显高于正常组织,且有淋巴结转移的患者其阳性表达率明显升高。提示HIF-1α在NSCLC发生中发挥重要作用,可能成为判断NSCLC恶性程度的指标。
COX-2是花生四烯酸代谢过程中的限速酶,在细胞因子、致癌剂、癌基因等的作用下可迅速表达,与肿瘤发生发展及预后密切相关[7]。COX-2选择性抑制剂塞来昔布可抑制多种肿瘤细胞增殖,与其他药物具有协同抗肿瘤细胞作用[8],在肿瘤的化学预防与治疗中具有潜在的应用价值。本研究结果显示,有淋巴结转移的患者NSCLC肿瘤组织中COX-2阳性表达明显增高。提示COX-2表达可能具有一定判断预后价值。
有研究显示,VEGF、HIF-1α、COX-2在某些肿瘤中的表达具有相关性,推测三者在肿瘤发生发展中可能具有协同作用[9-11]。最近研究发现,用shRNA抑制COX-2基因表达可显著降低VEGF-C mRNA的合成,并影响其蛋白水平[9]。而且,在子宫颈癌细胞中,COX-2抑制剂可通过抑制VEGF-C的表达影响细胞的侵袭转移[10]。de Francesco等[11]研究认为,HIF-1α信号通路参与乳腺癌细胞中VEGF的表达,影响细胞增殖。而COX-2抑制剂塞来昔布可明显抑制急性早幼粒细胞白血病细胞株NB4中VEGF、HIF-1α的表达。
综上所述,在NSCLC肿瘤组织中,VEGF、HIF-1α、COX-2表达均发生变化,提示三者参与了该肿瘤的发生发展,而且VEGF、HIF-1α、COX-2之间可能存在协同关系,但需进一步深入研究。
[参考文献]
[1]Parkin DM,Bray F,Ferlay J,et al. Global cancer statistics,2002[J]. CA Cancer J Clin,2005,55(2):74-108.
[2]安峰,何薇薇,林媛媛,等.涎腺黏液表皮样癌中信号传导和转录激活因子3、血管内皮生长因子的表达及临床意义[J].河北医科大学学报,2015,36(5):540-542,546,封三.
[3]Park S,Ha SY,Cho HY,et al. Prognostic implications of hypoxia-inducible factor 1α in epidermal growth factor receptor-negative non-small cell lung cancer [J]. Lung Cancer,2011,72(1):100-107.
[4]Maeda A,Nakata M,Yasuda K,et al. Influence of vascular endothelial growth factor single nucleotide polymorphisms on non small cell lung cancer tumor angiogenesis[J]. Oncol Rep,2013,29(1):39-44.
[5]王芳,付占昭,张丽娇,等.缺氧诱导因子1和P糖蛋白在乳腺癌中的表达及意义[J].临床荟萃,2014,29(7): 744-746.
[6]Kuo WH,Shih CM,Lin CW,et al. Association of hypoxia inducible factor 1α polymorphisms with susceptibility to non-small-cell lung cancer[J]. Transl Res,2012,159(1):42-50.
[7]Onguru O,Gamsizkan M,Ulutin C,et al. Cyclooxygenase-2(COX-2) expression and angiogenesis in glioblastoma[J]. Neuropathology,2008,28(1):29-34.
[8]Li J,Xue L,Hao H,et al. Rapamycin combined with celecoxib enhanced antitumor effects of mono treatment on chronic myelogenous leukemia cells through downregulating mTOR pathway[J]. Tumour Biol,2014,35(7):6367-6374.
[9]Wang YH,Wu MW,Yang AK,et al. COX-2 Gene increases tongue cancer cell proliferation and invasion through VEGF-C pathway[J]. Med Oncol,2011,28(Suppl 1):S360-366.
[10]Liu H,Xiao J,Yang Y,et al. COX-2 expression is correlated with VEGF-C,lymphangiogenesis and lymph node metastasis in human cervical cancer[J]. Microvasc Res,2011,82(2):131-140.
[11]de Francesco EM,Lappano R,Santolla MF,et al. HIF-1α/GPER signaling mediates the expression of VEGF induced by hypoxia in breast cancer associated fibroblasts(CAFs)[J]. Breast Cancer Res,2013,15(4):R64.
(本文编辑:许卓文)
Expressions of VEGF, HIF-1α and COX-2 in non-small-cell lung cancer
SHI Guo-yi1, LIU Yu-ling2, WANG Min1
(1.Department of Surgery, the People′s Hospital of Zanhuang County, Hebei Province,Zanhuang 051230, China;2.Department of Endoscopy Room, the People′s Hospital of Zanhuang County, Hebei Province,Zanhuang 051230,China )
[Abstract]ObjectiveTo study the expressions and clinicopathological relationship of vascular endothelial growth factor(VEGF), hypoxia inducible factor-1α(HIF-1α) and cyclooxygenase-2(COX-2) in tissues of non-small-cell lung cancer(NSCLC). MethodsEighty-nine samples of non-small-cell lung cancer and 17 cases of normal lung tissue were involved in this study, and the expressions of VEGF, HIF-1α and COX-2 were detected using immunohistochemistry(IHC). ResultsThe positive rates of VEGF, HIF-1α and COX-2 expressions were 71.9%, 47.2%, 57.3% in NSCLC, which is significantly higher than those in the control group respectively(29.4%, P=0.001; 17.6%, P=0.024; 23.5%, P=0.011). Notably, the expressions of VEGF, HIF-1α and COX-2 were higher in cases with lymphatic metastasis than in negative lymphatic metastasis(P<0.05). Moreover, the samples at Ⅲ+Ⅳ stage showed significantly higher expressions of VEGF and HIF-1α than that at Ⅰ+Ⅱ stage(P<0.05). ConclusionThe expressions of VEGF, HIF-1α and COX-2 were higher in NSCLC, indicating that the three antigens played important roles in NSCLC development.
[Key words]carcinoma, non-small-cell lung; vascular endothelial growth factors;hypoxia-inducible factor 1
[中图分类号]R730.26
[文献标志码]A
[文章编号]1007-3205(2016)03-0256-04
[作者简介]石国一(1974-),男, 河北赞皇人,河北省赞皇县医院主治医师,医学学士,从事外科疾病诊治研究。
[收稿日期]2015-05-13;[修回日期]2015-06-26
