人工柠条-荒漠草地交错带拟步甲昆虫群落多样性
2016-04-13杨贵军王新谱贾彦霞张大治
杨贵军, 王新谱, 贾彦霞, 张大治
1 宁夏大学生命科学学院, 银川 750021
2 宁夏大学农学院, 银川 750021
3 宁夏大学西北退化生态系统恢复与重建省部共建教育部重点实验室, 银川 750021
人工柠条-荒漠草地交错带拟步甲昆虫群落多样性
杨贵军1,*, 王新谱2,3, 贾彦霞2, 张大治1
1 宁夏大学生命科学学院, 银川750021
2 宁夏大学农学院, 银川750021
3 宁夏大学西北退化生态系统恢复与重建省部共建教育部重点实验室, 银川750021
摘要:选取宁夏东部盐池县人工柠条灌丛-荒漠草地交错带为研究样地,以距离梯度形式,利用巴氏诱罐法对拟步甲科昆虫群落多样性进行了调查,研究了边缘效应对拟步甲昆虫群落多样性的影响。共采集拟步甲昆虫1405只,分属8属13种。结果表明,克小鳖甲和弯齿琵甲个体数量分别占总个体数的32.74%和43.27%,为该地区的优势种类。拟步甲昆虫在人工柠条灌丛-荒漠草地交错带的分布可分为3种类型,优势种克小鳖甲和弯齿琵甲属于栖息地广布型,但二者并没有表现出十分均匀的适应性,而且他们在各样带的分布呈显著负相关,克小鳖甲的分布趋向于沙生荒漠环境,弯齿琵甲的分布趋向于柠条灌丛;常见种蒙古漠王、小皮鳖甲的分布偏向于喜好荒漠草地;异距琵甲、奥氏真土甲、网目土甲和淡红毛隐甲的分布则偏向于喜好柠条灌丛。拟步甲昆虫丰富度与Shannon-Wiener多样性沿边缘分别向柠条灌丛和荒漠草地内部降低,个体数量总体上沿柠条灌丛、交错带向荒漠草地内部降低,但各样带差异不显著。从季节动态看,荒漠草地和柠条灌丛物种多样性季节变化相似,3种生境拟步甲活动密度季节变化相似。边缘效应强度分析呈现边缘正效应。CCA排序图显示分类地位相近的物种在生态适应上具有趋同性。多元回归分析表明,植被密度影响拟步甲昆虫群落的优势种和个体数量,植被盖度和高度分别影响拟步甲群落的均匀度和丰富度。主坐标分析(PCoA)排序表明人工柠条灌丛-荒漠草地交错带的拟步甲昆虫群落组成与柠条灌丛内部没有明显分化,但趋于向柠条灌丛生境演替。
关键词:拟步甲; 边缘效应; 多样性; 柠条-荒漠草地交错带
生境破碎化和栖息地丧失是造成生物多样性丧失的重要原因之一[1- 2],生境破碎后出现的群落交错带是边缘效应的产生区,通常引起生物和非生物条件的变化,包括食物、栖息地、繁殖场所等,从而影响嵌块中的有机体[3- 5]。森林的边缘一直是生态研究和保护的重点[6- 7],已有研究表明地表昆虫对森林生境破碎化非常敏感[8]。在森林短期和长期形成的“锋利边缘”群落交错带内,步甲物种多样性存在差异[9- 10],在不同形式的森林边缘,步甲物种组成差异不明显[9- 13]。物种对森林边缘的反应有明显的分化,存在边缘特有种的聚集分布, 另外由于相邻栖息地物种的扩散,会导致森林边缘地表昆虫物种多样性在短期内提高[11,14- 17],而在“锋利”的森林边缘,几乎没有边缘特有种[9-10]。森林斑块面积、形成时间、边缘植被构成以及季节,干扰也对交错带的边缘效应产生影响[7,18- 21]。破碎化的荒漠景观昆虫群落的研究也颇受关注[22- 24],在荒漠草原-人工固沙柠条林和荒漠草原-固定半固定沙地两种类型的交错带,边缘的地表甲虫多样性特征高于相邻生境,但边缘效应存在差异[24]。
盐池县位于宁夏东部,属鄂尔多斯台地向黄土高原过渡地带,沙生植被草场是盐池县草原的主体。该地区植被受沙化环境和人为因素的影响,呈点、片、带状分布,构成了典型的沙化地破碎化荒漠植被景观。近年来,盐池县在沙化植被区种植固沙灌丛柠条26.67万hm2,有效减缓了草原的沙化进程。本研究选择位于宁夏盐池县四墩子的人工柠条-荒漠草地交错带,以拟步甲昆虫为研究对象,该科昆虫被视为植被退化程度高低和土壤沙化轻重的指示类群[25]。本文通过比较人工柠条灌丛、柠条灌丛边缘以及荒漠草地拟步甲昆虫的丰富度、个体数量和多样性等差异及季节动态,并分析影响拟步甲昆虫分布的植被特征,探讨人工柠条灌丛-荒漠草地交错带边缘效应对拟步甲昆虫多样性的影响及群落组成演替。
1研究地区与研究方法
1.1研究地概况
研究区位于宁夏东部的盐池县(37°04′—38°10′N,106°30′—107°41′E),该地北与毛乌素沙漠相连,南靠黄土高原,处于典型中温带大陆性气候带,年均气温8.1 ℃,年降水量250—350 mm,植被类型是从干草原向荒漠草原的过渡地带,主要有灌丛、草原、草甸、沙地植被和荒漠植被,其中灌丛、草原、沙地植被数量较大,分布也广。草原分干草原和荒漠草原,群落中常见植物种类以旱生和中旱生类型为主。
研究样地为人工柠条(Caraganaintermedia)灌丛和荒漠草地的交错带,没有人为及放牧干扰。其中柠条灌丛为人工种植9年的灌丛,连片面积约6.22 km2,柠条行间距约4 m,株距约1 m,平均株高1.46 m,平均株冠约2.43 m,柠条林行间主要有老瓜头(Cynanchumkomarovii)、糙隐子草(Cleistogenessquarrosa)、沙芦草(Agropyronmongolicum)、砂珍棘豆(Oxytropispsamocharis)、猪毛蒿(Artemisiascoparia)和叉枝鸦葱(Scorzoneradivaricata),夏季行间植物高度约16.60 cm,盖度约30%。荒漠草地为没有开垦过的原始荒漠草本植物带,主要植物有沙芦草、叉枝鸦葱、胡枝子(Lespedezabicolor)、狗尾巴草(Setairaviridis)、狭叶米口袋(Gueldenstaedtiastenophylla)、砂珍棘豆和砂蓝刺头(Echinopsgmelinii)等,夏季群落高度约20.20 cm,盖度约为41%。
1.2调查方法
本研究以巴氏罐诱法进行标本采集[4,7,17,26]。采用400 mL塑料杯(高9 cm,口径7.5 cm)作为容器,杯壁上方1/4处(杯口下方约2.5 cm)打一小孔(直径约0.5 cm),以免由于雨水过多使标本流失;引诱剂为醋、糖、酒精和水的混合物,重量比为2∶1∶1∶20,每个诱杯内放引诱剂40—60 mL。采集到的标本存放在70%的酒精内。采样时间为2012年6月到10月,每月采样1次,每次放置诱杯时间3 d。

图1 研究样地设置Fig.1 Map of the study site showing actual positions of each plot
根据Meiners和Pickett[27]及Heliölä等[9]研究边缘效应的建议,以距离梯度形式研究柠条灌丛内部、柠条-荒漠草地交错带和荒漠草地内部的差异。在设计样点时,每条样带以柠条灌丛边缘为中心,分别向荒漠草地和柠条灌丛延伸100 m,以每隔25 m的距离设置样点,这样每个研究样带包括9个研究样点,即柠条灌丛边缘1个,柠条灌丛内和荒漠草地内各4个(距柠条草地边缘的距离分别为25、50、75 m和100 m);每个样点由5个诱杯组成,间距1—2 m,呈五点排列,平行于柠条灌丛边缘,每个样带包括45个诱杯。共设置5条研究样带,样带间距为30 m(图1)。
为了研究植被特征对拟步甲昆虫分布的影响,还调查了9个研究样带(以样点中央诱杯为中心,直径2 m的范围)的植被种类、密度、高度和盖度等特征,并统一在调查中期(2012年8月)进行调查。
1.3数据处理与分析
在数据分析时,以拟步甲昆虫的物种数、个体数量、多样性、均匀度及优势度为对象,将45个研究地点(5个重复研究样带,每个样带包括9个研究地点)根据与柠条灌丛边缘的距离聚成3组:柠条灌丛生境包括深入到柠条灌丛内部的3个距离组(50、75 m以及100 m),荒漠草地生境包括深入到荒漠草地内部的3个距离组(50、75 m以及100 m),交错带包括其他3个距离组(边缘、深入柠条灌丛生境25 m,深入荒漠草地生境25 m)。
以“活动密度”反映不同样地拟步甲昆虫的数量,其含义为样地中荒漠草地、交错带和柠条灌丛各75个巴氏罐3 d所捕获的甲虫个体数。
物种多样性(H′)分析采用Shannon-Wiener多样性指数,计算公式为:H′=-∑PilnPi,式中Pi=Ni/N,Pi是第i种个体数占总个体数的比率,Ni是第i种的个体数,N是总个体数;均匀度(J)分析采用Pielou均匀度指数,计算公式为:J=H′/lnS,S是物种数;优势度(C)分析采用Simpson优势度指数,计算公式为:C = ∑(ni/N)2[28- 29]。丰富度以物种数(NS)表示。
边缘效应强度(E):E=mY/∑yi,令由m个群落所形成的交错区的这一指标为Y,m个群落的这一指标为yi(yi= 1, 2, 3,…,m) 。再以Shannon-Wiener 多样性指数(H′)和Berger-Parker优势度指数(C) 这两个定量指标去拟合上述公式,则可得出分别由H′值和C值计算出的边缘效应值EH′和EC:EH′=m H′/∑Hi′,EC=mC/∑Ci。式中H′为群落组成的交错带地表甲虫的多样性指数;Hi′为各群落里地表甲虫的生物多样性指数;C为群落组成的交错带里地表甲虫的优势度;Ci为各个群落里地表甲虫的优势度指数[30]。
利用SPSS16.0对拟步甲和环境数据的显著性检验:对服从正态分布或转换后服从正态分布的数据,采用单因素方差以及Tukey多重比较分析荒漠草地、交错带以及柠条灌丛间拟步甲虫科的物种数、活动密度、多样性、均匀度以及优势度的差异。采用Pearson相关系数分析拟步甲昆虫个体数量在各样带的分布的相关性。采用多元线性逐步回归(stepwise)分析检验拟步甲昆虫的丰富度、活动密度、多样性、均匀度以及优势度与植被特征之间的关系。
基于Bray-Curtis相似性系数,使用统计软件PAST进行主坐标分析(PCoA)排序[16- 17],对柠条灌丛内部、边缘以及荒漠草地间拟步甲昆虫群落的组成进行分析。典范对应分析(CCA)使用软件CANOCO4.5和CANODRAW4. 0对环境数据和物种数据采用log10(x+1)进行处理后排序分析,得到环境因子间的相关性[31]。
2结果与分析
2.1拟步甲昆虫群落种类组成
调查共采集拟步甲昆虫1405只,分属8属13种(表1)。其中克小鳖甲和弯齿琵甲个体数量最多,分别占总个体数的32.74%和43.27%,为该地区的优势种类。蒙古漠王、小皮鳖甲、异距琵甲、奥氏真土甲、网目土甲和淡红毛隐甲个体数量在1%—10%之间,为该地区常见类群。小丽东鳖甲、钝齿琵甲、异形琵甲、边粒琵甲和达氏琵甲个体数量少于1%,为该地区稀有类群。
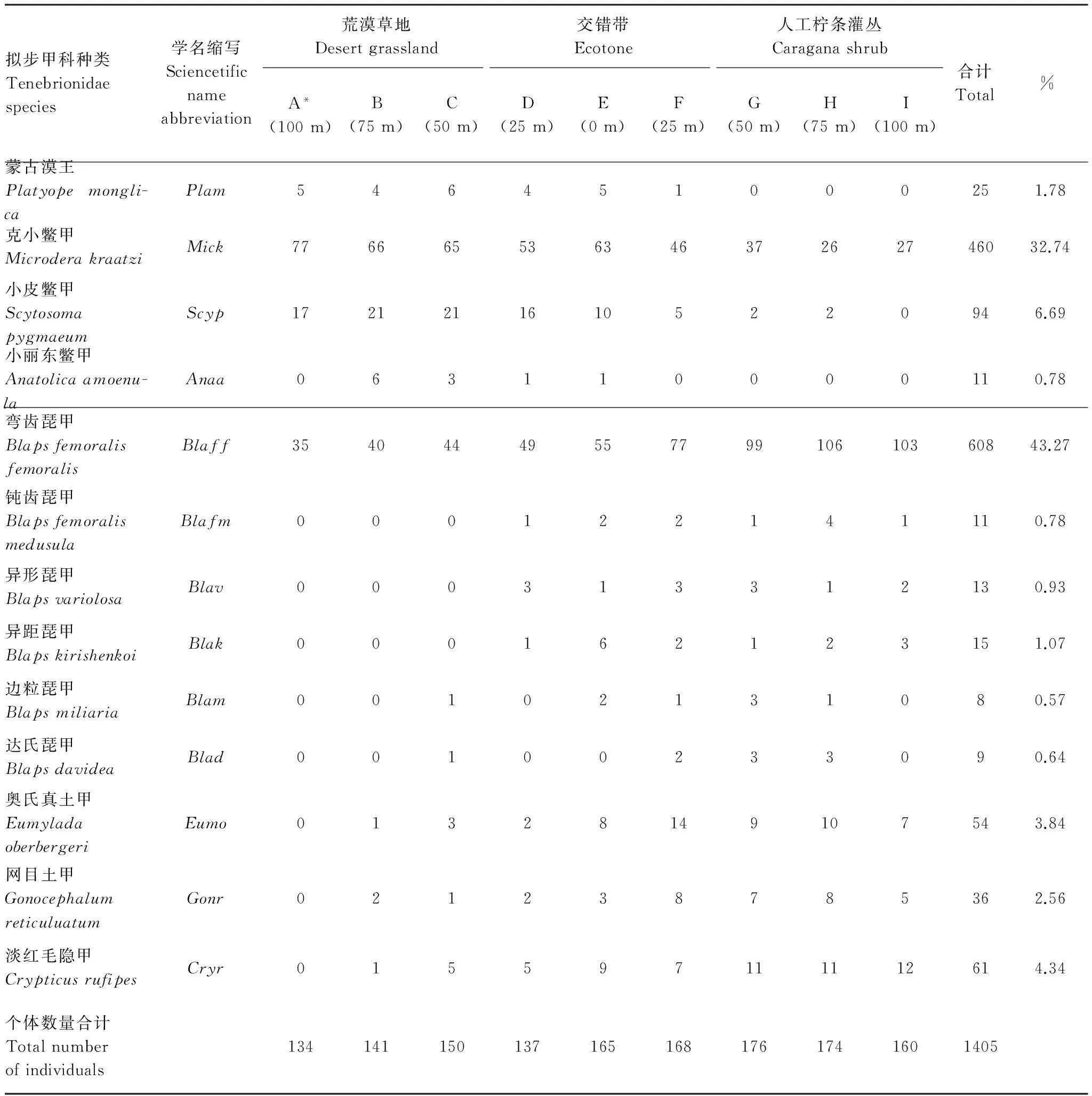
表1 不同样带拟步甲昆虫的组成和数量分布
*研究样带

图2 不同边缘距离的拟步甲昆虫群落丰富度和个体数 Fig.2 Abundance and individuals of darkling beetles community in different transect
2.2不同边缘距离拟步甲昆虫分布
对距边缘不同距离的拟步甲昆虫群落丰富度和个体数量进行比较,结果见图2。柠条灌丛和荒漠草地的拟步甲昆虫丰富度基本上沿边缘分别向柠条灌丛和荒漠草地内部降低,且总体上以柠条灌丛内部的丰富度高于荒漠草地内部,但各样带间差异不显著(F=1.345, df=8,P=0.2536)。个体数量沿边缘向荒漠草地内部降低,沿边缘向柠条灌丛内部先升高后降低,各样带间差异亦不显著(F=0.197, df=8,P=0.9896)。
优势种在不同样带的分布见图3。克小鳖甲在各个样带均有分布,个体数量沿荒漠草地、交错带到柠条灌丛内部呈现逐渐降低,样带间分布差异不显著;弯齿琵甲的个体数量在各样带的分布与克小鳖甲显著负相关(r=-0.965,P<0.0001),且各样带间差异显著(F=2.827,df=8,P=0.0153)。二者沿距离梯度的分布特征,表明这两个物种对生境的广适性,但克小鳖甲的分布趋向于沙生荒漠环境,弯齿琵甲的分布趋向于干旱半干旱腐殖质较丰富的土壤环境。
常见种蒙古漠王、小皮鳖甲在各样带的分布偏向于喜好荒漠草地,尤其是蒙古漠王在柠条灌丛没有分布。异距琵甲、奥氏真土甲、网目土甲和淡红毛隐甲在各样带的分布则偏向于喜好柠条灌丛,在荒漠草地分布很少,尤其是异距琵甲在荒漠草地内部没有分布。

图3 优势种和常见种在不同样带的数量分布Fig.3 Quantitative distribution of dominant and common species of darkling beetles community in different transect
2.3拟步甲昆虫群落多样性及边缘效应分析
不同生境拟步甲昆虫群落多样性特征见表2。交错带的拟步甲群落的丰富度高于荒漠草地和柠条灌丛,交错带和荒漠草地拟步甲丰富度差异显著。拟步甲群落Shannon-Wiener多样性变化趋势与丰富度一致,但3种生境间差异不显著。均匀度以荒漠草地最大,柠条灌丛最小,荒漠草地与柠条灌丛差异显著。优势度以柠条灌丛最高,交错带最低,二者差异显著。活动密度表现为从柠条灌丛、交错带到荒漠草地逐渐降低,但差异显著。

表2 不同生境拟步甲昆虫群落多样性比较
*同列数据间不同字母表示差异显著(P<0.05)
从基于拟步甲昆虫群落组成为属性的主坐标排序图看(第1和第2轴分别解释了60.49%和24.08%的变异)(图4),荒漠草地内部和柠条灌丛内部几乎没有重叠,说明荒漠和柠条拟步甲昆虫群落的差异很明显,而交错带分别与荒漠草地、柠条灌丛都有较大重叠,具有这两个生境拟步甲昆虫群落的特征,其物种组成来自周边生境的扩散。

图4 以拟步甲群落组成为属性的对荒漠草地、交错带及人工柠条灌丛生境的主坐标排序图Fig.4 Ordination plot (PCoA, Principal Coordinate Analysis) of the range of pitfall catches per trap location in desert grassland, caragana shrub-desert grassland ecotone and caragana shrub
边缘效应强度是对边缘效应的强弱进行测量的定量指标,据王伯荪等所组建的测度模型[30]来计算,EH′=1.22>1,EC=0.76(变换为倒数为1.31>1),可以看出这种边缘类型呈正的边缘效应作用。
2.4拟步甲昆虫群落多样性时间变化
拟步甲昆虫群落多样性时间变化见图5。在整个调查期,交错带的拟步甲昆虫丰富度比荒漠草地和柠条灌丛内部高(表2),但从不同月份调查看,荒漠草地、交错带到柠条灌丛3种生境变化较大;3种生境拟步甲群落丰富度随调查时间变化趋势亦不完全一致,荒漠草地随时间降低,交错带和柠条灌丛变化趋势一致,6月至8月的丰富度较高,变化不大,9月和10月有较大降低。活动密度的月份变化与整个调查期的总趋势基本相符,从柠条灌丛、交错带到荒漠草地依次逐渐递减;3种生境拟步甲活动密度变化趋势一致,在8月最高。物种多样性月份变化在调查中期(7—9月)与整个调查期的总和趋势一致,而6月和10月则不同;荒漠草地拟步甲物种多样性随月份逐渐降低,交错带和柠条灌丛的变化趋势一致,在7月份出现最高峰。均匀度、优势度的月份变化与整个调查期的总和趋势不同,且在荒漠草地、交错带及柠条灌丛3种生境的月份变化趋势亦不一致。
优势种克小鳖甲各月份间个体数量差异显著(F=15.069,df=4,P=0.0001),在7月份数量最多,10月份最低,6月和9月数量相当。弯齿琵甲各月份间个体数量差异亦显著(F=10.065,df=4,P=0.0001),在8月份数量最多,6月次之,10月份最低。

图5 荒漠草地、交错带和人工柠条灌丛拟步甲昆虫活动密度、多样性、均匀度、丰富度和优势度以及优势种个体数量的时间变化Fig.5 Monthly changes of activity density, diversity, evenness, richness and dominance of darkling beetles in desert grassland, caragana shrub-desert grassland ecotone and caragana shrub and number of individuals of dominant species
2.5拟步甲昆虫群落与植被特征的相关性
由表3可以看出,不同研究样带的植物Shannon-Wiener多样性差异不显著,表现为柠条灌丛(G、H、I带)>荒漠草地(A、B、C带)>交错带(D、E、F带)的趋势。植被密度沿柠条灌丛、交错带到荒漠草地降低,不同样带间差异不显著。植被盖度变化总趋势表现为交错带>荒漠草地>柠条灌丛,但不同样带间差异不显著。植被高度变化总趋势表现为荒漠草地>柠条灌丛>交错带,不同样带间差异显著(F=3.024,df=8,P=0.0244)。
以表1各样带拟步甲昆虫的组成和表3各样带的植被特征为属性进行典范对应分析(CCA)(图6,表4),Axis1和Axis2的特征值分别为0.163和0.014,累计达到总特征值(0.183)的89.12%和96.56%;与Axis1关系最大的是植被密度,相关系数为-0.7863(permutation test,F=4.491,P=0.008),为负相关,其次为植被高度,为负相关,可以认为Axis1是一个植被密度变化轴,沿该轴方向植被密度有降低的趋势;与Axis2关系最大的是植被盖度,相关系数为0.6895,沿该轴方向植被盖度有升高趋势。优势种克小鳖甲分布于植被高度和盖度正相关,与植被多样性和密度负相关;弯齿琵甲分布于植被盖度负相关,与植被高度、植被多样性和密度正相关。CCA排序图也直观的显示了9个样带和13个拟步甲物种随植被特征变化的分布。从柠条灌丛、交错带到荒漠草地沿Axis1方向排列。蒙古漠王、小皮鳖甲和小丽东鳖甲分布偏好于荒漠草地;克小鳖甲和弯齿琵甲接近坐标的原点,克小鳖甲更靠近荒漠草地,弯齿琵甲则距离柠条灌丛一侧较近;琵甲属Blaps的另外5个种、奥氏真土甲、网目土甲和淡红毛隐甲趋向于柠条灌丛一侧及交错带分布。

表3 不同研究样带的植被特征
*同列数据间不同字母表示差异显著(P<0.05)

图6 拟步甲物种、样带与环境因子的CCA排序图 Fig.6 CCA two-dimensional ordination diagram of darkling beetles between plots and vegetation characteristics

植被特征VegetationcharacteristicsAX1AX2植物群落多样性Shannon-Wienerdiversityindexofplantcommunity(HP)-0.5574-0.089植被密度Plantdensity(DP)-0.7863-0.4344植被高度Vegetationheight(VH)0.5946-0.278植被盖度Plantcoverage(CP)0.40780.6895
对拟步甲昆虫物种数、活动密度、多样性、均匀度以及优势度与表4的植被特征进行多元回归检验见表5,植被密度是影响拟步甲活动密度(r2=0.635,F=12.152,P=0.01)的决定因素、植被盖度是影响拟步甲昆虫均匀度(r2=0.529,F=7.856,P=0.026)的决定因素;植被高度影响拟步甲昆虫的丰富度(r2=0.565,F=9.074,P=0.02)。植被特征对拟步甲的物种多样性没有显著的回归关系。对优势种克小鳖甲和弯齿琵甲的回归分析显示,其活动密度由植被密度(r2=0.584,F=9.835,P=0.016;r2=0.689,F=15.509,P=0.006)决定。
表5植被特征与拟步甲昆虫活动密度、丰富度、多样性、均匀度及优势度间回归分析
Table 5Regression analysis of vegetation characteristics and activity density, richness,diversity, evenness and dominance e of darkling beetles

回归模型RegressionmodelFr2/P活动密度Activitydensity AD=25.706+0.167DP12.1520.635/0.01均匀度Evenness J=0.569+0.005CP7.8560.529/0.026丰富度Richness C=9.272-0.221VH9.0740.565/0.02克小鳖甲活动密度ActivitydensityofMicroderakraatzi MAD=16.229-0.182DP9.8350.584/0.016弯齿琵甲活动密度ActivitydensityofBlapsfemoralisfemoralis BAD=3.181-0.313DP15.5090.689/0.006
3讨论
本研究表明,在群落水平上,拟步甲昆虫群落的丰富度和个体数量总体上表现为从柠条灌丛内部及交错带到荒漠草地降低的趋势,虽然没有达到显著差异,但说明通过种植人工固沙的柠条灌丛,是有利于提高荒漠生态系统拟步甲昆虫群落的组成和数量的。这一结果和其他的灌木林生态系统的研究相一致[32- 33],表明灌木覆盖对地表昆虫的丰富度和多样性具有促进作用,有学者分析是由于灌木覆盖的“顶篷”效应降低了地表生物和非生物环境的差异[34- 36]。目前已有研究表明,灌丛“顶篷”降低了对地表的太阳辐射和地表极温[37],可以截流更多雨水渗入地表[38- 39],落叶和种子易在灌木周围积累,为食草和腐食性昆虫提供丰富的食物资源[40],灌木周围相对温和的微环境可为地表昆虫提供安全的产卵场所[41],由此可以看出,灌木覆盖可明显的改变地表环境并能影响地表昆虫的聚集。本文研究显示柠条灌丛与荒漠草地拟步甲昆虫群落的丰富度和个体数量没有达到显著差异,可能和柠条灌丛的行间距较大有关,行间虽然有草本层,但总体覆盖度和高度又小于荒漠草地,导致沿人工柠条灌丛及交错带到荒漠草地的植被异质性较低。
从物种水平来看,拟步甲昆虫在人工柠条灌丛-荒漠草地交错带的分布可分为3种类型,优势种克小鳖甲和弯齿琵甲属于栖息地广布型,但二者并没有表现出十分均匀的适应性,而且他们在各样带的分布呈显著负相关,克小鳖甲的分布趋向于沙生荒漠环境,弯齿琵甲的分布趋向于干旱半干旱腐殖质较丰富的土壤环境(柠条灌丛);常见种蒙古漠王、小皮鳖甲的分布偏向于喜好荒漠草地;异距琵甲、奥氏真土甲、网目土甲和淡红毛隐甲的分布则偏向于喜好柠条灌丛。克小鳖甲、蒙古漠王和小皮鳖甲属于拟步甲科的漠甲亚科(Pimeliinae),弯齿琵甲、异距琵甲、奥氏真土甲、网目土甲和淡红毛隐甲属于拟步甲科的拟步甲亚科(Tenebrioninae),由此看出,拟步甲分类上的差异与生态适应相联系。数量排序中的每个物种在多个环境梯度上的空间位置反映了它们在分类学性状上的差异[42],本文CCA排序图显示生态学上拟步甲的每个物种在二维空间中特定的位置,反映了各个物种在人工柠条灌丛-荒漠草地交错带的分布情况,同样说明了分类地位相近的物种在生态适应上的趋同性[43]。
本文结果显示,植被群落多样性对拟步甲群落个体数量及多样性分布没有明显影响。植被密度影响拟步甲昆虫群落的优势种和个体数量,植被盖度和高度分别影响拟步甲群落的均匀度和丰富度。可以看出,沿荒漠草地-人工柠条灌丛交错带的植被特征对拟步甲昆虫群落的多样性的影响存在差异。在其他的群落交错带的地表甲虫群落研究也支持这一结果,环境变量在解释甲虫科丰富度、个体数量、多样性以及均匀度等方面并不一致[44],这可能与不同甲虫类群对特定环境变量的偏好和敏感性相关[45]。
主坐标分析(PCoA)排序表明人工柠条灌丛-荒漠草地交错带边缘的拟步甲昆虫群落与柠条灌丛内部的群落组成没有明显分化,但柠条灌丛内的拟步甲群落正处于与荒漠草地逐渐分化的趋势,边缘的EH′值大于1,说明这种边缘类型呈正的边缘效应作用。一般情况下,栖境边缘地带常会有新的微观环境(包括生物和非生物两方面),可能导致有高的生物多样性[46]。已有关于森林边缘的地表甲虫的研究,一般表现正的边缘效应[9],也有表现为负的边缘效应[10,47],分析原因是因为中度干扰提高了边缘的多样性,而强度干扰降低了边缘的多样性。在本研究区域,交错带的拟步甲群落多样性和丰富度均高于相邻生境,与同类型的交错带地表甲虫多样性研究结果不完全一致[24]。人工柠条灌丛内部的拟步甲昆虫群落物种丰富度、个体数量及物种多样性都表现出较荒漠草地高的趋势,尤其是一些拟步甲亚科的种类偏好于柠条灌丛生境分布,说明种植柠条正在减缓荒漠草地的沙化进程,柠条灌丛-荒漠草地交错带的拟步甲昆虫群落正趋于向柠条灌丛生境下的群落组成演替。
致谢:中国科学院动物研究所于晓东副研究员对本文写作给予帮助,宁夏盐池县农牧科学研究所彭文栋所长对野外调查工作给予支持,贺奇和白兴龙协助实验,特此致谢。
参考文献(References):
[1]Fahrig L. Effects of habitat fragmentation on biodiversity. Annual Review of Ecology, Evolution, and Systematics, 2003, 34(1): 487- 515.
[2]杨芳, 贺达汉. 生境破碎化对生物多样性的影响. 生态科学, 2006, 25(6): 564- 567.
[3]Gehlhausen S M, Schwartz M W, Augspurger C K. Vegetation and microclimatic edge effects in two mixed-mesophytic forest fragments. Plant Ecology, 2000, 147(1): 21- 35.
[4]Yu X D, Luo T H, Zhou H Z. Distribution of carabid beetles (Coleoptera, Carabidae) across ecotones between regenerating and mature forests in Southwestern China. Environmental Entomology, 2009, 38(4): 1053- 1060.
[5]Ewers R M, Didham R K. Confounding factors in the detection of species responses to habitat fragmentation. Biological Reviews of the Cambridge Philosophical Society, 2006, 81(1): 117- 142.
[6]Davies K F, Margules C R. Effects of habitat fragmentation on carabid beetles: experimental evidence. Journal of Animal Ecology, 1998, 67(3): 460- 471.
[7]Yu X D, Luo T H, Zhou H Z, Yang J. Distribution of carabid beetles (Coleoptera, Carabidae) across a forest-grassland ecotone in Southwestern China. Environmental Entomology, 2007, 36(2): 348- 355.
[8]Didham R K, Ghazoul J, Stork N E, Davis A J. Insects in fragmented forests: a functional approach. Trends in Ecology & Evolution, 1996, 11(6): 255- 260.
[9]Heliölä J, Koivula M, Niemelä J. Distribution of carabid beetles (Coleoptera, Carabidae) across a boreal forest-clearcut ecotone. Conservation Biology, 2001, 15(2): 370- 377.
[10]Kotze D J, Samways M J. Invertebrate conservation at the interface between the grassland matrix and natural Afromontane forest fragments. Biodiversity & Conservation, 1999, 8(10): 1339- 1363.
[11]Magura T. Carabids and forest edge: spatial pattern and edge effect. Forest Ecology and management, 2002, 157(1- 3): 23- 37.
[12]Magura T, Elek Z, Tóthmérész B. Impacts of non-native spruce reforestation on ground beetles. European Journal of Soil Biology, 2002, 38(3): 291- 295.
[14]Barbosa O, Marquet P A. Effects of forest fragmentation on the beetle assemblage at the relict forest of Fray Jorge, Chile. Oecologia, 2002, 132(2): 296- 306.
[15]Magura T, Tóthmérész B, Molnár T. Forest edge and diversity: carabids along forest-grassland transects. Biodiversity & Conservation, 2001, 10(2): 287- 300.
[16]Máthé I. Forest edge and carabid diversity in a Carpathian beech forest. Community Ecology, 2006, 7(1): 91- 97.
[17]于晓东, 罗天宏, 周红章, 杨建. 边缘效应对卧龙自然保护区森林-草地群落交错带地表甲虫多样性的影响. 昆虫学报, 2006, 49(2): 277- 286.
[18]Andresen E. Effect of forest fragmentation on dung beetle communities and functional consequences for plant regeneration. Ecography, 2003, 26(1): 87- 97.
[19]Lövei G L, Magura T, Tóthmérész B, Ködöböcz V. The influence of matrix and edges on species richness patterns of ground beetles (Coleoptera: Carabidae) in habitat islands. Global Ecology and Biogeography, 2006, 15(3): 283- 289.
[20]Gaublomme E, Hendrickx F, Dhuyvetter H, Desender K. The effects of forest patch size and matrix type on changes in carabid beetle assemblages in an urbanized landscape. Biological Conservation, 2008, 141(10): 2585- 2596.
[21]Ewers R M, Thorpe S, Didham R K. Synergistic interactions between edge and area effects in a heavily fragmented landscape. Ecology, 2007, 88(1): 96- 106.
[22]Sanchez B C, Parmenter R R. Patterns of shrub-dwelling arthropod diversity across a desert shrubland-grassland ecotone: a test of island biogeographic theory. Journal of Arid Environments, 2002, 50(2): 247- 265.
[23]张大治, 马艳, 李岳诚, 于有志, 贺达汉. 小尺度下柠条林破碎化生境对地表甲虫多样性的影响. 应用昆虫学报, 2013, 50(4): 934- 941.
[24]王巍巍, 贺达汉, 张大治. 荒漠景观地表甲虫群落边缘效应研究. 应用昆虫学报, 2013, 50(5): 1383- 1391.
[25]杨贵军, 贺海明, 王新谱. 盐池荒漠草地拟步甲昆虫群落时间结构和动态. 应用昆虫学报, 2012, 49(6): 1610- 1617.
[26]Martin J E H. The Insects and Arachnids of Canada, Part 1: Collecting, Preparing, and Preserving Insects, Mites, and Spiders. Hull, Quebec: Supply and Services Canada, 1978: 1- 182.
[27]Meiners S J, Pickett S T A. Changes in community and population responses across a forest-field gradient. Ecography, 1999, 22(3): 261- 267.
[28]赵志模, 郭依泉. 群落生态学原理与方法. 重庆: 文献和科学技术出版社, 1990: 147- 279.
[29]马克平, 刘玉明. 生物群落多样性的测度方法:α-多样性. 生物多样性, 1994, 2(4): 231- 239.
[30]王伯荪, 彭少麟. 鼎湖山森林群落分析——X. 边缘效应. 中山大学学报: 自然科学版, 1986, (4): 52- 56.
[31]张金屯. 数量生态学. 北京: 科学出版社, 2004: 120- 176.
[32]Stapp P. Microhabitat use and community structure of darkling beetles (Coleoptera: Tenebrionidae) in shortgrass prairie: effects of season shrub and soil type. American Midland Naturalist, 1997, 137(2): 298- 311.
[33]Mazía C N, Chaneton E J, Kitzberger T. Small-scale habitat use and assemblage structure of ground-dwelling beetles in a Patagonian shrub steppe. Journal of Arid Environments, 2006, 67(2): 177- 194.
[34]Liu J L, Li F R, Liu C A, Liu Q J. Influences of shrub vegetation on distribution and diversity of a ground beetle community in a Gobi desert ecosystem. Biodiversity & Conservation, 2012, 21(10): 2601- 2619.
[35]Cushman J H, Waller J C, Hoak D R. Shrubs as ecosystem engineers in a coastal dune: influences on plant populations, communities and ecosystems. Journal of Vegetation Science, 2010, 21(5): 821- 831.
[36]Barber N A, Marquis R J. Leaf quality, predators, and stochastic processes in the assembly of a diverse herbivore community. Ecology, 2011, 92(3): 699- 708.
[37]Valiente-Banuet A, Ezcurra E. Shade as a cause of the association between the cactusNeobuxbaumiatetetzoand the nurse plantMimosaluisanain the Tehuacan Valley, Mexico. Journal of Ecology, 1991, 79(4): 961- 971.
[38]Li X Y, Liu L Y, Gao S Y, Ma Y J, Yang Z P. Stemflow in three shrubs and its effect on soil water enhancement in semiarid loess region of China. Agricultural and Forest Meteorology, 2008, 148(10): 1501- 1507.
[39]Wang X P, Wang Z N, Berndtsson R, Zhang Y F, Pan Y X. Desert shrub stemflow and its significance in soil moisture replenishment. Hydrology and Earth System Sciences, 2011, 15(2): 561- 567.
[40]Li F R, Wang T, Zhang A S, Zhao L Y, Kang L F, Chen W. Wind-dispersed seed deposition patterns and seedling recruitment ofArtemisiahalodendronin a moving sandy land. Annals of Botany, 2005, 96(1): 69- 80.
[41]Titus J H, Nowak R S, Smith S D. Soil resource heterogeneity in the Mojave Desert. Journal of Arid Environments, 2002, 52(3): 269- 292.
[42]Irmler U, Hoernes U. Assignment and evaluation of ground beetle (Coleoptera: Carabidae) assemblages to sites on different scales in a grassland landscape. Biodiversity & Conservation, 2003, 12(7): 1405- 1419.
[43]杨贵军, 贺奇, 王新谱. 盐池四墩子拟步甲昆虫群落组成与环境因子的相关性. 应用生态学报, 2010, 21(9): 2375- 2382.
[44]于晓东, 罗天宏, 周红章. 林业活动和森林片断化对甲虫多样性的影响及保护对策. 昆虫学报, 2006, 49(1): 126- 136.
[45]Humphrey J W, Haws C, Peace A J, Ferris-Kaan R, Jukes M R. Relationships between insect diversity and habitat characteristics in plantation forests. Forest Ecology and Management, 1999, 113(1): 11- 21.
[46]Murcia C. Edge effects in fragmented forests: implications for conservation. Trends in Ecology & Evolution, 1995, 10(2): 58- 62.
[47]于晓东, 罗天宏, 杨建, 周红章. 卧龙自然保护区落叶松林不同恢复阶段地表甲虫的多样性. 动物学研究, 2006, 27(1): 1- 11.
Diversity of darkling beetle community in the artificial cultivationCaraganaintermediashrub-desert grassland ecotone in Yanchi County, Ningxia, China
YANG Guijun1,*, WANG Xinpu2,3, JIA Yanxia2, ZHANG Dazhi1
1SchoolofLifeSciences,NingxiaUniversity,Yinchuan750021,China2SchoolofAgriculture,NingxiaUniversity,Yinchuan750021,China3KeyLaboratoryforRestorationandReconstructionofDegradedEcosysteminNorthwesternChinaofMinistryofEducation,NingxiaUniversity,Yinchuan750021,China
Abstract:Forty-five percent of darkling beetle species recorded in China occur in the northern arid and semi-arid areas. Some ecological studies have suggested that tenebrionid beetles can be used as effective indicators of vegetation degradation and soil desertification in desert ecosystems because they are well-adapted desert conditions. Large areas of artificial shrubland have been established on China′s desert steppe, but little is known about how this shrubland influence ground-dwelling arthropods. We studied the distribution of darkling beetles (Coleoptera: Tenebrionidae) across the ecotone between man-made Caragana intermedia shrubland and natural desert steppe to evaluate the effects of desert vegetation restoration on ground-dwelling beetle assemblages in Northwestern China. Using pitfall traps, beetles were sampled along five transects crossing the boundary between the artificial shrubland and natural desert steppe. The study was conducted from June to October in 2012 in Yanchi, Ningxia, Northwestern China. A total of 1405 tenebrionid beetles were collected, belonging to 13 species and 8 genera. Of these species, Microdera kraatzi and Blaps femoralis femoralis were the most common, accounting for 32.74% and 43.27% of all individuals, respectively. Darkling beetles were divided into three groups by habitat: (1) habitat generalists, which were numerous in all habitats, e.g., M. kraatzi and B. femoralis femoralis (M. kraatzi was most abundant in sandy steppe, while B. femoralis femoralis occurred mostly in shrubland); (2) desert steppe specialists, e.g., Platyope monglica and Scytosoma pygmaeum; and (3) shrub specialists, e.g., Blaps kirishenkoi, Eumylada oberbergeri, Gonocephalum reticuluatum, and Crypticus rufipes. Species richness and Shannon-Wiener diversity were higher at the boundary between shrubland and desert steppe than in either habitat, and abundance was greatest in shrubland, declining towards the desert steppe. However, there were no statistically significant differences between these three indices among the three habitats. Seasonal variation in Shannon-Wiener diversity in the desert steppe was similar to that in shrubland. Activity density in the three habitats were shown with the similar seasonal changes. Analysis of the intensity of edge effects showed positive effects at the edge. Canonical correspondence analysis (CCA) suggested that related species occupied similar habitats. Multiple linear regression showed that vegetation density was related to the activity density of the dominant species, and the vegetation cover and height were important factors associated with beetle evenness and richness indices. Principal coordinate analysis (PCoA) showed that beetle assemblages at the ecotone between the artificial Caragana shrubland and desert steppe showed no significant difference with those in the interior of the artificial Caragana shrubland, suggesting that the community structure of darkling beetles at the ecotone was changing to resemble the assemblages in shrubland.
Key Words:darkling beetles; edge effects; diversity; Caragana intermedia shrub-desert grassland ecotone
DOI:10.5846/stxb201405271085
*通讯作者
Corresponding author.E-mail: yang_gj@nxu.edu.cn
收稿日期:2014- 05- 27; 网络出版日期:2015- 06- 12
基金项目:国家自然科学基金项目(31160435, 31360511)
杨贵军, 王新谱, 贾彦霞, 张大治.人工柠条-荒漠草地交错带拟步甲昆虫群落多样性.生态学报,2016,36(3):608- 619.
Yang G J, Wang X P, Jia Y X, Zhang D Z.Diversity of darkling beetle community in the artificial cultivationCaraganaintermediashrub-desert grassland ecotone in Yanchi County, Ningxia, China.Acta Ecologica Sinica,2016,36(3):608- 619.
