固定化三角褐指藻对海水中壬基酚的去除和降解作用研究
2016-04-07柴囡囡王朋涛李正炎
柴囡囡, 王朋涛, 郭 蕾, 李正炎,2
(中国海洋大学1. 环境科学与工程学院; 2.海洋环境与生态教育部重点实验室, 山东 青岛 266100)
固定化三角褐指藻对海水中壬基酚的去除和降解作用研究
柴囡囡1, 王朋涛1, 郭蕾1, 李正炎1,2
(中国海洋大学1. 环境科学与工程学院; 2.海洋环境与生态教育部重点实验室, 山东 青岛 266100)
摘要:壬基酚是一种具有雌激素效应的内分泌干扰物,同时具有致癌作用。壬基酚在水环境中广泛存在,但是目前对其有效去除的技术有限。本文研究并比较了海藻酸钠包埋固定的三角褐指藻与悬浮自由藻对海水中壬基酚的去除和降解能力,实验设置了2个壬基酚浓度组,分别为低浓度组(1μg/L)和高浓度组(10μg/L)。结果表明:在2个浓度组中固定化藻细胞和自由藻细胞的细胞密度和叶绿素a浓度在168h的处理时间内均呈现类似的增长趋势;168h后,固定化藻细胞和自由藻细胞对壬基酚的去除率和降解率均达到95%左右。由于固定化藻珠具有易收获、可生产生物能源等优点,因此固定化三角褐指藻更适合于海水中壬基酚的去除。
关键词:壬基酚; 三角褐指藻; 固定化微藻; 生物降解; 水环境
壬基酚(Nonylphenol, NP)是壬基酚聚氧乙烯醚(Nonylphenol Ethoxylates, NPEOs)的降解产物。NP作为分散剂、洗涤剂、增塑剂等,广泛应用于造纸、皮革、化妆品、建材以及塑料等行业,与人们的日常生活关系密切[1]。NP及其母体化合物NPEOs主要通过污废水排放进入环境,对许多生物产生不同程度的危害,主要包括生殖系统和生物机体发育、内分泌系统、免疫系统以及致癌作用等[2],1996年美国环保署将NP列在有毒物质控制法的条例中。中国环境中NPEOs的排放量约占世界排放量的10%[3-4],研究表明中国近岸海水中的壬基酚已经达到了相当高的风险水平,对海洋生物及人类产生了很大的威胁[5-6]。NP已经对人类社会发展造成了显著影响,对其降解和去除已是十分迫切。现有的污水处理系统不能有效去除NP[7],因此迫切需要研发更加高效去除NP的方法和技术,以降低其生态和健康风险。
海洋微藻是海洋生态系统中的主要生产者,其体积小、营养丰富、对环境适应能力强[8],藻细胞中含有多种活性物质。微藻可以有效富集、降解包括偶氮染料、烷烃、重金属、营养物质等多种污染物[9]。相对于自由悬浮藻,利用固定化微藻吸附降解有毒难降解有机污染物具有操作简单、可耐受高浓度有毒物质等特点。本文利用海藻酸钠对三角褐指藻进行包埋固定,研究比较了固定化与自由藻细胞的生长和生理特征,及其对海水中NP的去除效果,为使用固定化微藻技术去除近岸海水中的NP提供了初步的理论依据。
1材料与方法
1.1 标准品、试剂及材料
NP(标准品,Sigma-Aldrich公司,美国)配成1 g/L的单标储备液。色谱用试剂均为色谱纯级,购于美国Tedia公司,其他的化学试剂为分析纯级。
三角褐指藻(Phaeodactylumtricornutum),由中国海洋大学海洋生命学院提供。采用f/2培养基[10],将接有藻种的三角瓶置于GXZ-280B型光照培养箱中培养。培养条件为:温度(20±3)℃,光照强度100 μmol·s-1·m-2,光暗比为12 h∶12 h。
1.2 微藻固定化和去固定化
将进入对数生长期的三角褐指藻(初始细胞密度为2.7×106cell·mL-1)离心浓缩(5000r/m,10min),弃去上清液后用无菌过滤海水重复离心2次,最后将藻细胞悬浮在无菌过滤海水中,按一定比例(体积比4∶3)与2.5% (g/g)海藻酸钠溶液均匀混合,用蠕动泵(BT100-2J型,保定兰格恒流泵有限公司)匀速(3.2mL/min)滴入2.5%预冷的氯化钙溶液,产生均匀的固定化藻珠,藻珠直径为(3.0±0.2) mm,在氯化钙溶液中进一步硬化(4 ℃,至少24 h)[11]。空白海藻酸钠珠的制备用无菌海水替代细胞悬浮液,其余与上述步骤基本相同。经硬化,2种藻珠在实验前均用无菌海水清洗2次。
取一定数量藻珠放入5%的柠檬酸钠溶液中,充分振荡即可实现藻细胞的去固定。所有实验过程均在无菌条件下完成。
1.3 实验设计
将NP单标储备液稀释为1μg/L (低浓度组)和10μg/L (高浓度组)。每组分别按下列条件进行培养(1)固定化藻珠组:加入160个藻珠(初始叶绿素a浓度为0.4mg/L);(2)自由藻细胞组:加入一定体积的藻悬浮液(叶绿素a浓度与固定化藻珠组相同);(3)固定化空白珠组:加入160个空白珠;(4)对照组:不加任何藻或空白珠的壬基酚溶液设置为空白对照。每组设置3个平行,实验周期为168h,每隔一定时间取样测定藻细胞数量、叶绿素a浓度和NP残余量。
1.4 微藻生长和生理特征
分别在第24、96和168h,从各处理组中随机取出5mL溶液和15个藻珠。
将取出的15个藻珠随机分成3组,并分别浸没在5mL 5%柠檬酸钠溶液中脱固定。第一组用来测定藻细胞密度,使用血球计数板在光学显微镜(Optika Microscopes,意大利)下计数2次。第二组用来测定叶绿素a浓度[12],脱固定后藻液置于离心管中,在5 000r/m下离心10min, 弃去上清液,加入5mL 95% 甲醇混匀,水浴(60 ℃)加热5min后再次离心10min后取上清液,使用紫外分光光度计(TU-1810型,北京普析通用仪器有限公司)以95%甲醇溶液作空白,分别在665和652nm波长下测定吸光度,并按照下式计算提取液中叶绿素a浓度Ca:Ca=16.29 ×A665- 8.54 ×A652。
1.5 NP的测定
所取的5mL溶液和第三组藻珠用来测定NP残余量(包括被海藻酸钠吸附的NP、藻细胞对NP的吸收/吸附量以及残留在培养液中的NP)。针对固定化藻珠组,藻珠脱固定后离心15min,上清液用于测定吸附在海藻酸钠中的NP,沉淀的藻泥用于测定藻细胞的吸收/吸附量。针对自由藻细胞组,5mL藻液先在4 ℃下离心15min,上清液用于测定溶液中的NP残余量。对于固定化空白珠组,5mL溶液用于测定溶液中NP的残余量,空白珠脱固定化后用于测定海藻酸钠中NP的吸附量。
溶液中的NP用液-液萃取法提取,即水样中先加入50 μL 2mg/L的替代标准(庚基苯酚)和少量NaCl(经450 ℃马弗炉下灼烧6h),用5mL二氯甲烷重复萃取2次,再氮吹,最后加衍生化试剂(BSTFA)和内标用正己烷定容到0.5mL[13]。沉淀的藻泥用5mL二氯甲烷萃取,先用液氮冻融2次,再用细胞破碎仪破碎2次(每次5min,期间工作3s,间隔3s),其后处理方法同上。
NP的定量分析采用气相色谱-质谱联用仪(G1701DA,安捷伦科技公司,美国),色谱柱为HP-5(30m×0.25mm×0.25μm),采用选择离子模式定量,进样器和检测器的温度分别为280和300 ℃。测定过程升温程序如下:初始温度80 ℃,停留2min后,以20 ℃/min的速率升到100 ℃,再以10 ℃/min的速率升到200 ℃,最后以20 ℃/min的速率升到280 ℃,停留3min。
NP去除率和降解率的计算公式如下:
NP去除率(%) = (初始NP-培养液中残余NP)/初始NP × 100%,
(1)
NP降解率(%)=(初始NP-培养液中残余NP-藻细胞吸收/吸附NP-海藻酸钠吸附NP)/初始NP×100%,
(2)
固定化藻珠组的NP生物降解率(%)=固定化藻珠组NP降解率-固定化空白珠组NP降解率,
(3)
自由藻细胞组的NP生物降解率(%)=自由藻细胞组NP降解率-对照组NP降解率。
(4)
1.6统计分析
数据采用SPSS 18.0软件进行统计分析,运用参数方差分析和多重比较检验不同处理组中NP浓度的差异显著性,P<0.05表示差异显著,P<0.01表示差异极显著[14]。
2结果和讨论
2.1 固定化对藻细胞生长生理活性的影响
处理过程中固定化藻和自由藻的生长情况如图1。随着处理时间的延长,2种处理藻的细胞密度与叶绿素a浓度均呈现上升趋势;在2种NP浓度(1、10μg/L)暴露下,固定化藻组中细胞密度的比生长速率分别为1.10和1.30d-1,均低于自由藻细胞组(分别为1.64、1.51d-1);在实验时间内,固定化藻的细胞密度均低于自由藻,而叶绿素a浓度正好相反。由表1可知,固定化藻细胞中叶绿素a的含量明显高于自由藻细胞,处理24h后两组有明显差异(P<0.05)。处理168h后,在低浓度和高浓度组固定化藻细胞中叶绿素a含量分别是自由藻细胞的2和1.5倍。

((a)(b)-NP初始浓度为1 μg/L的低浓度组;(c)(d)-NP初始浓度为10 μg/L的高浓度组。(a)(b)-Initial concentration of NP was 1 μg·L-1for low pollution load;(c)(d)-Initial concentration of NP was 10 μg·L-1for high pollution load.)
图1自由藻细胞组和固定化藻珠组中三角褐指藻的生长曲线
Fig.1Growth curves ofPhaeodactylumtriconutumin free and alginate-immobilized microalgal cultures
上述结果表明在逆境条件下固定化藻细胞密度低于自由藻细胞,这是由于藻珠本身的光穿透力、营养吸收过程以及O2和CO2的扩散等因素造成的[15-17]。但是,经过168 h的处理固定化藻细胞密度接近9×106cells/mL,说明三角褐指藻在固定化小球中依然可以生长良好。Trevan和Mak研究表明固定化可以提高三角褐指藻的合成代谢,改善了藻对遮荫、光限制条件的不适应性,提高了固定化藻细胞中叶绿素a的浓度[18]。海藻酸钠本身一般不会影响营养物质的扩散,但营养物质和CO2会先被海藻酸钠球体最外层的藻细胞吸收,导致里层的藻细胞可吸收的营养源变少,从而导致固定化藻组中大部分藻细胞集中在藻珠表面[19-20]。

表1 低浓度组和高浓度组中固定化藻细胞与自由藻细胞中叶绿素a含量的比较
2.2 固定化藻珠处理组和自由藻处理组不同组分中NP的残余量
对照组实验结果表明NP在海水溶液中的自然降解率为30%左右。由表2可知,在低浓度和高浓度NP处理组中,随着处理时间的延长固定化藻组和自由藻组中残余在藻细胞中的NP含量均逐渐减少,说明藻细胞对NP有较高的降解能力。对于固定化空白珠组,2个浓度组中海藻酸钠球体对NP均有较强的吸附能力。前人研究表明,海藻酸钠球体对NP的吸附过程类似于对营养物质的吸附,是一个简单的物理化学过程,可以在较短时间内完成[11]。Lang等的研究表明,NP与海藻酸钠球体间的高分子间作用(氢键结合、疏水作用等)可以有效促进其对NP的吸收[21]。
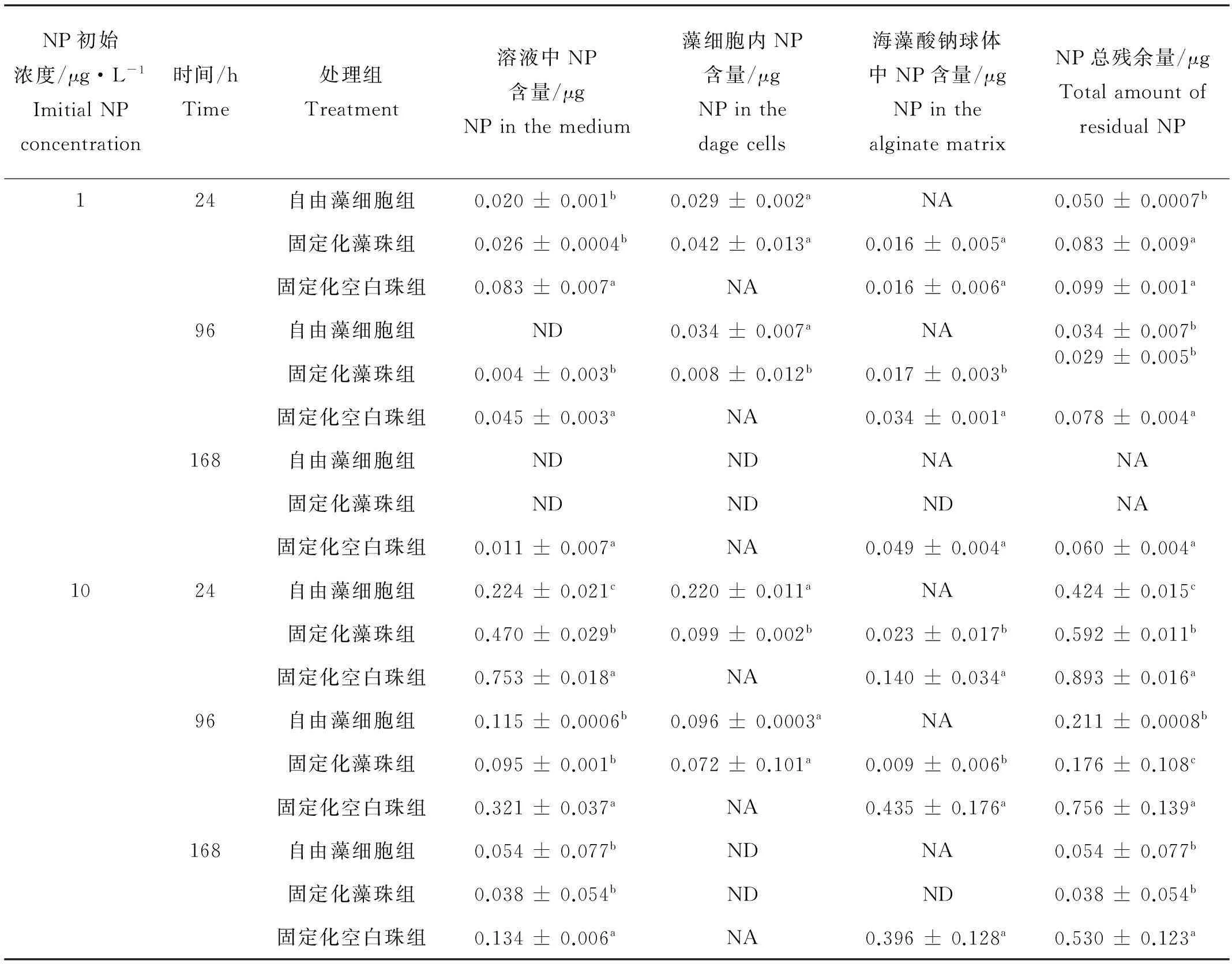
表2 各处理组中NP在溶液、藻细胞以及海藻酸钠中的残余量
注:1. ND:未检出;2. NA:无效值;3. 小写字母代表在0.05水平下各处理组间的差异显著性。1.ND:not detected;2.NA:not applicable;3.small letters mena significant difference at 0.05 level with each treatment
2.3 固定化藻细胞和自由藻细胞对NP的去除作用
固定化藻细胞对NP的去除过程包括海藻酸钠球体的吸附、藻细胞吸收/吸附、藻细胞生物降解以及非生物降解过程,除了海藻酸钠的吸附过程,自由藻细胞和固定化藻细胞去除NP的途径相同。
2.3.1 吸收/吸附过程对NP的去除作用由图2可知,2种NP初始浓度下,处理24 h后自由藻细胞中NP均出现了明显的降低,去除率接近80%,其他两个处理组去除率较低;96 h后,固定化藻珠组和自由藻细胞组对NP的去除已基本完成(都在90%左右);处理168 h后,固定化空白珠组中NP也出现明显的降低,去除率达到85%以上。
2.3.2 固定化藻细胞和自由藻细胞对NP的降解作用由图2可知,自由藻细胞和固定化藻细胞对NP的降解率远高于固定化空白珠。168 h后,固定化藻细胞组和自由藻细胞组中NP降解率均在95%以上,而固定化空白珠组只有40%左右。
固定化藻珠组的降解过程包括藻细胞的生物降解和非生物降解,而自由藻细胞的降解过程包括藻细胞的生物降解和自然降解。光照条件下藻对NP的生物降解作用主要包括3种情况:(1)藻光照后分泌的物质或部分破碎后释放的物质会产生氢氧自由基和其他活性氧物质从而促进NP的降解;(2) 藻光照后吸收的光能量转给藻表面的NP,促进NP直接降解;(3)光照会促使部分藻类细胞壁破碎,破碎细胞中会有脂类物质释放到水中,这些脂类物质也可能引发NP的降解[22]。根据表2以及公式(3)和(4),可得固定化藻细胞处理168 h后,低浓度组和高浓度组中NP的生物降解率分别为60%和49%,自由藻细胞处理组中NP的生物降解率分别为70%和65%。

此外,固定化藻珠具有易于收获、操作简便、不易被杂菌污染等优点,还可将收获的藻珠进行资源化处理,如提取脂质生产生物柴油、高蛋白饲料、沼气等,具有一定的经济价值[31]。
因此,用固定化三角褐指藻去除污水中的NP是可行的。但是,在应用于实际污水处理之前仍需开展小试、中试等,以完善相关处理条件。
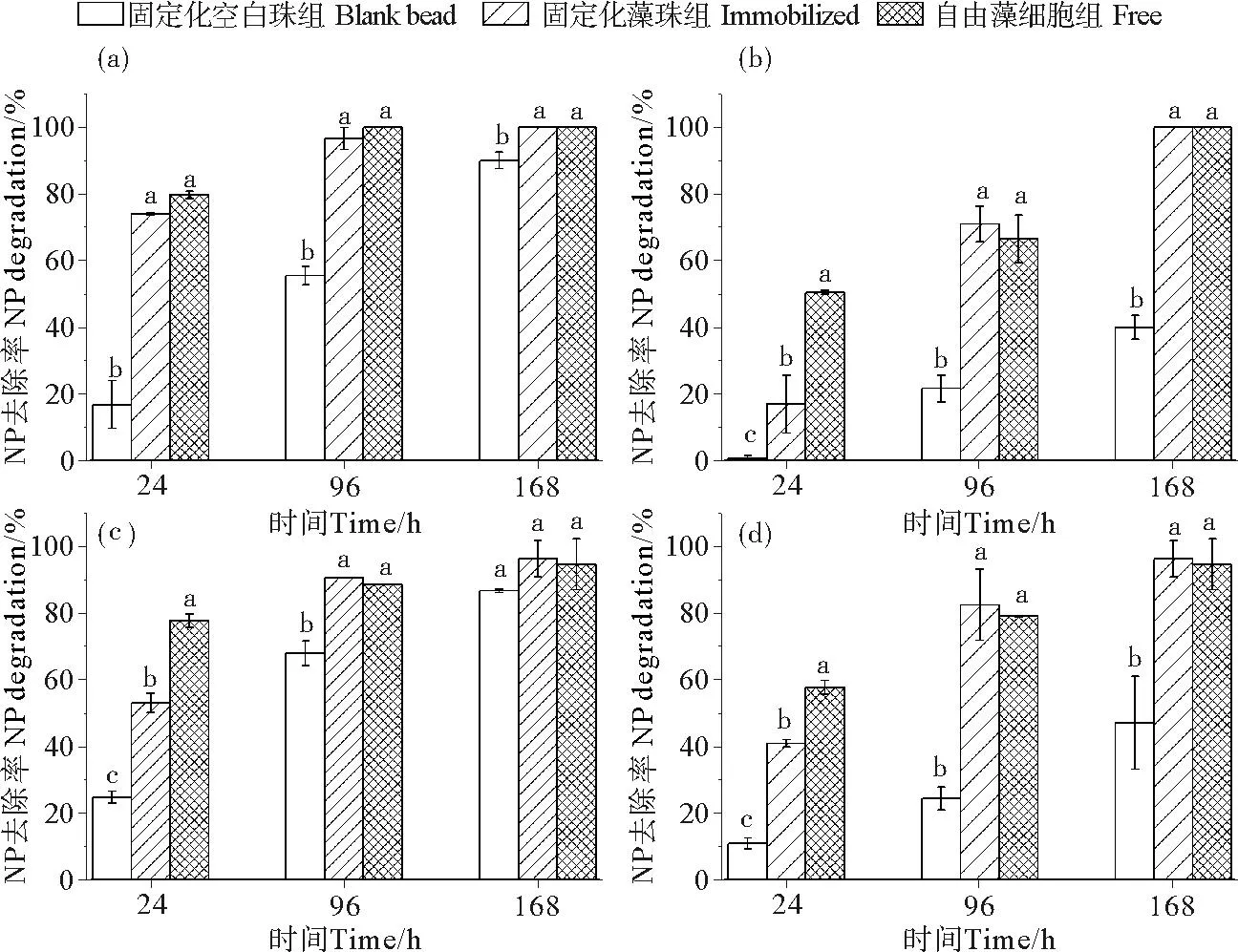
((a)(b)-NP初始浓度为1 μg/L的低浓度组(c)(d)-NP初始浓度为10 μg/L的高浓度组(小写字母代表0.05水平下各处理组间的差异显著性。small letters mean significant difference at 0.05 level with each treatment.(a)(b)-Initial concentration of NP was 1 μg·g-1for low pollution load;(c)(d)-Initial concentration of NP eas 10 μg·g-1for high pollution load.)
图2固定化藻细胞和自由藻细胞对NP的去除率和降解率
Fig.2Removal and degradation of NP by free and alginate-immobilizedPhaeodactylumtriconutumcells
3结语
利用海藻酸盐固定化三角褐指藻,固定化后藻的叶绿素a浓度有所提高。本文研究结果表明自由藻细胞和固定化三角褐指藻均能有效去除海水中的NP。处理96h后,低浓度组(1μg/L)和高浓度组(10μg/L)中NP去除率已接近100%;处理168h后NP降解率也达到95%以上。固定化藻珠具有操作简单、易于收获、耐杂菌污染等优点,可见该技术应用于废水处理,不仅可以解决藻水分离的难题,且藻类经固定化后其代谢活性大大提高。因此固定化三角褐指藻在去除沿岸海水中的壬基酚具有潜在应用前景。
参考文献:
[1]Soares A, Guieysse B, Jefferson, B, et al. Nonylphenol in the environment: a critical review on occurrence, fate, toxicity and treatment in wastewaters [J]. Environment International, 2008, 34: 1033-1049.
[2]Fu M, Li Z, Gao H. Distribution characteristics of nonylphenol in Jiaozhou Bay of Qingdao and its adjacent rivers [J]. Chemosphere, 2007, 69: 1009-1016.
[3]Ying G G, Brian W, Rai K. Environmental fate of alkylphenols and alkylphenol ethoxylates-A review [J]. Environment International, 2002, 28: 1-12.
[4]Xu J, Wang P,Guo W. F, et al. Seasonal and spatial distribution of nonylphenol in Lanzhou Reach of Yellow River in China [J]. Chemosphere, 2006, 65: 1445-1451.
[5]Li Z, Gibson M, Liu C, et al. Seasonal variation of nonylphenol concentrations and fluxes with influence of flooding in the Daliao River Estuary, China [J]. Environmental Monitoring and Assessment, 2013, 185 (6): 5221-5230.
[6]Huang W G, Tang J H, Chen Y J, et al. Distribution characteristics of alkylphenols and bisphenol A in surface waters from typical bays around Shandong Peninsula [J]. Marine Environmental Science, 2012, 31(3): 358-363.
[7]Liu Z H, Kanjo Y, Mizutani S. Removal mechanisms for endocrine disrupting compounds (EDCs) in wastewater treatment-physical means, biodegradation, and chemical advanced oxidation: a review [J]. Science of the Total Environment, 2009, 407: 731-748.
[8]South G R, Whittick A. An Introduction to Phycology [M]. USA: John Wiley & Sons, 2009.
[9]Gao Q T, Wong Y S, Tam N F Y. Removal and biodegradation of nonylphenol by differentChlorellaspecies [J]. Marine Pollution Bulletin, 2011, 63 (5-12): 445-451.
[10]Guillard,R R L. Cultures of phytoplankton for feeding marine invertebrates [M]//Smith W L, Chanley M H, Culture of Marine Invertebrates Animals. US: springer,1975: 29-60.
[11]Tam N F Y, Wong Y S. Effect of immobilized microalgal bead concentrations on wastewater nutrient removal [J]. Environment Pollution, 2000, 107 (1): 145-151.
[12]Porra R J, Thompson W A , Kriedemann P E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy [J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1989, 975 (3): 384-394.
[13]Rezaee M, Assadi Y, Millani M R, et al. Determination of organic compounds in water using dispersive liquid-liquid microextraction [J]. Journal of Chromatography A, 2006, 1116(1-2): 1-9.
[14]Zar J H. Biostatistical analysis [M]. [s.n.] Pearson Education India, 1999.
[15]Mallick N. Biotechnological potential of immobilized algae for wastewater N, P and metal removal: a review [J]. BioMetals, 2002, 15: 377-390.
[16]Robinson P K, Goulding K H. Mak A L , et al. Factors affecting the growth characteristics of alginate-entrapped Chlorella [J]. Enzyme and Microbial Technology, 1986, 8(12): 729-733.
[17]Pane L, Feletti M, Bertino C, et al. Viability of the marine microalga Tetraselmis suecica grown free and immobilized in alginate beads [J]. Aquaculture International, 1998, 6: 411-420.
[18]Trevan M D, Mak A L. Immobolized algae and their potential for use as biocatalysts [J]. Trends in Biotechnology, 1988, 6 (3): 68-73.
[19]Vilchez C, Vega J M. Nitrite uptake by immobilized Chlamydomonas reinhardtii cells growing in airlift reactors [J]. Enzyme and Microbial Technology, 1995, 17: 386-390.
[20]Gao Q T, Wong Y S, Tam N F Y. Removal and biodegradation of nonylphenol by immobilizedChlorellavulgaris[J]. Bioresoure Technololgy, 2011, 102(22): 10230-10238.
[21]Lang W, Dejma C, Sirisansaneeyakul S, et al Biosorption of nonylphenol on dead biomass of Rhizopus arrhizus encapsulated in chitosan beads [J]. Bioresoure Technology, 2009, 100 (23): 5616-5623.
[22]彭章娥, 冯劲梅, 何淑英, 等. 含藻水中壬基酚的光降解转化研究 [J]. 环境科学, 2012, 33(10): 3466-3472.
Peng Zhange, Feng Jinmei, He Shuying, et al. Study on the degradation and transformation of nonylphenol in water containing algae [J]. Environmental Science, 2012, 33(10): 3466-3472.
[23]Travieso L Pellón A. , Benítez F, et al. BIOALGA reactor: preliminary studies for heavy metals removal [J]. Biochemical Engineering Journal, 2002, 12: 87-91.
[24]Moreno-Garrido I. Microalgae immobilization: Current techniques and uses [J]. Bioresoure Technology, 2008, 99: 3949-3964.
[25]de-Bashan L E, Y Bashan. Immobilized microalgae for removing pollutants: review of practical aspects [J]. Bioresoure Technology, 2010, 101: 1611-1627.
[26]Luan T G, Jin J, Chan, S M N, et al. Biosorption and biodegradation of tributyltin (TBT) by alginate immobilizedChlorellavulgarisbeads in several treatment cycles [J]. Process Biochemistry, 2006, 41: 1560-1565.
[28]Stoichev T, Basto M C P, Vasconcelos V, et al. Fate and effects of nonylphenol in the presence of the cyanobacteriumMicrocystisaeruginosa[J]. Chemistry and Ecology, 2010, 26(5): 395-399.
[29]Zhou G J, Peng F Q, Yang B, et al. Cellular responses and bioremoval of nonylphenol and octylphenol in the freshwater green microalgaScenedesmusobliquus[J]. Ecotoxicology and Environmental Safety, 2013, 87: 10-16.
[30]Pluemsab W,Fukazawa Y, Furuike T, et al. Cyclodextrin-linked alginate beads as supporting materials for Sphingomonas cloacae, a nonylphenol degrading bacteria [J]. Bioresoure Technology, 2007, 98 (11): 2076-2081.
[31]Lam M K, Lee K T. Immobilization as a feasible method to simplify the separation of microalgae from water for biodiesel production [J]. Chemical Engineering Science, 2012, 191: 263-268.
责任编辑徐环
Removal and Degradation of Nonylphenol in Seawater by Immobilized MicroalgaePhaeodactylumttricornutum
CHAI Nan-Nan1, WANG Peng-Tao1, GUO Lei1, LI Zheng-Yan1,2
(Ocean University of China 1.College of Environmental Science and Engineering; 2.The Key Laboratory of Marine Environmental Science and Ecology, Ministry of Education, Qingdao 266100, China)
Abstract:Nonylphenol (NP) is a typical endocrine disruptor with estrogenic effects and it is widely distributed in aquatic environment. NP causes serious harm to physiology of various aquatic organisms, including reproduction, endocrine, immune, carcinogenesis and genetic toxicity. However, the technique research of NP removal in aquatic environment is limited. The efficiency of nonylphenol removal and degradation with alginate-immobilized microalgae Phaeodactylum triconutum is studied in comparison with its free microalgal cultures. Two initial concentrations of nonylphenol were set up in the experiment, i.e., 1μg/L and 10μg/L for low and high pollution load, respectively. The results show that both in the immobilized and free culture groups under two concentration conditions, cell density and chlorophyll a content showed a similar increasing pattern with seven days of treatment time; the removal and degradation percentage of NP in the immobilized and free culture groups reached about 95% over a treatment period of 168 h. With the convenience of handling and producing bio-energy, the immobilized microalgal system therefore provides a feasible tool for nonylphenol removal in seawater. Meanwhile, this study provided the scientific basis for removal and purification research of NP in natural water.
Key words:nonylphenol; Phaeodactylum triconutum; microalgal immobilization; biodegradation; aquatic environment
中图法分类号:X703
文献标志码:A
文章编号:1672-5174(2016)01-116-07
作者简介:柴囡囡(1990-),女,硕士生,主要研究方向为水污染控制。E-mail:cnnkuaile2012@sina.com
收稿日期:2014-11-05;
修订日期:2014-12-09
*基金项目:国家水体污染控制与治理科技重大专项(2013ZX07202-007)资助
DOI:10.16441/j.cnki.hdxb.20140363
引用格式:柴囡囡, 王朋涛, 郭蕾, 等.固定化三角褐指藻对海水中壬基酚的去除和降解作用研究[J].中国海洋大学学报(自然科学版), 2016, 46(1): 116-122.
CHAI Nan-Nan, WANG Peng-Tao, GUO Lei, et al. Removal and degradation of nonylphenol in seawater by immobilized microalgaePhaeodactylumtricornutum[J].Periodical of OceamVniersity of China,2016,46(1): 116-122.
Supported by Major Science and Technology Program for Water Pollution Control and Treatment(2013ZX07202-007)
**通讯作者:E-mail:zhengyan@ouc.edu.cn
