滋肾阴方对去势老龄鼠的预防和治疗作用
2016-04-06杜楚玲黄英红张荣华暨南大学药学院广东广州510632
杜楚玲, 夏 喜, 黄英红, 张荣华, 杨 丽, 蔡 宇(暨南大学药学院,广东广州510632)
滋肾阴方对去势老龄鼠的预防和治疗作用
杜楚玲, 夏 喜, 黄英红, 张荣华, 杨 丽, 蔡 宇*
(暨南大学药学院,广东广州510632)
摘要:目的 探索滋肾阴方对骨质疏松症的预防和治疗作用。方法 将100只老龄鼠按体质量随机均分为空白组、模型组、阳性组(预防组和治疗组)、给药组(预防低、中、高剂量组和治疗低、中、高剂量组),选择去势雌性大鼠动物模型作为大鼠形成骨质疏松的模型,预防组术后第7天给药120 d,治疗组术后第90天给药30 d,给药结束后测定血清生化指标。取股骨制作病理切片,观察骨形态学变化和进行骨计量学分析。结果 与模型组对比,给药组血清钙(Ca)、抗酒石酸酸性磷酸酶(TIACP)、骨碱性磷酸酶(BALP)、骨保护素(OPG)含有量显著升高,血清磷(P)、骨钙素(OCN)含有量显著降低,股骨切片骨小梁平均宽度(Tb.Th)和骨小梁面积百分比(Tb.Ar)数值显著升高,骨小梁分离度(Tb.Sp)数值显著降低,具有统计学意义(P<0.05,P<0.01);给药组骨小梁变粗、变密,骨髓腔较小。结论 滋肾阴方可以改变去势老龄鼠的骨代谢、骨形态从而达到预防和治疗的作用。
关键词:滋肾阴方;骨质疏松;骨代谢;骨形态
绝经后骨质疏松症是一种与年老女性密切相关的疾病,在女性绝经后卵巢功能衰退,雌激素水平下降,体内不同生化指标发生改变,骨转换加速,骨吸收大于骨形成,骨重建失衡引起骨量减少所导致,表现为骨显微结构异常,骨脆性增加且易发生骨折。从中医理论,绝经后骨质疏松症属“骨痪”范畴,据《黄帝内经》记载,女子七七,“任脉虚,太冲脉衰少,天癸竭,地道不通”,进而“肾脏衰,形体皆极”。肾为先天之本,主骨生髓,肾精亏虚则骨髓生化泛源,骨骼失养,骨矿含有量下降,骨密度降低,而发生骨质疏松症[1]。中医药临床健骨多从滋阴补肾治疗,本实验通过采用卵巢去势手术诱导大鼠骨质疏松模型,探究由熟地、杜仲、党参、山茱萸、制首乌、枸杞、山药等中药制备而成的滋肾阴剂对骨质疏松预防和治疗作用及可能的机制。
1 材料
1.1 药材及试剂 滋肾阴方由熟地(15 g)、党参(15 g)、山茱萸(15 g)、杜仲(15 g)、山药(12 g)、制首乌(12 g)、枸杞(12 g)等药材组成,提取工艺为浸泡1 h,提取2次,时间为2.5、2 h,料液比为1∶10、1∶8,所得提取液煎煮浓缩水提浓缩制成滋肾阴煎剂,生药量3 g/mL,经广东省中医院黄志海主任药师鉴定为正品;配置方法为用蒸馏水把滋肾阴煎剂配制为高、中、低剂量,质量浓度分别为1、0.5、0.25 g/mL,全部药材均购自广州市二天堂大药房;益肾补骨液(修正药业集团通化市制药有限公司,批号130801);血清钙(Ca)测定试剂盒、血清磷(P)测定试剂盒(南京建成生物工程研究所,批号20141127);大鼠抗酒石酸酸性磷酸酶(TIACP)、骨碱性磷酸酶(BALP)、骨钙素(OCN)、骨保护素(OPG)酶联免疫检测试剂盒(上海拜力生物科技有限公司,批号201312)。
1.2 动物 24周龄SD雌性大鼠100只(SPF级),体质量(405±32)g,由中山大学动物实验中心提供,动物许可证号SYXK(粤)2011-0029。
1.3 仪器 SIGMA 1-15K冷冻离心机(德国Sigma实验室离心机股份有限公司);恒温CO2培养箱(美国赛默飞公司);Synergy H4全功能酶标仪(美国伯腾仪器有限公司);紫外分光光度计(北京普析通用仪器有限责任公司);OLYMPUS CKX41倒置相差显微镜(日本奥林巴斯株式会社);OPTPro 3000图像分析系统(重庆奥特光学仪器有限责任公司)。
2 方法
2.1 建立模型 选择24周龄雌性大鼠,用20 g/L戊巴比妥钠腹腔注射进行麻醉,腹部剔除毛发,碘伏消毒,正中切开腹部皮肤,钝性分离腹肌、腹膜后进腹,卵巢于肾脏下方,呈粉红色、桑椹状,分别用丝线结扎将之摘除彻底,缝合切口[2]。术后注射十万U青霉素,术后1周拆线。
2.2 分组与给药 将100只SD大鼠按体质量随机分为10组,即空白组、模型组、阳性组(预防组和治疗组)、给药组(预防低、中、高剂量组和治疗低、中、高剂量组)[3]。其中给药预防组术后第7天灌胃给药120 d,治疗组术后第90天灌胃给药30 d。空白组和模型组分别给予1.0 mL/kg体质量蒸馏水,阳性组给予益肾补骨液4.05 m L/kg,给药组给予滋肾阴煎剂,低、中、高剂量分别为1.0、2.0、4.0 g/kg,每日灌胃给药1次。
2.3 样本收集与处理 实验大鼠于给药期结束后,20 g/L戊巴比妥钠麻醉,按0.1 mL/100 g体质量进行腹腔注射麻醉,腹主动脉取血约5 mL,于低温离心机中3 000 r/min迅速离心5 min,取上层血清-20℃保存备用;剥离肌肉,取出股骨,去除软组织后固定于福尔马林中,备用。
2.4 血清生化指标检测 依照购买试剂盒的实验步骤进行实验,血清Ca含有量采用微板法测定,血清P含有量采用磷钼酸法测定,血清TIACP、BALP、OCN及OPG采用ELISA法进行检测,用酶标仪和紫外读取吸光度(D)值,记录数值,根据试剂盒说明进行计算。
2.5 骨组织形态学及计量学观察 股骨固定于福尔马林中24 h后拿出,15%乙二胺四乙酸(EDTA)脱钙处理,石蜡切片,HE染色,制作股骨头切片,光学显微镜下观察股骨组织形态变化,观察骨小梁结构;每张切片随机选取3个视野(×40),取平均值,采用OPTPro 3000图像分析系统对其进行骨组织计量学评价:骨小梁平均宽度(Tb.Th)、骨小梁面积百分比(Tb.Ar)及骨小梁分离度(Tb.Sp)[4]。
2.6 统计学方法 采用SPSS 17.0及EXCEL 2007软件进行统计分析。计量资料以(±s)表示,采用单因素方差分析对所得数据进行处理,P<0.05代表有显著性差异,P<0.01代表有极显著性差异。
3 结果
3.1 血清Ca、P水平变化 与模型组对比,滋肾阴方各剂量组Ca含有量升高,且预防低和治疗低剂量组有显著性差异(P<0.05),预防中、高和治疗中、高剂量组有极显著性差异(P<0.01);滋肾阴方各剂量组P含有量降低,且治疗低、高有显著性差异(P<0.05),预防高和治疗中剂量组有极显著性差异(P<0.01);与模型组含有量有显著性差异基础上,与阳性组对比,预防和治疗组Ca含有量无显著性差异,预防高剂量组P和治疗各剂量组P含有量无显著性差异(P>0.05),结果见表1。
表1 各组大鼠血清Ca、P水平比较(±s,n=10)

表1 各组大鼠血清Ca、P水平比较(±s,n=10)
注:与空白组比较,※※P<0.01;与模型组比较,*P<0.05,**P<0.01
组别 剂量/ (g·kg-1)Ca/ (mmo1·L-1)P/ (mmo1·L-1)空白组- 1.25±0.18 0.86±0.21模型组 - 1.01±0.34※※1.45±0.68※※预防阳性组 4.5 mL/kg 1.22±0.14**0.92±0.15**预防低剂量组 1.0 1.16±0.07* 1.29±0.79预防中剂量组 2.0 1.20±0.04** 1.26±0.30预防高剂量组 4.0 1.29±0.12** 0.92±0.15**治疗阳性组 4.5 mL/kg 1.22±0.16**0.98±0.24**治疗低剂量组 1.0 1.16±0.05* 1.01±0.34*治疗中剂量组 2.0 1.26±0.14** 0.90±0.09**治疗高剂量组 4.0 1.29±0.11** 1.02±0.17*
3.2 血清TIACP、BALP、OCN、OPG水平变化 与模型组对比,滋肾阴方各剂量组TIACP均升高,且预防低、中剂量组有显著性差异(P<0.05),预防高和治疗中、高剂量组有极显著性差异(P<0.01);滋肾阴方各剂量组BALP均升高,且预防高、治疗中剂量组有极显著性差异(P<0.01);滋肾阴方各剂量组OCN均降低,且预防低、高、治疗高剂量组有显著性差异(P<0.05),预防中、治疗低剂量组有极显著差异(P<0.01);预防各剂量和治疗中、高剂量组OPG均升高,且预防中、高剂量组有显著性差异(P<0.05),治疗高剂量组有极显著性差异(P<0.01)。
与模型组含有量有显著性差异基础上,与阳性组对比,预防低、中剂量组TIACP无显著性差异;预防高和治疗中剂量组BALP无显著性差异。预防各剂量组、治疗低、高剂量组OCN无显著性差异;预防高剂量组OPG无显著性差异(P>0.05),具体见表2。
3.3 骨组织计量学变化 与模型组对比,滋肾阴方各剂量组Tb.Th均升高,且预防低和治疗高剂量组有极显著差异(P<0.01),治疗中剂量组有显著性差异(P<0.05);滋肾阴方各剂量组Tb.Ar均升高,且预防低、中和治疗低、中剂量组有极显著性差异(P<0.01),预防高、治疗高组有显著性差异(P<0.05);滋肾阴方各剂量Tb.Sp均降低,且预防各剂量组和治疗中剂量有极显著性差异(P<0.01),治疗低、高剂量组有显著性差异(P<0.05)。
表2 各组大鼠血清TRACP、BALP、0 CN、0 PG水平比较(±s,n=10)

表2 各组大鼠血清TRACP、BALP、0 CN、0 PG水平比较(±s,n=10)
注:与空白组比较,※P<0.05,※※P<0.01;与模型组比较,*P<0.05,**P<0.01;与阳性组比较,#P<0.05,##P<0.01
组别 剂量/(g·kg-1) TIACP/(U·L-1) BALP/(ng·mL-1) OCN/(ng·m L-1) OPG/(ng·mL-1)空白组2.53±0.46 25.10±5.78 9.27±0.35 1.17±0.17模型组 - 3.12±0.30※ 19.99±5.02※※ 9.85±0.87 1.53±0.25※※预防阳性组 4.5 mL/kg 3.58±0.70* 23.65±1.99 8.56±1.97 1.86±0.07**预防低剂量组 1.0 3.84±0.42* 23.03±3.83 8.13±2.35* 1.73±0.23预防中剂量组 2.0 3.77±0.65* 23.27±0.50 7.60±1.35** 1.73±0.21*#预防高剂量组 4.0 4.31±0.74**# 25.79±3.75** 8.26±2.35* 1.76±0.16*治疗阳性组 4.5 m L/kg 3.48±0.55 24.49±3.52* 8.15±1.27* 1.72±0.18治疗低剂量组 1.0 3.48±0.75 20.17±2.78 7.14±1.77** 1.40±0.37治疗中剂量组 2.0 3.91±0.33**# 27.80±7.33** 8.81±1.66 1.60±0.16治疗高剂量组 4.0 4.48±1.13**## 23.54±5.03 7.22±1.34* 1.93±0.34**#-
表3 各组大鼠骨组织计量学比较(±s,n=10)

表3 各组大鼠骨组织计量学比较(±s,n=10)
注:与空白组比较,※P<0.05;与模型组比较,*P<0.05,**P<0.01;与阳性组比较,#P<0.05,##P<0.01
组别 剂量/(g·kg-1) Tb.Th/μm Tb.Ar/% Tb.Sp/μm空白组88.80±2.72 53.92±2.52 272.57±39.95模型组 - 83.45±3.08※ 48.83±8.23※ 322.04±58.11※预防阳性组 4.5 mL/kg 93.61±4.78** 54.54±6.36* 215.83±134.7*预防低剂量组 1.0 94.65±8.63** 58.49±5.62** 235.20±38.98**预防中剂量组 2.0 84.05±4.10 56.51±4.52** 236.73±55.48**预防高剂量组 4.0 84.89±6.76 55.66±7.16* 255.02±56.31**治疗阳性组 4.5 mL/kg 94.39±6.70** 54.99±1.04* 197.33±38.50**治疗低剂量组 1.0 85.70±13.36 60.75±5.75** 256.48±84.97*##治疗中剂量组 2.0 101.19±22.18* 55.09±6.78** 224.44±59.37**#治疗高剂量组 4.0 91.62±4.43** 57.20±9.38* 237.29±88.05*#-
与模型组含有量有显著性差异基础上,与阳性组对比,预防低和治疗中、高剂量组Tb.Th无显著性差异,预防和治疗组Tb.Ar无显著性差异,预防组Tb.Sp无显著性差异(P均>0.05),具体见表3。
3.4 骨组织形态学观察 在100倍光镜下拍照观察大鼠股骨切片组织形态学变化,见图1。空白组骨质较厚且骨基质沉积均匀,骨小梁排列紧密,表面可见破骨细胞、成骨细胞及骨细胞。模型组明显骨小梁变薄、变细、穿孔甚至断裂坍塌,骨基质沉积明显减小,髓腔明显变大,破骨细胞、成骨细胞及骨细胞减少。阳性组、预防组和治疗组骨小梁排列都较紧密,明显增厚,骨小梁变粗、变密,骨基质沉积比较均匀,成骨细胞活跃,骨细胞密度增大,骨髓腔较小。
4 讨论
破骨细胞作用时,Ca和P从骨质中释放出来称为骨吸收,Ca和P沉着于类骨组织中形成新骨称为骨形成,旧骨吸收和新骨形成构成骨重建[5]。在正常情况下,血Ca和骨Ca处于一个平衡的状态,当骨吸收大于骨形成时,血Ca含有量降低,骨Ca就会释放以维持血Ca含有量,骨Ca减少,出现骨质疏松症[6]。实验结果表明,对比模型组,给药组血清Ca含有量较高,这有助于维持血液中血Ca含有量的稳定,降低骨Ca向血液中转移,降低骨吸收;给药组血清P含有量降低,这是因为Ca吸收主要依赖于Ca、P之间的比例,如果P含有量过高会与Ca2+形成不溶性磷酸钙,阻碍Ca2+吸收,加剧骨质疏松,在维持基本代谢的基础上低P更利于Ca的吸收。这提示我们在治疗和治疗骨质疏松时,必须增加钙的摄入,控制磷的摄入。
破骨细胞是骨吸收的主要功能细胞,TIACP由破骨细胞合成并直接分泌入血,是破骨细胞的主要标志[7]。成骨细胞是骨形成过程中重要的功能细胞,BALP由成骨细胞合成分泌,是成骨细胞的标志,为反映骨形成的主要生化指标[8-9]。实验结果显示,大鼠去卵巢后,TIACP升高,BALP明显降低,表明破骨细胞活性升高,骨吸收增强,成骨细胞活性下降,骨形成下降,骨吸收大于骨形成,造成骨质疏松,骨质疏松模型成功。给药后TIACP出现不同程度升高,BALP也出现不同程度升高,所以猜测给药后,由成骨细胞主导的骨形成和破骨细胞主导的骨吸收在加快重建,成骨细胞活性增加,骨形成加强,骨质代谢加强。OCN由成骨细胞合成并分泌,OCN可以反映成骨细胞活性和骨转换水平,绝经后骨质疏松症属于高转换型,OCN明显升高[10]。本实验结果显示,大鼠去卵巢后,OCN有所升高,骨转换率升高,容易造成骨质疏松;给药后,不同剂量组OCN都明显地降低,骨转换率下降。OPG是一种新发现肿瘤坏死因子受体超家族成员,不仅可以抑制破骨细胞生成,还可以抑制破骨细胞主导的骨吸收。重组的OPG可以逆转严重骨质疏松[11-12],表明大鼠去卵巢后OPG升高,其机制可能是由于雌激素突然降低,使得骨重建加强,骨吸收和骨形成增加,OPG过性升高来应激调节破骨细胞的募集和形成,给药后不同组别OPG升高,推测是由于药物的作用,刺激OPG升高,以抑制破骨细胞生成,抑制抗酒石酸酸性磷酸酶生成,抑制骨吸收,降低骨质疏松的水平。
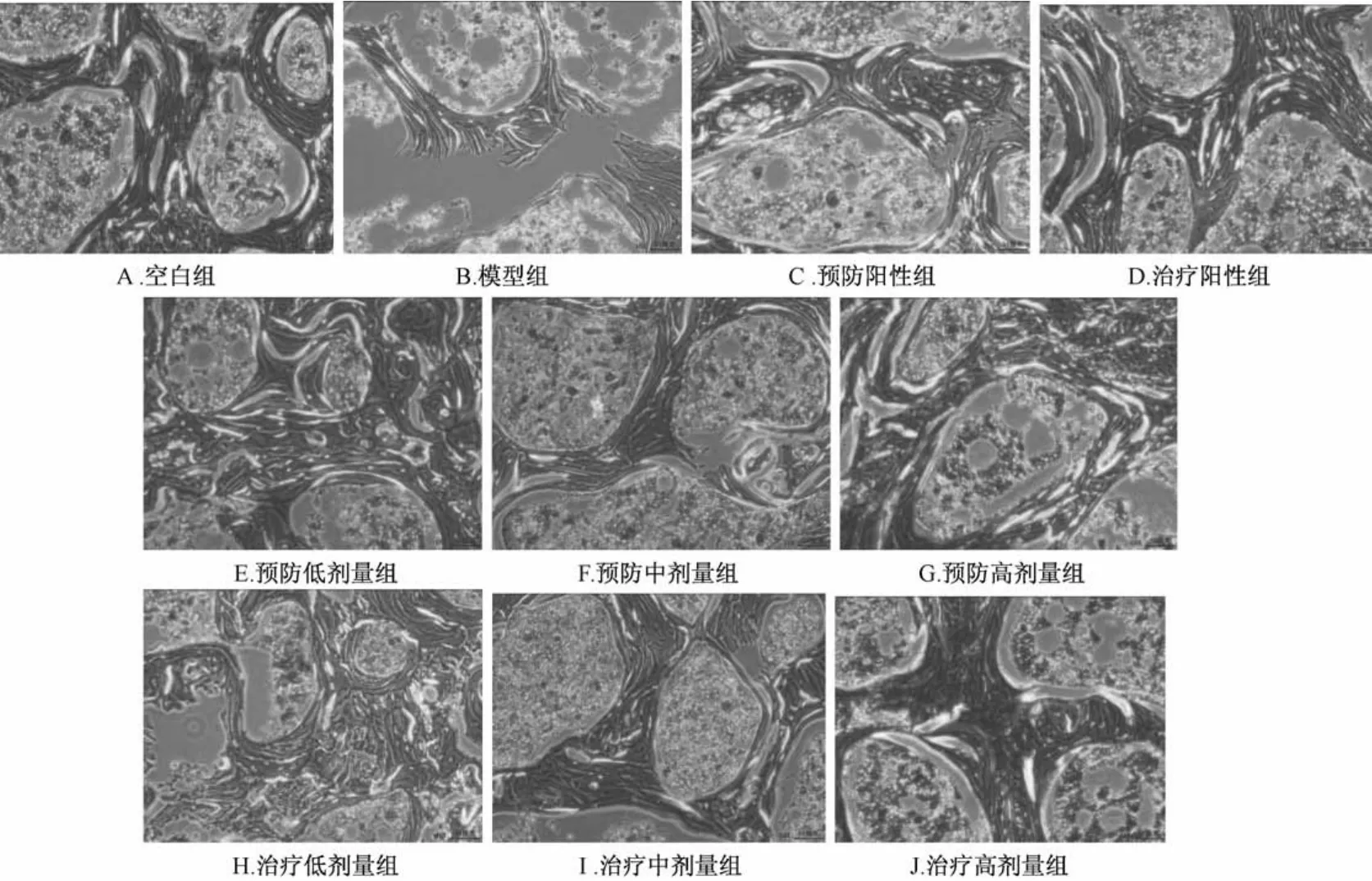
图1 大鼠股骨切片组织形态学变化(×100)
骨组织形态计量学是近年来研究骨质疏松的一门体视学技术,可以直观定量观察和研究骨组织形态及结构,对骨组织结构进行定量分析的重要手段[13]。从组织学上,对骨微细结构、骨质特征等方面进行研究。参考文献研究表明骨质疏松表现为骨小梁数量减少,骨体积分数百分比降低,间距增加等现象[14]。本实验切片形态和计量数据显示:空白组骨质较厚、骨基质沉积均匀,模型组明显骨小梁变薄、变细、穿孔甚至断裂坍塌,骨体积分数百分比降低,骨基质沉积明显减小,髓腔明显变大。阳性组、预防组和治疗组骨小梁排列都较紧密,明显增厚,骨小梁变粗、变密,骨体积分数百分比升高,骨基质沉积比较均匀,骨髓腔较小。从形态学上,可以清楚地看出给药骨质增多、增厚,表明滋肾阴方能使骨骼健全、粗壮,对于预防和治疗骨质疏松有非常显著的效果。
中医理论认为,骨骼依赖于骨髓的滋养,骨髓又为肾精气化所生,肾精的的盛衰决定骨骼生长发育的强弱[15]。本方由熟地、党参、山茱萸、杜仲、山药、制首乌、枸杞等药材组成,具有滋阴补肾的功效,通过对去势老龄鼠骨代谢及骨形态影响的研究,发现其预防骨质疏松和治疗骨质疏松作用显著,这为进一步临床应用提供了基础,但其具体作用机制尚不完全明确,有待进一步研究。
参考文献:
[1] 谢 林,郭振球,姚共和.绝经后骨质疏松症中医辨证分析[J].中国医药学报,1999,14(3):35-39.
[2] 周 丽,邓伟民.去势雌性大鼠动物模型在绝经后骨质疏松症中的应用[J].中国组织工程研究与临床康复,2008,12(7):1323-1326.
[3] 李高峰,郑卫东,张季铠,等.防风多糖对骨质疏松大鼠的作用及机制研究[J].中成药,2014,36(11):2399-2401.
[4] 李 义,张建中,宋 英.姜黄素对去卵巢骨质疏松模型鼠的机制研究[J].中成药,2014,35(7):1359-1362.
[5] 汤淑媛.骨康对去势大鼠钙磷代谢影响的研究[D].广州:广州中医药大学,2001.
[6] Hendy GN,Hruska K A,Mathew S,et al.New insights into minera1and ske1eta1regu1ation by active formsof vitamin D[J]. Kidney Int,2006,69(2):218-223.
[7] 董 伟,冯晓洁,梁永强,等.双膦酸盐对破骨细胞分化及抗酒石酸酸性磷酸酶的影响[J].中国组织工程研究,2014,18(38):6069-6073.
[8] 蒲画华.补肾中药与阿法骨化醇联合应用对去势大鼠骨质疏松的防治作用[D].上海:复旦大学,2010.
[9] 于海涛,李 慧,章 琦,等.狗脊炮制品中促进成骨细胞增殖分化成分的筛选[J].中成药,2012,34(6):1139-1142.
[10] 魏双平,李 蒙,李瑞玉,等.传统中药对成骨细胞及骨钙素合成的影响[J].中国组织工程研究,2013,17(11):2083-2090.
[11] 王小斌,单其俊,马根山.骨保护素的研究进展[J].中国临床康复,2004,8(20):4066-4067.
[12] 吴亚东,史晓林,晁振宇.福善美对绝经后骨质疏松症患者血清骨保护素及骨密度的影响[J].中医正骨,2011,23 (6):16-19.
[13] 吴建斌.不同填充材料及脂肪源干细胞移植对骨质疏松大鼠的影响[D].广州:南方医科大学,2013.
[14] EstaiM A,Suhaimi F,Soe1aiman IN,et al.Bone histomorphometric study ofyoung rats fo11owing oestrogen deficiency[J]. Afr JBiotechnol,2011,56(10):12064-12070.
[15] 王少君,李 艳,刘 红,等.中医理论对骨质疏松症发病机制的认识[J].世界中医药,2013,8(9):1044-1048.
*通信作者:蔡 宇(1972—),男,教授,中药制剂新工艺及新药开发研究。Te1:18826237541,E-mai1:caiyu8@sohu.com
作者简介:杜楚玲(1990—),女,硕士,从事中药制剂研究。Te1:13713322395,E-mai1:382169183@qq.com
收稿日期:2015-04-24
doi:10.3969/j.issn.1001-1528.2016.03.043
中图分类号:I 285.5
文献标志码:B
文章编号:1001-1528(2016)03-0676-05
