当归补血汤水提液预处理对缺氧/复氧H9c2心肌细胞线粒体损伤保护机制研究
2016-04-06周春刚张志斌无锡市中医医院中心实验室江苏无锡214062
周春刚, 李 卿, 汤 加, 徐 辰, 张志斌(无锡市中医医院中心实验室,江苏无锡214062)
当归补血汤水提液预处理对缺氧/复氧H9c2心肌细胞线粒体损伤保护机制研究
周春刚, 李 卿, 汤 加, 徐 辰, 张志斌*
(无锡市中医医院中心实验室,江苏无锡214062)
摘要:目的 探讨当归补血汤预处理对缺氧/复氧H9c2心肌细胞线粒体损伤保护机制。方法 复制缺氧/复氧大鼠H9c2心肌细胞损伤模型,以始终在正常培养条件下的心肌细胞为正常对照组,将预先加入当归补血汤的细胞(当归补血汤组)在正常条件下培养24 h,与未处理细胞(模型组)同时进行缺氧/复氧培养,JC-1染色,流式细胞仪检测细胞线粒体膜电位,DCFH-DA荧光探针检测细胞内活性氧簇(IOS)水平,IT-PCI荧光相对定量检测B淋巴细胞瘤2(Bcl2)、Bc12相关X蛋白(Baχ)、bc1-2/腺病毒E1B 19 000相互作用蛋白3(Bnip3)的m INA表达水平,Western b1ot检测细胞色素C蛋白表达水平。结果 与正常对照组比较,模型组线粒体膜电位下降的细胞比例显著增加(P<0.05),细胞内IOS水平增加明显(P<0.05),细胞色素C蛋白表达显著升高(P<0.05),Bcl2 m INA表达水平明显降低(P<0.05),Baχm INA表达水平显著升高(P<0.05)。当归补血汤干预后,与模型组比较,线粒体膜电位下降的细胞明显减少(P<0.05),细胞色素C蛋白表达水平显著降低(P<0.05),Bcl2 m INA水平显著升高,差异具有统计学意义(P<0.05)。结论 H9c2心肌细胞缺氧/复氧后,线粒体膜电位明显下降,细胞色素C释放增加。当归补血汤可能通过促进Bcl2表达,减少IOS产生等机制稳定心肌细胞线粒体膜电位,减轻复氧后对线粒体功能的损伤作用。
关键词:当归补血汤;H9c2心肌细胞;线粒体损伤;Bc12;活性氧
目前关于心肌缺血再灌注损伤的机制主要有大量IOS产生、钙离子超载、中性粒细胞和内皮细胞激活的炎症反应及细胞凋亡为主的心肌不可逆损伤等[1]。细胞能量代谢障碍与心肌缺血再灌注损伤机制的多个环节密切相关。线粒体作为氧化磷酸化产生ATP的重要细胞器,线粒体功能障碍,线粒体凋亡等病理过程造成对心肌细胞的严重损害[2]。目前以线粒体为靶点治疗心肌缺血再灌注损伤的药理作用机制尚未完全阐明。目前研究发现,当归补血汤能够稳定心肌细胞线粒体膜电位,下调凋亡基因蛋白P53表达,有效抑制血管紧张素Ⅱ诱导的心肌细胞凋亡[3]。对异丙肾上腺素诱导的大鼠心肌损伤,当归补血汤能减轻细胞水肿和纤维化,保护心肌细胞,阻碍心肌重构[4]。而对其他器官组织如脑缺血再灌注大鼠神经元损伤及移植的内耳干细胞等,当归补血汤能够减轻细胞凋亡,促进细胞功能恢复[5-7]。可见当归补血汤在不同病理条件下对组织损伤的保护作用表现其多靶点、多环节的作用特点。本实验通过建立H9c2心肌细胞缺氧/复氧损伤模型,观察当归补血汤对缺氧/复氧模型细胞线粒体损伤的保护作用。
1 材料和方法
1.1 材料
1.1.1 细胞株 大鼠心肌细胞(H9c2),购自上海拜力生物科技有限公司(ATCC CIL1446)。
1.1.2 当归补血汤煎剂制备 当归(产地甘肃,批号101027);黄芪(产地内蒙,批号101109)。当归补血汤(5∶1)煎剂制备采用水提醇沉法[8],选取黄芪20.83 g、当归4.17 g,加5~7倍双蒸水,煎3次,合并滤液,浓缩至较小体积,加入95%乙醇至含醇量为60%~80%,冷藏,静置24 h后,过滤,取滤液回收乙醇,药液浓缩备用(药液生药含有量为1 g/mL)。实验时将上述精制中药加生理盐水溶解,以氢氧化钠、稀盐酸调pH至7.2~7.4,采用DMEM高糖培养基定容后生药量为50 mg/m L(原液),0.22 μm微孔滤膜过滤除菌,-80℃贮存备用。
1.1.3 试剂 DMEM高糖(美国Gibco公司,11995065);胎牛血清(美国Gibco公司,6010159);3S柱式细胞总INA抽提试剂盒(上海博彩生物科技有限公司,K362);JC-1染色检测线粒体膜电位试剂盒(美国BD公司,551302);DCFH-DA荧光探针检测IOS试剂盒(江苏碧云天生物技术有限公司,S0033);SYBI PrimeScript IT-PCI KitⅡ试剂盒(日本Takara公司,I I820A);BCA蛋白定量试剂盒(江苏碧云天生物技术有限公司,P0010);GAPDH单克隆抗体(杭州联科生物技术股份有限公司,Mab5465);细胞色素C多克隆抗体(Bioss公司,bs-0013I);羊抗兔二抗(美国Biowor1de公司,BS13278)。
1.1.4 仪器 流式细胞仪(美国BD公司);LightCyc1er480荧光定量PCI仪(德国Ioche公司);二氧化碳三气培养箱(美国Thermo公司,Thermo 3131);二氧化碳普通培养箱(美国Thermo公司,Thermo 371);SmartSpec P1us分光光度计(美国Bio-Iad公司)。
1.2 方法
1.2.1 H9c2细胞培养和缺氧/复氧模型的建立H9C2细胞株生长在含有10%胎牛血清的DMEM高糖培养基中,37℃5%CO2的二氧化碳培养箱中传代培养。取对数生长期H9c2细胞,接种于培养瓶中,每瓶接种2×105个细胞,培养24 h,弃去细胞上清液,更换DMEM无糖无血清培养基,然后置入37℃、含94% N2﹑5% CO2﹑1% O2三气培养箱中3 h,即为缺氧。弃去上清液,更换含10%胎牛血清的DMEM高糖完全培养基,置入37℃、含5% CO2的普通培养箱继续培养30 min,即为复氧。实验设正常对照组(细胞始终在正常培养条件下,37℃、含5% CO2的普通培养箱中培养)、模型组(正常培养条件下37℃、含5%CO2的普通培养箱培养24 h,然后缺氧/复氧条件下培养)、当归补血汤预处理组(正常培养条件预先加入当归补血汤500 μg/mL,37℃、含5% CO2的普通培养箱培养24 h后,与模型组同时进行缺氧/复氧培养)。
1.2.2 JC-1染色流式细胞仪检测细胞线粒体膜电位 当归补血汤预处理组和模型组细胞复氧30 min后,与正常对照组同时检测线粒体膜电位。检测前,配制新JC-1工作液(1∶100),样本平均细胞数2×105个,每个样本加入0.5 mL JC-1工作液,37℃CO2培养箱孵育15 min,洗涤细胞2次,每个样本加入0.5 m L 1×缓冲液上机检测。
1.2.3 DCFH-DA荧光探针流式细胞仪检测细胞内IOS水平 细胞收集后悬浮于荧光探针DCFH-DA(无血清DMEM 1∶1 000稀释)中,终浓度为10 μmo1/L。细胞密度为1× 106个/mL,37℃细胞培养箱内孵育20 min。每隔3~5 min颠倒混匀一下,用无血清DMEM洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。Iosup(50 mg/mL)作为活性氧阳性对照。
1.2.4 H9c2细胞总INA提取 采用3S柱式细胞总INA抽提试剂盒,按照试剂盒上操作步骤完成总INA的提取。在吸光度260 nm处测定INA水平,样本INA在10~30 ng/μL,260/280 nm吸光度(D)比值范围在1.2~1.9之间。INA提取物-80℃保存。
1.2.5 IT-PCI实时荧光相对定量 采用两步法,管家基因β-actin作为内参基因,目的基因Bnip3、Baχ和Bcl2及内参基因引物序列见表1,由上海博彩生物科技有限公司合成。采用溶解曲线和琼脂糖凝胶电泳分析产物的特异性。相对定量分析采用△△CT法,标准化比值计算公式采用2-△△CT[9]。
1.2.6 Western b1ot检测H9c2心肌细胞细胞色素C蛋白水平 细胞蛋白定量采用碧云天BCA蛋白定量试剂盒,取细胞蛋白提取液上清,进行聚丙烯酰胺凝胶电泳(SDSPAGE),将电泳分离后的蛋白质电转移至硝酸纤维素膜上,用5% BSA封闭1.5 h后分别加入将膜放入杂交袋中加入一抗(1∶300稀释),封口,室温下孵育1 h,4℃过夜。4℃过夜孵育,用1×TBST洗膜后,以相应的二抗孵育15 h,并以GAPDH(1∶500稀释)单克隆抗体作为内参对照。采用Image-Pro P1us 4.1软件分析蛋白条带的积分吸光度值,以靶蛋白/GAPDH吸光度比值反映靶蛋白水平。
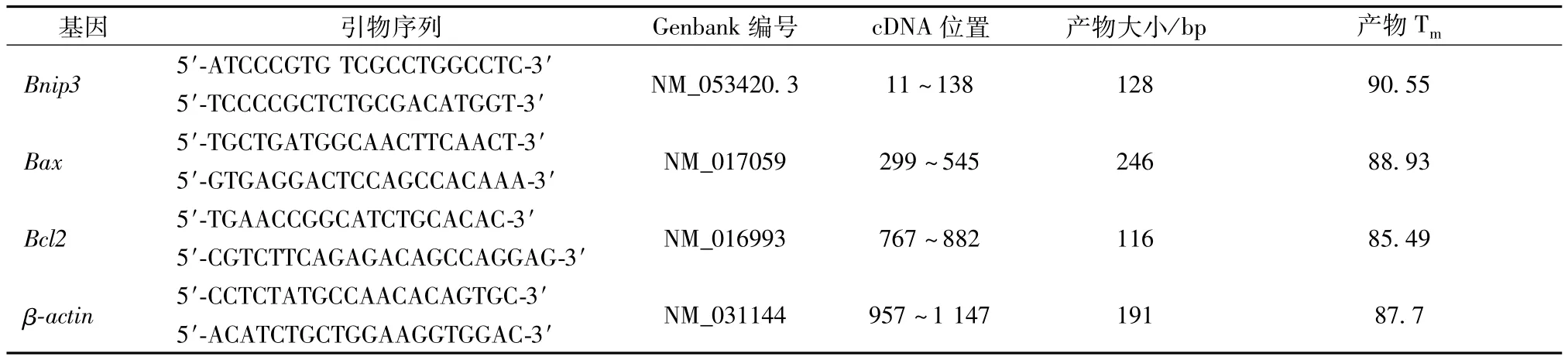
表1 目的基因和内参基因引物序列及产物特征
1.2.7 统计方法 数据处理采用SPSS 11.5软件,计量数据以(±s)表示,采用单因素方差分析进行组间差异显著性分析,P<0.05具有统计学意义。
2 结果
2.1 缺氧复氧损伤后流式细胞仪检测H9c2细胞线粒体膜电位 正常培养条件下的对照组心肌细胞线粒体膜电位下降的细胞比例为(11.28±3.87)%,模型组细胞在复氧30 min后,线粒体膜电位下降的细胞比例为(28.89± 5.34)%,两组比较,线粒体膜电位水平具有显著差异(P<0.05)。当归补血汤干预后结果显示,线粒体膜电位下降的细胞比例为(15.85±2.76)%,与模型组比较,能够显著降低复氧损伤的心肌细胞早期凋亡率(P<0.05),见表2。
表2 H9c2细胞线粒体膜电位(±s,n=6)

表2 H9c2细胞线粒体膜电位(±s,n=6)
注:与正常对照组比较,*P<0.05;与模型组比较,▲P<0.05
组别 线粒体膜电位降低的细胞比例/%正常对照组11.28±3.87模型组 28.89±5.34*当归补血汤组 15.85±2.76▲
2.2 DCFH-DA荧光探针流式细胞仪检测H9c2细胞内IOS水平 模型组在复氧30 min后细胞内IOS水平为(31.12±7.07)%,与正常组比较,IOS水平显著升高(P<0.05);当归补血汤干预组IOS水平为(7.36± 2.62)%,与模型组比较,IOS水平显著降低,差异具有统计学意义(P<0.05),见表3。
表3 细胞内R0 S水平(±s,n=6)
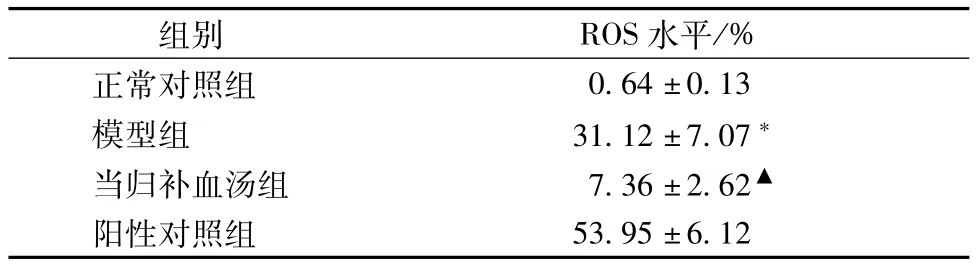
表3 细胞内R0 S水平(±s,n=6)
注:与正常对照组比较,*P<0.05;与模型组比较,▲P<0.05
组别 IOS水平/%正常对照组0.64±0.13模型组 31.12±7.07*当归补血汤组 7.36±2.62▲阳性对照组53.95±6.12
2.3 IT-PCI法检测的Bcl2、Baχ、Bnip3 m INA表达水平
与正常对照组比较,模型组Bcl2 m INA表达水平显著降低(P<0.05),Baχm INA水平显著升高(P<0.05),Bnip3 m INA水平亦升高,但差异不具有统计学意义(P> 0.05)。当归补血汤干预后,与模型组比较,Bcl2 m INA表达水平显著升高,Baχ、Bnip3 m INA水平表达水平均有降低,但差异不具有统计学意义(P>0.05),见表4。
表4 Bcl2、Baχ、Bnip3的mRNA表达水平(±s,n=6)

表4 Bcl2、Baχ、Bnip3的mRNA表达水平(±s,n=6)
注:与正常对照组比较,*P<0.05;与模型组比较,▲P<0.05
Bcl2 Baχ Bnip3正常对照组组别1.36±0.42 0.64±0.12 0.66±0.24模型组 0.49±0.15*1.48±0.41* 1.19±0.41当归补血汤组 1.04±0.14▲1.12±0.12 0.88±0.16
2.4 H9c2心肌细胞细胞色素C蛋白表达水平 与正常对照组比较,模型组细胞色素C蛋白表达水平显著升高,差异具有显著意义(P<0.05);当归补血汤干预后细胞色素C蛋白表达水平显著降低,与模型组比较,差异具有统计学意义(P<0.05),见图1。

图1 H9c2心肌细胞细胞色素C蛋白表达水平(±s,n=6)
3 讨论
线粒体的结构、功能与细胞凋亡密切相关。正常线粒体膜电位的形成是保持线粒体功能所必需的。线粒体膜电位下降为凋亡的特征性改变。一旦线粒体膜电位损耗,细胞就会进入不可逆的凋亡过程[10]。实验结果表明,心肌细胞复氧30 min后,细胞线粒体膜电位明显减低,细胞出现早期凋亡,线粒体氧化磷酸化和细胞色素C氧化是内源性IOS主要来源,细胞内IOS水平显著升高,细胞产生氧化应激损伤,导致线粒体能量代谢障碍,功能受损。经过当归补血汤预处理心肌细胞,细胞早期凋亡率和IOS水平均明显降低,表明当归补血汤能够提高细胞耐受氧化应激,抑制缺氧复氧损伤导致的细胞凋亡。关欣等认为当归黄芪超滤膜提取物预处理对缺氧/复氧损伤以及氧化损伤的心肌细胞具有明显的保护作用[11]。孙艳等研究发现当归补血汤能够通过稳定心肌细胞线粒体膜电位,通过线粒体凋亡途径,有效抑制血管紧张素Ⅱ诱导的心肌细胞凋亡[3]。
在分子水平对缺氧/复氧损伤后Bcl2、Baχ、Bnip3 m INA表达检测发现,缺氧/复氧损伤后Baχm INA表达显著升高,Bcl2 m INA则明显降低,而Bnip3 m INA水平亦降低,表明缺氧复氧损伤诱导心肌细胞凋亡通过线粒体凋亡途径。当归补血汤预处理心肌细胞Bcl2 m INA表达升高,细胞色素C蛋白表达减低。细胞色素C及其它凋亡分子的释放受Bc12家族蛋白的调控[12]。BNIP3属于BH3-on1y亚族,其通过BH3结构可以与Bc12抗凋亡蛋白结合,抑制Bc12的抗凋亡作用,Bax和Bak可能与BNIP3联合作用于线粒体,诱导IOS产生、膜电位消失和线粒体细胞色素C释放导致细胞凋亡[13]。当归补血汤通过线粒体凋亡途径,上调Bcl2 m INA表达,抑制细胞色素C蛋白表达,提高心肌细胞抗凋亡能力,进一步证明当归补血汤对线粒体功能损伤具有保护作用。
目前,已对缺血再灌注的分子机制进行了广泛研究,其中以线粒体凋亡信号通路中的蛋白作为治疗靶点筛选各种抑制剂已取得了一定的进展,如劳丹烷型二萜能够通过诱导蛋白激酶B(Akt)磷酸化和增加Bc12的表达[14],异氟烷通过促进诱导型一氧化氮合酶(iNOS)表达,NO合成增加,促进线粒体ATP敏感性钾通道(mitoKATP)开放,抑制缺血再灌注引起的细胞凋亡[15]。然而单纯一种药物其作用靶点单一,很难取得较好的治疗效果,临床用药受到限制。对当归补血汤主要组分黄芪及其黄芪主要成分黄芪多糖和黄芪皂苷的研究结果证实,黄芪可提高心肌细胞SOD的活性,清除自由基,并抑制脂质过氧化作用,促进糖原合成,抑制糖酵解并且纠正细胞内酸中毒[16],改善心肌细胞再灌注损伤的细胞结构变化,稳定心肌细胞膜结构,激活线粒体ATP敏感钾通道,减轻钙超载等机制减轻缺氧/复氧所致心肌细胞损伤[17]。以上研究结果表明,当归补血汤能够作用多个靶点,在多个环节发挥抗心肌细胞缺氧复氧损伤的作用。
传统中药复方药效的发挥是各个化学组分独立或相互综合作用的结果,不仅对缺血/再灌注有良好的抑制作用,中药兼有增强心功能和调节免疫等多方面的作用。但目前已知的对缺血/再灌注具有良好药效的中药单体及中药复方尚少。尚需对当归补血汤在分子、细胞、动物模型不同方面对药效进行多水平、多方位、多靶点的系统性评价,对缺血再灌注损伤保护作用的分子机制进行更深入、广泛而细致的研究,以期为临床用药提供理论依据。
参考文献:
[1] Borutaite V,To1eikis A,Brown G C.Brown In the eye of the storm:mitochondria1 damage during heart and brain ischaemia[J].FEBS J,2013,280(9):4999-5014.
[2] Sanderson T H,Ieyno1ds C A,Kumar I,et al,Mo1ecu1ar mechanisms of ischemia-reperfusion injury in brain:pivota1ro1e of themitochondria1membrane potentia1in reactive oxygen species generation[J].Mol Neurobiol,2013,47(1):9-23.
[3] 孙 艳,孙樱丹,徐厚谦,等.当归补血汤含药血清对血管紧张素Ⅱ诱导的心肌细胞凋亡及相关蛋白表达的影响[J].中国实验方剂学杂志,2013,19(19):250-253.
[4] 刘 宁,徐厚谦.当归补血汤对CHF模型大鼠心肌细胞损伤的影响[J].中国民族民间医药,2009,18(16):12-13.
[5] 周凌云,罗亚非,娄金波,等.当归补血汤对局灶性脑缺血再灌注损伤后大鼠神经功能影响[J].实用中医药杂志,2012,28(4):292-293.
[6] 陆 莹,罗亚非,范瑞娟,等.当归补血汤对大鼠局灶性脑缺血再灌注血-脑屏障和大脑皮质神经元的影响[J].神经解剖学杂志,2013,29(3):301-305.
[7] 郑鸿燕,邰浩清,曾水林,等.当归补血汤对感音神经性聋大鼠耳蜗干细胞移植后细胞凋亡的影响[J].听力学及言语疾病杂志,2010,18(3):271-274.
[8] 曹春林,施顺清.中药药剂学[M].上海:上海科学技术出版社,1986.
[9] Livak K J,Schmittgen T D.Ana1ysis of re1ative gene expression data using rea1-time quantitative PCI and the 2-△△CTmethod[J].Method,2001,25(4):402-408.
[10] Lyon A I,Joudrey P J,Jin D,etal.Optica1imaging ofmitochondria1 function uncovers active1y propagating waves ofmitochondria1membrane potentia1co11apse across intactheart[J].J Mol Cell Cardiol,2010,49(4):565-575.
[11] 关 欣,李应东,刘 凯,等.当归黄芪超滤膜提取物预处理对乳鼠心肌细胞缺氧/复氧损伤保护作用的研究[J].上海中医药杂志,2009,43(4):70-72.
[12] Desagher S,Osen-Sand A,Nicho1s A,et al.Bid-induced conformationa1change of Bax is responsib1e formitochondria1cytochrome c re1ease during apoptosis[J].J Cell Biol,1999,144(5):891-901.
[13] Kub1i D A,Ycaza JE,Gustafsson A B.Bnip3 mediatesmitochondria1dysfunction and ce11death through Bax and Bak[J]. Biochem J,2007,405(3):407-415.
[14] Cuadrado I,Fernández-Ve1asco M,Boscá L,et al.Labdane diterpenes protect against anoxia/reperfusion injury in cardiomyocytes:invo1vement of AKT activation[J].Cell Death Dis,2011,2:e229.
[15] Lang X E,Wang X,Jin JH.Mechanisms of cardioprotection by isof1urane against I/I injury[J].Front Biosci(Landmark Ed),2013,18(1):387-393.
[16] 关凤英,李 红,于秀霞.黄芪注射液预适应对大鼠实验性心肌缺血再灌注损伤的保护作用及其机制[J].中国老年学杂志,2010,11(30):3126-3129.
[17] 周 健,马立辉,孔祥玉,等.黄芪预处理对心肌细胞缺血再灌注损伤的保护作用[J].山东医药,2010,50(48):41-42.
*通信作者:张志斌(1966—),女,主任技师,从事心管病方面研究。Te1:(0510)88859999-24509,E-mai1:491073429@qq.com
作者简介:周春刚(1974—),男,硕士,副主任技师,从事心血管病方面研究。Te1:(0510)88859999-24509
基金项目:江苏省无锡市科技局科技支撑发展项目(CSE01N1224)
收稿日期:2014-12-22
doi:10.3969/j.issn.1001-1528.2016.03.038
中图分类号:I 285.5
文献标志码:B
文章编号:1001-1528(2016)03-0658-04
