介孔二氧化硅纳米粒对黄酮类化合物载药性能及药物释放的影响
2016-04-06刘亚男裴高升邱喜龙戚爱棣任晓亮天津中医药大学中药学院天津300193
刘亚男, 裴高升, 邱喜龙, 戚爱棣, 任晓亮(天津中医药大学中药学院,天津300193)
介孔二氧化硅纳米粒对黄酮类化合物载药性能及药物释放的影响
刘亚男, 裴高升, 邱喜龙, 戚爱棣, 任晓亮*
(天津中医药大学中药学院,天津300193)
摘要:目的 制备介孔二氧化硅纳米粒,并研究其对黄酮类化合物(芹菜素、槲皮素、橙皮素)载药性能及药物释放的影响。方法 制备负载黄酮类化合物的介孔二氧化硅纳米粒,扫描/透射电镜、傅里叶红外光谱仪、X射线衍射、氮气吸附-脱附解析对其进行表征,高效液相色谱仪测定纳米粒的载药量。结果 所得纳米粒形状大小均一,平均粒径230~250 nm,比表面积为1 045 cm2/g,孔径2.8 nm。橙皮素、槲皮素和芹菜素的载药量分别为27%、23%和18%,40 min时的释放量分别为84%、80%和76%。结论 介孔二氧化硅纳米粒可实现黄酮类化合物的高负载,并显著提高其在水溶液中的溶出度。
关键词:介孔二氧化硅;纳米粒;芹菜素;槲皮素;橙皮素;载药性能;药物释放
KEY W 0 RDS:mesoporous si1ica;nanopartic1es;apigenin;quercetin;hesperetin;drug 1oading;drug re1ease
现代中药筛选的活性成分有相当一大部分为疏水性药物,在水中溶解度极微,药物不易被胃肠道吸收,导致生物利用度低,进而影响治疗效果,极大地限制了其临床应用[1-3]。目前,虽然已有多种新制剂技术,如水溶性前体药物的合成[4]、包合物[5-6]、纳米晶[7]、自乳化[8]等,分别通过减小药物粒径、使药物以分子状态存在、改变药物与胃肠黏膜的亲和性和透过性等方法提高其溶出度和生物利用度,但这些技术要求药物必须具备特定的物理化学性质[9-11],使常规纳米技术在中药制剂中应用受到极大限制。因此,迫切需要寻找符合中药特点的高载药量、适用范围广的给药系统。
与传统的药物载体,如脂质体、乳剂、聚合物纳米粒相比,无机载体具有物理稳定性好、粒子大小及形态控制简单、易于表面功能化等优势[12-14],在医药领域显示出巨大的应用前景。近年来,许多不同结构特性的无机材料,如金属纳米粒子[15]、纳米阀门[16-19]、量子点[20]、MOF体系[21-22]在药物传递中的应用受到广泛关注与重视。其中,介孔二氧化硅纳米粒[23]由于其较大的比表面积、较高的孔隙率、较好的稳定性、表面易被功能化修饰、良好的生物相容性,能渗透到细胞内而达到药物靶向释放的固有属性[24]等特点,作为药物载体已引起了生物医药领域研究人员的极大关注。例如,喜树碱[25]、紫杉醇[26]等疏水性药物包封在介孔硅中,当受到外界刺激时,可以从孔道中很好地释放出来。Wang等基于介孔二氧化硅的生物相容性和细胞渗透性,将替米沙坦药物包裹在介孔硅内,再结合制剂工艺,使其溶出速率加快,生物利用度提高[27],在改善难溶性药物的生物利用度方面具有较大优势。鉴于此,本实验以介孔二氧化硅纳米粒为优良载体,负载黄酮类活性成分,并对芹菜素、槲皮素和橙皮素的增溶作用进行考察。
1 材料
1.1 仪器 Shimadzu LC-20AT高效液相色谱仪(日本岛津公司);Bruker 550红外光谱仪(德国Bruker公司);I igakuU1tima IV粉末X射线衍射仪(日本I igaku公司);JEOL JSM 6700F扫描电镜(日本JEOL公司);Hitachi H-800透射电镜(日本Hitachi公司);DF-101S集热式磁力搅拌器(巩义市予华仪器有限责任公司);THZ-82恒温水浴振荡器(江苏省金坛市荣华仪器制造有限公司);台式离心机(美国Beckman公司);Sartorius BT125D天平(赛多利斯科学仪器北京有限公司);AX205分析天平、pH计(瑞士Mett1er To1edo公司);超纯水系统(美国Mi11ipore公司);Varian Cary 50 UV-Vis分光光度计(美国Varian公司)。
1.2 药品与试剂 芹菜素、橙皮素对照品购自南京泽朗医药科技有限公司(纯度≥98%);槲皮素对照品购自中国食品药品检定研究院(批号100081-200907)。十六烷基三甲基溴化铵(CTAB)、正硅酸乙酯(TEOS)购自阿拉丁公司。盐酸、氢氧化钠等试剂购自国药集团化学试剂有限公司;磷酸缓冲盐(pH=6.8)根据《中国药典》2010版附录XV制备;超纯水(18.2 MΩcm,Mi1-1ipore超纯水净化系统制得)。
2 方法
2.1 介孔二氧化硅纳米粒的制备[28 -29]称取十六烷基三甲基溴化铵(CTAB)1.0 g,加入240 mL蒸馏水和2 mo1/L NaOH溶液3.5 mL,超声溶解。80℃下磁力搅拌30 min(转速800 r/min)以活化CTAB模板剂,得到澄清溶液。逐滴加入5 mL TEOS,剧烈搅拌15 min,再在80℃油浴条件下继续反应2 h。将得到的白色沉淀纳米粒趁热过滤,大量水和甲醇洗涤,真空干燥过夜,得到含有CTAB的二氧化硅纳米粒子。再取制备的未脱模板剂的二氧化硅纳米粒子1.0 g,置于圆底烧瓶中,加入100 mL甲醇和1 mL浓盐酸,60℃下磁力搅拌12 h,重复1次,除去模板剂CTAB,再用大量蒸馏水和甲醇反复冲洗,常温下真空干燥,即得。
2.2 介孔二氧化硅纳米粒的表征测试
2.2.1 扫描电镜分析 采用扫描电镜测定介孔二氧化硅纳米粒的形貌特征,真空度大于1.33× 10-9kPa,加速电压10.0、20.0 kV,放大倍数× 3、6、10、20 k。
2.2.2 透射电镜分析 通过透射电镜分析介孔二氧化硅纳米粒内部孔道的特征,真空度大于1.33× 10-9kPa,加速电压200.0 kV,放大倍数×80.0、100.0、200.0 k,拍摄介孔材料的粒子形貌及孔结构。
2.2.3 红外分析 采用红外光谱分析测定介孔二氧化硅纳米粒的结构及官能团特征,KBr压片,波数范围400~4 000 cm-1,分辨率4 cm-1,扫描次数32次。
2.2.4 氮气吸附/脱附分析 采用氮气吸附-脱附法,分析介孔二氧化硅纳米粒的比表面及孔径分布。样品于250℃下真空脱气2 h,进行预处理,然后在77 K,实验压力与初始压力比(P/P0)为0.01~0.99的条件下进行氮吸附-脱附实验。根据BET、BJH公式,分别计算介孔硅纳米粒子的比表面积及孔体积。
2.2.5 X-射线粉末衍射分析 通过X-射线粉末衍射分析介孔二氧化硅纳米粒的晶型结构,管电压40 kV、管电流40 mA,铜靶、低角及高角扫描范围2θ分别为1~10°及10~75°,狭缝宽(1/6)°,扫描速率分别为2°/min及5°/min,波长0.154 10 nm。2.3 载药体系的制备 称取槲皮素、芹菜素和橙皮素适量,溶于20 mL乙醇中,配制成1 mo1/L标准品溶液。称取介孔硅纳米粒子50 mg,加到乙醇溶液中,超声分散20 min后,置于磁力搅拌器上,600 r/min下室温避光搅拌24 h,10 000 r/min离心10 min,分离沉淀,水和乙醇各洗涤3次,常温下真空干燥12 h,得到介孔硅负载黄酮类化合物的复合微球(MSN@槲皮素、MSN@芹菜素和MSN@橙皮素)。合并所有上清液和洗涤液,定容至50 mL,HPLC法于各自最大吸收波长处测定并计算药物的含有量。
2.4 载药量的测定
2.4.1 HPLC色谱条件 Waters Symmetry Shie1dTMIPC18色谱柱(4.6 mm×150 mm,5 μm);流动相为甲醇(A)-0.1%甲酸水(B),条件及检测波长见表1;体积流量1.0 mL/min;柱温室温;进样量10 μL。
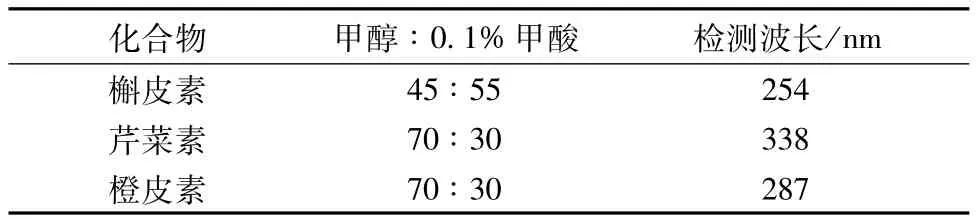
表1 流动相条件及检测波长Tab.1 M oblie phase conditions and detection Wavelengths
2.4.2 黄酮类化合物的测定 精密称取槲皮素、芹菜素、橙皮素对照品适量,置于10 mL棕色量瓶中,加甲醇定容至刻度,配制对照品储备液。按倍数用甲醇逐级稀释,置于10 mL棕色量瓶中,摇匀,配制成一系列标准溶液。按“2.4.1”项下色谱条件进样10 μL,进行分析,记录峰面积(图1)。以峰面积为纵坐标(Y),各对照品质量浓度(μg/mL)为横坐标(X)进行线性回归,得到回归方程(表2),表明各对照品在一定范围内均具有良好的线性关系。另外,槲皮素、芹菜素、橙皮素在水溶液中的饱和质量浓度分别为0.088 8、0.112 1、0.926 1 μg/mL,表明其在水溶液中的溶解度较低,在体内很难达到有效药物浓度以发挥药效。通过介孔二氧化硅纳米粒对槲皮素、芹菜素、橙皮素的负载,可提高其在水溶液中的溶出度,载药量计算公式为[30]载药量=[(m1-m2)/m]× 100%。其中,m、m1、m2分别为MSN@药物的质量、总投药量、上清液和洗涤液中的剩余药量。

图1 槲皮素、芹菜素、橙皮素的HPLC色谱图Fig.1 HPLC chromatograms of apigenin,quercetin and hesperetin

表2 黄酮类化合物的标准曲线Tab.2 Standard curves of flavonoid com pounds
2.4.3 药物的体外释放[28]分别精密称取各载药样品适量,置于渗析袋(分子质量≤8 000 Da)中,然后放置在盛有3 mL磷酸盐缓冲溶液(pH=6.8)的比色皿中,100 r/min磁力搅拌,间隔一定时间取样。然后,将比色皿置于紫外-可见分光光度计在各药物的最大吸收波长处,测定其载药样品的药物释放吸光度。
3 结果与讨论
3.1 扫描电镜和透射电镜的表征结果 如图2所示,从扫描电镜图片中可见制备的纳米粒呈近圆型,大小均一,粒径230~250 nm。而且,从透射电镜图片中可以明显地看到其狭长的孔道、六边形蜂窝状介孔结构和高度有序的排列。

图2 介孔二氧化硅纳米粒的扫描电镜图及透射电镜图Fig.2 Images of mesoporous silica nanoparticles revealed by scan electron m icroscopy and transm ission electron m icroscopy
3.2 红外表征结果 对介孔二氧化硅纳米粒进行FT-II表征,结果见图3。由图可知,793、460 cm-1处为Si-O-Si的伸缩振动和弯曲振动吸收峰;3 460 cm-1处是硅羟基Si-OH的弯曲振动峰;954 cm-1处是硅羟基Si-OH对称伸缩振动吸收峰;2 950 cm-1处的振动吸收峰与介孔硅的C-H伸缩振动吸收峰一致[28]。

图3 介孔二氧化硅纳米粒的红外光谱图Fig.3 Infrared spectrum ofmesoporous silica nanoparticles
3.3 介孔硅载体比表面积和孔径的表征结果 如图4所示,吸附等温线处有明显的回滞环,为Ⅳ型等温线,表明所制备的载体孔径在介孔范围内。由孔径分布图可知,孔径集中在2.8 nm左右,与透射电镜表征结果一致,而且非常均一。BET的测定结果表明,纳米粒的比表面积达1 045 m2/g,孔容为1.2 cm3/g。
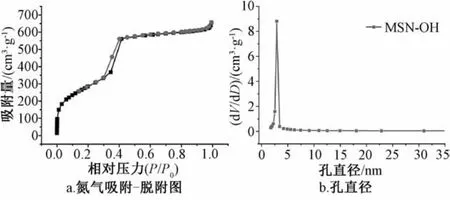
图4 介孔二氧化硅纳米粒的氮气吸附-脱附图和孔径分布Fig.4 N2 adsorption-desorption curve and pore size distribution ofmesoporous silica nanoparticles
3.4 粉末X射线衍射表征结果 对制备的纳米粒进行X射线衍射,结果见图5。由图可知,在低衍射角处有1个吸收很强的衍射峰,而在较高衍射角处有3个吸收较弱的衍射峰,分别为100°、110°、200°、220°典型峰,表明采用溶胶-凝胶法制备的纳米粒具有六方结构,属于MCM-41型[28]。
3.5 药物的体外释放 在药物浓度为1 mmo1/L,常温载药24 h时,纳米粒负载橙皮素、槲皮素和芹菜素的载药量分别为27%、23%和18%,三者于磷酸缓冲盐(pH=6.8)中的释放曲线见图6。起初,药物根据浓度差从纳米粒中缓慢释放,在40 min时达到平衡状态,橙皮素、槲皮素和芹菜素从纳米粒中的释放量分别为84%、80%和76%。

图5 介孔二氧化硅纳米粒的X射线衍射谱图Fig.5 X-ray diffraction pattern of mesoporous silica nanoparticles
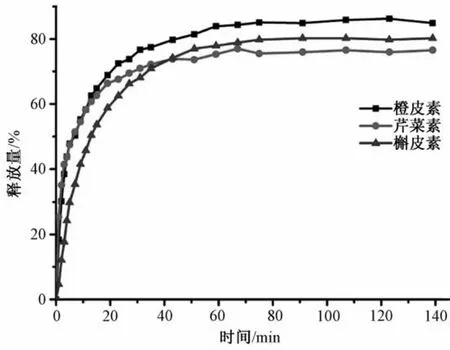
图6 载药(槲皮素、芹菜素和橙皮素)释放曲线Fig.6 Release curves of loaded drugs(quercetin,apigenin and hesperetin)
4 结论
本实验采用溶胶-凝胶法,制备有序介孔二氧化硅纳米粒子。采用溶剂吸附平衡法,使黄酮类化合物成功载入载体孔道结构中,由于其刚性结构能完全保护进入孔道中的药物,实现水难溶性中药的增溶效果。因此,固体分散体的载药量可以满足口服制剂的需要,有望成为药物的优良载体,对提高难溶性药物口服吸收具有潜在的应用价值[31]。
参考文献:
[1] Wang Z X,Deng Y J,Zhang X P.The nove1app1ication of tertiary buty1 a1coho1 in the preparation of hydrophobic drug-HP beta CD comp1ex[J].J Pharm Pharmacol,2006,58(3):409-414.
[2] Ferris D P,Lu J,Gothard C,et al.Synthesis of biomo1ecu1emodified mesoporous si1ica nanopartic1es for targeted hydrophobic drug de1ivery to cancer ce11s[J].Small,2011,7(13):1816-1826.
[3] Arya1S,Hu CM J,Fu V,etal.Nanopartic1e drug de1ivery enhances the cytotoxicity of hydrophobic-hydrophi1ic drug conjugates[J].JMater Chem,2012,22(3):994-999.
[4] Dahan A,Zimmermann E M,Ben-Shabat S.Modern prodrug design for targeted ora1drug de1ivery[J].Molecules,2014,19 (10):16489-16505.
[5] Shi J,Chen Y,Wang Q,et al.Construction and efficient radica1 cation stabi1ization of cyc1odextrin/ani1ine po1ypseudorotaxane and its conjugate with carbon nanotube[J].Adv Mater,2010,22(23):2575-2578.
[6] Uekama K,Hirayama F,Irie T.Cyc1odextrin drug carrier systems[J].Chem Rev,1998,98(5):2045-2076.
[7] Meyers M A,Mishra A,Benson D J.Mechanica1properties of nanocrysta11inemateria1s[J].Prog Mater Sci,2006,51(4):427-556.
[8] Mercuri A,Passa1acqua A,Wickham M S,et al.The effect of composition and gastric conditions on the se1f-emu1sification process of ibuprofen-1oaded se1f-emu1sifying drug de1ivery systems:A microscopic and dynamic gastric mode1 study[J]. Pharm Res,2011,28(7):1540-1551.
[9] Liu Y,Chen Y.Cooperative binding and mu1tip1e recognition by bridged bis(β-cyc1odextrin)swith functiona11inkers[J]. Acc Chem Res,2006,39(10):681-691.
[10] Chen Y,Liu Y.Cyc1odextrin-based bioactive supramo1ecu1ar assemb1ies[J].Chem Soc Rev,2010,39(22):495-505.
[11] Kusari S,Tatsimo S J,Züh1ke S,et al.Tramado1-A true natura1product?[J].Angew Chem Int Ed Engl,2014,53(45):12073-12076.
[12] Tarn D,Ferris D P,Barnes JC,etal.A reversib1e 1ight-operated nanova1ve on mesoporous si1ica nanopartic1es[J]. Nanoscale,2014,6(6):3335-3343.
[13] Li H,Chen D X,Sun Y L,et al.Vio1ogen-mediated assemb1y of and sensing with carboxy1atopi11ar[5]arene-modified go1d nanopartic1es[J]. J Am Chem Soc,2013,135(4):1570-1576.
[14] Ho D,Sun X L,Sun S H,etal.Monodispersemagnetic nanopartic1es for theranostic app1ications[J].Acc Chem Res,2011,44(10):875-882.
[15] Hao I,Yu J,Ge Z,etal.Deve1oping Fe3O4nanopartic1es into an efficientmu1timoda1ity imaging and therapeutic probe[J]. Nanoscale,2013,5(23):11954-11963.
[16] Ambrogio MW,Thomas C I,Zhao Y L,etal.Mechanized si1-ica nanopartic1es:a new frontier in theranostic nanomedicine[J].Acc Chem Res,2011,44(10):903-913.
[17] Li Z X,Barnes JC,Bosoy A,et al.Mesoporous si1ica nanopartic1es in biomedica1 app1ications[J].Chem Soc Rev,2012,41(7):2590-2605.
[18] Xue M,Zink J I.An enzymatic chemica1 amp1ifier based on mechanized nanopartic1es[J].J Am Chem Soc,2013,135 (47):17659-17662.
[19] Ma X,Tian H.Stimu1i-responsive supramo1ecu1ar po1ymers in aqueous so1ution[J]. Acc Chem Res,2014,47(7):1971-1981.
[20] Chen D X,Sun Y L,Zhang Y,et al.Supramo1ecu1ar se1f-assemb1y and photophysica1 properties of pi11ar[5]arene-stabi-1ized CdTe quantum dotsmediated by vio1ogens[J].Rsc Adv,2013,3(17):5765-5768.
[21] Tan L L,Li H,Zhou Y,et al.Zn2+-Triggered drug re1ease from biocompatib1e zirconium MOFsequipped with supramo1ecu-1ar gates[J].Small,2015,11(31):3807-3813.
[22] Tan L L,LiH,Qiu Y C,etal.Stimu1i-responsivemeta1-organic frameworks gated by pi11ar[5]arene supramo1ecu1ar switches[J].Chem Sci,2015,6(3):1640-1644.
[23] Yang YW,Sun Y L,Song N.Switchab1e host-guestsystemson surfaces[J].Acc Chem Res,2014,47(7):1950-1960.
[24] Song N,Yang YW.Mo1ecu1ar and supramo1ecu1ar switches on mesoporous si1ica nanopartic1es[J].Chem Soc Rev,2015,44 (11):3474-3504.
[25] Lu J,Liong M,Zink JI,etal.Mesoporous si1ica nanopartic1es as a de1ivery system for hydrophobic anticancer drugs[J]. Small,2007,3(8):1341-1346.
[26] Lu J,Liong M,Sherman S,et al.Mesoporous si1ica nanopartic1es for cancer therapy:energy-dependent ce11u1ar uptake and de1ivery of pac1itaxe1 to cancer ce11s[J].Nanobiotechnology,2007,3(2):89-95.
[27] Wang T Y,Zhao Q F,Han X,et al.App1ication of two kinds ofmesoporous si1ica for preparation of nimodipine so1id dispersion[J].Chin Pharm J,2014,49(13):1139-1145.
[28] Sun Y L,Yang YW,Chen D X,etal.Mechanized si1ica nanopartic1es based on pi11ar[5]arenes for on-command cargo re-1ease[J].Small,2013,9(19):3224-3229.
[29] Ange1os S,Yang Y W,Pate1K,et al.pH-Iesponsive supramo1ecu1ar nanova1ves based on cucurbit[6]uri1 pseudorotaxanes[J].Angew Chem Int Ed,2008,120(12):2254-2258.
[30] 胡 坪,邱莉苹,宁方红,等.氨基表面修饰有序介孔硅对槲皮素的载药性能及药物释放影响研究[J].中国药学杂志,2013,11(48):894-898.
[31] BarbéC,Bart1ett J,Kong L,et al.Si1ica partic1es:A nove1 drug-de1ivery system[J]. Adv Mater,2004,16(21):1959-1966.
Effects ofmesoporous silica nanoparticles on the drug loading and release of flavonoid com pounds
LIU Ya-nan, PEIGao-sheng, QIU Xi-1ong, QIAi-di, IEN Xiao-1iang*
(College of Traditional Chinese Medicine,TianJin University of Traditional Chinese Medicine,TianJin 3OOI93,China)
ABSTRACT:AIM To prepare mesoporous si1ica nanopartic1es and to study their impacts on f1avonoid compounds’(apigenin,quercetin and hesperetin)drug 1oading and re1ease.METH0DS The characters of prepared mesoporous si1ica nanopartic1es 1oaded with f1avonoid compoundswere determined by scan e1ectron microscopy,transmission e1ectron microscopy,Fourier transform infrared spectroscopy,X-ray diffraction and nitrogen adsorption-desorption ana1ysis.The drug 1oadings of nanopartic1es were then measured by high performance 1iquid chromatography(HPLC).RESULTS Found in a homogeneous shape,the obtained nanopartic1es demonstrated their average partic1e sizeswithin the range of 230 -250 nm,with a specific surface area of1 045 cm2/g and pore size of2.8 nm.In addition,for hesperetin,quercetin and apigenin,their re1eases at40 min were 84%,80% and 76% with the corresponding drug 1oadings of 27%,23% and 18%,respective1y.C0 NCLUSI0N The mesoporous si1ica nanopartic1es can he1p to achieve a high drug 1oading of f1avonoid compounds,and significant1y increase their disso1ution rates in aqueous so1utions.
*通信作者:任晓亮(1980—),男,副教授,从事中药化学、中药质量控制方法和药代动力学方面的研究。Te1:(022)59596221,E-mai1:xiao1iang_ ren@sina.com
作者简介:刘亚男(1984—),女,讲师,从事中药药代动力学、药效学评价、胃肠道稳定性方面的研究。Te1:13752728350,E-mai1:tianyinan2007@163.com
基金项目:国家自然科学基金青年基金项目(81473543)
收稿日期:2015-09-21
doi:10.3969/j.issn.1001-1528.2016.03.011
中图分类号:I944
文献标志码:A
文章编号:1001-1528(2016)03-0528-05
