子宫下段受累可能为Ⅰ期内膜癌辅助放疗的不良预后因素
2016-03-30侯晓荣晏俊芳刘志凯张福泉
侯晓荣,胡 克,沈 捷,连 欣,孙 帅,晏俊芳,刘志凯,张福泉
中国医学科学院 北京协和医学院 北京协和医院放射治疗科,北京100730
子宫下段受累可能为Ⅰ期内膜癌辅助放疗的不良预后因素
侯晓荣,胡 克,沈 捷,连 欣,孙 帅,晏俊芳,刘志凯,张福泉
中国医学科学院 北京协和医学院 北京协和医院放射治疗科,北京100730
目的 探讨子宫下段受累对Ⅰ期子宫内膜癌术后放疗患者的预后作用。方法 回顾性分析1999年1月至2012年12月在北京协和医院进行术后放疗的Ⅰ期子宫内膜癌患者265例,中位年龄53岁,病理类型主要为子宫内膜样腺癌 (226例,85.3%)。根据病理结果是否有子宫下段受累分为两组:子宫下段受累组和子宫下段未受累组,比较两组患者的预后因素和临床治疗结果,并对其中的高危和高中危患者进行亚组分析。主要研究终点包括总生存率、无进展生存率、局部区域复发率、远处转移率和治疗失败率。使用Kaplan-Meier法统计生存率,不同组间生存率的比较使用Log-rank检验,使用Cox比例风险回归模型进行预后因素分析。结果 所有Ⅰ期内膜癌患者的5年总生存率和无进展生存率分别为92.8%和89.7%,5年局部区域复发率、远处转移率和治疗失败率分别为4.5%、6.4%和7.8%。单因素分析显示,子宫下段受累是影响总生存率和无进展生存率的相关因素 (P=0.015,0.035)。Cox比例风险回归模型显示,子宫下段受累组患者的总生存率和无进展生存率更低 (P=0.041,RR=0.346,95%CI:0.125~0.959;P=0.041,RR=0.411,95%CI: 0.175~0.963)。亚组单因素分析显示,在高危和高中危患者中,子宫下段受累是影响治疗失败率的相关因素 (P= 0.034)。结论 子宫下段受累可能是影响Ⅰ期内膜癌辅助放疗患者总生存率和无进展生存率的不良预后因素;在高危和高中危患者中,子宫下段受累主要与治疗失败的发生相关。
子宫内膜癌;术后放疗;子宫下段受累;高中危;预后因素
Med J PUMCH,2016,7(4):246-252
子宫内膜癌患者子宫下段受累的概率约为4% ~58%[1],虽然国际妇产科联盟 (International Federation of Gynecology and Obstetrics,FIGO)手术病理分期并未将子宫下段受累列为诊断标准,但是有文献报道子宫下段受累是早期内膜癌患者的不良预后因素,有子宫下段受累的患者更容易出现肿瘤复发和淋巴结转移[2-4],美国国立综合癌症网络 (National Comprehensive Cancer Network,NCCN)也将子宫下段受累列为子宫内膜癌术后选择辅助放疗需要考虑的危险因素之一[5]。目前还不清楚子宫下段受累能否作为生存率的一个独立预后因素。本研究回顾性分析了265例Ⅰ期子宫内膜癌术后放疗患者的临床资料,比较有无子宫下段受累患者的各预后因素和临床治疗结果,旨在明确子宫下段受累对子宫内膜癌术后放疗的预后作用。
资料和方法
一般资料
1999年1月至2012年12月在北京协和医院放射治疗科进行术后放疗、手术病理分期为Ⅰ期的子宫内膜癌患者共265例,中位年龄53岁 (28~82岁)。病理类型:子宫内膜样腺癌226例 (85.3%)、腺鳞癌18例 (6.8%)、棘腺癌 1例 (0.4%)、鳞癌 1例(0.4%)、混合型癌18例 (6.8%)、黏液性腺癌1例(0.4%)。所有患者初始治疗均行全子宫双附件切除术,加或不加盆腔淋巴结切除或活检术,部分行腹主动脉旁淋巴结切除或活检术。术后病理证实有以下高危因素者进行辅助放疗:高龄 (60岁以上)、深肌层浸润、组织分级高 (G2~3级)、子宫下段受累、淋巴脉管间隙侵犯或盆腔淋巴结切除不彻底 (淋巴结切除数目小于10个)。将所有病例根据病理结果是否有子宫下段受累分为两组:子宫下段受累组和子宫下段未受累组。
治疗方式
手术方式为完全分期手术者 (全子宫双附件切除、盆腔/腹主动脉旁淋巴结切除)172例 (64.9%),全子宫双附件切除术者87例 (32.8%),全子宫双附件切除加淋巴结活检术者6例 (2.3%)。
术后辅助放疗方式有3种:盆腔外照射35例(13.2%)、单纯阴道内照射107例 (40.4%)、内外照射联合治疗123例 (46.4%)。盆腔外照射使用15或18MV-X线“箱形”四野等中心照射和调强放疗两种技术,剂量34~50 Gy;阴道内照射使用192Ir源后装治疗机,照射阴道残端及上1/2段,参考点于阴道黏膜下0.5 cm,参考剂量8~30 Gy。27例 (10.2%)接受辅助化疗,5例 (1.9%)接受内分泌治疗。
治疗后随诊及评价内容
治疗后前2年每3~6个月随诊一次,以后每6~12个月随诊一次。肿瘤复发分为两种情况:局部区域复发和远处转移。局部区域复发定义为阴道和盆腔内复发,所有盆腔外复发均定义为远处转移,所有局部区域复发和远处转移均定义为治疗失败。
总生存率统计自确诊开始至死亡或末次随诊日期,无进展生存率统计自放疗开始之日直至出现肿瘤复发、死亡或末次随诊日期。毒副反应评价参照美国放疗肿瘤学研究组和欧洲癌症研究治疗组织 (Radiation Therapy Oncology Group and the European Organiza-tion for Research and Treatment of Cancer,RTOG/ EORTC)急性、慢性放射损伤分级标准[6]。
危险因素分组
根据NCCN[5]及文献 [7]推荐的危险因素分组标准,筛选高中危和高危患者,并评价子宫下段受累对此类患者治疗结果的影响。具体标准如下:主要危险因素为:深肌层浸润和组织学G3级,次要危险因素为:年龄大于60岁、淋巴脉管间隙浸润、肿瘤大于2 cm、子宫下段受累或宫颈腺体浸润。同时满足2个主要危险因素者为高危患者,满足1个危险因素,伴有次要危险因素者为高中危患者。
统计学处理
采用SPSS 20.0统计软件进行统计学分析。使用Kaplan-Meier法统计生存率,不同组间生存率的比较使用Log-rank检验,使用Cox比例风险回归模型进行预后因素分析。多因素分析中,阳性事件定义为复发或死亡,各组之间的比较使用Cox比例风险回归模型进行,并对其中潜在的混杂因素进行调整 (例如:年龄、肿瘤分级、深肌层侵犯、淋巴脉管间隙侵犯、淋巴结手术方式和术后辅助放疗方式等)。P<0.05为差异有统计学意义。
结果
患者临床病理特征
265例患者中,子宫下段受累组83例 (31.3%),子宫下段未受累组182例 (68.7%);根据FIGO 2009手术-病理分期,Ia期145例 (54.7%),Ib期120例(45.3%)。病理分级为高分化 (G1级)101例(38.1%)、中分化 (G2级)113例 (42.6%)、低分化 (G3级)51例 (19.2%),其中有8例为子宫内膜样腺癌混有少部分透明细胞癌或浆液性乳头状癌成分者,划为G3级。病理类型:子宫内膜样腺癌226例(85.3%)、其他类型39例 (14.7%)。
两组患者的预后因素分布
两组患者详细的预后因素分布情况见表1。子宫下段未受累组中,年龄≥60岁和深肌层浸润的患者比例明显高于子宫下段受累组 (36.3%比28.9%,P= 0.000;51.6%比31.3%,P=0.002),而子宫下段未受累组进行外照射的患者比例高于子宫下段受累组(P=0.002)。放疗前有无贫血、组织学分级、淋巴脉管间隙侵犯、手术方式等其他预后因素在两组中的分布差异无统计学意义。

表1 子宫下段受累组与子宫下段未受累组患者的临床病理特征及预后因素分布[例 (%)]
生存分析
所有患者5年随访率85.7%,中位随诊时间53个月。15例患者出现了局部复发和/或远处转移,其中有6例发生了局部复发并远处转移,单纯局部复发者共2例,单纯远处转移者共7例。局部复发部位包括:阴道残端、盆腔淋巴结,主要远处转移部位包括:肺、腹腔、腹壁、腹股沟、纵隔、锁骨上、骨、脑等。共17例患者死亡,其中9例死于子宫内膜癌,8例死于其他疾病 (心脑血管疾病、其他恶性肿瘤等)。5年总生存率和无进展生存率分别为92.8%和89.7%。5年局部区域复发率、远处转移率和治疗失败率分别为4.5%、6.4%和7.8%。子宫下段未受累组5年总生存率和无进展生存率分别为97.2%和92.9%,明显优于子宫下段受累组 (分别为83.3%和81.4%,P=0.015,0.035)(图1、2)。子宫下段受累组的5年局部复发率、远处转移率和治疗失败率分别为5.1%、8.6%和9.9%,而子宫下段未受累组分别为3.3%、3.9%和6.5%。单因素分析显示子宫下段受累是影响总生存率和无进展生存率的相关因素(P=0.015,0.035)。
Cox比例风险回归模型显示,子宫下段受累组患者的总生存率和无进展生存率更低 (P=0.041,RR= 0.346,95%CI:0.125~0.959;P=0.041,RR= 0.411,95%CI:0.175~0.963)。
高危和高中危患者分析
符合危险因素分组标准的高危和高中危患者共95例,中位年龄 61岁;其中子宫下段受累组 39例(41.1%),子宫下段未受累组56例 (58.9%);进行盆腔外照射者63例 (66.3%),进行单纯阴道内照射者32例 (33.7%)。高危和高中危患者的临床病理特征及预后因素分布情况见表2。子宫下段未受累组中,年龄≥60岁和深肌层浸润的患者比例明显高于子宫下段受累组 (年龄≥60岁:75%比53.8%,P=0.000;深肌层浸润:78.6%比56.4%,P=0.021),其他预后因素在两组中的分布差异无统计学意义。在高危和高中危患者中,子宫下段受累组的5年总生存率和无进展生存率低于未受累组,但差异无统计学意义(90.7%比98.1%,P=0.375;85.3%比98.1%,P= 0.139)(图3、4)。单因素分析发现子宫下段受累是影响治疗失败率的因素 (P=0.034),但多因素分析未显示两者的相关性。

图1 子宫下段受累组与子宫下段未受累组患者总生存率比较

图2 子宫下段受累组与子宫下段未受累组患者无进展生存率比较
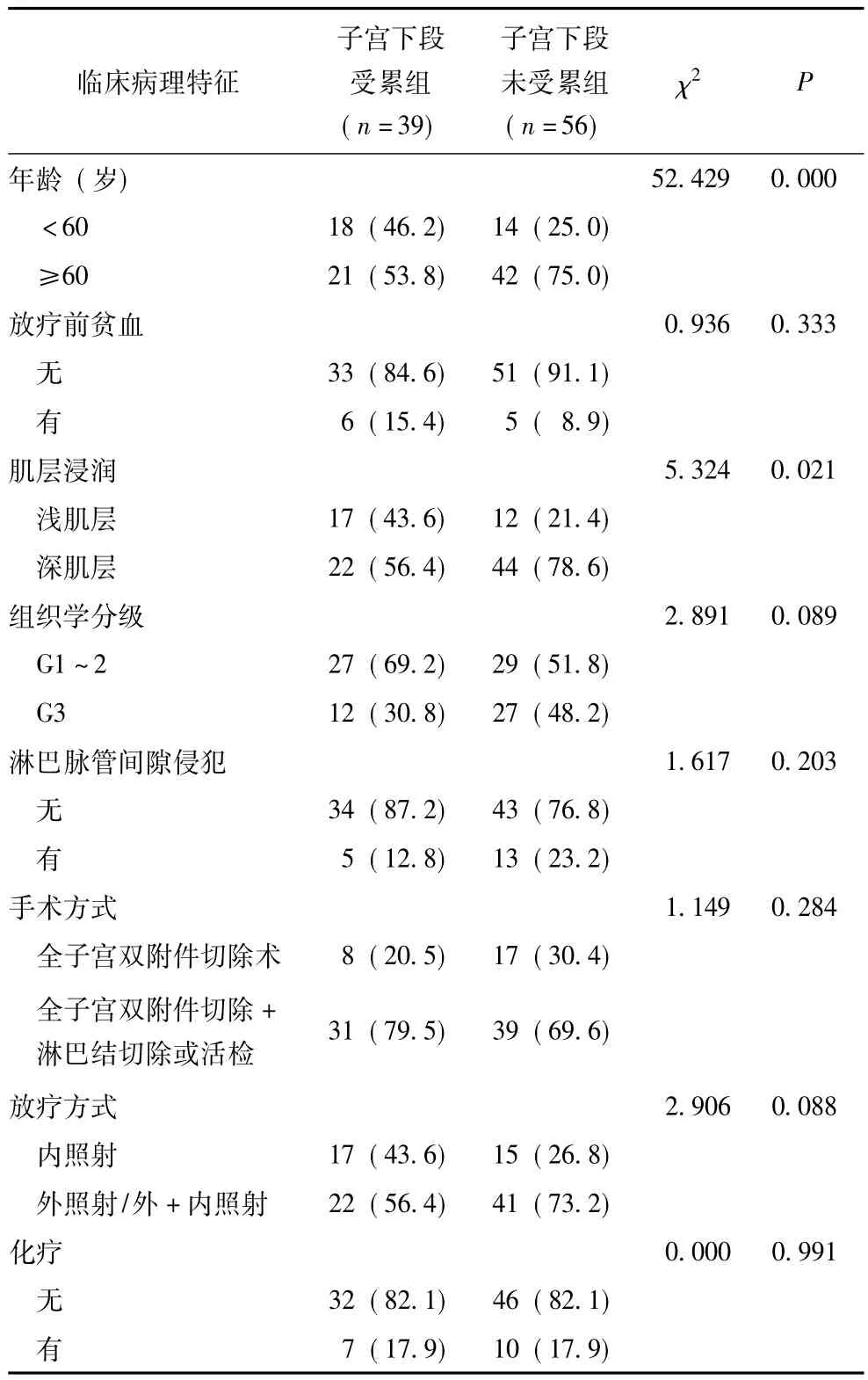
表2 高危和高中危患者中子宫下段受累组与子宫下段未受累组的临床病理特征及预后因素分布[例 (%)]

图3 高危和高中危患者中子宫下段受累组与子宫下段未受累组患者总生存率比较
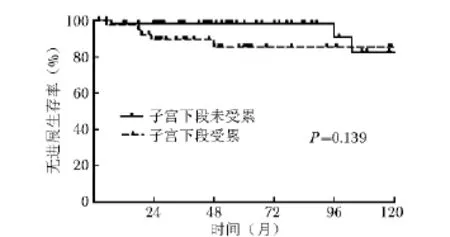
图4 高危和高中危患者子宫下段受累组与子宫下段未受累组患者无进展生存率比较
讨论
早期子宫内膜癌治疗后的预后良好,其预后不良因素主要包括分期、高龄、深肌层浸润、肿瘤组织分级、淋巴脉管间隙侵犯、组织学类型 (浆液性乳头状癌和透明细胞癌)等[8],而子宫下段受累能否作为生存率的一个独立预后因素,目前还有很多争论。本研究发现,子宫下段受累是影响Ⅰ期子宫内膜癌辅助放疗患者总生存率和无进展生存率的不良预后因素。在针对高危和高中危患者的亚组分析中,子宫下段受累也显示了对总生存率和无进展生存率影响的趋势,单因素分析显示子宫下段受累是影响治疗失败率的相关因素。
一些文献报道子宫下段受累是早期内膜癌患者的不良预后因素[2,9-10]。Gemer等[9]进行了一项多中心研究,共纳入来自以色列5个妇科肿瘤中心的Ⅰ期子宫内膜样腺癌患者769例,术后病理结果显示有子宫下段受累者138例,未受累者631例,结果发现全组患者中,子宫下段受累的发生率约为18%,子宫下段受累与肿瘤组织学分级高 (G3级)、深肌层浸润和淋巴脉管间隙浸润等因素明显相关 (P=0.002,<0.001,0.01)。单因素分析结果显示,子宫下段受累的患者无复发生存率 (P=0.09)、无远处转移生存率(P=0.04)和总生存率 (P=0.002)更低。Cox比例风险回归模型也显示子宫下段受累的患者总生存率更低 (HR 2.3;95%CI:1.3~3.9;P=0.003)。因此研究结论认为子宫下段受累是Ⅰ期子宫内膜样癌的一个不良预后因素,当这一因素存在时应该给予更彻底的治疗,包括分期手术和术后的辅助治疗。Grigsby等[11]研究发现子宫下段受累患者的5年无病生存率较未受累者低 (73%比89%),然而,多因素分析却未显示子宫下段受累可作为内膜癌的预后因素。Irwin等[12]也发现子宫下段受累患者的5年总生存率和无病生存率更低。本研究也显示了相似结果,子宫下段受累患者的5年总生存率和无进展生存率均低于子宫下段未受累者,但对局部区域复发率和远处转移率并无明显影响。
几项随机对照研究发现,术后放疗可明显降低早期子宫内膜癌的复发风险,尤其对高危和高中危患者。欧洲的子宫内膜癌术后放疗研究-1(Post OperativeRadiation Therapy in EndometrialCarcinoma-1,PORTEC-1)[13]纳入了714例 Ia期 G2~3级、Ib期G1~2级患者,根据术后病理有无高危因素 (肌层侵犯大于50%、脉管间隙受侵、G3级、宫颈受累)分为高、中、低危组,研究发现术后放疗明显降低了中危组和高中危组患者的5年局部复发率,中危组由14%降至4%,高中危组降低更为明显,由18%降至5%。美国妇科肿瘤组 (Gynecologic Oncology Group,GOG99)研究[14]纳入Ⅰ期、个别Ⅱ期子宫内膜癌患者共392例 (排除浆液性乳头状癌和透明细胞癌),随机分为手术+盆腔外照射组与单纯手术组。结果也显示术后放疗可以降低4年的局部复发率,中低危组由6%降至2%,高中危组由27%降至13%。另外加拿大的ASTEC/EN.5研究 (联合试验:ASTEC,淋巴结切除术及辅助外照射放疗子宫内膜癌随机研究; EN.5,单纯放疗或观察治疗手术后子宫内膜癌患者研究)[15]纳入905例早期内膜癌患者,随机分为手术+盆腔外照射组与单纯手术组,结果发现外照射组的局部复发率由6.1%降至3.2%,对总生存率无明显改善。基于以上随机对照研究的系统回顾和荟萃分析结果也显示,术后辅助放疗可以大大降低局部复发风险(降低72%),但没有发现放疗可以降低死亡、远处转移和肿瘤相关死亡风险。亚组分析中发现外照射可能会给高危患者 (例如Ib期G3级)带来生存方面的受益[16]。
但是对于低危患者,术后盆腔外照射可能会增加治疗毒副反应。2012年的一项荟萃分析共纳入8项随机对照研究,目的是评价Ⅰ期子宫内膜癌术后放疗的作用,结果发现在517例低危组病例中,术后放疗与内膜癌的相关死亡风险升高有关 (RR 2.64,95%CI: 1.05~6.66)[16]。挪威的一项随机对照研究纳入的是临床Ⅰ期患者,比较内外照射联合治疗与单纯内照射的治疗结果,随诊20年的结果显示:两组患者的总生存率并无明显差异 (HR 1.13,95%CI:0.96~1.35),但对于年龄小于60岁的患者,反而发现其生存率更低(HR 1.36,95%CI:1.06~1.76),同时发生第二原发肿瘤的风险更高 (HR 2.02,95%CI:1.30~3.15),而且有更高的治疗并发症发生率 (G2级:27%比5%,G3/4:3%比0)[17]。在本研究中,子宫下段未受累组患者接受盆腔外照射的比例高于子宫下段受累组患者,而且因为治疗时间跨度大,病例中也包括了一些中低危患者,那么所观察到的由子宫下段受累与否产生的生存差异,是否是由于治疗作用的干扰或者是中低危患者的参与作用呢?因此,本研究又进一步进行了亚组分析。
本研究中满足研究标准的高危和高中危患者共有95例,其中子宫下段受累者有39例 (41.1%)。在预后因素分布比较中,子宫下段未受累组的患者,年龄≥60岁和深肌层浸润的比例明显高于子宫下段受累组 (75%比 53.8%,P=0.000;78.6% 比56.4%,P=0.021),其他预后因素在两组中的分布并无明显差异,即子宫下段未受累组的预后不良因素更多。虽然两组的生存率差异无统计学意义,但从生存曲线图上看,子宫下段受累者的5年总生存率和无进展生存率低于未受累者 (90.7% 比98.1%,P=0.375;85.3%比98.1%,P=0.139)。此外,单因素分析发现子宫下段受累是影响治疗失败率的相关因素 (P=0.034)。Doll等[4]发现G3级及组织分化差的子宫内膜癌,子宫下段受累和肿瘤大小都与盆腔淋巴结转移相关,子宫下段受累还和腹主动脉旁淋巴结转移明显相关 (OR 3.83,95%CI:1.70~8.60,P= 0.01;OR 5.13;95%CI:1.96~13.45,P=0.01)。Mayr等[1]发现子宫下段受累时,肿瘤复发概率接近于Ⅱ期的子宫内膜癌患者。Madom等[2]研究了299例内膜癌患者,发现其中174例 (58%)有子宫下段受累,子宫下段受累的患者中出现淋巴结转移的概率明显高于无子宫下段受累者 (25%比8%,P= 0.0001)。在单因素分析中,子宫下段受累、淋巴血管间隙受累和深肌层浸润均预示淋巴结转移的可能性更大。在多因素分析中,子宫下段受累仍是子宫内膜癌患者出现淋巴结转移的预测因素。这和本研究结果相似。因此,子宫下段受累的患者可能更容易出现淋巴结或远处转移。
本研究的优势在于:(1)为单中心的研究结果,所有病例的治疗原则、治疗方案选择、治疗方案实施等方面的相对统一,减少了由于治疗差异等因素带来对治疗结果影响的干扰。(2)仅选择病理类型以子宫内膜样腺癌为主的病例,也规避了部分由此可能产生的混杂因素。病理类型为透明细胞癌或浆液性乳头状癌的子宫内膜癌,即使是早期,生物学行为也更具侵袭性。(3)对高危和高中危患者进行了亚组分析,发现子宫下段受累的患者更容易出现治疗失败。不足之处为本研究为回顾性,可能存在某些尚未发现的混杂因素,影响治疗及分析的结果。
综上,子宫下段受累可能是影响Ⅰ期子宫内膜癌术后辅助放疗患者总生存率和无进展生存率的不良预后因素。亚组分析发现,子宫下段受累与高危和高中危患者的治疗失败相关。
[1]Mayr NA,Wen BC,Benda JA,et al.Postoperative radiation therapy in clinical stageⅠ endometrial cancer:corpus,cervical,and lower uterine segment involvement—patterns of failure[J].Radiology,1995,196:323-328.
[2]Madom LM,Brown AK,Lui F,et al.Lower uterine segment involvement as a predictor for lymph node spread in endometrial carcinoma[J].Gynecol Oncol,2007,107:75-78.
[3]Misirlioglu S,Guzel AB,Gulec UK,et al.Prognostic factors determining recurrence in early-stage endometrial cancer[J].Eur J Gynaecol Oncol,2012,33:610-614.
[4]Doll KM,Tseng J,Denslow SA,et al.High-grade endometrial cancer:revisiting the impact of tumor size and location on outcomes[J].Gynecol Oncol,2014,132:44-49.
[5]National Comprehensive Cancer Network.NCCN Clinical Practice Guidelines In Uterine Neoplasms,V.1.2015[EB/ OL].http://www.nccn.org/professionals/physician_gls/ pdf/uterine.pdf.
[6]Pointreau Y,Kreps S,Hennequin C.Side effects evaluation of ionizing radiation[J].Cancer Radiother,2010,14:246-249.
[7]Klopp A,Smith BD,Alektiar K,et al.The role of postoperative radiation therapy for endometrial cancer:Executive summary of an American Society for Radiation Oncology evidencebased guideline[J].PractRadiatOncol,2014,4: 137-144.
[8]Kupets R,Le T,Le T,et al.The role of adjuvant therapy in endometrial cancer[J].J Obstet Gynaecol Can,2013,35: 375-379.
[9]Gemer O,Gdalevich M,Voldarsky M,et al.Lower uterine segment involvement is associated with adverse outcome in patients with stageⅠendometroid endometrial cancer:results of a multicenter study[J].Eur J Surg Oncol,2009,35:865-869.
[10]Brown AK,Madom L,Moore R,et al.The prognostic significance of lower uterine segment involvement in surgically staged endometrial cancer patients with negative nodes[J].Gynecol Oncol,2007,105:55-58.
[11]Grigsby PW,Perez CA,Kuten A,et al.Clinical stageⅠendometrial cancer:prognostic factors for local control and distant metastasis and implications of the new FIGO surgical staging system[J].Int J Radiat Oncol Biol Phys,1992,22: 905-911.
[12]Irwin C,Levin W,Fyles A,et al.The role of adjuvant radiotherapy in carcinoma of the endometrium-results in 550 patients with pathologic stageⅠ disease[J].Gynecol Oncol,1998,70:247-254.
[13]Creutzberg CL,Nout RA,Lybeert ML,et al.Fifteen-year radiotherapy outcomes of the randomized PORTEC-1 trial for endometrial carcinoma[J].Int J Radiat Oncol Biol Phys,2011,81:e631-e638.
[14]Ko EM,Funk MJ,Clark LH,et al.Did GOG99 and PORTEC1 change clinical practice in the United States?[J].Gynecol Oncol,2013,129:12-17.
[15]Blake P,Swart AM,Orton J,et al.Adjuvant external beam radiotherapy in the treatment of endometrial cancer(MRC ASTEC and NCIC CTG EN.5 randomised trials):pooled trial results,systematic review,and meta-analysis[J].Lancet,2009,373:137-146.
[16]Kong A,Johnson N,Kitchener HC,et al.Adjuvant radiotherapy for stageⅠendometrial cancer:an updated Cochrane systematic review and meta-analysis[J].J Natl Cancer Inst,2012,104:1625-1634.
[17]Onsrud M,Cvancarova M,Hellebust TP,et al.Long-term outcomes after pelvic radiation for early-stage endometrial cancer[J].J Clin Oncol,2013,31:3951-3956.
Lower Uterine Segment Involvement as a Predictor for Poor Prognosis in Patients Receiving Adjuvant Radiotherapy for Stage I Endometrial Carcinoma
HOU Xiao-rong,HU Ke,SHEN Jie,LIAN Xin,SUN Shuai,YAN Jun-fang,LIU Zhi-kai,ZHANG Fu-quan
Department of Radiation Oncology,Peking Union Medical College Hospital,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100730,China
ZHANG Fu-quan Tel:010-69155485,E-mail:zhangfuquan3@sina.com
Objective To explore the effect of lower uterine segment involvement(LUSI)in predicting the prognosis of stageⅠendometrial carcinoma patients treated with postoperative radiotherapy.Methods The data of a total of 265 patients with stageⅠendometrial carcinoma treated with hysterectomy and adjuvant radiotherapy between January 1999 and December 2012 were retrospectively analyzed.The median age of the cohort was 53 years.The most common pathological type was endometrioid adenocarcinoma(226/265,85.3%).The patients were divided into two groups according to the presence of LUSI:LUSI group and non-LUSI group.The prognostic factors and treatment outcomes were compared between the two groups,subgroup analysis was conducted in the high-risk and high-intermediate-risk patients in the two groups.Primary outcomes were overall survival(OS),progression-free survival(PFS),loco-regional recurrence(LR),distant metastasis(DM),and treatment failure (TF).The survival rates were calculated using the Kaplan-Meier method.The survival rates between differentgroups were compared using the Log-rank test.Prognostic factors for survival were analyzed using a Cox proportional hazards regression model.Results The 5-year OS and PFS for all the patients were 92.8%and 89.7%,respectively;the 5-year LR,DM,and TF were 4.5%,6.4%,and 7.8%,respectively.Univariate analysis revealed that LUSI was a significant predictor of OS and PFS(P=0.015,0.035).Cox proportional hazard model demonstrated a significantly decreased OS and PFS in the LUSI group compared with the non-LUSI group(P= 0.041,RR=0.346,95%CI:0.125-0.959;P=0.041,RR=0.411,95%CI:0.175-0.963).Subgroup univariate analysis showed that for high-risk and high-intermediate-risk patients,LUSI was a significant predictor of TF(P=0.034).Conclusions LUSI may be a significant predictor of reduced OS and PFS in patients with stageⅠ endometrial carcinoma treated with adjuvant radiotherapy.In addition,LUSI may be associated with treatment failure in high-risk and high-intermediate-risk patients.
endometrial carcinoma;postoperative radiotherapy;lower uterine segment involvement;high-intermediate risk; prognostic factor
张福泉 电话:010-69155485,E-mail:zhangfuquan3@sina.com
R544.1
A
1674-9081(2016)04-0246-07
10.3969/j.issn.1674-9081.2016.04.002
2016-01-18)
