酒精性肝病患者肝组织NLRP3炎症复合体基因水平检测及其意义*
2016-03-24张龙玉孙颖黄昂郝书理李保森张纪元邹正升
张龙玉,孙颖,黄昂,郝书理,李保森,张纪元,邹正升
·酒精性肝病·
酒精性肝病患者肝组织NLRP3炎症复合体基因水平检测及其意义*
张龙玉,孙颖,黄昂,郝书理,李保森,张纪元,邹正升
目的探讨核苷酸结合性寡聚区蛋白样受体(NLR)P3炎症复合体在酒精性肝病(ALD)发病中的作用。方法本研究获得酒精性肝炎(AH)12例、酒精性肝硬化(ALC)4例和健康人(HC)12例肝组织,采用RT-PCR法检测肝组织NLRP3、Caspase-1和IL-1βmRNA水平。采集ALD患者84例【AH20例、ALC48例(Child-Pugh A级19例、B级22例和C级7例)和重症酒精性肝炎(SAH)16例】和健康人40例血浆,采用ELISA法检测血浆IL-1β水平,采用Spearman秩相关分析血浆IL-1β水平与临床检验指标的相关性。结果AH和ALC患者肝组织NLRP3 mRNA水平分别为(28.1±2.8)和(28.4±3.1),均显著高于HC组【(8.8±1.8),P<0.001】,Caspase-1 mRNA水平分别为(18.8±1.2)和(24.6±1.8),均显著高于HC组【(15.1±1.0),P<0.05】,IL-1βmRNA水平分别为(17.0±2.9)和(16.3±4.4),均显著高于HC组【(7.0±1.1),P<0.01】;肝组织NLRP3 mRNA水平分别与IL-1βmRNA或Caspase-1 mRNA水平呈正相关(P<0.05);AH、ALC和SAH患者血浆IL-1β水平分别为(36.1± 1.8)pg/mL、(28.0±1.6)pg/mL和(32.5±2.4)pg/mL,均显著高于HC组【(14.7±0.8)pg/mL,P<0.01】;不同Child-Pugh分级ALC患者IL-1β水平无显著性差异(P>0.05);ALD患者血浆IL-1β水平与ALT和AST/ALT比值呈正相关。结论NLRP3炎症复合体主要组分及促炎细胞因子IL-1β在ALD患者肝组织和血浆水平升高,可能参与了ALD发病的炎症反应过程。
酒精性肝病;核苷酸结合性寡聚区蛋白样受体P3炎症复合体;Caspase-1;白介素-1β
属于核苷酸结合性寡聚区蛋白样受体(Nucleotide-binding and oligomerization domainlike receptors,NLRs)家族的NLRP3、凋亡相关点样CARD区的蛋白(Apoptosis-associated speck-like protein containing a CARD,ASC)和胱天蛋白酶前体(Pro-caspase-1)共同构成NLRP3炎症复合体[1~4]。NLRP3是NLRs家族的重要成员之一[5,6],作为胞浆内模式识别受体(Pattern-recognition receptors,PRRs)能感知病原体相关分子模式(Pathogen-associated molecular patterns,PAMPs)和内源性危险信号(Endogenous danger signals,DAM Ps),进而启动炎症复合体激活[7]。NLRP3的核苷酸结合性寡聚结构域(Nucleotide binding domain,NBD,又称NACHT区)通过介导自身寡聚化招募ASC和Pro-caspase-1,将Pro-caspase-1剪接为胱天蛋白酶(Caspase-1)。促炎细胞因子白细胞介素-1β前体(Pro-IL-1β)在Caspase-1的作用下生成具有活性的IL-1β,并释放到胞外,引起炎症反应[8~10]。目前已经证实NLRP3炎症复合体与许多疾病相关,而其与ALD发病的关系,到目前为止还不是很明确。本研究采用RT-PCR法检测了ALD患者和健康人肝组织NLRP3炎症复合体mRNA水平,现将结果报道如下。
1 对象与方法
1.1 研究对象2015年1月至8月于我中心住院治疗的酒精性肝炎(Alcoholic hepatitis,AH)12例、酒精性肝硬化(Alcoholic liver cirrhosis,ALC)4例患者的肝组织(主要来自肝脏穿刺活检术或因肝硬化行脾切除时所取得的少许肝组织)和健康对照(Health control,HC)12例肝组织(主要来自肝移植手术时正常肝组织或因血管瘤手术切除血管瘤时所取得的少许肝组织),均为男性。同时留取ALD患者血浆84例,其中AH患者20例、ALC患者48例(Child-Pugh A级19例、B级22例和C级7例)和重症酒精性肝炎(Severe alcoholic hepatitis,SAH)患者16例,均为男性。诊断参照中华医学会肝病分会脂肪肝和酒精性肝病学组2010年修订的《酒精性肝病诊疗指南》[1]。排除HBV、HCV和HIV感染、药物性肝损伤、自身免疫性肝病、肝脏原发性或继发性恶性肿瘤、孕妇以及合并严重的心、脑、血管、呼吸系统、泌尿系统疾病者。同时抽取40例男性HC血浆作为对照。各组在年龄、性别等方面无统计学差异,组间均衡性好,具有可比性。本研究经我院医学伦理委员会批准,受试者签署知情同意书。研究对象基线资料见表1。
1.2 肝组织有关基因mRNA测定提取新鲜肝组织总RNA,试剂盒购自Axygen公司(SFO,USA)。经分光光度计检测总RNA,并反转录为cDNA,试剂盒购自Promega公司(Wisconsin,USA)。采用RT-PCR法对NLRP3、Caspase-1和IL-1βmRNA进行检测,试剂盒购自博日科技(杭州,中国)。引物序列见表2,引物由赛百盛(上海,中国)合成。所得mRNA水平=2-△CT(△CT=目的基因的CT值-GAPDH的CT值)。
表1 研究对象临床资料(±s)

表1 研究对象临床资料(±s)
①中性粒细胞/淋巴细胞比值
HC(n=40)AH(n=20)ALC(n=48)SAH(n=16)年龄(岁)44.3±1.9 45.3±2.0 50.4±1.0 49.5±0.6饮酒时间(年)16.1±1.4 21.8±1.0 21.1±0.6日饮酒精量(g)117.3±13.7 100.3±4.5 102.3±3.0 NLR①1.9±0.2 2.1±0.3 2.7±0.2 2.9±0.2 ALB(g/L)42.1±1.6 40.9±1.2 31.2±0.7 32.2±0.5 TBIL(μmol/L)10.6±3.1 55.5±19.7 44.9±3.8 59.6±4.8 ALT(U/L)19.6±1.2 89.0±12.8 40.2±4.6 55.8±5.3 AST(U/L)23.1±2.9 96.4±16.1 57.1±4.6 64.9±3.8 ALP(U/L)56.8±4.1 134.2±17.2 117.5±11.1 123.8±7.1 PTA(%)96.1±2.1 92.6±4.9 64.1±2.0 38.2±1.5 INR 0.9±0.3 1.0±0.1 1.3±0.0 1.3±0.0
1.3 血清IL-1β检测清晨空腹采集静脉血,分离血浆,冻存于-80℃低温冰箱备测。采用ELISA法检测血浆IL-1β水平(eBioscience公司,Santiago,USA,检测范围为0~720 pg/ml,批内和批间变异系数分别为<5%和<10%),所有标本被重复检测2次。
1.4 统计学分析应用Windows系统SPSS 19.0(SPSS Inc.Chicago,IL,USA)统计软件分析,计量资料以(±s)表示,同组间比较采用Wilcoxon rank检验,不同组间比较采用Mann-Whitney U检验。采用Spearman秩相关,均为双侧检验。P<0.05被认为差异具有显著统计学意义。

表2 RT-PCR引物序列
2 结果
2.1 不同组肝组织NLRP3、Caspase-1和IL-1βmR -NA水平比较AH和ALC患者肝组织NLRP3 mRNA水平均显著高于HC(P<0.001),而AH与ALC患者之间无显著性差异(图1A);肝组织Caspase-1 mRNA水平均显著高于HC(P<0.05),三组肝组织Caspase-1 mRNA水平之间均有显著性差异(P<0.05,图1B);肝组织IL-1βmRNA水平均显著高于HC(P<0.01),而AH组与ALC组之间无显著性差异(图1C,表3)。
表3 3组肝组织NLRP3、Caspase-1和IL-1β m RNA水平(±s)比较

表3 3组肝组织NLRP3、Caspase-1和IL-1β m RNA水平(±s)比较
与HC组比,①P<0.05;与AH组比,②P<0.05

图1 A 3组肝组织NLRP3 mRNA水平比较

图1 B 3组肝组织Caspase-1 mRNA水平比较

图1 C 3组肝组织IL-1βmRNA水平比较
2.2 相关性分析对HC和ALD肝组织NLRP3 mRNA、Caspase-1mRNA和IL-1βmRNA水平进行分析发现,肝脏组织NLRP3 mRNA与IL-1βmRNA水平呈正相关(r=0.451,P<0.001,图2A);NLRP3 mRNA与Caspase-1 mRNA水平呈正相关(r=0.162,P<0.05,图2B);Caspase-1 mRNA与IL-1βmRNA水平无相关(r=0.080,P>0.05,图2C)。

图2 A肝组织NLRP3与IL-1βmRNA水平的相关性分析
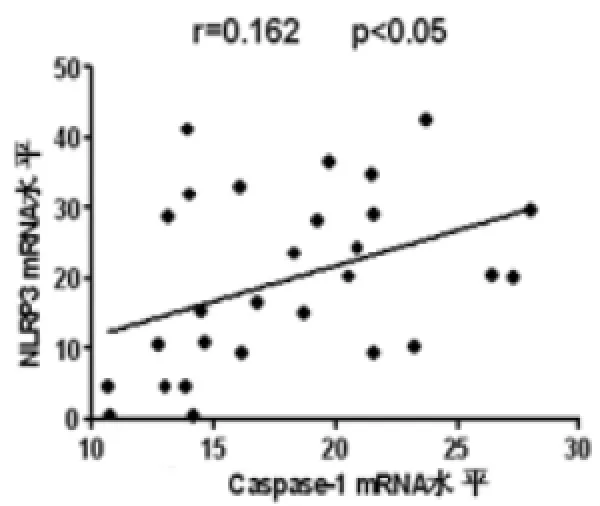
图2 B肝组织NLRP3与Caspase-1 mRNA水平的相关性分析

图2 C肝组织Caspase-1与IL-1βmRNA水平的相关性分析
2.3 血浆IL-1β水平比较AH(n=20)、ALC(n=48)和SAH(n=16)患者外周血血浆IL-1β水平分别为(36.1±1.8)pg/mL、(28.0±1.6)pg/mL和(32.5± 2.4)pg/mL,均显著高于HC组(n=40)【(14.7±0.8)pg/mL,P<0.001,图3A】;Child-Pugh A级(n=19)、B级(n=22)和C级(n=7)ALC患者血浆IL-1β水平分别为(27.5±2.8)pg/mL、(29.9±7.5)pg/mL和(21.1±4.2)pg/mL,3组之间无显著性差异(P>0.05,图3B)。

图3 A不同组血浆IL-1β水平比较

图3 B不同Child-Pugh分级ALC患者血浆IL-1β水平比较
2.4 血浆IL-1β水平与临床指标的相关性分析84例ALD患者血浆IL-1β水平与血清ALT(r=0.258,P<0.05,图4A)和AST/ALT比值(r=-0.374,P<0.05,图4B)呈正相关,而与NLR、ALB、TBIL、AST、ALP、PTA和INR无显著相关性。

图4 A血浆IL-1β与ALT水平的相关性

图4 B血浆IL-1β与AST/ALT比值的相关性
3 讨论
2002年,Martinon研究证实NLRP1能够与相关分子相互作用,形成大型蛋白复合体,即炎症复合体,从而活化Caspase-1,促进pro-IL-1β分子的成熟和释放[5,11]。NLRs是胞浆内具有信号传导功能的PRRs,与Toll样受体(Toll-like receptor,TLRs)一样,都是天然免疫系统对PAMPs和DAMPs识别的重要感受器。NLRP3作为NLRs家族中的一员,主要表达于单核-巨噬细胞、中性粒细胞和树突状细胞等[12~14]。NLRP3蛋白分子与ASC分子和pro-Caspase-1共同构成NLRP3炎症复合体。激活的NLRP3炎症复合体能促使caspase-1活化,进而促进pro-IL-1β的成熟和分泌[15,16]。近年来,NLRP3炎症小体在相关疾病中的作用引起了人们的关注。目前已经证实2型糖尿病、肥胖、痛风、阿尔茨海默病和克罗恩病等的发生与NLRP3炎症小体的激活有关[17~19]。
NLRP3炎症复合体的激活在ALD动物模型研究中被证实是导致肝细胞损伤、免疫细胞激活和肝脏炎症放大的原因之一。最近,Petrasek et al对NLRP3炎症复合体在酒精性肝炎中的作用进行了深入的研究,发现ALD小鼠肝内NLRP3炎症复合体的组分ASC、Caspase-1和效应因子IL-1β显著增加,而给小鼠体内注射重组IL-1受体拮抗剂(IL-1 receptor antagonist,IL-1Ra)阿那白滞素(Anakinra)可以减轻IL-1信号途径激活造成的ALD,提示重组IL-1Ra具有潜在的临床应用价值[20]。NLRP3炎症复合体与酒精性肝病患者肝内炎症、脂肪变和纤维化程度的关系还不是很明确,仍存有很大的研究空间。
本实验以临床ALD患者为研究对象,探讨了NLRP3炎症复合体信号通路及其相关分子与ALD发生和发展的关系。实验结果表明,ALD患者肝组织NLRP3 mRNA、Caspase-1 mRNA和IL-1βmRNA水平均显著高于HC组,具有统计学差异(P<0.05)。NLRP3 mRNA与IL-1βmRNA(r=0.451,P<0.001)、NLRP3 mRNA与Caspase-1 mRNA(r=0.162,P<0.05)均呈正相关。AH、ALC和SAH患者血浆IL-1β水平分别为(36.1±1.8)pg/m l、(28.0±1.6)pg/ml和(32.5±2.4)pg/ml,显著高于HC组[(14.7±0.8)pg/ml,P<0.001],但不同Child-Pugh分级ALC患者血浆IL-1β水平无显著差异(P>0.05)。在与临床指标的相关性分析中,ALD患者血浆IL-1β水平与ALT(r=0.258,P<0.05)和AST/ALT比值(r=-0.374,P<0.05)呈正相关。
NLRP3炎症复合体主要组分和促炎细胞因子IL-1β在ALD患者肝组织和血浆水平升高,提示NLRP3炎症复合体可能参与了ALD患者肝内炎症反应过程,在ALD炎症发病机制中发挥了重要作用,但其具体的相互作用机制还有待于进一步阐述。
[1]中华医学会肝病学分会脂肪肝和酒精性肝病学组.酒精性肝病诊疗指南.中华肝脏病杂志,2010,18(3):167-171.
[2]王晓霞,李保森.2002至2011年中国“北方”地区住院肝硬化患者病因构成及变化趋势分析.实用肝脏病杂志,2014,17(2): 154-158.
[3]邹正升,王晓霞.住院的酒精性肝病患者临床疾病特点分析.实用肝脏病杂志,2014,17(1):26-29.
[4]Martinon F,Burns K,Tschopp J,et al.The inflammasome:a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta.Mol Cell,2002,10(2): 417-426.
[5]Akira S US,Takeuch I.Pathogen recognition and innateimmunity. Cell,2006,124(4):783-801.
[6]Tschopp J.NALPs:a novel protein family involved in inflammation.Nat Rev Mol Cell Biol,2003,4(2):95-104.
[7]Cassel SL,Joly S,Sutterwala FS,et al.The NLRP3 inflammasome: a sensor of immune danger signals.Semin Immunol,2009,21(4): 194-198.
[8]Albano E,Vidali M.Immune mechanisms in alcoholic liver disease.Genes Nutr,2010,5:141-147.
[9]Szabo G,Csak T.Inflammasomes in liver diseases.J Hepatol,2012,57(3):642-654.
[10]Gross O,Thomas CJ,Guarda G,et al.The inflammasome:an integrated view.Immunol Rev,2011,243(1):136-151.
[11]Szabo G,Petrasek J.Inflammasome activation and function in liver disease.Nature Rev Gastroenterol Hepatol,2015,12: 387-400.
[12]Lippai D,Bala S,Petrasek J,et al.Alcohol-induced IL-1 in the brain is mediated by NLRP3/ASC inflammasome activation that amplifies neuroinflammation.J Leukoc Biol,2013,94:171-182.、
[13]Ayna G,Krysko DV,Kaczmarek A,et al.ATP release from dying autophagic cells and their phagocytosis are crucial for inflammasome activation in macrophages.PLoSOne,2012,7(6):e40069.
[14]Zhou1 R,Yazdi1 AS,Menu1 P,et al.A role for mitochondria in NLRP3 inflammasome activation.Nature,2011,469:221-226.
[15]Petrasek J,Bala S,Csak T,et al.IL-1 receptor antagonist ameliorates inflammasome-dependent alcoholic steatohepatitis in mice.JClin Invest,2012,122(10):3476-3489.
[16]Peng Y,French BA,Tillman B,et al.The inflammasome in alcoholic hepatitis:Its relationship with Mallory-Denk body formation.Ex p Mol Pathol,2014,97(2):305-313.
[17]Larsen CM,Faulenbach M,Vaag A,et al.Interleukin-1-receptor antagonist in type 2 diabetes mellitus.Medication,2007,356: 1517-1526.
[18]McGonagle D,Tan AL,Madden J,et al.Successful treatment of resistant pseudogout with anakinra.Arthritis Rheum,2008,58(2):631-633.
[19]So A,De Smedt T,Revaz S,et al.A pilot study of IL-1 inhibition by anakinra in acute gout.Arthritis Res Ther,2007,9(2):R28.
[20]Bauernfeind F,Ablasser A,Bartok E,et al.Inflammasomes: current understanding and open questions.Cell Mol Life Sci,2011,68(5):765-783.
(收稿:2015-12-02)
(本文编辑:陈从新)
Role of nucleotide-binding and oligom erization dom ain-like recep tors P3 inflamm asome in patients with alcoho licliverd iseases
Zhang Longyu,Sun Ying,Huang Ang,et al.
Center for Diagnosis and Treatment of Non-Infectious Liver Disease,302nd Hospital,Beijing 100039,China
Objective To explore the role of nucleotide-binding and oligomerization domain-like receptors(NLR)P3 inflammasome in patients with alcoholic liver diseases(ALD).M ethods The liver tissues from 12 patients with alcoholic hepatitis(AH),4 with alcoholic liver cirrhosis(ALC)and 12 healthy persons were obtained in this study,and NLRP3,Caspase 1 and IL-1 beta mRNA levels were detected by RT-PCR.Plasma IL-1βlevels were assayed by ELISA in 84 patients with ALD[20 with AH,48 with ALC(19 with Child-Pugh class A,22 with class B and 7 with class C),16 with severe alcoholic hepatitis(SAH)and 40 healthy persons.The correlation of plasma IL-1βlevel to biochemical indexes was analyzed.Resu lts The hepatic NLRP3 mRNA levels in patients with AH and ALC were(28.1±2.8)and(28.4±3.1),significantly higher than that in healthy control[(8.8±1.8),P<0.01],the Caspase-1 mRNA levels were(18.8±1.2)and(24.6±1.8),significantly higher than that in healthy persons[(15.1±1),P<0.05],IL-1βmRNA levels were(17.0±2.9)and(16.3±4.4),significantly higher than that in healthy control[(7.0±1.1),P<0.01],and NLRP3 mRNA levels was positively correlated to IL-1βmRNA or Caspase 1 mRNA(P<0.05);plasma IL-1βlevels in patients with AH,ALC and SAH were(36.1±1.8) pg/mL,(28.0±1.6)pg/m l and(32.5±2.4)pg/m l,respectively,significantly higher than that in healthy persons[(1.5±0.8)pg/ml,P<0.01];the plasma IL-1β levels in patients with Child-Pugh class A,B and C had no significant difference(P>0.05);plasma IL-1β level in patients with ALD was positively correlated to serum ALT or the ratio of AST/ALT.Conclusion NLRP3 inflammasome and proinflammatory cytokinesIL-1βare involved in patients with ALD,and they might play an important roles in liver inflammatory process.
Alcoholic liver diseases;Nucleotide-binding and oligomerization domain-like receptors P3;Caspase-1;Interleukin-1β
10.3969/j.issn.1672-5069.2016.06.010
国家自然科学基金面上项目(编号:81370530,8157 041750)
100039北京市北京大学医学部教学医院/解放军第302医院非感染性肝病诊疗中心(张龙玉,孙颖,黄昂,郝书理,李保森,邹正升);肝病生物治疗研究中心(张纪元)
张龙玉,女,27岁,硕士研究生。主要从事酒精性肝病致病机制与治疗学研究。E-mail:zhly302@163.com
邹正升,E-mail:zszou302@163.com
