PI3K/Akt/Sirt1信号通路介导硫化氢后处理对大鼠缺血心肌的保护作用
2016-03-24胡明珠陈俊良庞庆丰
胡明珠,周 波,盛 琼,杜 斌,陈俊良,庞庆丰,季 永
[1.江南大学附属医院 (无锡市第四人民医院)麻醉科,江苏 无锡 214062;2.江南大学无锡医学院,江苏 无锡 214062]
PI3K/Akt/Sirt1信号通路介导硫化氢后处理对大鼠缺血心肌的保护作用
胡明珠1,2,周波1,盛琼2,杜斌2,陈俊良2,庞庆丰2,季永1,2
[1.江南大学附属医院 (无锡市第四人民医院)麻醉科,江苏 无锡214062;2.江南大学无锡医学院,江苏 无锡214062]
中国图书分类号:R-332;R322.11;R329.25;R331.31;R542.202.2
摘要:目的探讨PI3K/Akt/Sirt1 信号通路是否参与硫化氢(H2S)抗心肌缺血/再灌注( I/R )损伤的作用。方法采用Langendorff灌流装置建立大鼠离体心脏I/R损伤模型,平衡灌注20 min后,全心停灌30 min,复灌60 min。60只♂SD大鼠,随机分为5组(n=12):空白组(Control组)、缺血/再灌注组(I/R组)、H2S后处理组(H2S组)、抑制剂LY294002组(LY组)、H2S后处理+ 抑制剂组(H2S+LY组)。统计平衡末及再灌注末的左室舒张末期压(LVEDP)、左室发展压(LVDP)、左室内压上升最大速率(+dp/dtmax)和左室内压下降最大速率(-dp/dtmax);TTC法测定心肌梗死面积;实时荧光定量PCR 法检测Sirt1和PGC-1α的 mRNA 含量;通过Western blot法检测总的Sirt1和PGC-1α 的蛋白表达水平;免疫组化检测Sirt1的细胞分布情况。结果各组间的心功能指标在平衡末差异无统计学意义(P>0.05)。再灌注60 min,H2S组与I/R组相比,心功能的各项指标明显改善(P<0.05),心肌梗死面积减少(26.9±4.9)% vs(48.9±5.6)%(P<0.05);Sirt1和PGC-1α表达水平明显升高(P<0.05);Sirt1的细胞核阳性表达指数增加(P<0.05)。LY294002逆转了H2S后处理产生的心肌保护效应,使H2S后处理+抑制剂组心功能指标、Sirt1和PGC-1α 的表达及Sirt1的细胞核阳性表达指数降低,心肌梗死面积增加。结论PI3K/Akt/Sirt1信号通路参与了H2S后处理对大鼠缺血心肌的保护作用。
关键词:缺血/再灌注损伤;硫化氢;后处理;PI3K/Akt;Sirt1;PGC-1α;心脏保护
越来越多的研究表明,H2S是一种有效的心脏保护气体信号分子,参与许多心血管系统的病理、生理调节过程。虽然本课题组前期研究证实,外源性H2S后处理通过磷脂酰肌醇3 激酶/ 蛋白激酶B(phosphatidyqinositol-3 kinase/protein kinase B,PI3K/Akt) 信号通路保护大鼠缺血心肌[1-2],但其下游靶分子仍未完全清楚。有文献报道,Sirt1表达水平的降低可导致心肌梗死的发生[3],激活PI3K/Akt可磷酸化Sirt1,使其进入细胞核发挥作用[4]。然而,PI3K/Akt/Sirt1信号通路是否参与了H2S后处理对大鼠缺血心肌的保护作用还未见报到。本研究拟通过使用大鼠离体心脏I/R损伤模型及PI3K/Akt特异性抑制剂LY294002来探索PI3K/Akt/Sirt1信号通路在H2S保护缺血心肌中的作用。
1材料与方法
1.1试剂氯化三苯基四氮唑(TTC)、硫氢化钠、 LY294002(Sigma, 美国);鼠抗Sirt1单克隆抗体(ab110304,Abcam)、兔抗PGC-1α多克隆抗体(ab54481,Abcam);兔抗β-actin多克隆抗体(Bioworld Technology, 美国)、辣根过氧化物酶标记的山羊抗兔IgG(北京中杉金桥生物公司)及辣根过氧化物酶标记的山羊抗鼠IgG(武汉博士德生物公司);SDS-PAGE 凝胶试剂盒、SDS-PAGE蛋白上样缓冲液、超敏ECL化学发光试剂盒(碧云天生物技术公司);动物组织总RNA提取试剂盒(天根生化科技);逆转录及实时荧光定量PCR检测试剂盒(TaKaRa,日本)。
1.2仪器Langendorff离体心脏灌流装置、Power Lab八通道生理记录仪(ADInstrument ,澳大利亚);Roche实时荧光定量PCR仪(Roche Light Cycler480Ⅱ,德国)。
1.3大鼠离体心脏I/R模型的制备清洁级♂SD大鼠60只(8~10周龄,250±30 g),上海斯莱克实验动物责任有限公司提供,实验动物许可证号:SCXK (沪) 2012-0002。腹腔注射3%的戊巴比妥钠(80 mg·kg-1)麻醉,肝素钠500 U·kg-1抗凝。麻醉后迅速打开胸腔取出心脏,置于呈冰水混合物状态的95% O2和5% CO2混合气体饱和的K-H液中,然后经主动脉逆行插管固定在Langendorff 灌注装置上。使用37 ℃恒温加热的95% O2和5% CO2混合气体饱和的改良K-H液进行常规恒流灌注(12 mL·min-1)。改良的K-H液成分为(mmol·L-1):NaCl 118.5、KCl 4.7、CaCl22.5、MgSO41.2、KH2PO41.2、NaHCO324.8、D-Glucose 11、EDTA-2Na 0.125,pH=7.2~7.4。通过左心室内自制球囊实时监测心脏血流动力学指标:左室发展压(LVDP)、左室内压上升/下降最大速率(±dp/dtmax)和左室舒张末压(LVEDP)等。
1.4实验动物分组60 只♂SD大鼠随机分为5组(n=12):① Control组,全心持续灌注110 min;② I/R组,平衡20 min后,全心停灌30 min,再灌注60 min;③ I/R + NaHS组(H2S组),全心停灌30 min后,复灌即刻给予含NaHS 10 μmol·L-1的K-H液15 s,不含NaHS的K-H液15 s,连续重复4次[1],其余处理同I/R组;④ I/R+LY294002组(LY组), 平衡末10 min及复灌前5 min给予15 μmol·L-1LY294002[8]溶于0.02% DMSO的K-H液,共15 min,其余处理同I/R组;⑤ I/R+NaHS+LY294002组(H2S+LY组),平衡末10 min及复灌前5 min给予15 μmol·L-1LY294002溶于0.02% DMSO的K-H液,共15 min,同时复灌即刻给予含NaHS 10 μmol·L-1的K-H液15 s,不含NaHS的K-H液15 s,重复4次,其余处理同I/R组。
1.5TTC法测定心肌梗死面积复灌末取下大鼠心脏,置于-80 ℃冷冻5~10 min,剔除右心室和右心房后,将心脏横切成约2~3 mm的薄片(4~6片),然后浸于37 ℃的1% TTC磷酸缓冲液(pH 7.4)中闭光孵育20 min。终止反应后,可见梗死的灰白色心肌以及存活的砖红色心肌。甲醛固定后,将切片心肌进行扫描,采用Image J软件计算心肌梗死面积百分比/%=(梗死心肌面积之和/心肌总面积之和)× 100%。
1.6荧光实时定量PCR法检测Sirt1和PGC-1α的 mRNA含量取复灌末置于-80 ℃冰箱保存的心肌组织,按照总RNA提取试剂盒说明书步骤提取总RNA,并以总RNA为模板,加入逆转录试剂合成 cDNA。根据SYBR Green 试剂盒说明书,以cDNA为模板进行逆转录聚合酶链式反应,通过Roche Light Cycler480Ⅱ荧光定量PCR仪实时监测荧光强度。根据Light Cycler480 optical system software(SW1.5.1)提供的CP值,以GAPDH为内参,用算术公式“2-ΔΔCT”对结果进行计算后再统计分析[3]。以检索Genbank得到的基因序列设计引物如下:Sirt1,5′-CACCGAGGAACTACCTGAT-3′(forward),5′-CATCCCAGCCTCCGTTAT-3′(reverse)。PGC-1α, 5′-CCTCCATGCCTGACGGCACC-3′(forward),5′-GAGCTGAGTGTTGGCTGGCG-3′(reverse)。GAPDH,5′-GGA TGGAATTGTGAGGGAGA-3′(forward),5′-GTGGACCT CATGGCCTACAT-3′(reverse)。引物均由上海生工合成。
1.7Western blot 法测定Sirt1和 PGC-1α的蛋白表达取适量-80 ℃保存的心肌组织置于冰上,加入预冷的裂解液,快速制备组织匀浆,4 ℃ 14 000×g离心10 min后取上清。BCA法测定蛋白浓度后配平,加入5×SDS上样缓冲液后煮沸。取40 μg总的心肌蛋白进行SDS-PAGE电泳,然后将蛋白转移到PVDF膜上。5%的脱脂奶粉室温摇床封闭2 h ,加入TBST稀释的一抗(Sirt1,1 ∶1 000; PGC-1α,1 ∶1 000;β-actin,1 ∶3 000),4℃摇床孵育过夜,TBST漂洗后加入相应的HRP标记的二抗(1 ∶2 000),继续室温摇床封闭2 h ,最后采用超敏ECL发光液进行曝光,用Image J对蛋白条带进行分析。
1.8免疫组化法检测Sirt1的细胞分布心肌组织石蜡切片,按照SABC即用型免疫组化试剂盒说明书进行标记染色(武汉博士德生物公司)。按标准免疫组化步骤处理石蜡切片。加入PBS稀释的一抗(Sirt1,1 ∶300),4 ℃孵育过夜后DAB显色,镜下不断观察染色程度,终止反应后苏木精染核。每张切片在×400镜头下随机选取6个高倍视野,统计相应视野内的Sirt1 阳性细胞核个数,以细胞核阳性表达指数(%)即视野内阳性细胞核个数/视野内所有心肌细胞个数来反映各组心肌组织中Sirt1的细胞分布情况 。
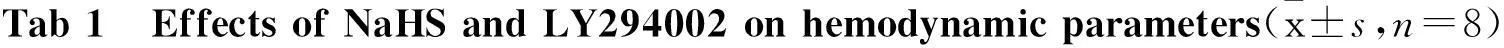

GroupBaselineReperfusion30min60minLVEDP/kPaControl0.83±0.181.05±0.191.09±0.20I/R0.85±0.166.06±0.85*6.46±0.75*I/R+NaHS0.84±0.164.38±0.57#4.50±0.76#I/R+LY2940020.85±0.186.46±0.91△6.06±0.91△I/R+LY294002+NaHS0.83±0.185.98±0.89△5.80±0.90△LVDP/kPaControl14.30±0.6513.75±0.5113.49±0.52I/R14.33±0.915.86±1.11*6.13±1.33*I/R+NaHS13.99±0.838.00±1.56#8.32±1.70#I/R+LY29400214.08±0.895.58±1.21△5.61±1.57△I/R+LY294002+NaHS13.82±0.995.84±1.55△5.66±1.47△+dp/dtmax/kPa·s-1Control361±23358±25348±25I/R360±25170±25*155±25*I/R+NaHS341±24208±23#230±27#I/R+LY294002345±26148±27△152±27△I/R+LY294002+NaHS331±26151±25△146±25△-dp/dtmax/kPa·s-1Control-311±24-293±24-290±24I/R-298±23-125±27*-113±29*I/R+NaHS-293±23-161±27#-163±27#I/R+LY294002-297±26-117±26△-112±29△I/R+LY294002+NaHS-316±24-124±28△-128±28△
**P<0.05vscontrol group;#P<0.05vsI/R group;△P<0.05vsI/R+NaHS group

2结果
2.1硫氢化钠后处理对大鼠各项心功能指标的影响实验结果显示,在平衡末各组心功能指标间差异无统计学意义(P>0.05)。除Control组外,复灌30 min 和60 min后,其它4组与平衡末基础值相比,LVEDP明显升高(P<0.05),LVDP和±dp/dtmax明显降低(P<0.05);与I/R组比较,H2S组 LVEDP 明显降低(P<0.05),LVDP和±dp/dtmax明显升高(P<0.05);与H2S组相比,H2S+LY组LVEDP明显升高(P<0.05),LVDP和±dp/dtmax明显降低(P<0.05),见Tab 1。
2.2硫氢化钠后处理对大鼠缺血心肌梗死面积的影响复灌末I/R组的心肌梗死面积为(48.9±5.6) %,与Control组梗死面积百分比(16.3±4.1)%相比明显增加(P<0.05);与I/R组比较,H2S组梗死面积百分比减小,为(26.9±4.9)%(P<0.05);与H2S组相比,H2S+LY组梗死面积百分比增加为(49.0±5.7)% (P<0.05),见Fig 1。

Fig 1 Percentage of infract size of myocardium
One representative image of the myocardial infarct size of each group is shown. a: Control; b:I/R; c:I/R +NaHS; d:I/R+LY294002; e: I/R+LY294002+NaHS.*P<0.05vscontrol group;#P<0.05vsI/R group;△P<0.05vsI/R+NaHS group
2.3硫氢化钠后处理对大鼠缺血心肌Sirt1和PGC-1α mRNA水平的影响实时荧光定量PCR法检测结果见Fig 2A和Fig 2B。I/R组Sirt1、PGC-1α mRNA的表达水平升高,但与Control组相比差异无统计学意义(P>0.05);与I/R组比较,H2S组Sirt1、PGC-1α mRNA的表达水平进一步升高(P<0.05);与H2S组相比,H2S+LY组Sirt1、PGC-1α mRNA表达水平明显降低(P<0.05)。

Fig 2 Effects of NaHS on Sirt1 and ±s,n=3)
A and B: The levels of Sirt1 and PGC-1α mRNA were tested using real-time PCR; C and D: The protein levels of Sirt1 and PGC-1α were tested using Western blot.*P<0.05vscontrol group;#P<0.05vsI/R group;△P<0.05vsI/R+NaHS group
2.4硫氢化钠后处理对大鼠缺血心肌Sirt1和PGC-1α蛋白表达水平的影响Western blot法分析结果见Fig 2C和Fig 2D。I/R组与Control组相比,Sirt1蛋白表达水平明显降低(P<0.05);与I/R组比较,H2S组Sirt1 蛋白表达水平升高(P<0.05);与H2S组相比,H2S+LY组Sirt1蛋白表达水平明显降低(P<0.05)。PGC-1α在正常心肌组织中表达量比较低,在I/R组中,PGC-1α蛋白表达水平升高,但差异无统计学意义(P>0.05);与I/R组比较,H2S组PGC-1α蛋白表达水平升高(P<0.05);与H2S组相比,H2S+LY组PGC-1α蛋白表达水平明显降低(P<0.05)。
2.5硫氢化钠后处理对大鼠缺血心肌Sirt1的细胞分布影响免疫组化法检测心肌组织中Sirt1的细胞分布,见Fig3A、3B。结果显示,在Control组中Sirt1主要位于细胞核中,阳性表达指数为(51±4)%,与Control组比较,I/R组Sirt1阳性细胞核个数明显减少,为(22±3)%(P<0.05);与I/R组比较,H2S组Sirt1细胞核阳性表达指数增加,为(43±4)%(P<0.05);与H2S组比较,H2S+LY组Sirt1细胞核阳性表达指数减少,为(25±4)%(P<0.05)。
3讨论
Sirt1是尼克酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)依赖的高度保守第三类组蛋白/非组蛋白去乙酰酶抑制剂家族的成员之一,作为敏感的能量感应器调节着许多重要的代谢和生理过程。本课题组的近期研究表明,PGC-1α参与了H2S后处理对心肌I/R损伤的保护作用[5]。虽然PGC-1α作为Sirt1的直接下游靶分子,可以被Sirt1去乙酰化而激活,发挥其调节线粒体生物合成和能量代谢的重要作用[6],但是Sirt1是否也参与了H2S的抗心肌缺血作用还尚未知。本实验发现,Sirt1 在I/R组减少,而在硫化氢后处理组增加,同时心肌梗死面积减少及心脏整体功能提高,认为Sirt1在硫化氢后处理保护缺血大鼠心肌中起重要作用。这与Wu等[7]近期研究结果:硫化氢可通过Sirt1途径减轻氧化应激诱导的心肌凋亡相一致。

Fig 3 Effects of NaHS on location of ±s,n=3)
A:Sirt1 location was examined by IHC(40×).One representative image of each group is shown. a: Control; b:I/R; c:I/R+NaHS; d:I/R+LY294002; e:I/R+LY294002+NaHS. B:The percentage of Sirt1-positive nuclei for each group was quantified.*P<0.05vscontrol group;#P<0.05vsI/R group;△P<0.05vsI/R+NaHS group
PI3K/Akt是细胞内重要的信号转导通路,在细胞的生存、凋亡以及增殖等活动中发挥重要的生物学功能。季永等[8]研究结果表明,外源性硫化氢后处理通过PI3K/Akt 信号通路调节线粒体Cx43蛋白,保护大鼠缺血心肌。有文献报道[5],当细胞受到外界刺激时,激活PI3K/Akt,磷酸化Sirt1,使其进入细胞核发挥作用。为了研究Sirt1在硫化氢后处理中的保护机制及H2S是否通过PI3K/Akt信号通路调节Sirt1的表达,本实验使用PI3K/Akt 信号通路抑制剂LY294002,观察各组心功能指标、心肌梗死面积、Sirt1和PGC-1α的表达水平以及Sirt1的细胞分布。
研究结果显示,离体大鼠心脏经过全心缺血30 min,复灌60 min后,心脏整体功能明显下降。与I/R组比较,H2S组明显改善了心脏功能,主要表现为LVDP和±dp/dtmax均升高,LVEDP降低,心肌梗死面积减少等。在Control组中,Sirt1 的表达量较高,I/R损伤明显降低了Sirt1 的表达量。但在H2S后处理后,与I/R组比较,Sirt1和PGC-1α蛋白表达水平及mRNA水平都明显提高了。而加入PI3K/Akt抑制剂LY294002 后,H2S后处理的缺血心肌改善作用被废除,Sirt1和PGC-1α蛋白表达水平及mRNA水平降低,提示PI3K/Akt/Sirt1 参与了H2S后处理对心肌I/R损伤的保护作用。
Sirt1几乎在所有的哺乳动物细胞中都有表达,但其亚细胞定位却不尽相同,有的仅在细胞质中表达,有的仅在细胞核中表达,还有一些在细胞质和细胞核中均有表达[9-10]。已有研究表明Sirt1是一种可以往返于细胞核和细胞质的蛋白[11],而且Sirt1细胞核转移量对其发挥细胞保护功能至关重要[12]。因此,我们采用了免疫组化的方法检测了Sirt1的亚细胞定位。实验结果显示,在Control组中,Sirt1主要位于细胞核中,I/R损伤降低了Sirt1 的阳性细胞核指数。而与I/R组相比,H2S组提高了Sirt1 的阳性细胞核指数,提示H2S后处理通过调节Sirt1的蛋白表达量以及增加Sirt1阳性细胞核指数,保护大鼠缺血心肌。但Sirt1发挥其保护作用的具体机制将有待于进一步的深入研究。
综上所述,本实验研究结果表明H2S 后处理通过PI3K/Akt 信号通路增加Sirt1、PGC-1α的 表达及Sirt1阳性细胞核指数,减轻离体大鼠I /R 损伤。
(致谢:本实验研究主要在江南大学无锡医学院庞庆丰教授、邱丽颖教授实验室以及医学院综合实验平台完成,感谢庞庆丰教授和邱丽颖教授给予课题实验的悉心指导!)
参考文献:
[1]Ji Y, Pang Q F, Xu G, et al. Exogenous hydrogen sulfide postconditioning protects isolated rat hearts against ischemia-reperfusion injury[J].EurJPharmacol, 2008,587(1-3):1-7.
[2]于水,杨海口,米琰,等.PI3K/Akt 信号通路在外源性硫化氢后处理大鼠离体心肌中的作用[J].中国药理学通报,2010,26(6):759-64.
[2]Yu S,Yang H K,Mi Y,et al. Function of PI3K/Akt signaling pathway in exogenous hydrogen sulfide postconditioning on isolated rat hearts[J].ChinPharmacolBull,2010,26(6):759-64.
[3]Cui Y, Wang H, Chen H, et al. Genetic analysis of the SIRT1 gene promoter in myocardial infarction[J].BiochemBiophysResCommun,2012,426(2):232-6.
[4]Tanno M,Sakamoto J,Miura T, et al. Nucleocytoplasmic shuttling of the NAD+-dependent histone deacetylase SIRT1[J].JBiolChem,2007,282(9):6823-32.
[5]杨洁琼,胡明珠,季永,等. AMPK/PGC-1α信号通路在硫化氢抗心肌缺血/再灌注损伤中的作用[J].中国药理学通报,2015,31(7):951-6.
[5]Yang J Q, Hu M Z, Ji Y, et al. Role of AMPK/PGC-1α pathway in cardioprotection of hydrogen sulfide against ischemia/reperfusion injury[J].ChinPharmacolBull,2015,31(7):951-6.
[6]Li Y G, Zhu W, Tao J P, et al. Resveratrol protects cardiomyocytes from oxidative stress through SIRT1 and mitochondrial biogenesis signaling pathways[J].BiochemBiophysResCommun,2013,438(2):270-6.
[7]Wu D, Hu Q, Liu X, et al. Hydrogen sulfide protects against apoptosis under oxidative stress through SIRT1 pathway in H9c2 cardiomyocytes[J].NitricOxide,2015,46:204-12.
[8]季永,张可璇,毛洪雅,等. 缝隙连接蛋白Cx43介导硫化氢后处理对大鼠心肌的保护作用[J].中国药理学通报,2013,29(7): 999-1003.
[8]Ji Y, Zhang K X, Mao H Y, et al. Protective effects of Cx43-mediated exogenous hydrogen sulfide postconditinoing on rat hearts[J].ChinPharmacoloBull, 2013, 29(7):999-1003.
[9]Hisahara S, Chiba S, Matsumoto H, et al. NAD-dependent histone deacetylase SIRT1 modulates neuronal differentiation by its nuclear translocation[J].PharmacolSci,2008,105(40):15599-604.
[10]Sundaresan N R, Pillai V B, Gupta M P. Emerging roles of SIRT1 deacetylase in regulating cardiomyocyte survival and hypertrophy[J].JMolCellCardiol,2011,51(4):614-8.
[11]Gu C, Xing Y, Jiang L, et al. Impaired cardiac SIRT1 activity by carbonyl stress contributes to aging-related ischemic intolerance[J].PLoSOne,2013,8(9):e74050.
[12]Tanno M, Kuno A, Yano T, et al. Induction of manganese superoxide dismutase by nuclear translocation and activation of SIRT1 promotes cell survival in chronic heart failure[J].JBiolChem,2010,285(11):8375-82.
PI3K/Akt/Sirt1 signaling pathway mediated hydrogen sulfide postconditioning-induced protection against I/R injury
HU Ming-zhu1,2,ZHOU Bo1,SHENG Qiong2,DU Bin2,CHEN Jun-liang2,PANG Qing-feng2,JI Yong1,2
[1.DeptofAnesthesiology,theAffiliatedHospitalofJiangnanUniversity(Wuxi4thPeople′sHospital),WuxiJiangsu214062,China;2.WuxiMedicalSchool,JiangnanUniversity,WuxiJiangsu214062,China]
Abstract:AimTo explore the role of PI3K/Akt/Sirt1 pathway in cardioprotection of hydrogen sulfide(H2S) postconditioning against ischemia/reperfusion(I/R) injury.MethodsLangendorff perfusion apparatus was used to build an isolated rat myocardial I/R model. Isolated rat hearts were subjected to 30 min global ischemia followed by 60 min reperfusion after 20 min of equilibrium. 60 male SD rats were randomly divided into 5 groups(n=12): control group(Control), ischemia/reperfusion group(I/R), H2S postconditioning group(H2S), inhibitor LY294002 group(LY) and H2S with inhibitor group(H2S+LY). The left ventricular diastolic pressure(LVEDP),the left ventricular developed pressure(LVDP), the maximum rate of increase or decrease of left ventricular pressure(±dp/dtmax) were registered at the end of 20 min equilibrium, 30 and 60 min of reperfusion separately. Triphenyl tetrazolium chloride(TTC) staining was used to determine the myocardial infarct size. The levels of Sirt1 and PGC-1 mRNA were tested using real-time PCR. The expressions of Sirt1and PGC-1α were detected with Western blot analysis. Immunohistochemical method was used to determine the location of Sirt1.ResultsThere were no differences in equilibrium hemodynamics observed between the experimental groups(P>0.05). At the end of reperfusion, compared with I/R group, H2S group had obviously ameliorated functional recovery and significantly decreased the myocardial infarct size(26.9±4.9)% vs(48.9±5.6)%(P<0.05). Meanwhile, the expression of Sirt1 and PGC-1α increased significantly. However,LY294002 reversed the cardioprotective effects provided by hydrogen sulfide postconditioning and reduced the level of Sirt1and PGC-1α, the percentage of Sirt1-positive nuclei.ConclusionPI3K/Akt/Sirt1 signaling pathway mediates the hydrogen sulfide postconditioning-induced protection against I/R injury.
Key words:ischemia/reperfusion; hydrogen sulfide; postconditioning; PI3K/Akt; Sirt1; PGC-1α; cardioprotection
文献标志码:A
文章编号:1001-1978(2016)02-0268-06
doi:10.3969/j.issn.1001-1978.2016.02.023
作者简介:胡明珠(1989-),女,硕士生,研究方向:重要脏器功能衰竭的机制及预防,E-mail :luhehude@163.com;季永(1969-),男,博士,主任医师,硕士生导师,研究方向:心、 肺、脑功能衰竭的机制及预防,通讯作者,E-mail:jiyong6914@163.com
基金项目:国家自然科学基金资助项目(No 81270126);无锡市医学管理中心医学科研面上项目(No YGZXM1407);江苏省大学生创新项目(No KYLX_1174)
收稿日期:2015-10-26,修回日期:2015-11-28
网络出版时间:http://www.cnki.net/kcms/detail/34.1086.R.20160125.1557.046.html
网络出版地址:2016-1-25 15:57
