Pyrin重组蛋白对肺纤维化大鼠VEGF/VEGFR2/MMP-9 信号通路的影响
2016-03-24安钟健延光海郑明昱李良昌朴红梅
安钟健,金 燕,延光海,齐 鹏,郑明昱,李良昌,朴红梅
(1.延边大学附属医院呼吸内科,吉林 延吉 133000; 2.延边大学中医学院,吉林 延吉 133002;3. 延边大学医学院解剖学教研室,吉林 延吉 133002)
Pyrin重组蛋白对肺纤维化大鼠VEGF/VEGFR2/MMP-9 信号通路的影响
安钟健1,金燕3,延光海2,齐鹏1,郑明昱2,李良昌3,朴红梅1
(1.延边大学附属医院呼吸内科,吉林 延吉133000; 2.延边大学中医学院,吉林 延吉133002;3. 延边大学医学院解剖学教研室,吉林 延吉133002)
中国图书分类号:R-332;R322.35;R329.25;R563.13;R977.3;R977.6
摘要:目的探讨Pyrin重组蛋白对博莱霉素诱导的大鼠肺纤维化的影响及其机制是否与VEGF/VEGFR2/MMP-9信号通路有关。方法60只SD大鼠随机分为对照组(n=10)、模型组(n=20)、Pyrin重组蛋白组(n=20)、SU5416阳性对照组(n=10),除对照组外,其余3组均经气道注入博莱霉素5 mg·kg-1建立大鼠肺间质纤维化模型; 造模d 2各组予以相应药物进行干预。于d 14及d 28分两批进行取材,用HE染色观察肺泡炎程度、用Masson染色观察肺纤维化程度,免疫组化及RT-PCR检测血管内皮生长因子(VEGF)、血管内皮生长因子受体2(VEGFR2)、基质金属蛋白酶-9(MMP-9)蛋白和mRNA表达。结果d 14及d 28模型组大鼠肺组织,肺泡炎和纤维化程度以及VEGF、VEGFR2、MMP-9蛋白及mRNA表达较对照组明显增强(P<0.05);d 14 Pyrin重组蛋白组肺泡炎和纤维化程度以及VEGF、VEGFR2、MMP-9蛋白及mRNA表达较d 14模型组减弱(P<0.05),d 28 Pyrin重组蛋白组肺泡炎和纤维化程度以及VEGF、VEGFR2、MMP-9蛋白及mRNA表达较d 28模型组减弱(P<0.05)。结论Pyrin重组蛋白可能通过下调VEGF/VEGFR2/MMP-9信号通路而发挥抗肺纤维化作用。
关键词:Pyrin重组蛋白; 肺纤维化; 血管内皮生长因子; 血管内皮生长因子受体2; 基质金属蛋白酶-9; 大鼠
肺纤维化是各种不同病因导致的肺间质疾病的共同结局,包括特发性肺纤维化、尘肺及药物引起的纤维化等,日久患者因肺结构改变、呼吸衰竭而死亡[1]。近几年,国内外对肺纤维化的发病机制有较多研究进展,已经从最初的“炎症学说”转移到“损伤修复学说”为中心,认为肺微血管生成在肺纤维化发病中具有重要作用。前期研究表明Pyrin重组蛋白明显减少哮喘模型小鼠气道重塑和气道炎症,而且通过NF-κB信号通路减少肺纤维化的进程[2-3]。肺微血管生成是肺纤维化的重要环节,迄今尚未见有Pyrin重组蛋白抗肺纤维化血管生成及相关信号通路的研究。本实验通过检测Pyrin重组蛋白对肺纤维化大鼠VEGF、VEGFR2、MMP-9基因表达影响,探讨Pyrin重组蛋白抗肺纤维化血管生成的作用及其作用机制。
1材料
1.1动物♂ SD大鼠60只,体质量(200±20) g,清洁级,购自延边大学实验动物中心,合格证号SCXK(吉)2011-0007。本研究得到延边大学医学院伦理委员会批准,在整个实验中遵守《实验动物管理条例》,做到减轻大鼠痛苦,增加其舒适度。
1.2药物与试剂Pyrin重组蛋白由日本岩手医科大学山内广平教授提供;博莱霉素购自哈尔滨博莱制药有限公司,用生理盐水配制成1 g·L-1溶液;VEGF、VEGFR2、MMP-9购自美国Santa Cruz公司;免疫组化试剂盒由长春百奥公司提供。
1.3仪器轮转式切片机(2135型,德国徕卡公司),真彩色病理显微图像分析系统(CH30RF200,中国),分光光度计(Thermo 公司),PCR议(Perkin-Elmer Applied Biosystems,美国),酶联免疫检测仪(RT-2100C,美国),5415D型低温高速多功能离心机(Eppendorf公司),凝胶成像系统(Flour Chem公司),Western blot转膜仪(BioRad公司)。
2方法
2.1模型制备与分组给药将SD大鼠随机分成6组:对照组(n=10)、模型组(n=20)、Pyrin重组蛋白组(n=20)、SU5416阳性对照组(n=10)。将大鼠用10%水合氯醛3.5 mL·kg-1腹腔注射麻醉后,仰卧位固定于手术板上,颈正中切开,暴露气管,对照组一次性气管内注入生理盐水0.2 mL·kg-1,模型组、Pyrin重组蛋白高剂量组、SU5416阳性对照组向气管内一次性注入溶解了博莱霉素(5 mL·kg-1)的生理盐水0.2 ml,对照组注入等量生理盐水,然后将大鼠直立并旋转,以使药液在肺内分布均匀。动物清醒后随意进食、饮水。从造模后d 2起,每日上午气道内注入Pyrin重组蛋白以0.1 mg·kg-1配制成0.2 mL液体,按时间点连续治疗14 d、28 d,持续到处死动物的前1 天。SU5416以50 mg·kg-1配制成0.2 mL液体,进行腹腔注射。于造模后d 14、28,随机分两批用10%水合氯醛3.5 mL·kg-1麻醉,将大鼠仰卧固定,打开胸腔,止血钳夹闭右侧肺。从左心尖置入针头,用止血钳连心室一起夹住,针头连接50 mL注射器(针头磨平),右心耳剪一约2 mm左右切口。向左心室快速匀速灌注生理盐水100 mL,至肺内血液冲洗干净,肺组织洁白。将灌注液体换为4%多聚甲醛,继续灌注100 mL,直至大鼠全身变硬,停止灌注。剪下灌注后的左肺,放入4%多聚甲醛中固定24 h,切取合适大小组织放入包埋盒、流水过夜、常规脱水、石蜡包埋,连续组织切片(厚4 μm),进行HE染色和Masson染色; 右肺迅速剪下,锡纸包裹,放入-80℃保存,行RT-PCR检测。
2.2肺泡炎症、肺纤维化程度判断左肺石蜡切片行常规HE染色和Masson染色,光镜下观察肺组织病理学改变。参照Szapiel等[4]的方法用HE染色评定肺组织肺泡炎症程度,0分: 无肺组织炎;1分:轻度肺组织炎,炎性细胞浸润仅限于局部或近胸膜部,面积小于全肺的20%;2分:中度肺组织炎,受累面积占全肺的20%~50%;3分: 重度肺组织炎,受累面积大于50%。Masson染色评定肺组织纤维化程度,0分:无肺纤维化;1分:轻度肺纤维化,受累面积少于全肺20%;2分:中度肺纤维化,受累面积占20%~50%;3分:重度肺纤维化,受累面积大于50%,肺泡结构紊乱。
2.3免疫组化染色石蜡切片脱蜡, PBS液浸泡,一抗孵育过夜,PBS冲洗,标记二抗,缓冲液冲洗后DAB显色,自来水充分冲洗、复染、脱水、透明干燥、封片。胞质内出现棕黄色颗粒为阳性反应。半定量图像分析:每张切片随机取5个视野,400倍光镜下观察,利用Media Cybemetics公司图像分析管理系统对免疫组化实验结果进行图像分析,测定阳性细胞面积, 平均光密度,计算总光密度。
2.4大鼠肺组织VEGF、VEGFR2、MMP-9 mRNA表达① 按照TRIzol试剂说明书步骤严格操作,提取右肺组织总RNA,测量RNA样品纯度,OD值1.9~2.2认为有效,测定浓度。② 采用反转录试剂盒合成cDNA。取2 μL总RNA作为模板,寡核苷酸(oligo-dT)做引物,反应体系为20μL,所得混合物25℃退火5 min,42℃延伸1 h,70℃灭活15 min,合成cDNA。③RT-PCR: PCR循环条件为95℃ 2 min,1个循环→95℃ 15 s,60℃ 60 s,40个循环→95℃ 15 s,60℃ 15 s,95℃ 15 s,1个循环。为了消除样本提取、逆转录和PCR反应过程中造成的差异,同时进行管家基因β-actin mRNA表达的测定。β-actin前引物5′-TCCCTGGAGAAGAGCTATGAG-3′,后引物5′-TCCATACCCAGGAAGGAAG-3′;VEGF前引物5′-GAGACCCTGGTGGACATCTT-3′,后引物5′-GATCCGCATGATCTGCATAG-3′;VEGR2前引物5′-AAGAGATTTGTTCCGGATGG-3′,后引物5′-CGGCAGATAGCTCAATTTCA-3′;MMP-9前引物5′-GGAGACCTGAGAACC-3′,后引物5′-TCCAATAGGTGATGTYGTCGG-3′。PCR结束后,分析结果并统计,用2-△△CT法来决定目的基因在各组的相对表达量。
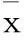
3结果
3.1各组大鼠肺组织病理变化光镜下可见对照组肺泡清晰完整,肺泡隔无增厚,气管肌层可见胶原沉积,偶有大鼠肺泡间质有少量炎细胞浸润。各造模组可见肺泡塌陷融合,肺泡隔增厚,肺实变呈斑片状分布,气管周围明显。肺局部可见出血,大小不等的囊性气腔,气管周围及肺间质有大量淋巴细胞、嗜酸性粒细胞、中性粒细胞、巨噬细胞浸润,肺泡中有巨噬细胞浸润。局部可见成纤维灶,气管及肺泡周围可见胶原纤维沉积。d 28炎症细胞浸润较d 14减轻,但是胶原沉积则加重。HE染色分级:模型组及给药各组在d 14和d 28肺泡炎程度较对照组严重(P<0.05)。d 14及d 28时Pyrin重组蛋白治疗组肺泡炎程度较模型组有改善(P<0.05)。d 14时,Pyrin重组蛋白治疗组及SU5416阳性对照组较模型组肺泡炎有改善(P<0.05)。每组肺泡炎程度,d 14与d 28比较,未见差异。见Fig 1。Masson 染色分级: 模型组及给药各组纤维化程度在d 14和d 28均较对照组明显(P<0.05)。纤维化呈进展趋势,其中Pyrin重组蛋白组d 14及d 28纤维化程度均较模型组改善(P<0.05)。d 14和d 28各组肺纤维化程度对比差异虽无显著性(P>0.05),但可见纤维化有加重趋势。见Fig 1。统计学分析表明,与模型组同期比较,Pyrin重组蛋白d 14、28肺泡炎症明显减轻(P<0.05),d 14、28纤维化程度亦明显降低(P<0.05) 。见Tab 1。
Tab 1 Effect of PRP on pulmonary
**P<0.05vsmodel group
3.2肺组织VEGF、VEGFR2、MMP-9免疫组化染色 d 14模型组大鼠肺组织VEGF、VEGFR2、MMP-9表达较d 14对照组增强(P<0.05); d 14 Pyrin重组蛋白治疗组和SU5416阳性对照组大鼠肺组织VEGF、VEGFR2、MMP-9表达较d 14模型组减弱(P<0.05)。d 28模型组VEGF、VEGFR2、MMP-9仍维持较高表达水平,与d 28对照组比较明显增强(P<0.05); d 28 Pyrin重组蛋白治疗组和SU5416阳性对照组VEGF、VEGFR2、MMP-9表达水平较d 28模型组减弱(P<0.05)。见Fig 2。
3.3VEGF、VEGFR2、MMP-9 mRNA表达对照组VEGF、VEGFR2、MMP-9 mRNA表达水平稳定,其余各组均可见d 28 VEGF、VEGFR2、MMP-9表达水平较d 14组有升高趋势,但差异无显著性(P>0.05)。模型组、Pyrin重组蛋白治疗组及SU5416阳性对照组VEGF、VEGFR2、MMP-9表达水平较对照组明显增高(P<0.05)。Pyrin重组蛋白治疗组VEGF、VEGFR2、MMP-9表达水平d 14及d 28均较模型组明显降低(P<0.05)。见Fig 3。

Fig 1 Effect of PRP on inflammation of lung tissues (HE×100)
HE staining:(A: Control group; B: Model group 14 d; C: Model group 28 d; D: Pyrin recombinant protein group 14 d; E: Pyrin recombinant protein group 28 d; F: SU5416 group 28 d); Masson stain (G: Control group; H: Model group 14 d; I: Model group 28 d; J: Pyrin recombinant protein group 14 d; K: Pyrin recombinant protein group 28 d; L: SU5416 group 28 d).

Fig 2 VEGF,VEGFR2,MMP-9 subunit examined by immunohistochemistry staining (×100)
VEGF staining (A: Control group; B: Model group 14 d; C: Model group 28 d; D: Pyrin recombinant protein group 14 d; E: Pyrin recombinant protein group 28 d; F: SU5416 group 28 d); VEGFR2 staining (G: Control group; H: Model group 14 d; I: Model group 28 d; J: Pyrin recombinant protein group 14 d; K: Pyrin recombinant protein group 28 d; L: SU5416 group 28 d); MMP-9 staining (M: Control group; N: Model group 14 d; O: Model group 28 d; P: Pyrin recombinant protein group 14 d; Q: Pyrin recombinant protein group 28 d; R: SU5416 group 28 d).
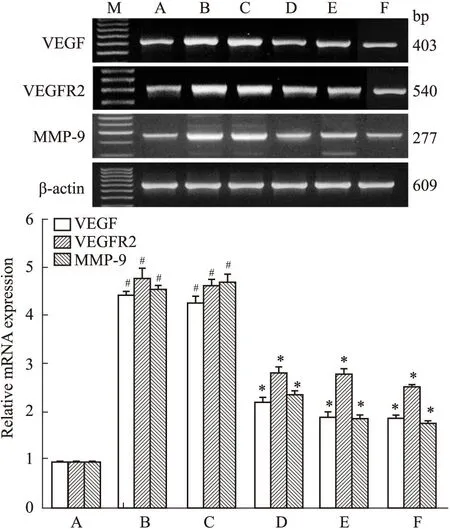
Fig 3 Effect of Pyrin recombinant protein on
A: Control group; B: Model group 14 d; C: Model group 28 d; D: Pyrin recombinant protein group 14 d; E: Pyrin recombinant protein group 28 d; F: SU5416 group 28 d.#P<0.05vscontrol;*P<0.05vsthe same time period of model
4讨论
目前的研究认为,异常的血管生成是肺纤维化进展中的重要病理环节,血管过度生成与炎性反应和纤维化修复并行。肺纤维化动物模型早期观察到的肺炎性反应时肺血管内皮损伤,血管内皮细胞增生,由抗黏附、抗凝、舒张表型转换为促黏附、促凝、收缩表型,继之发生微血管内皮细胞的迁移、增殖, 异常的血管生成是纤维化性修复、纤维沉积的启动和推动因素[5]。VEGF信号途径在新生血管形成中起核心作用, 新生血管形成后为代谢活跃的炎症细胞提高氧气和营养供给,同时也为纤维化炎性病灶带走大量坏死物和代谢废物,在纤维化过程中发挥重要作用。VEGF是一种营养因子,促进内皮增殖、迁移和存活等,内皮细胞在纤维化中具有重要作用。VEGF主要通过与受体结合发挥其生理功能,VEGF的受体主要包括VEGFR1、VEGFR2等; 生理状态下VEGF的少量表达能维持血管正常状态和完整性,病理状态下,两者结合能够抑制血管内皮细胞的凋亡且促进其增生、迁移及分化,促进血管通透性增加、刺激体内新生血管生成。VEGFR为介导血管生成的主要信号传递分子,VEGF与VEGFR结合是血管内皮细胞介导血管生成的主要通路[6]。Qu等[7]研究发现,博莱霉素诱导的大鼠肺间质纤维化中VEGF/VEGFR2表达明显增高,肺泡炎期毛细血管数目明显增加,VEGF受体阻断剂SU5416通过VEGF/VEGFR2信号通路明显减少小鼠的肺间质血管密度以及肺纤维化的进程。本实验结果显示,模型组大鼠VEGF及受体VEGFR2的基因表达从d 14到d 28有递增趋势。提示气管内给予博莱霉素后存在持续的炎症反应、血管新生,该过程持续28 d。Pyrin重组蛋白可以下调VEGF及VEGFR2基因表达水平,显示Pyrin重组蛋白通过减少肺泡炎时的异常血管新生而具有抗肺间质纤维化作用。MMP-9是参与细胞外基质(ECM)降解的重要蛋白酶类,它对肺基膜及其结构支架的完整性、ECM合成与降解平衡的维持起至关重要的作用, 与肺纤维化发生、发展的关系密切。研究发现,在发生肺结构广泛改建的特发性肺纤维化中,MMP-9在上皮细胞、肺巨噬细胞、中性粒细胞中表达增强[8]。本实验结果显示,模型组大鼠MMP-9基因表达水平从d 14到d 28有平稳趋势。提示气管内注入博莱霉素后存在持续的炎症反应,该过程持续28 d。Pyrin重组蛋白可以下调MMP-9基因表达水平,提示Pyrin重组蛋白通过减少ECM而具有抗肺间质纤维化作用。研究报道VEGF/VEGFR2通过STAT1上调MMP-9信号通路,激活慢性淋巴细胞白血病细胞的迁移[10];酒精摄入通过VEGFR2/MMP-9信号通路可引起脑功能不全和脑部炎症。表明VEGF/VEGFR2可通过激活MMP-9信号通路在肺纤维化中起到重要的作用。本实验结果也显示,VEGF受体阻断剂SU5416可抑制MMP-9蛋白的表达,进一步说明在肺纤维化进程中VEGF/VEGFR2可调控MMP-9信号通路。
综上所述,本研究结果表明Pyrin重组蛋白通过VEGF/VEGFR2/MMP-9信号通路,产生抗肺纤维化作用,这些作用机制的揭示为指导临床用药提供了可靠的药理学依据,但其作用与机制仍有待进一步深入探讨。
参考文献:
[1]Ding W, Zhang X Y, Pan M, et al. Interleukin-17A promotes the formation of inflammation in the lung tissues of rats with pulmonary fibrosis[J].ExpTherMed, 2015,10(2): 491-7.
[2]延光海,朴红梅,安昌善,等. Pyrin重组蛋白对支气管哮喘小鼠气道炎症的影响[J].中华微生物学和免疫学杂志,2012,32(2):102-7.
[2]Yan G H, Piao H M, An C S, et al. The inhibitory effects and mechanism of Pyrin recombination protein on airway inflamation in mouse with bronchial asthma[J].JMicrobiolImmunol, 2012,32(2):102-7.
[3]齐鹏,延光海,祝家彬,等. Pyrin重组蛋白对博来霉素诱导的小鼠肺纤维化的干预作用[J].中国药理学通报,2012,30(11):1627-8.
[3]Qi P, Yan G H, Zhu J B, et al. The intervention effect of Pyrin recombinant protein on bleomycin-induced pulmonary fibrosis in mice[J].ChinPharmacolBull, 2014,30(11):1627-8.
[4]Szapiel S V, Elson N A, Fulmur J D, et al. Bleomycin induced interstitial pulmonary disease in the nude, athymic mouse[J].AmRevRespirDis,1979,120(4):1627-8.
[5]Iyer A K, Ramesh V, Castro C A, et al. Nitric oxide mediates bleomycin-induced angiogenesis and pulmonary fibrosis via regulation of VEGF[J].JCellBiochem, 2015,116(11):2484-93.
[6]Bien M Y, Wu M P, Chen W L, et al. VEGF correlates with inflammation and fibrosis in tuberculous pleural effusion[J].SciWorldJ, 2015,2015:417124.
[7]Ou X M, Li W C, Liu D S, et al.VEGFR-2 antagonist SU5416 attenuates bleomycin- induced pulmonary fibrosis in mice [J].IntImmunopharmacol, 2009,9(1):70-9.
[8]Jin X, Dai H, Ding K, et al. Rapamycin attenuates bleomycin-induced pulmonary fibrosis in rats and the expression of metalloproteinase-9 and tissue inhibitors of metalloproteinase-1 in lung tissue[J].ChinMedJ, 2014,127(7):1304-9.
[9]Kobayashi T, Kim H, Liu X, et al. Matrix metalloproteinase-9 activates TGF-β and stimulates fibroblast contraction of collagen gels[J].AmJPhysiolLungCellMolPhysiol,2014,306(11):L1006-15.
[10]Ugarte-Berzal E, Redondo-Muoz J, Eroles P, et al.VEGF/VEGFR2 interaction down-regulates matrix metalloproteinase-9 via STAT1 activation and inhibits B chronic lymphocytic leukemia cell migration[J].Blood, 2010,115(4):846-9.
[11]Fiorelli A, Morgillo F, Fasano M, et al. The value of matrix metalloproteinase-9 and vascular endothelial growth factor receptor 1 pathway in diagnosing indeterminate pleural effusion[J].InteractCardiovascThoracSurg,2013,16(3):263-9.
[12]Abdul Muneer P M, Alikunju S, Szlachetka A M, et al. The mechanisms of cerebral vascular dysfunction and neuroinflammation by MMP-mediated degradation of VEGFR-2 in alcohol ingestion[J].ArteriosclerThrombVascBiol, 2012,32(5):1167-77.
Effects of pyrin recombinant protein on VEGF/VEGFR2/MMP-9 signaling pathway in pulmonary fibrosis of rats
AN Zhong-jian1, JIN Yan3, YAN Guang-hai2, QI Peng1, ZHENG Ming-yu2, LI Liang-chang3, PIAO Hong-mei1
(1.DeptofRespiratoryMedicine,AffiliatedHospitalofYanbianUniversity,YanjiJilin133000,China;2.YanbianUniversityCollegeofTraditionalChineseMedicine,YanjiJilin133002,China;3.DeptofAnatomy,YanbianUniversityCollegeofMedicine,YanjiJilin133002,China)
Abstract:AimTo study the effects of pyrin recombinant protein(PRP) on VEGF/VEGFR2/ MMP-9 signaling pathway in bleomycin-induced pulmonary fibrosis of rats. MethodsSixty male Wistar rats were randomly divided into groups of control (n=10), model (n=20), PRP (n=20), and SU5416 (n=10). All the rats, except for those in control group, were established as the model of interstitial pulmonary fibrosis by perfusion of bleomycin (5 mg·kg-1) through tracheal intubation. From the second day after modeling, all rats were intragastrically administered with drugs or saline, according to different groups designed. The rats were sacrificed on the 14th and 28th day, and lung samples were taken out. The pathological changes of interstitial pulmonary fibrosis were observed by HE staining and Masson staining to evaluate the degree of alveolitis and pulmonary fibrosis. Expressions of VEGF, VEGFR2, MMP-9 protein and mRNA were detected by immunohistochemistry and RT-PCR. ResultsOn the 14th and 28th day, the alveolitis, pulmonary fibrosis, expression of VEGF, VEGFR2, MMP-9 and mRNA increased significantly in the model group compared with in the control group(P<0.05), and decreased significantly in PRP group than those in the model group(P<0.05). ConclusionPRP plays a role of anti-pulmonary fibrosis via the down-regulation of VEGF/VEGFR2/MMP-9 signaling pathway.
Key words:pyrin recombinant protein; pulmonary fibrosis; VEGF; VEGFR2; MMP-9; rats
文献标志码:A
文章编号:1001-1978(2016)02-0234-05
doi:10.3969/j.issn.1001-1978.2016.02.017
作者简介:安钟健(1980-),男,硕士生,研究方向:过敏性疾病,E-mail:852078595@qq.com;朴红梅(1969-),女,博士,教授,硕士生导师,研究方向:支气管哮喘与肺间质疾病,通讯作者,E-mail: piaohm2000@aliyun.com
基金项目:国家自然科学基金资助项目(No 81260016,30960140,81260665);吉林省科技厅自然科学基金资助项目(No 201215235);吉林省科技厅中青年科技创新领军人才及创新团队项目(No 20140519013JH)
收稿日期:2015-10-22,修回日期:2015-11-16
网络出版时间:http://www.cnki.net/kcms/detail/34.1086.R.20160125.1557.034.html网络出版地址:2016-1-25 15:57
