1-磷酸鞘氨醇后适应对人脐静脉内皮细胞缺氧/复氧损伤的保护作用
2016-03-24李蒙蒙王雨晴张丽志娄建石
李蒙蒙,王雨晴,张丽志,娄建石,温 克
(1.天津医科大学基础医学院药理学教研室,天津 300070;2.天津市第一中心医院妇产科,天津 300192)
1-磷酸鞘氨醇后适应对人脐静脉内皮细胞缺氧/复氧损伤的保护作用
李蒙蒙1,王雨晴1,张丽志2,娄建石1,温克1
(1.天津医科大学基础医学院药理学教研室,天津300070;2.天津市第一中心医院妇产科,天津300192)
中国图书分类号:R322.123;R329.24;R329.25;R845.22
摘要:目的研究1-磷酸鞘氨醇(S1P)后适应对人脐静脉内皮细胞(HUVEC)缺氧/复氧损伤的保护作用,并探讨其作用机制。方法建立HUVEC缺氧/复氧损伤模型,将HUVEC细胞分为5组,正常对照组、S1P低剂量组、S1P中剂量组、S1P高剂量组以及缺氧/复氧损伤(H/R)组。MTT法检测细胞存活率;流式细胞术分析测定细胞凋亡率;比色法测定细胞培养液中总超氧化物歧化酶(total superoxide dismutase,T-SOD)、铜锌超氧化物歧化酶(copper/zinc superoxide dismutase,CuZn-SOD)和锰超氧化物歧化酶(manganese superoxide dismutase,Mn-SOD)活力以及一氧化氮(nitric oxide,NO)、丙二醛(malondialdehyde,MDA)含量;荧光显微镜下观察线粒体膜电位;Western blot测定HUVECs细胞Bcl-2/Bax、eNOS蛋白的表达水平。结果与H/R组相比,S1P低、中、高剂量组可明显增加HUVECs细胞缺氧/复氧损伤后细胞存活率;均明显升高T-SOD活力、CuZn-SOD活力、Mn-SOD活力,降低MDA含量,明显升高NO含量及增加eNOS蛋白表达,降低凋亡率,抑制线粒体膜电位下降。结论S1P能够使H/R损伤的HUVECs细胞凋亡率降低,且呈一定的浓度依赖性。S1P对H/R损伤的HUVECs细胞凋亡的保护作用可能与降低细胞内MDA含量,提高细胞内SOD活力,提升线粒体膜电位,增强抗凋亡蛋白Bcl-2/Bax的表达有关。
关键词:S1P;缺氧/复氧;HUVECs细胞;Bcl-2/Bax;eNOS;凋亡
心肌缺血/再灌注损伤(myocardial ischemia reperfusion injury,I/R)过程中除心肌细胞坏死、凋亡外,血管内皮细胞的损伤也发挥着重要作用。表现为内皮细胞屏障功能障碍、微血管通透性增加、粒细胞浸润、炎性介质释放;同时内皮细胞eNOS表达下降、一氧化氮(nitric oxide,NO)生成减少,导致微血管收缩,参与无复流现象的发生,心肌损伤加重[1]。
本实验室前期研究发现,1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)具有心血管保护作用,可抑制氧化应激状态下或炎症状态下(血小板活化因子)引起的在体大鼠微血管内皮细胞通透性增加,具有内皮细胞保护作用。S1P后适应抑制炎症反应、拮抗氧化应激、保护线粒体结构功能,减轻大鼠心肌缺血/再灌注损伤,亦可缓解心肌细胞缺氧/复氧(hypoxia/reoxygenation, H/R)损伤[2-3]。其他实验室研究亦发现,离体大鼠心肌缺血后适应保护作用与内源性S1P有关[4]。但S1P是否对内皮细胞H/R损伤具有保护作用尚未见报道。本实验通过建立人脐静脉内皮细胞HUVEC缺氧/复氧损伤模型,以观察S1P对HUVEC H/R损伤是否具有保护作用,为临床用药提供依据。
1材料
HUVECs 人脐静脉内皮细胞株(上海艾研生物有限公司);S1P(美国Sigma,批号:032M4103V);超敏ECL化学发光试剂盒(批号:20130709)、BCA法蛋白定量试剂盒(批号:20140303)均购自江苏碧云天生物技术研究所;辣根过氧化物酶标记山羊抗兔抗体(批号:970380)、辣根过氧化物酶标记山羊抗小鼠抗体(批号:107724)均购自北京中衫金桥生物技术有限公司;兔抗人Bcl-2多克隆抗体(批号:L1311)、兔抗人Bax多克隆抗体(批号:B2812)、β-actin抗体(批号:E3012)、兔抗人NOS3多克隆抗体(批号:E1413)均购自Santa Cruz公司;Tubulin抗体(江苏碧云天生物技术研究所,批号:AT819-1);Annexin V-PI 双染色流式法细胞凋亡检测试剂盒(美国BD公司,批号:3337788);FACS Calibur型流式细胞仪(美国BD 公司);FV1000荧光显微镜(NIKON公司);ELx800吸收光酶标仪(BioTek公司)。
2方法
2.1细胞培养及实验分组HUVECs细胞常规用含10%胎牛血清的DMEM培养基培养于37℃、5% CO2培养箱内。取对数期生长的HUVECs细胞,调整细胞密度为1×108·L-1,均匀接种于板中,24 h后细胞融合至80% 左右。将培养的HUVECs细胞随机分为5组,即正常对照(Control)组、缺氧/复氧(H/R)组、S1P高、中、低剂量组。Control组换无血清的培养基。H/R组首先用模拟缺氧液(NaCl 139 mmol·L-1、KCl 4.7 mmol·L-1、CaCl21.0 mmol·L-1、MgCl20.5 mmol·L-1、HEPES 5 mmol·L-1、乳酸钠 20 mmol·L-1,pH 6.2)置换正常培养基,放入细胞厌氧培养装置密封,通入95% N2、5% CO2的混合气15 min,密封装置,置于37℃培养箱,缺氧处理16 h后,取出培养板,换用无血清培养基在95% O2+5% CO2的正常培养条件下培养4 h,建立H/R损伤模型。S1P低、中、高剂量组于复氧前加入含S1P(终浓度为2、4、6 μmol·L-1)的无血清培养基,余同H/R组。
2.2测定指标
2.2.1细胞存活率细胞缺氧/复氧损伤后,利用MTT法测定490 nm波长下每孔光吸收度值(OD 值),实验重复3次。并按下述公式计算细胞增殖率/%=(各实验组OD值-空白对照组OD值)/ (正常对照组OD值-空白对照组OD值)×100%。
2.2.2SOD 活性、MDA 含量的检测收集各组HUVECs细胞,按试剂盒说明书操作收集细胞裂解液3 000×g×10 min离心,取上清液,比色法测定MDA含量及SOD活性。
2.2.3细胞培养液中NO含量测定按实验分组,每组分别取细胞培养液0.1 mL,根据测定试剂盒说明书测NO含量,并按照下述公式计算:NO含量/μmol·L-1=[(测定管OD-空白管OD)/(标准管OD-空白管OD)]×标准品浓度×稀释倍数。
2.2.4流式细胞仪检测细胞凋亡率各组缺氧/复氧细胞经胰酶消化后,采用Annexin V-PI 双染法对凋亡细胞进行染色,AnnexinV-FITC标记为绿色荧光,PI标记为红色荧光。流式细胞仪测定荧光强度,计算各组凋亡率。
2.2.5荧光显微镜法检测线粒体膜电位实验结束后,弃培养液,加入JC-1染色工作液,充分混匀。细胞培养箱中37℃孵育20 min。在孵育期间,按照每1 mL JC-1染色缓冲液(5×)加入4 mL蒸馏水的比例,配制适量的JC-1染色缓冲液(1×),并放置于冰浴。37℃孵育结束后,吸除上清,用JC-1染色缓冲液(1×)洗涤2次。加入2 mL细胞培养液。荧光显微镜下观察,并计算红色荧光(激发波长:525 nm,发射波长:590 nm)及绿色荧光(激发波长490 nm,发射波长530 nm)荧光强度。在低膜电位时,JC-1以单体形式存在,产生绿色荧光;高膜电位时,JC-1形成聚合物,发射红色荧光。计算红、绿色荧光强度比值可反映线粒体膜电位变化。
2.2.6Western blot检测实验结束后,用PBS洗涤细胞,并用适量胰酶消化、收集细胞。应用预冷裂解液冰上裂解细胞30 min,收集蛋白质样品,经BCA蛋白定量、电泳、转膜后用脱脂奶粉封闭2 h以上,加入一抗(tublin稀释度为1 ∶2 000,Bax、Bcl-2、eNOS、β-actin稀释度为1 ∶1 000),4℃摇床过夜,二抗(稀释度为1 ∶2 000)室温孵育1~2 h,再经显影、定影后观察结果并扫描,采用Quantitive软件分析条带的光密度值,计算Bcl-2/Bax、eNOS/tublin的比值。
3结果
3.1细胞存活率MTT数据显示,经缺氧/复氧处理后,与正常对照组比较,H/R组细胞存活率明显降低(P<0.01),而S1P各个浓度组存活率比H/R组有明显升高,其中中、高浓度组与H/R组比较差异具有显著性(P<0.05,P<0.01),且随S1P浓度增大,HUVEC细胞存活率逐渐上升,见Tab1。
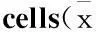
Tab 1 Protective effect of S1P on
***P<0.01vscontrol group;#P<0.05,##P<0.01vsH/R group
3.2细胞培养液中SOD活性与正常对照组比较,H/R组的T-SOD、CuZn-SOD、Mn-SOD活性明显降低(P<0.01);与H/R组相比,S1P各个浓度组均明显升高T-SOD活性(P<0.01)、CuZn-SOD活性(P<0.01)、Mn-SOD活性(P<0.01),见Tab2。
3.3细胞培养液中MDA含量与正常对照组比较,H/R组的MDA含量明显升高(P<0.0l);与H/R组相比,S1P各个浓度组均明显降低MDA含量(P<0.05),见Tab 2。
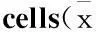
Tab 2 Effect of S1P on SOD activity, MDA content during H/R injury in HUVECs ±s,n=3)
**P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsH/R group
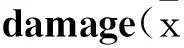
Tab 3 Effect of S1P on NO content, apoptosis and mitochondrial membrane potential of HUVECs cells after H/R ±s,n=3)
**P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsH/R group

Fig 1 Effect of different concentrations of S1P on apoptosis of HUVECs cells
A: Control group; B: H/R group; C: S1P (L) group; D: S1P (M) group; E: S1P (H) group
3.4细胞培养液中NO含量测定H/R组细胞经缺氧/复氧损伤后,NO含量明显降低(P<0.01)。与H/R组相比,S1P低、中、高各个浓度组均明显升高NO含量,且差异具有显著性(P<0.01),见Tab 3。
3.5流式检测细胞凋亡率与正常对照组比较,H/R组凋亡细胞数量明显增加(P<0.01)。S1P处理的不同浓度组可降低细胞凋亡率,其中高浓度组与H/R组比较差异具有显著性(P<0.01),见Tab 3及Fig 1。
3.6荧光显微镜法检测线粒体膜电位荧光显微镜下观察,正常对照组正常细胞被JC-1染色后显示红色荧光,H/R组多数细胞呈绿色荧光,提示线粒体膜电位下降。细胞经S1P各个浓度组处理后,随着药物浓度的增加,HUVECs细胞红色荧光颗粒逐渐增强,绿色荧光颗粒逐渐减少,提高红绿色荧光比值,其中,中、高浓度组与H/R比较差异具有显著性(P<0.05,P<0.01),见Tab 3及Fig 2。
3.7Western blot测定HUVECs细胞Bcl-2/Bax、eNOS的蛋白表达与正常对照组比较,H/R组Bcl-2蛋白表达较低,而Bax条带密度较深,Bcl-2/Bax比值较低。S1P各个浓度组可明显增加Bcl-2表达,降低Bax表达,提高Bcl-2/Bax,见Fig 3。与正常对照组比较,H/R组eNOS表达明显降低,S1P不同浓度组与H/R组比较,eNOS表达明显增多,见Fig 4。
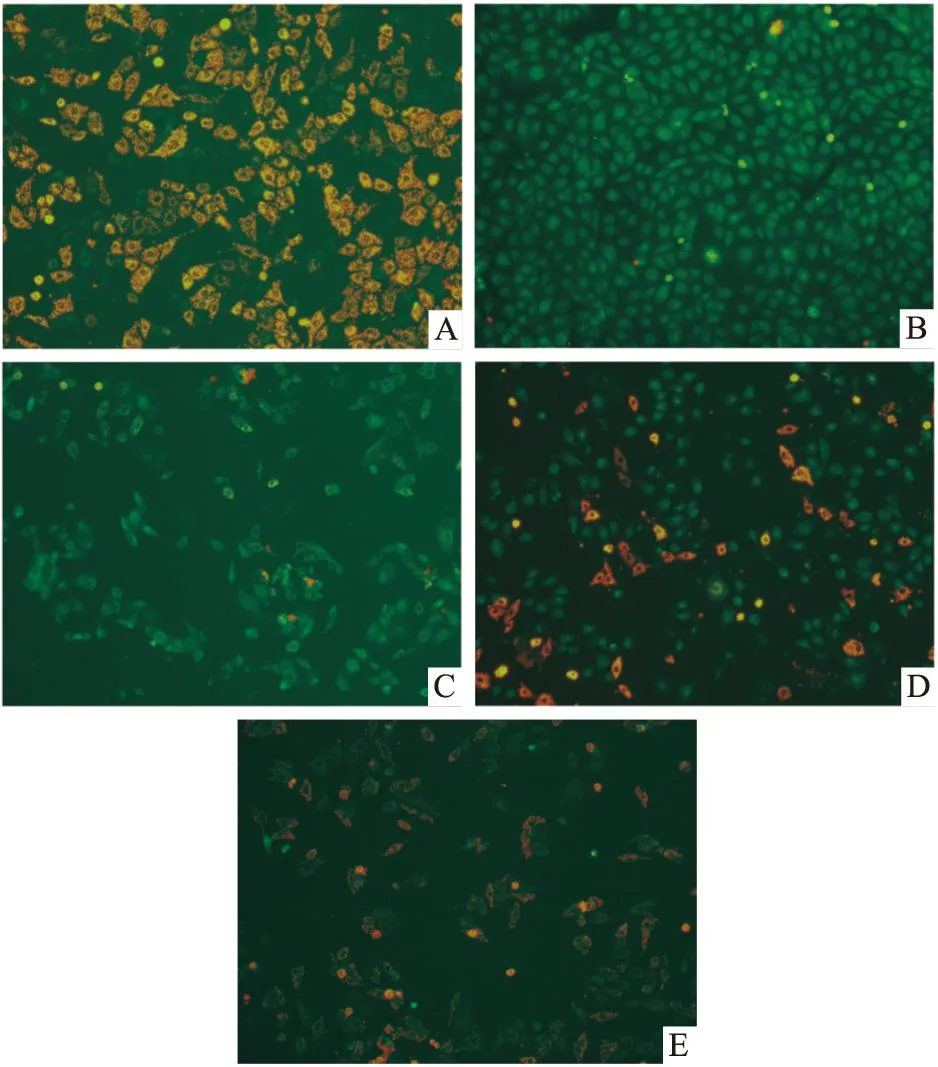
Fig 2 Fluorescence image of HUVEC loaded with JC-1
A: Control group; B: H/R group; C: S1P (L) group; D: S1P (M) group; E: S1P (H) group
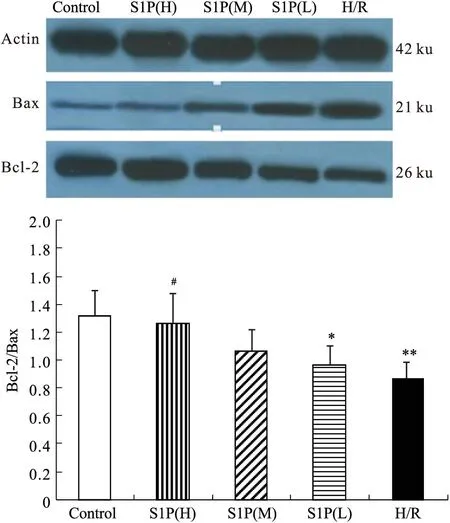
Fig 3 Effect of S1P on the expression of Bcl-2/Bax
**P<0.05,**P<0.01vscontrol group;#P<0.05vsH/R group
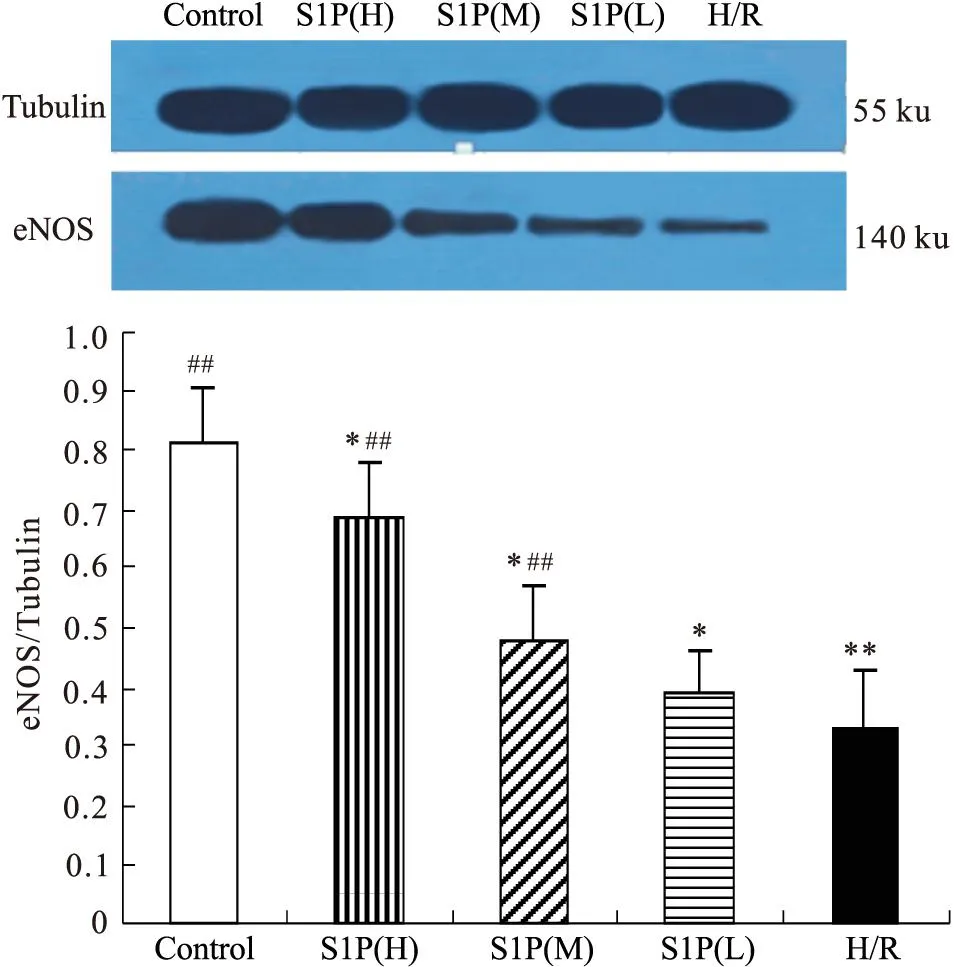
Fig 4 Effect of S1P on the expression of
**P<0.05,**P<0.01vscontrol group;##P<0.01vsH/R group
4讨论
心肌缺血/再灌注损伤过程中同时存在心肌细胞和内皮细胞损伤[1]。本实验前期研究已通过在体大鼠心肌缺血/再灌注损伤模型以及体外心肌缺氧/复氧损伤模型证实,S1P具有心肌细胞保护作用。本研究采用体外内皮细胞模型,观察了S1P对内皮细胞缺氧/复氧损伤的保护作用,研究证实,S1P可提高缺氧/复氧损伤细胞生存率,降低凋亡细胞数量。
eNOS在血管内皮细胞中高度表达,并催化NO的生成,发挥调节血管活性、抗凝血、抗血管增殖等作用。心肌缺血/再灌注时,内皮细胞功能障碍可导致eNOS水平下降、NO等扩血管物质减少,导致血管收缩、血小板黏附聚集,而进一步加重损伤[5]。Roviezzo等[6]研究发现,S1P处理牛胸主动脉后,能够引起Akt介导的eNOS表达上调以及NO的大量产生。本实验研究也证实,S1P处理后可上调内皮细胞eNOS表达水平,增加内皮细胞NO生成,减轻内皮细胞损伤。
内皮细胞缺氧/复氧损伤与多种因素密切相关,其中氧化应激是重要因素之一。细胞再给氧过程中,大量活性氧自由基(ractive oxygen species,ROS)产生超过了内源性抗氧化物质的清除能力,ROS可引起线粒体内细胞色素C释放,进而诱导凋亡发生[7-8]。SOD为机体内源性抗氧化物质,可分为主要位于线粒体的Mn-SOD及位于胞质的Cu/Zn-SOD[9]。本研究证实,S1P可提高细胞3种SOD活性,并可降低细胞膜脂质过氧化反应的主要产物MDA含量,提示S1P的抗内皮细胞缺氧/复氧损伤作用可能与其抗氧化应激作用有关。
缺氧/复氧损伤过程中,内皮细胞发生明显凋亡现象。细胞凋亡的机制主要包括死亡受体途径以及线粒体途径两种。其中,线粒体发挥着重要的作用,细胞缺氧/复氧损伤过程中,氧化应激、钙超负荷可导致线粒体通透性转换孔开放、线粒体膜电位下降、线粒体肿胀、线粒体外膜破裂[10]。而细胞的存活与Bcl-2家族中抗凋亡成分与促凋亡成分的比率密切相关[11]。Bax是促凋亡基因,Bcl-2是抑制凋亡基因。后者主要作用为分布于线粒体外膜,抑制细胞色素C释放,并维持线粒体外膜完整性[12],同时也有研究证实,Bcl-2可通过抗氧化作用抑制氧化应激诱导的凋亡[13]。Bax正常情况下主要位于胞质,在凋亡信号诱导后易位至线粒体,诱导特异性通透孔道形成,导致促凋亡因子(细胞色素C、凋亡诱导因子等)释放增加,诱导凋亡形成[14]。本研究采用JC-1荧光染色方法观察了细胞线粒体膜电位的变化。该荧光的强弱或颜色变化可以反映线粒体膜电位的增高或降低[15]。研究表明,S1P可抑制缺氧/复氧损伤引起的线粒体膜电位下降。同时关于Bcl-2及Bax表达的检测证实,S1P可增加Bcl-2的表达,降低Bax的表达,提高Bcl-2/Bax的比率。
综上所述,S1P可能通过增强抗凋亡蛋白Bcl-2表达、抑制线粒体膜电位下降、抗氧化应激作用减少内皮细胞缺氧/复氧损伤。
参考文献:
[1]Akpinar T S, Ozkok A, Kose M, et al. Endothelial constitutive nitric oxide synthase, angiotensin converting enzyme, angiotensin II type 1 receptor gene polymorphisms adendothelial functions in healthy individuals[J].EurRevMedPharmacolSci, 2014, 18(2): 39-45.
[2]贺苗, 赵杰, 苏健, 等. 1-磷酸鞘氨醇后适应对大鼠心肌缺血/再灌注损伤的保护作用[J]. 中国药理学通报, 2013, 29(10): 1369-73.
[2]He M, Zhao J, Su J, et al. Protective effect of sphingosine 1-phosphate postconditioning on myocardial ischemia/reperfusion injury in rats[J].ChinPharmacolBull, 2013, 29(10): 1369-73.
[3]郑新彬, 温克, 高卫真, 等. 1-磷酸鞘氨醇后适应对H9c2心肌细胞缺氧/复氧损伤的保护作用[J]. 中国现代应用药学, 2014, 31(1): 1-5.
[3]Zheng X B, Wen K, Gao W Z, et al. Protective effects of sphingosine-1-phosphate postconditioning on hypoxia/reoxygenation injury in rat H9c2 cardiomyocytes[J].ChinJModApplPharm, 2014, 31(1): 1-5.
[4]Vessey D A, Li L, Honbo N, et al. Sphingosine1-phosphateis an important endogenous cardioprotectant released by ischemic pre-and postconditioning[J].AmJPhysiolHeartCircPhysiol,2009, 297(4): H1429-35.
[5]Xuan Y T, Tang X L, Qiu Y, et al. Biphasic response of cardiac NO synthase isoforms to ischemic preconditioning in conscious rabbits[J].AmJPhysiolHeartCircPhysiol, 2000, 279(5):H2360-71.
[6]Roviezzo F, De Angelis A, De Gruttola L, et al. Involvement of proteinase activated receptor-2 in the vascular response to sphingosine 1-phosphate[J].ClinSci(Lond), 2014, 26(8): 545-56.
[7]Jayakumar T, Chang C C, Lin S L, et al. Brazilin ameliorates high glucose-induced vascular inflammation via inhibiting ROS and cams production in human umbilical vein endothelial cells[J].BioMedResInt, 2014, 403703.
[8]Balasubramanian T, Senthilkumar G P, Karthikeyan M, et al. Protective effect of ethyl acetate fraction of stereospermum suaveolens against hepatic oxidative stress in STZ diabetic rats[J].TraditComplementMed, 2013, 3(3): 175-81.
[9]Brouwer M, Hoexum Brouwer T, Grater W, et al. Replacement of a cytosolic copper/zinc superoxide dismutase by a novel cytosolic manganese superoxide dismutase in crustaceans that use copper (haemocyanin) for oxygen transport[J].Biochem,2003, 374(1): 219-28.
[10]Kadenbach B,Ramzan R,Moosdorf R,et al.The role of mitochondrial membrane potential in ischemic heart failure[J].Mitochondrion,2011, 11(5): 700-6.
[11]Juin P, Geneste O, Gautier F, et al. Decoding and unlocking the BCL-2 dependency of cancer cells[J].NatRevCancer, 2013, 13(7): 455-65.
[12]Ulukaya E, Acilan C, Yilmaz Y.Apoptosis: why and how does it occur in biology[J].CellBiochemFunct,2011,29(6):468-80.
[13]Hockenbery D M, Oltvai Z N, Yin X M, et al. Bcl-2 functions in an antioxidant pathway to prevent apoptosis[J].Cell, 1993, 75(2): 241-51.
[14]Czabotar P E, Lessene G, Strasser A. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy[J].NatRevMolCellBiol, 2014, 15(1): 49-63.
[15]Liu X, Sun C, Jin X, et al. Genistein enhances the radiosensitivity of breast cancer cells via G2/M cell cycle arrest and apoptosis[J].Molecules, 2013, 18(11): 13200-17.
Protective effect of sphingosine 1- phosphate postconditioning on hypoxia/reoxygenation injury in human umbilical vein endothelial cell
LI Meng-meng1, WANG Yu-qing1, ZHANG Li-zhi2, LOU Jian-shi1, WEN Ke1
(1.DeptofPharmacology,SchoolofBasicMedicalSciences,TianjinMedicalUniversity,Tianjin300070,China; 2.DeptofObstetricsandGynecology,TianjinFirstCentralHospital,Tianjin300192,China)
Abstract:AimTo investigate the protective effects of sphingosine 1-phosphate (S1P) postconditioning on hypoxia/reoxygenation(H/R) injury in human umbilical vein endothelial cells (HUVEC) and its mechanisms.MethodsHUVECs cells were divided into five groups: normal (control) group, S1P low concentration group (L), S1P medium concentration group (M), S1P high concentration group (H) and H/R group. MTT method was used to measure cell survival. Using flow cytometric analysis, the rate of cell apoptosis was determined. The activities of total superoxide dismutase (T-SOD), copper/zinc superoxide dismuta-se (CuZn-SOD), manganese superoxide dismutase (Mn-SOD) activity, nitric oxide (NO) and malondialdehyde (MDA) content in cell culture medium were measured with colorimetry. Mitochondrial membrane potential in cells was observed with fluorescence microscope. Bax/Bcl-2, eNOS protein expression levels in HUVECs cells were observed with Western blot.ResultsCompared with H/R group, S1P low, medium and high concentrations in the intervention group could significantly increase the cell survival rate after H/R injury, and increase activity of T-SOD, CuZn-SOD, Mn-SOD and decrease content of MDA. Moreover, S1P could significantly increase NO content and increase eNOS protein expression, decrease apoptosis rate and inhibit the reduction of mitochondrial membrane potential. ConclusionsS1P can decrease cell apoptosis rate of HUVECs after H/R injury with a certain concentration dependence. The protection of S1P for cell apoptosis of HUVECs after H/R injury may be related to decreasing the intracellular MDA content and improving intracellular SOD activity, increasing mitochondrial membrane potential and enhancing expression of Bcl-2, anti-apoptotic protein.
Key words:S1P; hypoxia/reoxygenation; HUVECs cells; Bcl-2/Bax; eNOS;apoptosis
文献标志码:A
文章编号:1001-1978(2016)02-0184-06
doi:10.3969/j.issn.1001-1978.2016.02.008
作者简介:李蒙蒙(1991-),女,硕士生,研究方向:心血管药理学, E-mail: limeng50005@163.com;温克(1974-),男,博士,副教授,硕士生导师,研究方向:心血管药理学,通讯作者,E-mail:13820883653@163.com
基金项目:国家自然科学基金资助项目(No 81173058);国家自然科学基金青年基金资助项目(No 81502419);天津市自然科学基金资助项目(No 10JCZDJC20900)
收稿日期:2015-10-22,修回日期:2015-11-13
网络出版时间:http://www.cnki.net/kcms/detail/34.1086.R.20160125.1557.016.html网络出版地址:2016-1-25 15:57
