胆脂瘤上皮细胞中Caspase-9及Smac的表达变化及其相关性
2016-03-23刘东亮马秀岚
刘东亮,马秀岚
(中国医科大学附属盛京医院,沈阳110000)
胆脂瘤上皮细胞中Caspase-9及Smac的表达变化及其相关性
刘东亮1,马秀岚2
(中国医科大学附属盛京医院,沈阳110000)
摘要:目的探讨胆脂瘤上皮细胞中Caspase-9和Smac的表达变化及其相关性。方法 选取16例胆脂瘤样本及10例正常对照样本。应用免疫组化法及Western blotting法检测Caspase-9和Smac的表达。采用Spearman检验分析Caspase-9和Smac的相关性。结果胆脂瘤上皮细胞中Caspase-9及Smac蛋白表达较正常对照明显降低(P均<0.01),Smac及Caspase-9的表达水平呈正相关(r=0.744,P<0.01)。结论 胆脂瘤上皮细胞中Smac和Caspase-9的表达降低,Smac及Caspase-9的表达呈正相关。
关键词:胆脂瘤;Caspase-9;Smac;信号传导通路
胆脂瘤是以上皮细胞增殖分化形成的角化上皮堆积为特点的慢性中耳疾病,如不积极治疗,可进行性破坏中耳及周围重要结构(如面神经、颅底结构等),导致听力下降、面瘫等,甚至是严重性的颅内并发症。胆脂瘤虽具有肿瘤的某些特性,但它并非真正的肿瘤。无凋亡抑制是其与恶性肿瘤区别的一个重要因素。Caspase-9是內源性凋亡途径的起始因子,而Smac是内源性凋亡时由线粒体释放的促凋亡因子。我们检测胆脂瘤上皮细胞中Caspase-9和Smac的表达,并分析了其相关性,来初步探讨内源性凋亡在胆脂瘤中的作用。
1资料与方法
1.1临床资料取2012~2014年于中国医科大学附属耳鼻咽喉头颈外科诊断并行手术治疗的16例胆脂瘤患者的上皮组织标本(胆脂瘤组),其中患者男6例、女10例,年龄10~60(30.75±17.92)岁,均有1个月至40年的慢性耳流脓病史,标本均经病理证实为胆脂瘤;10例对照组标本来自于同期因耳后或耳廓肿物接受手术治疗的患者安全缘皮肤,病理证实无肿瘤细胞。
1.2上皮细胞中Caspase-9和Smac蛋白的检测 ①蛋白定性表达:采用免疫组化法。取新鲜胆脂瘤组织及安全缘皮肤,一部分送病理证实,余浸入甲醛溶液中保存,择期包埋,制作石蜡标本。按照常规SABC法进行检测,设空白对照。上述步骤中用己知阳性切片作为阳性对照,用PBS缓冲液代替一抗作为阴性对照,以排除非特异性着色。结果判定:细胞核或胞质内出现棕黄色颗粒者为阳性细胞。在阳性细胞标准基础上,综合染色强度及阳性细胞数两个方面进行分析。先按染色强度计分:O分为没有染色,1分为微弱棕黄色,2分为中等强度棕黄色,3分为深棕色;然后每张400倍显微镜下随机选取5个不重叠视野进行阳性细胞计数,每个视野计数200个细胞,计算5个视野的阳性细胞的平均百分比,按照百分比计分: 0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。每张切片随机取3个400倍视野,每个视野均进行染色强度计分与阳性细胞百分比计分,计算表达积分(染色强度计分与阳性细胞百分比计分乘积),并规定此积分:0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。②蛋白定量表达:采用Western blotting法。将少量组织块(100 mg左右)置于 1~2 mL 匀浆器中球状部位,加400 μL 单去污剂裂解液(含PMSF)于匀浆器进行匀浆,裂解30 min 后,即可用移液器将裂解液移至1.5 mL离心管中,然后在4 ℃、1 2000 r/min离心5 min,取上清分装于0.5 mL离心管中并置于-20 ℃保存。根据目的蛋白的分子量,配制10% SDS-PAGE胶垂直电泳,根据蛋白浓度调整上样量,保持每孔40 μg蛋白上样。电泳结束后转移到PVDF膜上。用5%脱脂奶粉常温下封闭摇床l h,PBS液洗膜3次,每次15 min,然后加入按说明书要求稀释的Caspase-9和Smac和内参GAPDH抗体,于4 ℃孵育过夜。TBST液洗膜3次,每次15 min,加入二抗,室温下摇床l h。TBST液洗膜3次,每次15 min,用ECL显色液显色,定影液终止显色。各实验重复3次。
2结果
2.1各组Caspase-9、Smac的表达对照组Smac表达局限于基底部增生区细胞胞质中,越靠近角质层其表达越弱或呈阴性表达。胆脂瘤上皮无或弱阳性(-~+)表达,主要集中在颗粒细胞层。对照组Caspase-9局限于基底部增生区细胞胞质中,越靠近角质层其表达越弱或呈阴性表达。胆脂瘤上皮无或弱阳性(-~+)表达,主要集中在颗粒细胞层和透明细胞层。胆脂瘤组Smac的表达为-、+、++、+++分别为0、6、4、0例,对照组分别为5、11、0、0例。胆脂瘤上皮的Smac表达明显弱于对照组(χ2=4.975,P<0.05)。胆脂瘤组Caspase-9的表达为-、+、++、+++分别为0、6、4、0例,对照组分别为6、10、0、0例。胆脂瘤组Caspase-9表达明显弱于对照组(χ2=10.156,P<0.01)。胆脂瘤组、对照组Caspase-9表达分别为0.47±0.11、0.87±0.14,Smac表达分别为0.23±0.12、0.71±0.13。胆脂瘤组Caspase-9、Smac的表达均低于对照组(P均<0.05)。见图1。
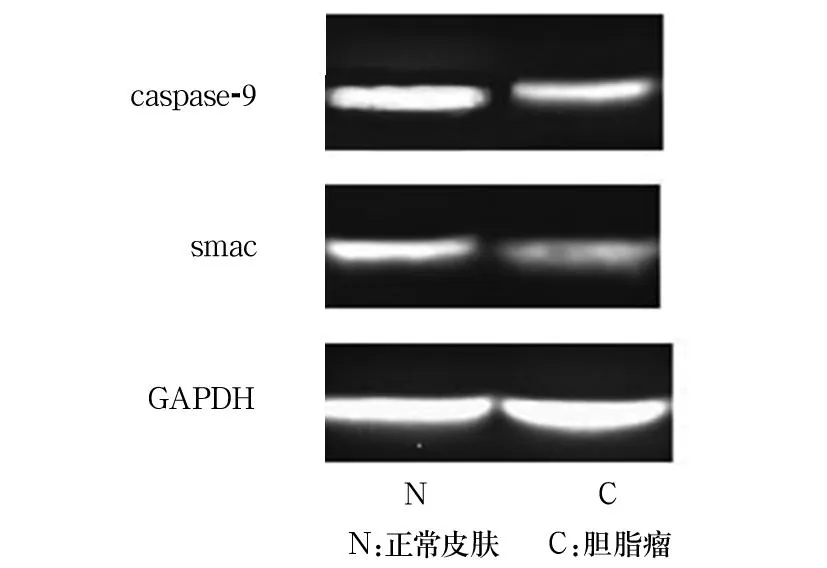
图1 Western blotting法检测Caspase-9及Smac的表达
2.2Smac及Caspase-9表达的相关性Smac与Caspase-9的表达呈明显正相关(r=0.744,P<0.01)。
3讨论
中耳胆脂瘤为囊袋状结构,囊内壁为复层鳞状上皮,后天原发或继发于中耳的胆脂瘤上皮多来源于鼓膜上皮层,形成的囊内充满脱落上皮、角化物质和胆固醇结晶。人们通过研究胆脂瘤上皮细胞中增殖标志物,试图证明胆脂瘤囊内壁复层鳞状上皮高度增生的特性。这些标志物包括细胞角蛋白[1]、增殖细胞核抗原[2]、表皮生长因子[3]、Ki67[4]、HMGB-1[5]等。最后这些结果都支持胆脂瘤上皮细胞具有高度增殖的行为,且这种增殖主要以基底层为主。
在一个多细胞机体中,细胞分裂增殖与凋亡是对立统一的,共同协调着组织和器官形态发生的发展方向,使组织细胞数处于动态平衡。在中耳胆脂瘤中,其鳞状上皮具有高度增殖现象已经被公认,这与肿瘤相似,但是中耳胆脂瘤上皮细胞仍具有凋亡能力,从而使中耳胆脂瘤上皮的细胞处于相对的动态平衡,高速产生大量的角化碎片。
目前认为细胞凋亡的发生主要集中在三条途径:外源性凋亡途径(死亡受体途径)、内源性凋亡途径(线粒体凋亡途径)及内质网应激途径[6~8]。Caspase 家族成员大多都是凋亡的启动子或效应子, 在细胞凋亡过程中发挥重要作用[9]。目前已经发现的有14 种Caspase蛋白,其中Caspase-3 起着关键作用,而且也是目前为止在Caspase家族中研究比较透彻的一个,它是最主要的效应因子,一旦被激活,即发生下游的级联反应,则凋亡便不可避免,于是Caspase-3 也被称为“死亡蛋白酶”[10]。正常情况下,胞质中的Caspase-3 以无活性的酶原形存在, 细胞凋亡信号的出现可导致Caspase-3 在多种蛋白水解酶的作用下,发生裂解而活化[11~13]。
凋亡的执行过程是一系列Caspase蛋白级联切割的过程。不同蛋白酶分别切割并激活Caspase-3 酶原。活化的Caspase-3 又进一步切割不同的底物,导致蛋白酶级联切割放大,最终使细胞走向死亡。在内源性凋亡途径中,由于生长激素撤退、射线辐射等凋亡因素刺激后,引起BH3-Only蛋白中促凋亡因子较抗凋亡因子成分增加,线粒体膜改变(如离子通道开放、膜电位下降及通透性增高等),线粒体膜间隙的细胞色素C等释放,释放到胞质中的细胞色素C与Apaf-1及dATP结合,形成的复合物募集pro-Caspase-9,形成凋亡复合体,pro-Caspase-9自动活化,Caspase-9为线粒体凋亡的起始因子,活化的Caspase-9剪切并将执行Caspase(如Caspase-3, -6 and -7)活化,从而诱导细胞凋亡[14~17]。凋亡抑制蛋白(IAPs)是Caspase家族的抑制因子,该家族成员均含有1~3个杆状病毒IAP重复序列,利用此结构区与Caspase-8,7,9结合而发挥抑制凋亡的作用[16]。Smac蛋白正常时也位于线粒体膜间隙,在凋亡诱导因子的作用下,同细胞色素C一起释放人胞质,与凋亡IAPs结合并解除其对Caspases的抑制作用,从而使Caspase活性增强,促进细胞凋亡发生[17]。
本实验结果中我们发现Smac与Caspase-9在胆脂瘤上皮细胞中的表达均弱于对照组,说明以Caspase-9为起始因子的内源性凋亡途径在胆脂瘤上皮细胞凋亡的过程中是被抑制的,这可能与胆脂瘤的病因及刺激因素有关,因为内源性凋亡的刺激因素主要为生长因子撤退、癌基因激活、DNA损伤、化疗和射线等。本病例中患者均有慢性中耳炎病史,而在炎症反应过程中炎细胞释放的白介素、肿瘤坏死因子等恰恰是诱导外源性凋亡的重要细胞因子;本实验中发现对照组上皮细胞的Smac及Caspase-9均有阳性表达,且均以基底层为主,说明皮肤正常细胞确实存在增殖与凋亡的负反馈作用,使基底细胞在迅速增殖的过程中凋亡相关因子亦增加,阻止基底细胞的过度增殖。无论在对照组亦或是胆脂瘤组,Caspase-9与Smac的表达水平呈正相关,证实了Smac通过结合IAP,阻断IAP对Caspase-9的抑制作用,增强了Caspase-9的促凋亡作用。但是由于IAP不仅能结合Caspase-9,也能结合其他凋亡相关的Caspases,所以Smac结合IAP后,亦能增强其他Caspases的凋亡活性。
总之,本研究结果显示,与正常上皮比较,内源性凋亡在胆脂瘤中是明显受到抑制的,通过解除这种抑制从而达到对胆脂瘤的药物治疗效果,可能将会是今后努力的方向。
参考文献:
[1] Olszewska E, Sudhoff H. Comparative cytokeratin distribution patterns in cholesteatoma epithelium[J]. Histol Histopathol, 2007,22(1):37-42.
[2] Raffa S, Leone L, Scrofani C, et al. Cholesteatoma-associated fibroblasts modulate epithelial growth and differentiation through KGF/FGF7 secretion[J]. Histochem Cell Biol, 2012,138(2):251-269.
[3] Thorup MB, Munk M, Poulsen SS, et al. Expression of the epidermal growth factor system in human middle ear cholesteatoma[J]. Acta Otolaryngol, 2014,134(2):124-134.
[4] Kuczkowski J, Pawelczyk T, Bakowska A, et al. Expression patterns of Ki-67 and telomerase activity in middle ear cholesteatoma[J]. Otol Neurotol, 2007,28(2):204-207.
[5] Chi Z, Wang Z, Liang Q, et al. Induction of cytokine production in cholesteatoma keratinocytes by extracellular high-mobility group box chromosomal protein 1 combined with DNA released by apoptotic cholesteatoma keratinocytes[J]. Mol Cell Biochem, 2015,400(1-2):189-200.
[6] Kiechle FL, Zhang X. Apoptosis: biochemical aspects and clinical implications[J]. Clin Chim Acta, 2002,326(1-2):27-45.
[7] Ashe PC, Berry MD. Apoptotic signaling cascades[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2003,27(2):199-214.
[8] Liu H, Baliga R. Endoplasmic reticulum stress-associated caspase 12 mediates cisplatin-induced LLC-PK1 cell apoptosis[J]. J Am Soc Nephrol, 2005,16(7):1985-1992.
[9] Stepień A, Izdebska M, Grzanka A. The types of cell death[J]. Postepy Hig Med Dosw, 2007,61:420-428.
[10] Poreba M, Strózyk A, Salvesen GS, et al. Caspase substrates and inhibitors[J]. Cold Spring Harb Perspect Biol, 2013,5(8):a008680.
[11] Galluzzi L, Kepp O, Kroemer G. Caspase-3 and prostaglandins signal for tumor regrowth in cancer therapy[J]. Oncogene, 2012, 31(23):2805-2808.
[12] Snigdha S, Smith ED, Prieto GA, et al. Caspase-3 activation as a bifurcation point between plasticity and cell death[J]. Neurosci Bull, 2012,28(1):14-24.
[13] Choudhary GS, Al-Harbi S, Almasan A. Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis[J]. Methods Mol Biol, 2015,1219:1-9.
[14] Shi L, Chen J, Yang J, et al. MiR-21 protected human glioblastoma U87MG cells from chemotherapeutic drug temozolomide induced apoptosis by decreasing Bax/Bcl-2 ratio and caspase-3 activity[J]. Brain Res, 2010,1352:255-264.
[15] Kuida K. Caspase-9[J]. Int J Biochem Cell Biol, 2000,32(2):121-124.
[16] Yang D, Song X, Zhang J, et al. Therapeutic potential of siRNA-mediated combined knockdown of the IAP genes (Livin, XIAP, and Survivin) on human bladder cancer T24 cells[J]. Acta Biochim Biophys Sin, 2010,42(2):137-144.
[17] Du C, Fang M, Li Y, et al. Smac, a mitochondrial protein that promotes cytochrome c-dependent caspase activation by eliminating IAP inhibition[J]. Cell, 2000,102(1):33-42.
《山东医药》第55卷第45期73页“尘螨过敏哮喘患儿舌下含服粉尘螨滴剂后血清尘螨SlgE、SlgG4及IL-12、IL-13水平变化”一文应为上海市嘉定区卫生局青年科研基金立项项目(QNKYJJ 2012-12-02)。
本刊编辑部
(收稿日期:2015-03-09)
中图分类号:R735.8
文献标志码:B
文章编号:1002-266X(2016)01-0049-03
doi:10.3969/j.issn.1002-266X.2016.01.018
通信作者:马秀岚(E-mail:subtlety@126.com)
