酶分子稳定性改造研究进展
2016-03-19冯旭东吕波李春
冯旭东,吕波,李春
(北京理工大学生命学院,北京 100081)
酶分子稳定性改造研究进展
冯旭东,吕波,李春
(北京理工大学生命学院,北京 100081)
摘要:酶催化转化在食品、医药和精细化工等领域起着越来越重要的作用。然而,目前大多数酶反应需要在较温和的条件下进行以维持其正常活性,而在实际应用的逆境中(如高热、高酸、高盐等),酶的耐受性却较差、容易失活从而导致反应效率下降,极大地限制了其推广和应用。因此,对酶分子进行抗逆改造以提高其稳定性和催化活性,是当前研究的热点也是难点。本文从化学修饰和分子改造两个方面总结了酶分子稳定性改造的新进展,从定向进化、半理性设计、理性设计和糖基化修饰4个角度重点阐述了分子改造提高酶稳定性的方法,重点介绍了糖基化作为一种新的酶分子稳定性改造技术的思路。
关键词:生物化工;生物催化;酶;稳定性;分子改造;糖基化
2015-06-30收到初稿,2015-09-24收到修改稿。
联系人:李春。第一作者:冯旭东(1985—),男,博士研究生,讲师。
Received date: 2015-06-30.
引 言
生物转化是生物化工过程的核心技术之一,其中酶催化转化是生物转化的重要组成部分。酶分子是由活细胞产生的一种具有特殊催化功能的生物大分子,其高效性与专一性是其他化学催化剂所无法比拟的优势,因此其在食品、医药和精细化工等领域起着越来越重要的作用[1]。然而,目前大多数酶反应需要在较温和的条件下进行以维持其正常活性,而在实际应用的逆境中(如高热、高酸、高盐等),酶的耐受性却较差;容易失活从而导致反应效率下降,极大地限制了其推广和应用。因此,对酶分子进行抗逆改造以提高其稳定性和催化活性,是当前研究的热点也是难点。本文从化学修饰以及分子改造两个方面总结了酶分子稳定性改造的最新进展并展望了其未来的发展方向(图1)。
图1 化学修饰、分子改造以及糖基化改造酶分子稳定性Fig.1 Engineering enzyme stability through chemical modification, molecular modification and glycosylation
1 化学修饰
在分子生物学技术兴起之前,化学修饰是提高酶稳定性的最重要方法之一[2],其中应用最广泛的修饰剂是聚乙二醇(PEG)。PEG修饰法最早是在1985年由Veronese等提出[3],PEG主要与酶分子的巯基、α-氨基、ε-氨基、羧基以及羟基等基团进行反应[4],其原理目前普遍认为是PEG的两亲性可以提高酶分子的构象动力学从而提高其在高温、有机溶剂等逆境下的稳定性[5-6]。近些年也逐渐发展了其他的化学修饰方法。Inouye等[7]分别用2, 4, 6-三硝基苯磺酸,2, 4-二甲氧基聚乙二醇-6-氯-三嗪,以及戊二醛对小麦β-淀粉酶的氨基进行修饰,最终使其耐热温度提高了1~8℃,热力学性质分析表明酶稳定性的提高主要是熵驱动。Ismaya等[8]发现用非极性的酸酐修饰α-淀粉酶可以将其稳定性提高18倍,用亲水性的PEG修饰可以提高α-淀粉酶对EDTA和胰蛋白酶的抗性。离子液体修饰也可以提高酶的稳定性,Iborra等[9]用[btma][NTf2]或[toma][NTf2]修饰脂肪酶CALB,其在正己烷以及95℃高温下的稳定性均显著提高,构象分析表明离子液体有利于维持酶分子二级结构的稳定性。酶的固定化通常可以提高酶分子构象的刚性从而提高其热稳定性[10]。随着纳米技术的兴起,将酶固定在纳米材料上形成的纳米酶成为了研究的热点[11]。Ge等[12]通过向酶的磷酸盐缓冲液中加入硫酸铜制备出了杂化纳米花结构,而酶被包埋在了纳米花结构中,其稳定性较游离酶有了大幅度提高。但是不适当的化学修饰也会降低酶的稳定性,如van der Veen等[13]用琥珀酰基修饰溶菌酶后,其热稳定性反而有所下降,溶解温度降低了16.5℃,原因主要是由于琥珀酰基疏水基团的暴露降低了溶菌酶构象的稳定性。因此,化学修饰没有普适性的标准,需要根据酶的特性以及需求来选择合适的化学试剂及修饰方法。另外,化学修饰经常伴随着酶活性的损失,其对每批的酶分子都要进行修饰,不同批次之间存在着差异性。上述缺点限制了该方法在酶分子稳定性改造中的应用,如何解决这些问题将是化学修饰今后的研究重点。除了化学修饰,以遗传学操作为基础的分子改造技术是另外一种提高酶分子稳定性的重要方法。
2 分子改造
2.1 定向进化
定向进化通过模拟自然进化机制(随机突变、重组和自然选择),以改进的诱变技术结合确定进化方向的选择方法,在体外改造基因,定向选择有价值的非天然蛋白分子获得某性能优化的突变体[14-15]。定向进化主要包括建立突变文库、选择合适的表达体系以及建立快速、有效的高通量筛选方法3个关键步骤[16]。在建立突变体文库方面,为了得到分子多样性最广泛采用的方法有随机突变的易错PCR 和DNA改组技术[17]。定向进化的最大优点是不需事先了解蛋白分子的空间结构和机制就可以获得满足需要的突变体。一个经典的例子是在1996年,Moore等[18]通过4轮易错PCR的定向进化将p-硝基苄基酯酶在25%二甲基甲酰胺中的活性提高了50~60倍。Ogino等[19]利用易错PCR的定向进化方法将BPO-A1 过氧化氢酶的热稳定性提高了5倍。上述的定向进化是在原核生物中进行的,最近也有报道在真核生物中进行定向进化来提高酶的稳定性。Xu等[20]用2轮的易错 PCR和2轮的DNA改组技术提高了在毕赤酵母中表达的脂肪酶的热稳定性,其溶解温度提高了22℃,在60℃下的热稳定性提高了46倍。Zhao等[21]提出了定向进化和定点饱和突变相结合的方法提高酶的热稳定性,首先用易错PCR构建了含有3000个突变体的文库,在65℃下筛选到了7个热稳定性提高的单点突变体,接着通过组合饱和突变获得了四点突变体,其热稳定性较野生型提高了24.7倍。利用相同的思路,Yu等[22]将还原酶CgKR1溶解温度提高了12℃。Hatada等[23]通过定向进化的随机突变确定了对呋喃果糖苷酶热稳定性有影响的5个氨基酸位点,接着对其进行迭代饱和突变,最后获得的突变体在65℃下的半衰期提高了16.5倍。尽管定向进化被广泛应用到了酶稳定性改造并取得了很大的成功,但由于其构建的文库中突变体数量太多,筛选过程成为了一项非常庞杂的工作,而得到的绝大多数突变体性质却没有改进。随着越来越多的酶晶体结构得到解析,学者逐渐发展了结合酶晶体结构以及催化特性的半理性以及理性的改造方法[24]。
2.2 半理性设计
半理性设计以对酶分子结构与功能有一定的理解为基础,将目标集中在少量的位点上,与定向进化相比,其优势在于突变体文库较小,不需要高通量的筛选方法,更容易获得正向突变结果。半理性设计组合方法多变,主要策略有:基于蛋白质结构分析,对特定位点随机突变;针对特定位点,结合随机突变与点饱和突变进行改造;针对特定位点,先进行随机突变再点饱和突变;结合计算辅助的半理性设计。
2.2.1 提高蛋白质柔性区域的刚性 酶分子的稳定性主要取决于其构象的刚性,统计学表明蛋白质的刚性越强其抗逆性也越强,因此,学者提出对酶分子的柔性区域进行刚性增强的改造来提高其稳定性,其中,连接主要二级结构(α-螺旋和β-折叠)的位于酶蛋白表面的loop具有很大的柔性,引起了广泛关注[25]。例如,Rao等[26]对枯草芽孢杆菌脂肪酶表面所有loop的91个氨基酸进行了定点饱和突变,鉴定出了6个位点对脂肪酶稳定性有关键影响,最终得到的6点突变体在DMSO中的耐受性提高了3倍。除了表面的loop,蛋白质的N和C端也是柔性较高的区域,这也是蛋白质晶体衍射时,经常有N和C端氨基酸序列丢失的主要原因,因此对该区域进行改造经常可以提高酶的稳定性[25]。Gilbert 等[27]通过定向进化结合定点饱和突变得到了含有7个突变位点的木聚糖酶,其溶解温度较野生型提高了25℃,有趣的是7个位点全部位于酶分子的N端。Sylvestre等[28]发现将木聚糖酶N端的29、31、43 和58位的氨基酸突变后,其热稳定性较野生型提高了30倍,见图2。
2.2.2 增强亚基间的相互作用 对于多亚基酶来讲,亚基间是通过范德华力、氢键以及静电等非共价作用连接从而保持酶分子整体构象的稳定性,这些作用力较弱,在逆境下容易被破坏,成为酶分子变性的重要原因。因此,通过强化亚基界面的相互作用而提高多亚基酶的稳定性成为了一种新思路。Bechtold等[29]通过系统的亚基界面作用的优化提高了D-塔格糖异构酶(PcDTE)的稳定性(图3)。PcDTE是同源二聚体,作者通过分析亚基界面间的氨基酸,得到了31个潜在的对酶分子构象有影响的突变位点,接着对这些位点进行了迭代饱和突变,最终得到的9位点突变体,其半衰期较野生型提高了80多倍,构象分析表明稳定性提高的主要原因是突变后的氨基酸与相邻的亚基间形成了更多的氢键作用。
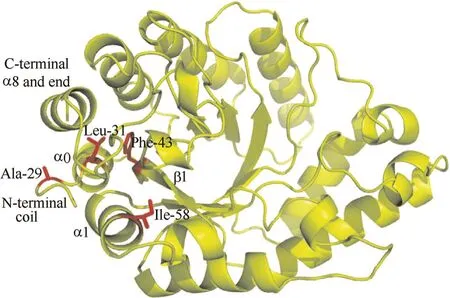
图2 木聚糖酶突变体N端的 Ala-29, Leu-31, Phe-43和Ile-58 通过与C端的疏水作用提高了酶分子的热稳定性[28]Fig.2 Ala-29, Leu-31, Phe-43, and Ile-58 at N-terminal of xylanase mutants established hydrophobic interaction with C-terminal to enhance thermostability[28]
2.2.3 基于B-factor的半理性设计 B-factor是半理性改造酶稳定性的一个重要依据,它反映一个氨基酸在整个酶分子中的柔性,B-factor值越大,柔性也越大,不利于酶的稳定性,因此可以选择B-factor值较大的氨基酸进行饱和突变,减弱其柔性,从而得到抗逆性强的酶突变体[30-31]。Reetz等[30]找到了脂肪酶LipA的B-factor值最高的10个氨基酸位点,通过对这些位点进行5轮的迭代饱和突变,将其在55℃的热稳定性提高了450多倍。Zhao等[32]对脂肪酶YlLip2的6个B-factor值最高的氨基酸位点进行迭代饱和突变,得到了两个阳性突变体,其耐热性的半衰期提高了2~5倍。需要注意的是,一般的B-factor值是通过酶分子的晶体结构得到的,而酶在溶液中的柔性要大于其晶体状态,因此,通过B-factor值进行酶稳定性改造时需要考虑到介质对酶蛋白构象的影响[33]。相应发现不同具有高稳定性的酶,其维持稳定性的机制不断被了解,使得采用理性设计对酶分子进行改造以提高其稳定性变得越来越具有理论意义。目前应用较为广泛的理性设计方法主要有:同源比对的策略,蛋白质表面电荷的优化策略,基于二硫键的设计策略,脯氨酸效应的设计策略,基于蛋白质解折叠自由能的设计策略等。
2.3 理性设计
理性设计是在对酶蛋白结构与功能深刻认识的基础上,以定点突变技术和定点饱和突变技术为主的,对酶分子进行改造的方法。随着研究的深入,
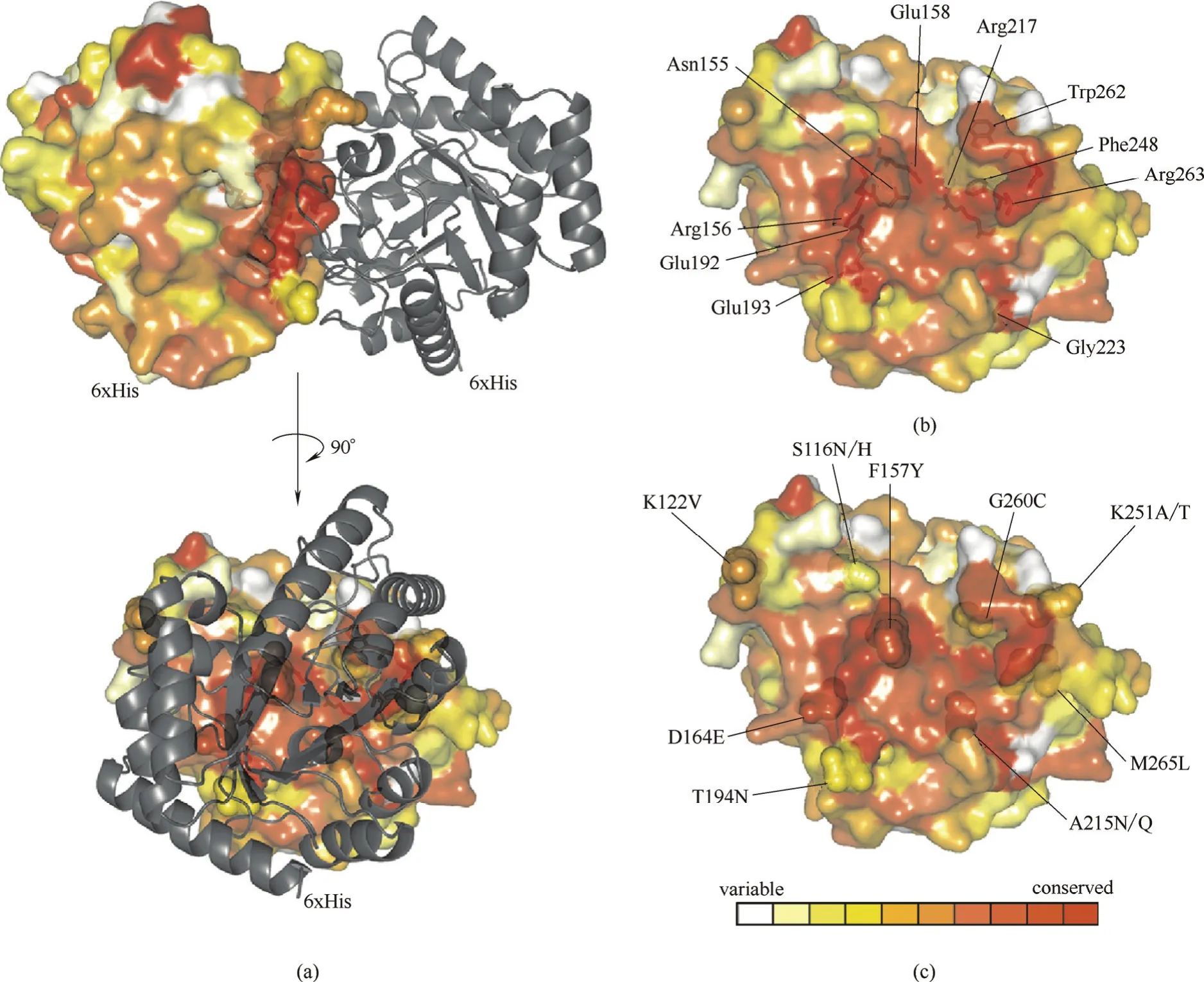
图3 D-塔格糖3-差向异构酶PcDTE的同源二聚体结构 (a);PcDTE单聚体界面的10个高度保留氨基酸 (b);PcDTE单聚体界面的对热稳定性有显著影响的9个氨基酸(c)[29]Fig.3 Dimer structure of PcDTE (a); ten highly conserved residues at PcDTE interface (b); and mutation of nine critical residues at PcDTE interface can significantly improve thermostability (c)[29]
2.3.1 同源比对 研究发现,中温酶与其同家族嗜热酶之间往往具有较高的同源性,因此,可以通过与热稳定性高的同源蛋白质比对序列,找出与热稳定性相关的氨基酸位点,然后对其进行突变,进而可以提高中温酶的稳定性[34]。Lau等[35]将嗜温性果胶酸酯裂解酶和4个同源耐热酶进行氨基酸序列比对,发现了9个潜在特异性显著的位点,以耐热酶为模板进行了定点突变,最终得到的突变体溶解温度提高了6℃,见图4。利用类似的方法,Bejar等[36]通过理性分析只对淀粉酶MAUS149的两个关键点进行定点突变,将其在55℃下的半衰期提高了15~25 min。
2.3.2 基于蛋白质构象的理性设计 除了定点突变,也有对酶分子柔性loop进行理性截短、截除或替换操作从而提高稳定性的报道。Hauer等[37]对NCR还原酶的结构进行分析,得到B-factor值较高的loop,将其中的4个氨基酸截除,突变酶在45℃的酶活较野生型提高了84.6%,在有机溶剂2-甲基-2-戊烯醛的耐受性提高了54.1%。Iwasaki等[38]通过对磷脂酶D结构的分析,找到了一个高度柔性的位于酶分子表面的loop,将该loop整个截除后,突变酶在70℃ 的热稳定性提高了11.7倍,模拟分析表明,loop环的截除有利于提高酶分子的构象稳定性,见图5。Bornscheuer等[39]发现loop替换也可以提高酶分子的稳定性,作者将嗜温性酯酶BsteE的“cap区域”与其同源的嗜热酯酶BsubE的相应区域进行对调,将BsteE的溶解温度提高了4℃。

图4 通过嗜温性果胶酸酯裂解酶NP_638163和4个同源耐热酶的氨基酸序列比对确定对其热稳定性有显著影响的突变体[35]Fig.4 Multiple sequence alignment of pectate lyases with its thermophilic counterparts[35]
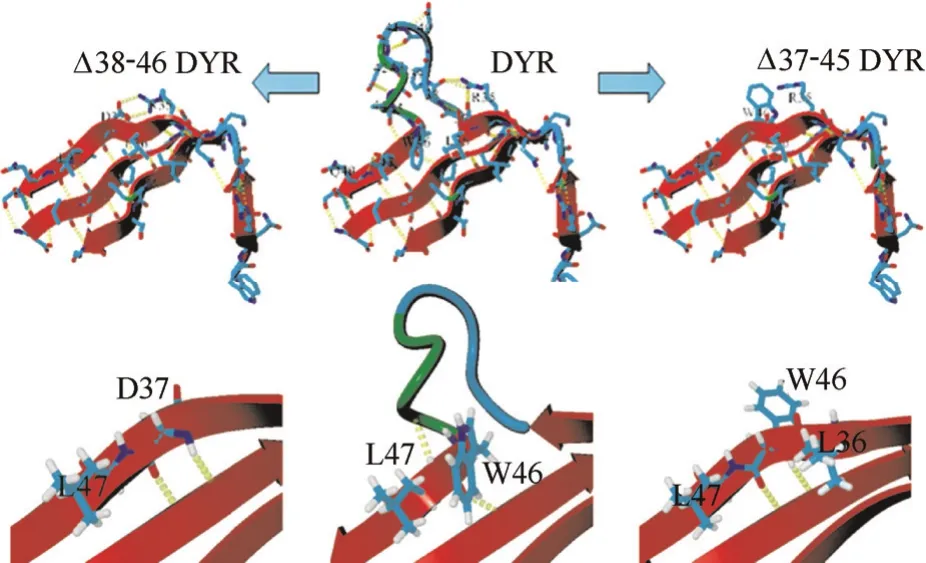
图5 通过截除磷脂酶D表面的loop提高酶分子热稳定性[38]Fig.5 Deletion of dynamic surface loop improves thermostability of phospholipase D[38]
2.3.3 基于计算机模拟的理性设计 上述的理性设计通常需要对酶分子的构象有较为深刻的认识,尽管随着X射线晶体衍射技术的进步,越来越多的蛋白质结构被解析出来,但是其总数量仍然很少,这大大限制了理性改造的进一步发展。近些年,计算机模拟技术的发展很好地弥补了这一不足,在研究某个目标蛋白时,即使没有其立体结构的信息,也可以同源结构为模板,借助分子模拟技术预测其结构,已经逐渐应用到酶分子的理性改造中[40]。Wu 等[41 ]通过分子动力学模拟了嗜温性木聚糖酶AoXyn11A和其同源嗜热酶EvXyn11TS的立体结构,接着比较了两者B-factor值差异较大的N端31个氨基酸,将EvXyn11TS的N端替换到AoXyn11A中,通过分子动力学模拟得到改造后的AoXyn11A能量从-611.2 减少到了-663.2 kJ·mmol-1,证明了其构象更加稳定,实验结果表明改造后的AoXyn11A在70℃的酶活提高了197倍, 见图6。Wu等[42]通过计算甲基硝苯硫磷酯水解酶所有位点突变后的熵值和去折叠自由能,以其为依据,得到了7个潜在的对酶分子热稳定性有影响的突变位点,实验结果表明,其中6个位点的突变可以提高酶的热稳定性,其溶解温度最多提高了11.7℃。
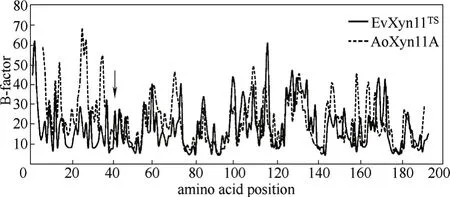
图6 通过分子动力学模拟研究两种热稳定性不同的木聚糖酶EvXyn11TS和AoXyn11A的B-factor[41]Fig.6 B-factors of amino acid residues of EvXyn11TSand AoXyn11A after a 15 ns MD simulation process at temperature of 300 K[41]
2.3.4 引入外源作用力的理性设计 除了通过遗传学操作改变酶分子自身的氨基酸或loop的组成改变其空间结构,也可以引入外源的分子或作用力稳定酶分子的构象从而提高其稳定性。例如,自聚集两性肽(SAPs)同时含有一定数量的亲水性和疏水性的氨基酸,其可以自发地形成规则的纳米结构,Chen等[43]向脂氧化酶的N端融合6种不同的SAPs,使其在50℃下的热稳定性提高了2.3~4.5倍,比酶活提高了1~2.8倍。向酶分子引入刚性较强的氨基酸也可以提高其稳定性,其中最重要的是脯氨酸法。脯氨酸包含一个亚氨基、一个羧基及一个吡咯烷环侧链,由于自身吡咯烷环的束缚,脯氨酸具有更小的构象自由度,可以减少酶分子构象在变性状态下的熵值,因此在酶分子柔性区域引入脯氨酸提高酶稳定性,成为了理性改造提高酶分子稳定性的重要手段[44]。汤恒等[45]对重组产紫青霉β-葡萄糖醛酸苷酶280位的甘氨酸突变为脯氨酸,使其在60 °C下的热稳定性提高了5倍。最近,Liu等[46]发现向α-淀粉酶的表面引入精氨酸也可以提高其热稳定性。
静电作用是维持酶分子构象稳定性的重要作用之一,因此在酶分子合适区域引入盐桥也可以提高酶的稳定性。Yu等[47]系统地研究了在不同区域引入盐桥对腈水合酶热稳定性的影响。作者找到了3个柔性较大的区域:近活性中心、表面loop以及C末端,接着分别向这3个区域引入盐桥,其中只有在C末端引入的盐桥使酶分子的热稳定性提高了160%、在超声波中的稳定性提高了75%。Hwang 等[48]通过B-factor指标,在葡萄糖苷酶的表面找到潜在的带同种电荷的氨基酸,将其突变成带相反电荷的氨基酸从而和相邻氨基酸形成盐桥,利用这种方法,共引入了6对盐桥,酶分子的溶解温度提高了0.6~8.8℃。二硫键对于维持大部分蛋白质的功能和稳定性起着重要的作用[49],因此,在酶分子合适区域引入二硫键也可以提高其构象稳定性[50]。Zhang等[51]向纤维素酶C的由56个氨基酸组成的柔性亚结构域引入了二硫键交联,使其在65℃下的半衰期提高了5.8倍。Wu等[52]通过分子动力学模拟确定了A型阿魏酸酯酶稳定性较差的氨基酸位点,结合软件分析考虑这些潜在位点的物理化学性质,从而提高二硫键的引入概率,最终找到了一对位点A126-N152,将其突变为半胱氨酸引入二硫键,将其热稳定性提高了10倍。
2.4 糖基化
糖基化是蛋白质翻译后的一种重要的加工过程,根据蛋白质与糖链连接类型的不同,糖基化主要分为N-糖基化和O-糖基化[53]。其中,N-糖基化修饰的糖链连接在Asn-X-Ser/Thr结构的(X-脯氨酸外的任意一种氨基酸)天冬酰胺侧链的酰胺基上[54]。N-糖基化是最普遍、最重要的糖基化方式,生物信息学分析表明多于一半的真核蛋白都是糖蛋白,且多数为N-糖蛋白[55]。大量研究表明糖基化对酶的稳定性有很大的影响。Fonseca-Maldonado等[56]研究了糖基化对P. pastoris中重组表达的木聚糖酶热稳定性的影响,通过质谱分析确定了4个糖基化位点,结果表明糖基化的去除会使木聚糖酶的耐热性降低至1/172,并且糖基化位点比糖链对热稳定性的影响更大。Li等[57-58]研究了N-糖基化对重组的β-葡萄糖醛酸苷酶的活性以及生化特性的影响。用酶解法完全水解掉糖基后,β-葡萄糖醛酸苷酶的热稳定性降低了15%~45%,另外,去糖基化对酶分子的二级结构没有显著的影响,但是会促进热变性过程中酶的聚集,增加其柔性,从而导致其不可逆变性。Wu等[59]发现当把P. pastoris表达的TI脂肪酶33位的糖基去除后,其耐热性降低了80%。Zheng 等[60]将弹性蛋白酶在P. pastoris中重组表达进行糖基化修饰,其热稳定性有了显著的提高,在70℃半衰期提高了40%。酶蛋白的空间结构决定了其功能,因此糖基化提高酶稳定性的机理主要在于其对酶蛋白结构方面的稳定作用。一般认为,糖基化可以减少蛋白质的聚集,有利于其正确折叠,增加蛋白质的刚性从而提高其稳定性。Shental-Bechor等[61]研究了糖基化对蛋白质SH3 domain折叠的影响,证明糖基化可以减少蛋白质在伸展状态的稳定性,从而有利于蛋白质的折叠并提高其折叠后的热力学稳定性。然而,生物体内自发的糖基化随机性较强,大多数糖基化不能处于稳定酶分子构象的最佳位点,导致其对酶分子稳定性的提升作用不显著,甚至不合适的糖基化还会降低酶的稳定性,大大限制了其应用[62-63]。鉴于此,有学者提出人工引入糖基化提高酶稳定性的思路。Han等[64]以毕赤酵母为底盘宿主向弹性蛋白酶的36和264位点人工引入了糖基化,其中264位的糖基化使酶在65℃下的半衰期延长了3.7 min,而36位的糖基化反而降低了8 min。由此可见,人工引入糖基化确实可以提高酶的稳定性,但糖基化位点需要谨慎选择。目前,国内外在这方面均处于刚起步,具有较大的发展空间。
3 结论与展望
目前对酶分子的稳定性改造主要集中在耐热性和耐有机溶剂等方面。化学法修饰可以在一定程度上提高酶的稳定性,但经常伴随着酶活性的损失,并对每批的酶分子都要进行修饰,不同批次之间存在着差异性的问题,解决上述问题是化学修饰今后的研究重点。分子改造中,由于定向进化的工作量较大以及筛选困难,半理性以及理性设计是未来的发展方向,因此如何结合酶分子晶体结构以及计算机辅助模拟来理性设计突变策略在不影响酶活的条件下有效提高酶稳定性是今后研究的重点。糖基化是调节酶稳定性的一种有效手段,但是目前对糖基化影响酶构象机理的研究还不彻底,如何能够理性地设计位点引入糖基化是今后的研究重点。
References
[1] BORNSCHEUER U T, HUISMAN G W, KAZLAUSKAS R J, et al. Engineering the third wave of biocatalysis [J]. Nature, 2012, 485 (7397): 185-194.
[2] STEPANKOVA V, BIDMANOVA S, KOUDELAKOVA T, et al. Strategies for stabilization of enzymes in organic solvents [J]. ACS Catalysis, 2013, 3 (12): 2823-2836.
[3] VERONESE F M, LARGAJOLLI R, BOCCU E, et al. Surface modification of proteins—activation of monomethoxy-polyethylene glycols by phenylchloroformates and modification of ribonuclease and superoside-dismutase [J]. Applied Biochemistry and Biotechnology,1985, 11 (2): 141-152.
[4] GONZALEZ-VALDEZ J, RITO-PALOMARES M, BENAVIDES J. Advances and trends in the design, analysis, and characterization of polymer-protein conjugates for “PEGylaided” bioprocesses [J]. Analytical and Bioanalytical Chemistry, 2012, 403 (8): 2225-2235.
[5] CASTILLO B, SOLA R J, FERRER A, et al. Effect of PEG modification on subtilisin Carlsberg activity, enantioselectivity, and structural dynamics in 1,4-dioxane [J]. Biotechnology and Bioengineering, 2008, 99 (1): 9-17.
[6] LI C M, HUANG M, GU Z B, et al. Nanosilica sol leads to further increase in polyethylene glycol (PEG) 1000-enhanced thermostability of beta-cyclodextrin glycosyltransferase from Bacillus circulans [J]. Journal of Agricultural and Food Chemistry, 2014, 62 (13): 2919-2924.
[7] DABA T, KOJIMA K, INOUYE K. Chemical modification of wheat β-amylase by trinitrobenzenesulfonic acid, methoxypolyethylene glycol, and glutaraldehyde to improve its thermal stability and activity [J]. Enzyme and Microbial Technology, 2013, 53 (6/7): 420-426.
[8] ISMAYA W T, HASAN K, KARDI I, et al. Chemical modification of Saccharomycopsis fibuligera R64 alpha-amylase to improve its stability against thermal, chelator, and proteolytic inactivation [J]. Applied Biochemistry and Biotechnology, 2013, 170 (1): 44-57.
[9] LOZANO P, DE DIEGO T, SAUER T, et al. On the importance of the supporting Candida antarctica lipase B in material for activity of immobilized ionic liquid/hexane and ionic liquid/supercritical carbon dioxide biphasic media [J]. Journal of Supercritical Fluids, 2007, 40 (1): 93-100.
[10] DICOSIMO R, MCAULIFFE J, POULOSE A J, et al. Industrial use of immobilized enzymes [J]. Chemical Society Reviews, 2013, 42 (15): 6437-6474.
[11] MISSON M, ZHANG H, JIN B. Nanobiocatalyst advancements and bioprocessing applications [J]. Journal of the Royal Society Interface, 2015, 12 (102). DOI: 10.1098/rsif.2014.0891.
[12] GE J, LEI J, ZARE R N. Protein-inorganic hybrid nanoflowers [J]. Nature Nanotechnology, 2012, 7 (7): 428-432.
[13] VAN DER VEEN M, NORDE W, STUART M C. Effects of succinylation on the structure and thermostability of lysozyme [J]. Journal of Agricultural and Food Chemistry, 2005, 53 (14): 5702-5707.
[14] COBB R E, CHAO R, ZHAO H M. Directed evolution: past, present, and future [J]. AIChE Journal, 2013, 59 (5): 1432-1440.
[15] MARTINEZ R, JAKOB F, TU R, et al. Increasing activity and thermal resistance of Bacillus gibsonii alkaline protease (BgAP) by directed evolution [J]. Biotechnology and Bioengineering, 2013, 110 (3): 711-720.
[16] KOYAMA Y, HIDAKA M, NISHIMOTO M, et al. Directed evolution to enhance thermostability of galacto-N-biose/lacto-N-biose I phosphorylase [J]. Protein Engineering Design & Selection, 2013, 26 (11): 755-761.
[17] DENARD C A, REN H Q, ZHAO H M. Improving and repurposing biocatalysts via directed evolution [J]. Current Opinion in Chemical Biology, 2015, 25: 55-64.
[18] MOORE J C, ARNOLD F H. Directed evolution of a para-nitrobenzyl esterase for aqueous-organic solvents [J]. Nature Biotechnology, 1996, 14 (4): 458-467.
[19] YAMADA R, HIGO T, YOSHIKAWA C, et al. Improvement of the stability and activity of the BPO-A1 haloperoxidase from Streptomyces aureofaciens by directed evolution [J]. Journal of Biotechnology, 2014, 192: 248-254.
[20] YU X W, WANG R, ZHANG M, et al. Enhanced thermostability of a Rhizopus chinensis lipase by in vivo recombination in Pichia pastoris [J]. Microbial Cell Factories, 2012, 11: 102.
[21] RAO G D, LEE J K, ZHAO H M. Directed evolution of phloroglucinol synthase PhlD with increased stability for phloroglucinol production [J]. Applied Microbiology and Biotechnology, 2013, 97 (13): 5861-5867.
[22] HUANG L, XU J H, YU H L. Significantly improved thermostability of a reductase CgKR1 from Candida glabrata with a key mutation at Asp 138 for enhancing bioreduction of aromatic alpha-keto esters [J]. Journal of Biotechnology, 2015, 203: 54-61.
[23] OHTA Y, HATADA Y, HIDAKA Y, et al. Enhancing thermostability and the structural characterization of Microbacterium saccharophilum K-1 beta-fructofuranosidase [J]. Applied Microbiology and Biotechnology, 2014, 98 (15): 6667-6677.
[24] WIJMA H J, FLOOR R J, JANSSEN D B. Structure- and sequence-analysis inspired engineering of proteins for enhanced thermostability [J]. Current Opinion in Structural Biology, 2013, 23 (4): 588-594.
[25] NESTL B M, HAUER B. Engineering of flexible loops in enzymes [J]. ACS Catalysis, 2014, 4 (9): 3201-3211.
[26] YEDAVALLI P, RAO N M. Engineering the loops in a lipase for stability in DMSO [J]. Protein Engineering Design & Selection, 2013, 26 (4): 317-324.
[27] DUMON C, VARVAK A, WALL M A, et al. Engineering hyperthermostability into a GH11 xylanase is mediated by subtle changes to protein structure [J]. Journal of Biological Chemistry, 2008, 283 (33): 22557-22564.
[28] SONG L T, TSANG A, SYLVESTRE M. Engineering a thermostable fungal GH10 xylanase, importance of N-terminal amino acids [J]. Biotechnology and Bioengineering, 2015, 112 (6): 1081-1091.
[29] BOSSHART A, PANKE S, BECHTOLD M. Systematic optimization of interface interactions increases the thermostability of a multimeric enzyme [J]. Angewandte Chemie:International Edition, 2013, 52 (37): 9673-9676.
[30] REETZ M T, D CARBALLEIRA J, VOGEL A. Iterative saturation mutagenesis on the basis of B factors as a strategy for increasing protein thermostability [J]. Angewandte Chemie:International Edition, 2006, 45 (46): 7745-7751.
[31] CHEN C C, LUO H Y, HAN X, et al. Structural perspectives of an engineered beta-1,4-xylanase with enhanced enhanced thermostability [J]. Journal of Biotechnology, 2014, 189: 175-182.
[32] WEN S, TAN T W, ZHAO H M. Improving the thermostability of lipase Lip2 from Yarrowia lipolytica [J]. Journal of Biotechnology, 2012, 164 (2): 248-253.
[33] EASTMAN P, PELLEGRINI M, DONIACH S. Protein flexibility in solution and in crystals [J]. Journal of Chemical Physics, 1999, 110 (20): 10141-10152.
[34] CURRIN A, SWAINSTON N, DAY P J, et al. Synthetic biology for the directed evolution of protein biocatalysts: navigating sequence space intelligently [J]. Chemical Society Reviews, 2015, 44 (5): 1172-1239.
[35] XIAO Z, BERGERON H, GROSSE S, et al. Improvement of the thermostability and activity of a pectate lyase by single amino acid substitutions, using a strategy based on melting-temperature-guided sequence alignment [J]. Applied and Environmental Microbiology, 2008, 74 (4): 1183-1189.
[36] BEN M S, AGHAJARI N, BEN A M, et al. Enhancement of the thermostability of the maltogenic amylase MAUS149 by Gly312Ala and Lys436Arg substitutions [J]. Bioresource Technology, 2011, 102 (2): 1740-1746.
[37] REICH S, KRESS N, NEST B M, et al. Variations in the stability of NCR ene reductase by rational enzyme loop modulation [J]. Journal of Structural Biology, 2014, 185 (2): 228-233.
[38] DAMNJANOVIC J, NAKANO H, IWASAKI Y. Deletion of a dynamic surface loop improves stability and changes kinetic behavior of phosphatidylinositol-synthesizing streptomyces phospholipase D [J]. Biotechnology and Bioengineering, 2014, 111 (4): 674-682.
[39] GALL M G, NOBILI A, PAVLIDIS I V, et al. Improved thermostability of a Bacillus subtilis esterase by domain exchange [J]. Applied Microbiology and Biotechnology, 2014, 98 (4): 1719-1726.
[40] DAMBORSKY J, BREZOVSKY J. Computational tools for designing and engineering enzymes [J]. Current Opinion in Chemical Biology, 2014, 19: 8-16.
[41] GAO S J, WANG J Q, WU M C, et al. Engineering hyperthermostability into a mesophilic family 11 xylanase from Aspergillus oryzae by in silico design of N-terminus substitution [J]. Biotechnology and Bioengineering, 2013, 110 (4): 1028-1038.
[42] TIAN J, WANG P, HUANG L, et al. Improving the thermostability of methyl parathion hydrolase from Ochrobactrum sp. M231 using a computationally aided method [J]. Applied Microbiology and Biotechnology, 2013, 97 (7): 2997-3006.
[43] LU X, LIU S, ZHANG D, et al. Enhanced thermal stability and specific activity of Pseudomonas aeruginosa lipoxygenase by fusing with self-assembling amphipathic peptides [J]. Applied Microbiology and Biotechnology, 2013, 97 (21): 9419-9427.
[44] BOONE C D, RASI V, TU C, et al. Structural and catalytic effects of proline substitution and surface loop deletion in the extended active site of human carbonic anhydrase II [J]. FEBS Journal, 2015, 282 (8): 1445-1457.
[45] 汤恒, 黄申, 冯旭东, 等. 理性设计提高β-葡萄糖醛酸苷酶的热稳定性 [J]. 化工学报, 2015, 66 (6): 2205-2211. TANG H, HUANG S, FENG X D, et al. Improvement of thermostability of beta-glucuronidase through rational design [J]. CIESC Journal, 2015, 66 (6): 2205-2211.
[46] DENG Z M, YANG H Q, SHIN H D, et al. Structure-based rational design and introduction of arginines on the surface of an alkaline alpha-amylase from Alkalimonas amylolytica for improved thermostability [J]. Applied Microbiology and Biotechnology, 2014, 98 (21): 8937-8945.
[47] CHEN J, YU H, LIU C, et al. Improving stability of nitrile hydratase by bridging the salt-bridges in specific thermal-sensitive regions [J]. Journal of Biotechnology, 2012, 164 (2): 354-362.
[48] LEE C W, WANG H J, HWANG J K, et al. Protein thermal stability enhancement by designing salt bridges: a combined computational and experimental study [J]. Plos One, 2014, 9 (11). DOI: 10.1371/journal.pone.0112751.
[49] HATAHET F, BOYD D, BECKWITH J. Disulfide bond formation in prokaryotes: history, diversity and design [J]. Biochimica Et Biophysica Acta-Proteins and Proteomics, 2014, 1844 (8): 1402-1414.
[50] HWA K Y, SUBRAMANI B, SHEN S T, et al. An intermolecular disulfide bond is required for thermostability and thermoactivity of beta-glycosidase from Thermococcus kodakarensis KOD1 [J]. Applied Microbiology and Biotechnology, 2014, 98 (18): 7825-7836.
[51] BADIEYAN S, BEVAN D R, ZHANG C. Study and design of stability in GH5 cellulases [J]. Biotechnology and Bioengineering, 2012, 109 (1): 31-44.
[52] YIN X, HU D, LI J F, et al. Contribution of disulfide bridges to the thermostability of a type A feruloyl esterase from Aspergillus usamii [J]. Plos One, 2015, 10 (5). DOI: 10.1371/journal.pone.0126864.
[53] NOTHAFT H, SZYMANSKI C M. Bacterial protein N-glycosylation: new perspectives and applications [J]. Journal of Biological Chemistry, 2013, 288 (10): 6912-6920.
[54] HEBERT D N, LAMRIBEN L, POWERS E T, et al. The intrinsic and extrinsic effects of N-linked glycans on glycoproteostasis [J]. Nature Chemcial Biology, 2014, 10 (11): 902-910.
[55] APWEILER R, HERMJAKOB H, SHARON N. On the frequency of protein glycosylation, as deduced from analysis of the SWISS-PROT database [J]. Biochimica Et Biophysica Acta-General Subjects, 1999, 1473 (1): 4-8.
[56] FONSECA-MALDONADO R, VIEIRA D S, ALPONTI J S, et al. Engineering the pattern of protein glycosylation modulates the thermostability of a gh11 xylanase [J]. Journal of Biological Chemistry, 2013, 288 (35): 25522-25534.
[57] ZOU S P, XIE L P, LIU Y L, et al. N-linked glycosylation influences on the catalytic and biochemical properties of Penicillium purpurogenum beta-D-glucuronidase [J]. Journal of Biotechnology, 2012, 157 (3): 399-404.
[58] ZOU S P, HUANG S, KALEEM I, et al. N-glycosylation enhances functional and structural stability of recombinant beta-glucuronidase expressed in Pichia pastoris [J]. Journal of Biotechnology, 2013, 164 (1): 75-81.
[59] ZHU J, LIU H, ZHANG J, et al. Effects of Asn-33 glycosylation on the thermostability of Thermomyces lanuginosus lipase [J]. Journal of Applied Microbiology, 2014, 117 (1): 151-159.
[60] HAN M H, WANG X F, DING H Y, et al.The role of N-glycosylation sites in the activity, stability, and expression of the recombinant elastase expressed by Pichia pastoris [J]. Enzyme and Microbial Technology, 2014, 54: 32-37.
[61] SHENTAL-BECHOR D, LEVY Y. Effect of glycosylation on protein folding: a dose book at thermodynamic stabilization [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105 (24): 8256-8261.
[62] SKROPETA D. The effect of individual N-glycans on enzyme activity [J]. Bioorganic & Medicinal Chemistry, 2009, 17 (7): 2645-2653.
[63] PIIRAINEN M A, DE RUIJTER J C, KOSKELA E V, et al. Glycoengineering of yeasts from the perspective of glycosylation efficiency [J]. New Biotechnology, 2014, 31 (6): 532-537.
[64] HAN M H, WANG X F, YAN G L, et al. Modification of recombinant elastase expressed in Pichia pastoris by introduction of N-glycosylation sites [J]. Journal of Biotechnology, 2014, 171: 3-7.
Foundation item: supported by the National Natural Science Foundation of China (21506011, 21425624, 21176028).
Advances in enzyme stability modification
FENG Xudong, LÜ Bo, LI Chun
(School of Life Science, Beijing Institute of Technology, Beijing 100081, China)
Abstract:Enzymes play an increasingly important role in diverse industrial fields such as food, pharmacy and fine chemistry. However, most of the enzymes require mild reaction conditions to maintain the activity, and they have poor tolerance towards heat, acid and salt under stressful conditions in real applications. Thus, the enzymes are very labile to lose their activity, severely limiting their applications. Therefore, it is critical and also challenging to engineer enzymes for higher stability. In this paper, the progress in enzyme stability modification is summarized from perspectives of chemical decoration and molecular modification. The molecular modification is illustrated with regards to directed evolution, semi-rational, ration design and glycosylation, where the glycosylation as a new tool to improve enzyme stability is briefly reviewed.
Key words:biochemical engineering; biocatalysis; enzyme; stability; molecular modification; glycosylation
Corresponding author:Prof. LI Chun, lichun@bit.edu.cn
基金项目:国家自然科学基金项目(21506011,21425624,21176028)。
中图分类号:Q 816
文献标志码:A
文章编号:0438—1157(2016)01—0277—08
DOI:10.11949/j.issn.0438-1157.20151025
