人工关节假体周围感染与无菌性松动界膜组织中人-防御素3的表达差异分析*
2016-03-15朱晨孔荣方诗元何年安夏睿徐婷娟李乾明黄威王磊朱思强
朱晨孔荣方诗元* 何年安夏睿徐婷娟李乾明黄威王磊朱思强
朱晨1,2孔荣1方诗元1* 何年安3夏睿1徐婷娟4李乾明1黄威1王磊1朱思强1
目的探讨股骨颈骨折的滑膜组织、人工关节无菌性松动和假体周围感染的界膜组织中人 -防御素-3(HBD-3)的表达差异。方法 30例患者,其中因假体周围感染进行髋关节翻修的患者、因无菌性松动接受髋关节翻修的患者以及因股骨颈骨折接受髋关节置换的患者各10例,采用酶联免疫吸附试验(ELISA)、实时定量聚合酶链反应(Realtime PCR)、免疫组化染色分析及免疫印迹分析(Western blot)进行假体周围界膜组织或滑膜组织中HBD-3表达水平的检测并进行统计学分析。结果RealtimePCR发现,假体周围感染后界膜组织中HBD-3 mRNA的表达,明显高于无菌性松动界膜组织和股骨颈骨折滑膜组织中HBD-3的表达。与创伤性滑膜组织相比,细菌感染刺激引起界膜组织中HBD-3的释放增加约5倍以上;与非感染性的无菌性松动界膜组织相比,HBD-3的释放增加约2倍以上。免疫组化染色显示局部细菌炎症刺激条件下,与无菌性松动界膜组织相比,感染导致界膜组织中的成纤维细胞和成骨细胞分泌 HBD-3增加。Westenblot显示,与非炎症组相比,葡萄球菌在局部定植引起组织中HBD-3蛋白水平显著提高。结论HBD-3在感染性界膜组织和无菌性松动界膜组织之间表达差异显著。未来,HBD-3一个可行的临床应用可以通过术中界膜组织的病理活检,来区别人工关节假体周围感染和无菌性松动。
-防御素;骨感染;耐药葡萄球菌;植入物
内植物相关的骨与关节感染,难以治愈,反复发作,目前已成为严重困扰骨科医生的难题,早期诊断尤为困难。美国每例人工关节感染的治疗费用平均大于5万美元,每年用于治疗人工关节感染的费用可高达10亿美元[1]。因此,探寻一种新的针对内植物相关的骨关节感染的早期鉴别诊断策略已势在必行。最近的研究发现,金黄色葡萄球菌可以诱导人成纤维细胞和成骨细胞分泌人 -防御素-3(Human -defensin-3,HBD-3)[2,3]。HBD-3是人体自身分泌的一种内源性抗菌肽,具有无毒、广谱、理化性质稳定、抗菌活性强以及调节自身免疫的特性[4,5]。本文将调查股骨颈骨折的滑膜组织、人工关节无菌性松动和假体周围感染的界膜组织中HBD -3的表达差异以及炎症感染对抗菌肽潜在的诱导作用,以明确HBD-3是否在内植物感染的炎症过程中发挥作用以及HBD-3是否可以做为假体周围感染的炎症标记物。
1 材料和方法
1.1 人体界膜或滑膜标本的采集
10例因假体周围感染进行髋关节翻修的患者,包括7例男性和3例女性,平均年龄为(63±9.8)岁(43~78岁),术中取股骨假体周围的界膜组织进行检测。患者的临床表现、实验室检查及术中所见,均提示人工关节假体周围感染,术后细菌培养5例培养为金黄色葡萄球菌和5例为表皮葡萄球菌。10例因无菌性松动接受髋关节翻修的患者,4名女性和6名男性,平均年龄为(64.3±5.7)岁(55~73岁),术中取股骨植入物周围的界膜获取组织样本。患者的临床表现、实验室检查及术中所见,均提示人工髋关节假体无菌性松动;同时均排除因手术技术原因,如假体安放不良及股骨侧力线不良导致的假体松动[6]。10例因股骨颈骨折接受髋关节置换的患者,包括3名男性和7名女性,平均年龄为(73.9±8.7)岁(61~86岁),术中取髋关节滑膜组织进行标本检测。患者临床表现、实验室检查及术中所见均排除细菌感染、强直性脊柱炎、类风湿关节炎或其它髋关节炎症。上述3组标本,一半固定在液氮中,另一半4%福尔马林固定、梯度乙醇脱水、石蜡包埋。随后,所有样品均进行 HBD-3表达的检测[7]。
1.2 酶联免疫吸附试验(ELISA)
人标本组织进行液氮冻存,实验前从液氮取出,并用pH值7.5的含NaCl 150mm、20 mM Tris-HCl缓冲液及1%的Triton X-100混匀。匀浆离心后取上清200L用ELISA试剂盒进行检测(伊艾博科技有限公司,武汉,中国),并按操作说明进行。标准参照或检测样品均加入到96孔微量滴定板,并与生物素标记的 HBD-3抗体37℃孵育2小时,随后PBS+0.1%吐温20清洗微量滴定板3次,再与辣根过氧化物酶抗生物素蛋白100 L在每个培养孔37℃暗光条件下孵育1h,然后90L 3.3',5.5'四甲基联苯胺作为显色剂,再被添加到每个培养孔内孵育15分钟,最后50 L硫酸溶液终止反应。各样本重复检测3次,样本在波长450nm的光学密度值使用Synergy HT酶标仪进行测量。重组HBD-3以下列各浓度值作为标准参照:0、0.3125、0.625、1.25、2.5、5、10、20、40、80、120 ng/L[8]。
1.3 免疫组化染色分析
免疫组化检测HBD-3在滑膜或界膜组织中的表达。人体标本进行脱水和石蜡包埋。所有的脱蜡切片3%过氧化氢在室温下封闭10分钟,以抑制内源性过氧化物酶。HBD-3(1∶500,NovusBiologicals,Littleton,CO,USA)多克隆一抗进行免疫组化染色,再用生物素标记的二抗孵育以及过氧化物酶标记的链霉亲和素生物素染色技术(DAKO,Glostrup,丹麦)。对于HBD-3,正常人体皮肤组织被用来作为阳性对照[7]。当抗菌肽与抗体结合产生阳性反应时,可显示一个棕色的反应产物在组织内的沉积。
1.4 实时定量聚合酶链反应(Realtime PCR)
人体组织标本液氮冻存后取出粉碎,根据RNeasyminikit试剂盒(Qiagen,Valencia,CA,USA)说明书,按操作说明提取总RNA,使用DNase I(Fermentas)去除基因组残留的DNA并进行纯度测定。然后根据FermentasRevertAidFirst Strand cDNA SynthesisKit试剂盒操作要求,将提取的RNA反转录为cDNA。最后根据Roche FastStart Universal SYBR Green Master(Rox)试剂盒操作说明,在 ABI 7500 Real TimePCR反应仪上进行PCR操作。所用基因的引物序列及退火温度见下表1, -actin为基因表达水平的内参基因。基因表达的定量分析,以每个样品的CT值为基础,每个样品平均重复3次测定[8,9]。
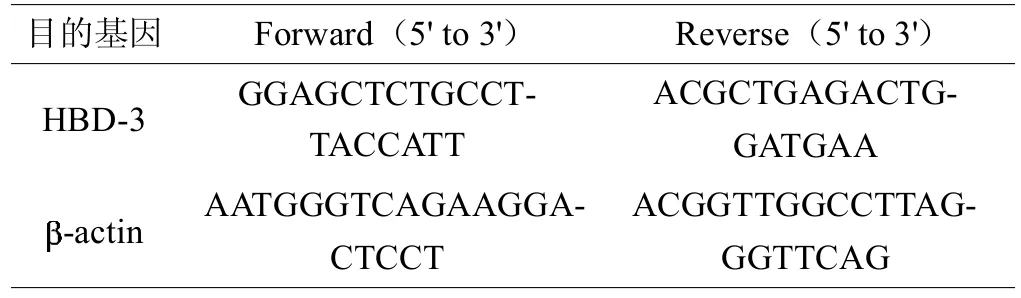
表1 本研究中所用引物的核苷酸序列
1.5 免疫印迹分析(Western blot)
人体标本中提取总蛋白根据试剂盒制造商(ProMabBiotechnologies)的操作手册进行。蛋白质定量根据BCA蛋白测定试剂盒(PierceBiotechnology)进行。每份样品均含蛋白(40 g/Lane),12%聚丙烯酰胺凝胶电泳分离经电转移到PVDF硝酸纤维素膜(Whatman),再用TBST(Tris缓冲溶液含0.1%吐温20)在5%脱脂奶粉中室温封闭1h。然后一抗(HBD-3,1∶300,Novus,NB200-117)浸润4°C过夜,二抗(GoatAntiRabbitIgG/HRP,1∶5000)室温下再孵育1 h。最后,硝酸纤维素膜用化学发光增强,pro4.0凝胶分析仪(Media Cybernetics)分析条带灰度值及IOD,以积分灰度值代表蛋白表达量,每个实验均重复3次[8,9]。
1.6 统计学分析
2 结果
2.1 葡萄球菌感染后假体界膜组织中HBD-3的释放评估
通过Realtime PCR检测发现,假体周围感染后界膜组织中HBD-3 mRNA的表达,明显高于非感染的无菌性松动界膜组织和股骨颈骨折滑膜组织中HBD-3的表达(图1A)。与创伤性滑膜组织相比,细菌感染刺激引起界膜组织中HBD-3的释放增加约5倍以上;与非感染性的无菌性松动界膜组织相比,HBD-3的释放增加约2倍以上(图1B)。免疫组化染色显示局部细菌炎症刺激条件下,与无菌性松动界膜组织相比,细菌性炎症感染将导致界膜组织中的成纤维细胞和成骨细胞分泌HBD-3增加,免疫组化染色强度增强(图2,3,图2彩图见插页)。此外,不同的致病菌种之间,金葡菌与表皮葡萄球菌,没有明显的差异。所有的滑膜组织染色显示,仅仅在成纤维细胞中发现HBD-3的免疫组化染色反应阳性(图2)。如图4所示,通过对HBD-3的浓度分析,可见抗菌肽HBD-3分子量相对应区域中出现单一条带。与非炎症组相比,葡萄球菌在局部定植引起组织中HBD-3蛋白水平显著提高。此外,股骨颈骨折的滑膜组织与无菌性松动的界膜组织之间HBD-3的蛋白水平亦有显著差异。水平以 -actin为内参基因。mRNA表达水平是与对照组的mRNA水平相比,相对的mRNA水平。ELISA显示HBD-3表达的基线水平(B)。细菌性骨感染时,HBD-3分泌水平升高,表明细菌诱导HBD-3分泌增加。数据用均数±标准差(SD)表示。*2组之间的差异有统计学意义,<0.05染(c)。用特异性抗体孵育后,骨折组(a)和无菌性松动组(b)仅显示只有微弱的检测。Western blot定量检测分析 HBD-3蛋白水平的IOD值(B)。不同组的蛋白水平以GAPDH为内参基因。数据用均数±标准差(SD)表示。*2组之间的差异有统计学意义,<0.05
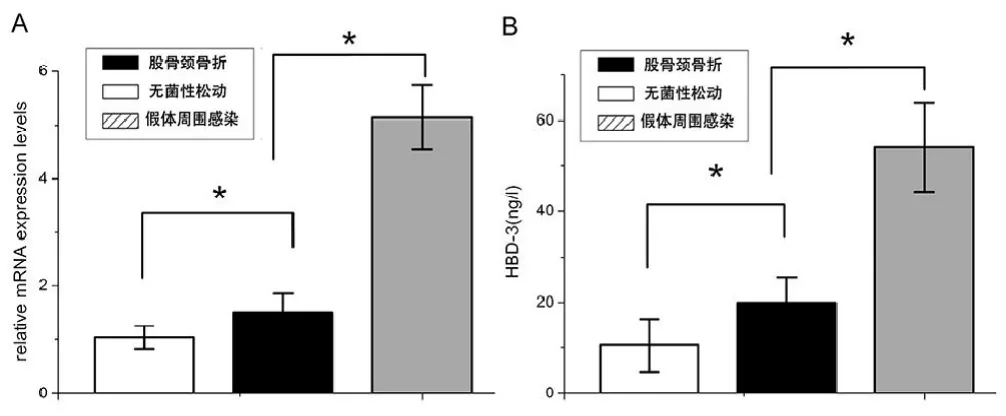
图1Real-time PCR分析HBD-3mRNA的表达(A)。HBD-3的表达
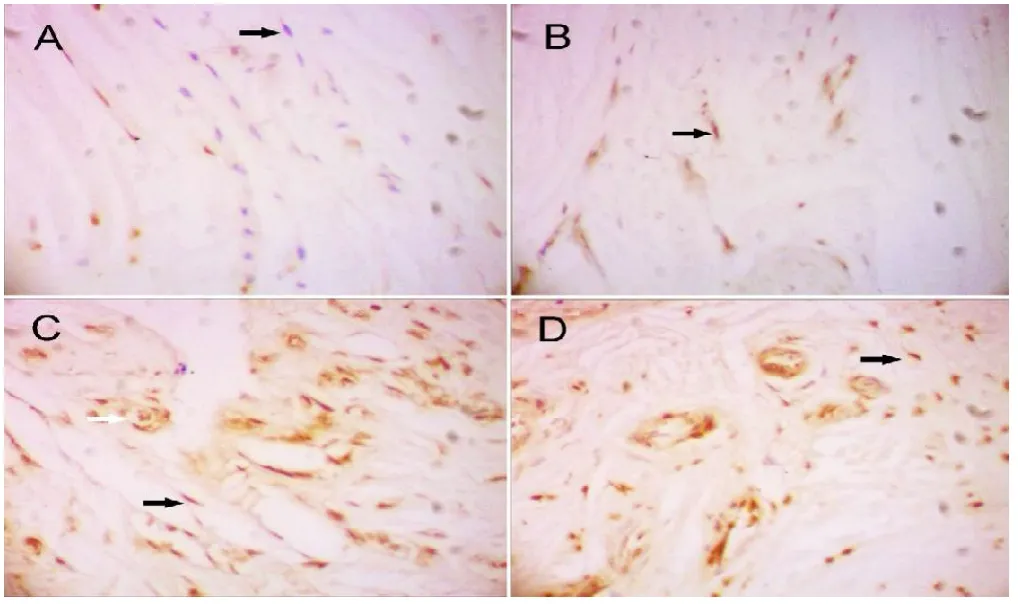
图2 免疫组化分析细菌感染的界膜组织中HBD-3的表达。股骨颈骨折(A),无菌性松动(B)和假体周围感染(C,金黄色葡萄球菌和D,表皮葡萄球菌)显示所有检测的组织样本,均见不同水平的HBD-3分布。免疫组化检测显示,感染的界膜组织样本中HBD-3抗体免疫组化染色反应明显。染色主要发现在成纤维细胞(黑色箭头)和骨细胞(白色箭头)的细胞外基质。原始放大倍数×400
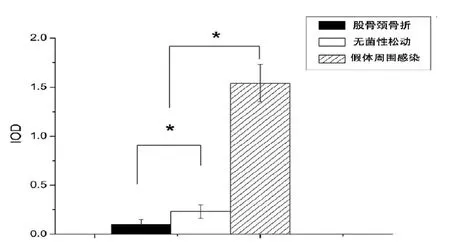
图3 免疫组化染色定量积分光密度值(IOD)分析HBD-3的表达。股骨颈骨折、无菌性松动和假体周围感染的标本进行评估。数据用均数±标准差(SD)表示。*2组之间的差异有统计学意义,<0.05
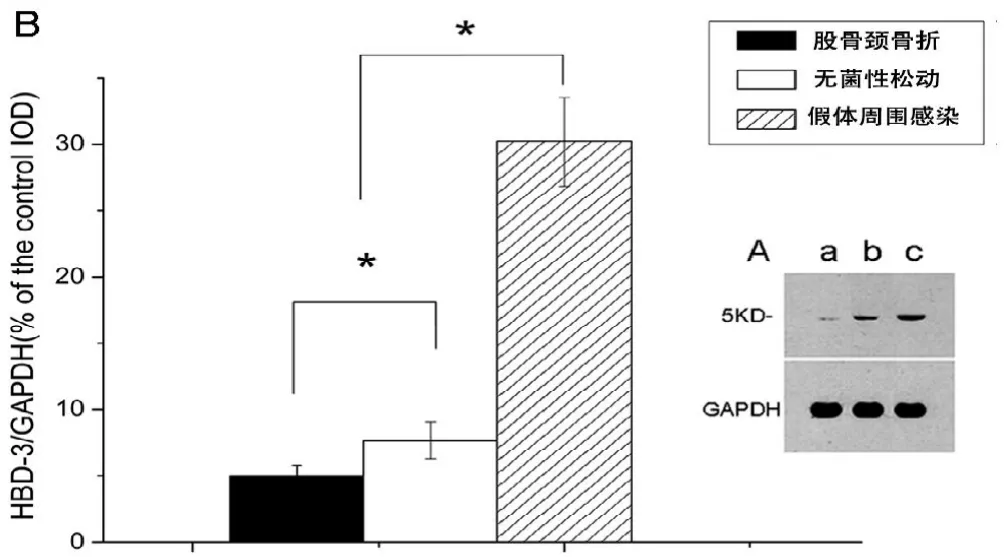
图4 Western blot免疫印迹分析检测感染的界膜组织标本中HBD-3蛋白表达升高(A)。股骨颈骨折(a)、无菌性松动(b)和假体周围感
3 讨论
本研究表明在炎症感染条件下,HBD-3做为人体自身分泌的可诱导的抗菌肽在人工关节假体周围界膜组织中表达增高。以往的研究表明,带正电荷的HBD-3可以较容易的通过静电作用与菌膜表面的负电荷相连接,继而通过膜内分子间的相互位移形成离子性通道,造成细菌膜结构破坏,使细菌失去膜势而死亡[10]。在假体周围感染的界膜组织标本中,采用免疫组化、Realtime PCR、ELISA和Western blot发现,当病原菌金葡菌或表皮葡萄球菌接触成骨细胞及成纤维细胞时,HBD-3表达并上调至较高的水平。与假体周围感染相比,在所有无菌性松动的界膜组织中,HBD-3的表达则明显降低。此外,与感染的界膜组织相比,笔者仅在部分滑膜组织的免疫组化检测中发现HBD-3分布,显示HBD-3的分泌表达与局部菌群的生长状态以及感染的程度密切相关[2,3,8]。以往研究还表明, -防御素还参与宿主先天性免疫和适应性免疫反应的调节。Presicce[11]等人提供的数据也显示,在人单核细胞来源的树突状细胞中,HBD-1具有诱导成熟标志物[例如主要组织相容性复合体(Majorhistocompatibility complex,MHC)II类和CD83]、共刺激标记物(例如CD80,CD86和 CD40)以及促炎症细胞因子(例如 TNF-、IL-6和IL-12p70)表达的能力。Sabag[12]等研究则发现,在大肠杆菌感染的小鼠模型中,HBD-3可以调控CD4+,提高Th1 mRNA的表达,刺激IL12A及IFN分泌,抑制炎症感染的进一步加重。笔者推测,HBD-3可能还具有趋化招募激活白细胞以及APC到炎症感染的部位调节宿主先天性免疫和适应性免疫反应的能力。HBD-3的可诱导性,使HBD-3做为一个炎症感染的免疫学蛋白标记物,成为早期诊断假体周围感染的有力候选者[13]。
本实验研究一个缺陷是,使用新鲜股骨颈骨折的髋关节滑膜标本作为对照组。最理想的对照组界膜组织,应取自关节假体周围无感染或不存在无菌性假体松动的患者;而最理想的对照组滑膜组织,则应取自健康成人的滑膜。然而,正常界膜组织是不容易获得的,因为不存在无菌性假体松动或假体周围感染的全髋关节是很少进行髋关节翻修手术的。同样,从正常髋关节得到滑膜组织的机会也是十分困难的。另一种选择对照组的方法,则是选择新鲜的股骨颈骨折的髋关节滑膜,虽然创伤性滑膜会显示出比正常的滑膜轻微的炎症反应以及水平稍高的促炎细胞因子[14]。更重要的是,与正常滑膜相比,创伤性滑膜可能会减少,而不是增加,界膜和对照组滑膜之间的差异。最近的一项研究发现,急性创伤或多发伤会诱发内源性抗菌肽,包括HBD-3的释放,使伤者血清的抗感染能力比健康人增强[15]。因此,如果正常滑膜作为对照组,界膜和对照组滑膜之间的差异可能增大而不是缩小。虽然本研究的样本数量有限,然而,结果已清楚的表明所有的病例标本中,葡萄球菌感染引起的关节假体周围感染,均诱导界膜中HBD-3表达增高。
炎症性疾病,无论是人工关节假体周围感染或是非感染的无菌性松动,均为临床上关节外科医师面临的突出问题。早期发现、早期诊断及早期鉴别感染性与非感染性疾病,对于尽早预防并发症以及制定合理的治疗方案有重要的意义[16,17]。该研究发现,由于HBD-3具有抗菌作用,其在感染性界膜组织和无菌性松动界膜组织之间表达差异显著。未来,HBD-3一个可行的临床应用,可以通过术中界膜组织的病理活检,来区别人工关节假体周围感染和无菌性松动,以达到术后合理的治疗。由于抗菌肽HBD-3可以选择性地结合到细菌的胞膜表面,另一个较实际的方法,可以通过放射性标记 HBD-3,一个潜在的放射性成像药物,可以在假体周围感染的组织中特异性的放射性核素成像以早期发现和诊断假体周围感染[16,17]。
[1]Lentino JR.Prosthetic joint infections:bane of orthopedists,challenge for infectiousdisease specialists[J].ClinInfect Dis,2003,36 (9):1157-1161.
[2]Warnke PH,Springer IN,Russo PA,et al.Innate immunity in human bone[J].Bone,2006,38(3):400-408.
[3]Menzies BE,Kenoyer A.Signal transduction and nuclear responses in Staphylococcus aureus-induced expression of human betadefensin 3 in skin keratinocytes[J].Infect Immun,2006,74(12): 6847-6854.
[4]Zhu C,Tan H,Cheng T,et al.Human -defensin 3 inhibits antibiotic-resistant Staphylococcus biofilm formation[J].J Surg Res, 2012,183:204-213.
[5]Zhu C,He N,Cheng T,et al.Ultrasound-targeted microbubble destruction enhances human -defensin 3 activity against antibioticresistant staphylococcus biofilms[J].Inflammation,2013,36: 983-996.
[6]Pan X,Mao X,Cheng T,et al.Up-regulated expression of MIF by interfacial membrane fibroblasts and macrophages around aseptically loosened implants[J].J Surg Res,2012,176(2):484-489.
[7]Paulsen F,Pufe T,Conradi L,et al.Antimicrobial peptides are expressed and produced in healthy and inflamed human synovial membranes[J].J Pathol,2002,198(3):369-377.
[8]Zhu C,Qin H,Cheng T,et al.Staphylococcus aureus supernatantinduces the release of mouse -defensin-14 from osteoblasts via the p38 MAPK and NF-B pathways[J].Int J Mol Med,2013,31 (6):1484-1494.
[9]Zhu C,Wang J,Cheng T,et al.The Potential Role of Increasing the Release of Mouse-Defensin-14 in the Treatment of Osteomyelitis in Mice:A Primary Study[J].PLoS One,2014,9(1):86874.
[10]Hoover DM,Rajashankar KR,Blumenthal R,et al.The structure of human beta-defensin-2 shows evidence of higher order oligomerization[J].J Biol Chem,2000,275(42):32911-32918.
[11]Presicce P,Giannelli S,Taddeo A,et al.Human defensins activate monocyte-derived dendritic cells,promote the production of proinflammatory cytokines,and up-regulate the surface expression of CD91[J].J Leukoc Biol,2009,86(4):941-948.
[12]Sabag O,Lorberboum-Galski H.Combining flagellin and human -defensin-3 to combat bacterial infections[J].Front Microbiol, 2014,5:673.
[13]朱晨,方诗元,孔荣,等.超声靶向微泡破坏增强人 -防御素3抑制小鼠体内耐药葡萄球菌生物膜形成[J].生物骨科材料与临床研究,2015,12(5):8-11,15.
[14]WalakovitsLA,Moore VL,Bhardwaj N,et al.Detection of stromelysin and collagenase in synovial fluid from patients with rheumatoidarthritis and posttraumatic knee injury[J].Arthritis Rheum, 1992,35(1):35-42.
[15]Lippross S,Klueter T,Steubesand N,et al.Multiple trauma induces serum production of host defence peptides[J].Injury,2012,43 (2):137-142.
[16]Liberatore M,Pala A,Scaccianoce S,et al.Microbial targeting of 99mTc-labeled recombinant human beta-defensin-3 in an animal model of infection:a feasibility pilot study[J].J Nucl Med,2009, 50(5):823-826.
[17]Lambrecht F,Yilmaz O,Una P,et al.Imaging of bacterial infection with 99m Tc-labeled HBD-1[J].J Radioanal Nucl Ch,2008, 277(3):555-559.
Analysis theexpression ofHuman-defensin-3 inhuman interfacial membranesaround periprostheticjointinfection compared with aseptic loosening
Zhu Chen1,2,KongRong1,Fang Shiyuan1,etal.
1DepartmentofOrthopaedicsSurgery;3 Department of Ultrasound; 4 CentralLab,AnhuiProvincialHospitalofAnhuiMedicalUniversity,HefeiAnhui,230001;2Department ofOrthopaedics, the Nanjing General Hospital of Nanjing Military Command,Nanjing Jiangsu,210002,China
Objective To investigate the expression of Human -defensin-3(HBD-3)in human interfacial membranes around periprosthetic joint infection compared with aseptic loosening and synovial samples of the hip joints under fracture conditions.Methods The tissue samples of interfacial membranes were obtained from the tissues around the femoral implantsin 10 patients whohadundergone revisiontotal hip replacement because of periprostheticjoint infection,10 patients who had undergone revision total hip replacement because of aseptic loosening of implants and 10 patients who underwent primary hip arthroplasty because of the fresh fracture of the femoral neck.The expression and release of HBD-3 was evaluated using ELISA,Real-time PCR,immunohistochemistry analysis and Western blot,then statistical analysis was carried out.Results By real time-PCR,HBD-3 mRNA transcripts were less detected from the non-infectious interfacial membrane in aseptic loosening and the synovial membrane in femoral neck fracture than the interfacial membrane in periprosthetic joint infection.After bacterial challenge,HBD-3 release was increased approximately five fold in infectious tissues compared with the synovial membranes,and more than 2 times compared with the non-infectious interfacial membranes by ELISA analysis.Immunohistochemistry revealed the staining intensity of HBD-3 localized in fibroblasts and osteocytes in inflamed interfacial membranes significantly higher than not inflamed interface membranes.In case of bacterial colonization with staphylococcus,an significant increase in HBD-3 expression compared with not inflamed tissues by Western blot.Conclusion In the study,the significant difference of the expression of HBD-3 which has been found between inflamed interfacial membranes and not inflamed interfacial membranes.In the future,a feasible application of HBD-3 may even help doctors make a distinction between periprostheticjoint infection and aseptic loosening by intraoperative histological biopsy of the interfacial membranes.
-defensin;Bone infection;Drug-resistant staphylococcus;Implant
R318
B
10.3969/j.issn.1672-5972.2016.02.003
swgk2015-12-00256
朱晨(1979-)男,博士,博士后在读,副主任医师。研究方向:关节外科、关节镜外科。
*[通讯作者]方诗元(1964-)男,硕士,教授,主任医师。研究方向:创伤、脊柱外科。
2015-12-18)
国家自然科学基金(No 81401815),中国博士后科学基金(No 2015M582900),江苏省博士后科学基金(No 1501146C)
安徽医科大学附属省立医院1骨一科;3超声科;4中心实验室,安徽合肥230001;2南京军区南京总医院骨科,江苏 南京210002
