地热水中一株好氧反硝化菌的分离鉴定及最优反硝化条件的研究*
2016-03-13张淑楠王心义夏大平于洪飞甄晓歌
张淑楠 王心义,2 夏大平 于洪飞 甄晓歌
(1.河南理工大学资源环境学院,河南 焦作 454000;2.中原经济区煤层(页岩)气河南省协同创新中心,河南 焦作 454000;3.河南理工大学能源科学与工程学院,河南 焦作 454000)
我国华北平原浅层地下水遭受污染的比例已接近1/2,可直接饮用的浅层地下水甚至不足1/4[1],其中尤以“三氮”污染最为严重。深层地下水虽然受污染较轻,但随着开采量的增加,“三氮”含量呈现出进一步升高的趋势[2-4]。因此,深层地下水劣变机制及修复技术的研究成为当今环境、水文地质领域的热门。目前,降低地下水“三氮”含量的方法有物理法、化学法和生物法,其中物理法和化学法(如反渗透法、离子交换法、电渗析法等[5])在生产中应用广泛,但存在处理费用高、生成高浓度含卤废液[6]等缺点。生物法因其具有成本低、操作简单等优点,成为最具发展前景的处理方法[7],其中,自养生物脱氮技术不需添加有机碳源、污泥产量低、发展前景良好,但自养反硝化菌难以培养,且中间产物亚硝态氮易产生积累,目前仍处于实验室研究阶段,未能在工程实例中有效实施[8]。
20世纪80年代,ROBERTSON等[9]首次分离出好氧反硝化菌,打破了反硝化菌只在厌氧条件下生存的传统认识。此后,国内外研究者又陆续分离出多种好氧反硝化菌,主要包括副球菌属(Paracoccussp.)[10]、产碱杆菌属(Alcaligenessp.)[11]、假单胞菌属(Pseudomonassp.)[12]、芽孢杆菌属(Bacillussp.)[13-14]、不动杆菌属(Acinetobacterssp.)[15]等。另有研究得出,菌株的生长环境会不同程度影响菌株的生长状况和反硝化效果[16]42-43。因此,开展生长环境对菌株反硝化效果的研究具有理论价值和实际意义。
本研究从开封市某酒店1 200 m深地热井中抽取地热水(实测温度36.9 ℃,pH 8.16,溶解氧质量浓度2.57 mg/L),筛选得到1株较高效的好氧反硝化菌,在实验室条件下进行生长量和脱氮效率研究。本研究在丰富好氧反硝化菌资源的同时,为富氮地热水原位修复的实际应用提供理论依据。
1 材料与方法
1.1 培养基配制
LB培养基:胰化蛋白胨10 g;酵母提取物5 g;NaCl 10 g;用摩尔浓度5 mol/L的NaOH调节pH至7.0,蒸馏水定容至1 L。
DM基础培养基:KNO30.361 g;K2HPO47.9 g;KH2PO41.5 g;NaCl 0.5 g;MgSO4·7H2O 0.01 g;微量元素溶液2 mL;pH 7.0~7.5;去离子水定容至1 L。碳源根据实验要求进行调整。
BTB培养基:在DM基础培养基上,添加1 mL 1%(质量分数)溴麝香草酚蓝(BTB,溶于酒精)和2.5%(质量分数)琼脂,调节pH 7.0~7.5。
1.2 菌株分离与筛选
将地热水中的细菌在LB培养基上进行富集,并在BTB培养基上涂布培养,然后挑取有蓝色光晕的单菌落在DM基础培养基上划线,分离纯化3次,并测定脱氮效率,选取脱氮效率最高的1株为目的菌株。本研究所有器皿、培养基使用前均在121 ℃下高温灭菌20 min。实验均使用250 mL锥形瓶,培养基量为100 mL,接种量为2%(体积分数)。
1.3 16S rRNA基因序列测定
使用Ezup柱式细菌基因组DNA抽提试剂盒提取16S rRNA基因;采用通用引物27F(引物序列为AGAGTTTGATCCTGGCTCA)和1492R(引物序列为GGTTACCTTGTTACGACTT)对16S rRNA基因进行聚合酶链式反应(PCR)扩增。PCR扩增采用25 μL反应体系,94 ℃预变性5 min,1个循环;94 ℃变性30 s ,56 ℃退火30 s,72 ℃延伸90 s,32个循环;72 ℃延伸10 min。将PCR扩增产物采用1.2%(质量分数)琼脂糖电泳检测、切胶,用胶回收试剂盒进行目的片段的回收,获得纯化的PCR扩增产物。参考T-载体PCR产物克隆试剂盒说明书进行连接与转化。选择在ITPG/X-gal平板上生长的白色菌落,用牙签挑至含氨苄青霉素的液体培养基,37 ℃培养过夜。采用质粒提取试剂盒抽提质粒,以质粒为模板,以27F和1492R为引物进行16S rRNA基因的PCR扩增,采用琼脂糖电泳检测片段大小,选择与16S rRNA基因片段大小相符合的菌液送样,由上海生工生物工程股份有限公司进行测序和拼接。
1.4 脱氮效率与最优条件
1.4.1 脱氮效率测定
分别以KNO3、KNO2为唯一氮源,以柠檬酸钠和琥珀酸钠为碳源,在pH为8.0下接种等量菌液,调节恒温振荡培养箱温度35 ℃、转速120 r/min,每隔2 h检测DM基础培养基中的菌株生长量(利用600 nm波长处的吸光度(OD600)表示)及硝态氮、亚硝态氮浓度(随着OD600及硝态氮、亚硝态氮浓度趋于稳定,检测间隔延长为4 h)。同时以未接种的DM基础培养基作为空白对照,实验设3组平行。
测定方法:硝态氮采用紫外分光光度法测定;亚硝态氮采用N-(1-萘基)-乙二胺偶氮分光光度法测定;TN采用过硫酸钾氧化/紫外分光光度法测定;OD600采用比浊法测定,所用仪器为752型紫外—可见分光光度计;pH、溶解氧采用SX751型多参数测量仪测定。
1.4.2 最优反硝化条件探索
以DM基础培养基为母液,以KNO3为氮源,调整C/N(质量比,下同)为12∶1,分别以柠檬酸钠、琥珀酸钠和甲醇为唯一碳源,考察碳源对筛选菌株的生长量和脱氮效率的影响。此外,考察初始pH、温度、溶解氧浓度(利用恒温振荡培养箱的转速控制浓度)对菌株的生长量和脱氮效率的影响。除考察不同碳源的影响外,其余实验均在碳源为柠檬酸钠和琥珀酸钠下进行;除考察不同初始pH的影响外,其余实验均在pH为8.0下进行;除考察不同温度的影响外,其余实验均在温度为35 ℃下进行;除考察不同溶解氧浓度的影响外,其余实验均设置转速为120 r/min。各实验均设3组空白和3组平行。
2 结果与讨论
2.1 菌株分离与鉴定
经BTB培养基初筛得到3株好氧反硝化菌,其中1株对硝态氮和TN的去除率最高(40 h内对硝态氮和TN的去除率分别为96.10%、90.60%),记为A1。将A1的16S rRNA基因进行PCR扩增,PCR产物连接载体后,得到长度1 511 bp的序列。将所得序列与美国国立生物信息技术中心(NCBI)的序列进行同源性比对,凭借99%的相似性,鉴定A1属于芽孢杆菌属(Bacillussp.)的地衣芽孢杆菌(Bacilluslicheniformis)。
2.2 不同氮源的脱氮效率
2.2.1 氮源种类的影响
以KNO3为唯一氮源时,A1的生长量与脱氮效率变化如图1(a)所示。4 h后,A1进入对数生长期,生长和代谢活动最为活跃,培养基中的硝态氮被大量用于生长并进行反硝化作用,14 h后,硝态氮质量浓度迅速降低至1.19 mg/L,去除率达到97.66%。18 h后,A1进入稳定期,硝态氮去除率接近100.00%。在整个培养过程中,亚硝态氮出现了轻微积累,于8 h时达到峰值3.01 mg/L,随后逐渐降低,最终低于0.10 mg/L。亚硝态氮与硝态氮的消耗不同步,表明A1在以KNO3为氮源时,先将硝态氮还原为亚硝态氮,而亚硝态氮又诱导产生了亚硝酸盐还原酶,从而使亚硝态氮被还原。
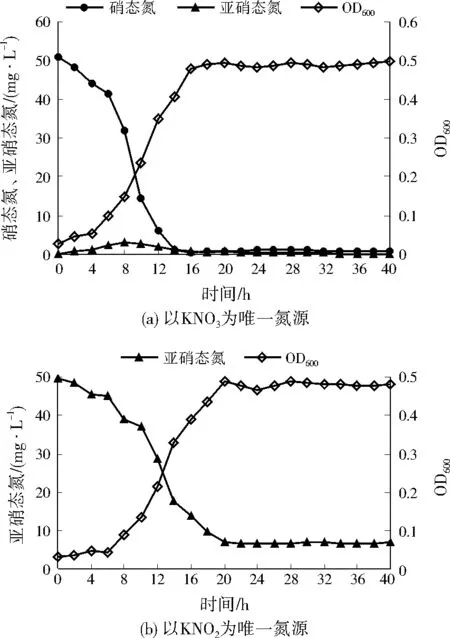
图1 不同氮源下A1的生长量与脱氮效率变化Fig.1 Growth and nitrogen removal rates of A1 under different nitrogen sources
以KNO2为唯一氮源时,A1的生长量与脱氮效率如图1(b)所示。6 h后,A1进入对数生长期,A1的反硝化作用也主要发生在对数生长期。经过反硝化作用,亚硝态氮质量浓度由最初的49.82 mg/L降低到6.91 mg/L,去除率达到86.13%。进入稳定期后,亚硝态氮浓度基本没有变化。
A1分别以KNO3、KNO2为氮源时,均生长良好(分别于4、6 h后进入对数生长期),并具有较高的脱氮效率(对硝态氮、亚硝态氮的去除率分别达到97.66%、86.13%),且对数生长期持续长,说明A1能较好地适应新环境。A1以KNO3为氮源时,进入对数生长期略早于以KNO2为氮源,且脱氮效率也略高于以KNO2为氮源,这是由于硝态氮的氧化还原电位比亚硝态氮高,能被优先利用作为电子受体。
2.2.2 氮源浓度的影响
为考察不同氮源浓度对A1脱氮效率的影响,利用KNO3将硝态氮初始质量浓度分别设置为20、50、80、120 mg/L,接种等量A1,间隔取样检测硝态氮的浓度变化,实验结果如图2(a)所示。由图2(a)可以看出:当硝态氮初始质量浓度分别为20、50、80 mg/L时,A1分别在14、14、16 h时完成反硝化作用;经过A1的反硝化作用,硝态氮质量浓度均低于1.00 mg/L,且出水均未发现亚硝态氮的积累,硝态氮去除率随硝态氮初始浓度的增大而增大。当硝态氮初始质量浓度达到120 mg/L时,A1在36 h时完成反硝化作用,去除硝态氮的速率减慢,说明硝态氮初始浓度过大时,A1的脱氮效率可能受到了抑制。
同样,设置亚硝态氮初始质量浓度分别为20、50、80、120 mg/L,研究不同亚硝态氮初始浓度对A1脱氮效率的影响,结果如图2(b)所示。当亚硝态氮初始质量浓度分别为20、50、80 mg/L时,A1分别在16、16、20 h时完成反硝化作用;经过A1的反硝化作用,亚硝态氮分别稳定在1.14、6.39、7.94 mg/L。当亚硝态氮初始质量浓度达到120 mg/L时,在A1的反硝化作用进行40 h时,亚硝态氮的质量浓度为10.94 mg/L,说明亚硝态氮初始浓度过大时,也可能抑制A1的脱氮效率。
2.3 最优反硝化条件
2.3.1 碳 源
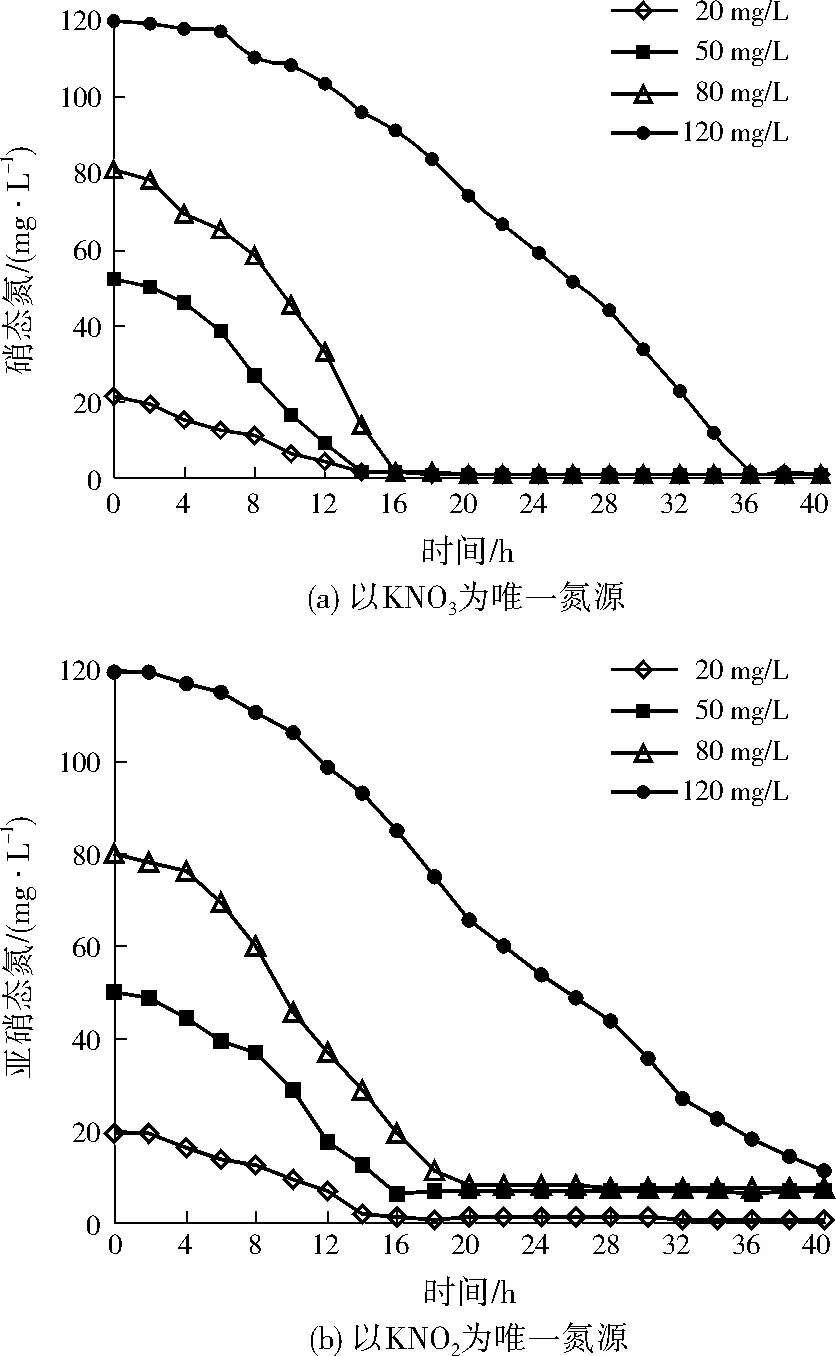
图2 不同氮源下A1的脱氮效率变化Fig.2 Nitrogen removal rates of A1 under different nitrogen source concentrations
不同碳源对A1的生长量以及脱氮效率的影响如图3所示。A1分别以琥珀酸钠、柠檬酸钠和甲醇作为唯一碳源时,分别于4、6、6 h后进入对数生长期,于14、18、20 h后进入稳定期。分别以琥珀酸钠和柠檬酸钠为唯一碳源时,A1的反硝化作用分别在14、16 h后完成,硝态氮去除率分别达到96.10%、96.20%。以甲醇作为唯一碳源时,A1于20 h后完成反硝化作用,所需的反硝化作用时间明显加长,硝态氮去除率为76.17%,去除率也相对偏低。综上可知,琥珀酸钠和柠檬酸钠比甲醇更适合作为A1的碳源,这是由于柠檬酸盐、琥珀酸盐是三羧酸循环中间产物,能被细菌直接利用,同时两者作为有机酸还能增强周质硝酸还原酶的活性[17]。
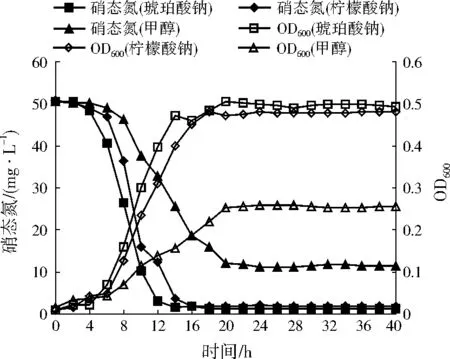
注:硝态氮(琥珀酸钠)、硝态氮(柠檬酸钠)和硝态氮(甲醇)分别表示以琥珀酸钠、柠檬酸钠和甲醇为碳源时的硝态氮浓度;OD600(琥珀酸钠)、OD600(柠檬酸钠)和OD600(甲醇)分别表示以琥珀酸钠、柠檬酸钠和甲醇为碳源时的OD600。
图3不同碳源下A1的生长量与脱氮效率变化
Fig.3 Growth and nitrogen removal rates of A1 under different carbon sources
2.3.2 初始pH
考察初始pH分别为6.0、6.5、7.0、7.5、8.0、8.5时,A1的生长量与脱氮效率变化,结果如图4所示。A1的脱氮效率因初始pH不同而存在差异。pH为6.0时,硝态氮的去除率最低,仅为74.77%;其次是初始pH为6.5、8.5时,硝态氮的去除率分别为79.42%、87.54%;初始pH为7.0~8.0时,硝态氮的去除率约为90%,初始pH为7.5时,硝态氮去除率最大,达到96.25%。TN的去除率变化与硝态氮基本保持一致。pH为8.5时,A1的生长量较小,TN与硝态氮的去除率较为接近,说明此时硝态氮大多被还原为N2,而用于A1生长所需的硝态氮较少。因此,A1的生长和反硝化作用能在较宽的pH范围内进行,中性或偏碱性环境最为适宜。
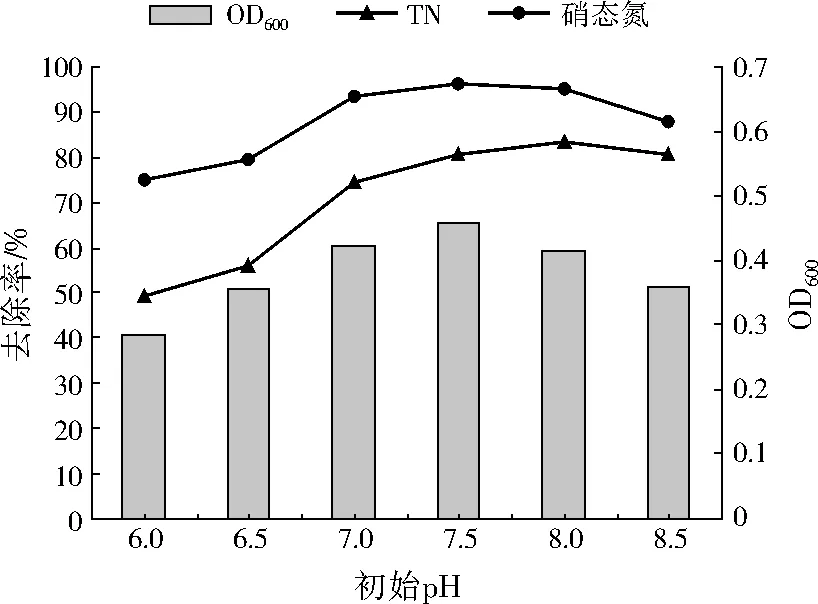
图4 不同初始pH下A1的生长量和脱氮效率变化Fig.4 Growth and nitrogen removal rates of A1 under different initial pH
2.3.3 温 度
为考察不同温度对A1的生长量以及脱氮效率的影响,设置温度分别为25、30、35、40、50 ℃,如图5所示。温度在25~35 ℃时,A1的生长量随温度的升高而增加,在35 ℃时达到最大生长量,此时硝态氮和TN的去除率也达到最大,分别为97.61%、82.98%。温度高于40 ℃时,A1的脱氮效率受到一定程度的抑制,但即便在50 ℃下,A1依然能正常生长,并具有较高的脱氮效率(硝态氮、TN的去除率分别为74.11%、49.50%)。因此,A1是一株耐高温的好氧反硝化菌,可在较宽的温度范围内正常生长并保持较高的脱氮效率。
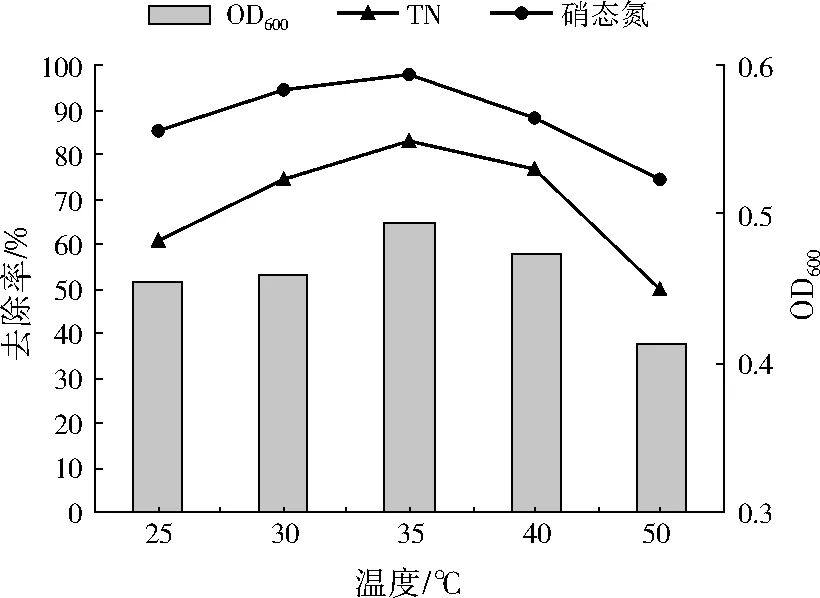
图5 不同温度下A1的生长量和脱氮效率变化Fig.5 Growth and nitrogen removal rates of A1 under different temperatures
2.3.4 溶解氧浓度
设置恒温振荡培养箱转速分别为0、60、100、140、180 r/min(对应的溶解氧质量浓度分别为(0.3±0.1)、(2.7±0.3)、(5.3±0.3)、(6.8±0.2)、(8.1±0.2) mg/L),考察不同溶解氧浓度对A1的生长量以及脱氮效率的影响,结果如图6所示。转速为140 r/min时,硝态氮去除率达到最大值,为96.22%。

图6 不同转速下A1的生长量和脱氮效率的变化Fig.6 Growth and nitrogen removal rates of A1 under different speeds
溶解氧浓度对好氧反硝化菌脱氮效率的影响理论可分为两类:一类是阈值理论[18],即在一定溶解氧浓度范围内,好氧反硝化菌会优先选择氧化还原电位高的O2作为电子受体,脱氮效率受溶解氧浓度的影响极小,但当溶解氧浓度降低到阈值以下时,硝态氮或亚硝态氮逐渐取代O2而成为电子受体,脱氮效率反而随溶解氧浓度降低显著升高。马放等[16]44-45研究发现,菌株Pseudomonaschloritidismutans的脱氮效率与溶解氧浓度的关系正符合该理论;另一类理论认为好氧反硝化菌的脱氮效率在某个溶解氧浓度达到峰值,低于或高于这个溶解氧浓度,脱氮效率均会下降[19],本研究支持该理论。另外,静置培养(转速为0 r/min)时,虽然A1生长量不高,但是硝态氮去除率达到90.22%,说明A1可能是兼性好氧菌,在好氧和厌氧环境中均能发挥反硝化作用。
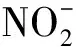
3 结 论
(1) 从开封市某酒店1 200 m深地热井中抽取地热水,筛选得到1株生长良好的高效好氧反硝化菌A1,对A1进行PCR扩增和16S rRNA基因序列测定后,确定为地衣芽孢杆菌(Bacilluslicheniformis)。A1在40 h内对硝态氮、TN的去除率分别达到96.10%、90.60%。
(2) 分别以KNO3和KNO2为氮源时,A1均生长良好并具有较高的脱氮效率,且对数生长期长,能较好地适应新环境。相比亚硝态氮,A1更容易利用硝态氮进行反硝化作用。
(3) A1生长与反硝化的最优条件为:以琥珀酸钠为碳源,初始pH 7.5,温度35 ℃,转速140 r/min。A1是耐高温的反硝化菌,在50 ℃下依然能正常生长并具有较高的脱氮效率。A1又是兼性好氧菌,在厌氧和好养条件下均能发挥反硝化作用。总之,A1生长速度快、适应能力强、脱氮效率高,对于原位修复富氮地热水具有良好的应用价值。但是,各影响因子对A1的交互影响,仍有待进一步的响应面实验。
[1] 环境保护部,国土资源部,住房和城乡建设部,等.华北平原地下水污染防治工作方案[EB/OL].[2015-06-15].http://www.zhb.gov.cn/gkml/hbb/bwj/201304/W0201304263859825 62738.pdf.
[2] ZHAO Li,WANG Xinyi,ZHANG Qing,et al.Study on the transformation mechanism of nitrate in a loose-pore geothermal reservoir:experimental results and numerical simulations[J].Journal of Geochemical Exploration,2014,144:208-215.
[3] 赵丽,王心义,杨英.低温孔隙地热水中铵氮的迁移转化规律研究[J].水土保持学报,2014,28(5):100-104.
[4] 王心义,李任政,张艳欣,等.孔隙地下热水中典型离子运移的异同性研究[J].水文地质工程地质,2015,42(2):156-160.
[5] 田华祥.地下水污染与防治技术综述[J].北方环境,2011,23(12):117-119.
[6] 丁炜,朱亮,徐京,等.好氧反硝化菌及其在生物处理与修复中的应用研究进展[J].应用与环境生物学报,2011,17(6):923-929.
[7] 刘虹,张兰英,刘娜,等.生物可渗透性反应墙修复石油烃污染地下水的效果及微生物多样性研究[J].环境污染与防治,2013,35(3):1-4.
[8] 艾小凡,王鹤立,陈祥龙.地下水硝酸盐污染生物修复中的亚硝态氮积累研究[J].环境工程,2014,32(1):33-36.
[9] ROBERTSON L A,KUENEN J G.Thiospaerapantotrophagen.nov.sp.nov.,a facultatively anaerobic,facuhatively autotrophic sulphur bacterium[J].Journal of General Microbiology,1983,129(8):2847-2855.
[10] SHI Zhuang,ZHANG Yu,ZHOU Jiti,et al.Biological removal of nitrate and ammonium under aerobic atmosphere byParacoccusversutusLYM[J].Bioresource Technology,2013,148(7):144-148.
[11] MAKOTO S,YOICHI I.Heterotrophic nitrification and aerobic denitrification of high-strength ammonium in anaerobically digested sludge byAlcaligenesfaecalisstrain No.4[J].Journal of Bioscience and Bioengineering,2014,117(6):737-741.
[12] WANG Pan,YUAN Yongze,LI Qian,et al.Isolation and immobilization of new aerobic denitrifying bacteria[J].International Biodeterioration & Biodegradation,2013,76(1):12-17.
[13] SONG Zengfu,AN Jian,YANG Xianle,et al.Isolation and characterization of an aerobic denitrifyingBacillussp.YX-6 from shrimp culture ponds[J].Aquaculture,2011,319(1/2):188-193.
[14] 廖小红,汪苹,刁惠芳,等.蜡状芽孢杆菌WXZ-8的异养硝化/好氧反硝化性能研究[J].环境污染与防治,2009,31(7):17-21.
[15] REN Yongxiang,YANG Lei,LIAN Xian.The characteristics of a novel heterotrophic nitrifying and aerobic denitrifying bacterium,AcinetobacterjuniiYB[J].Bioresource Technology,2014,171:1-9.
[16] 马放,王弘宇,周丹丹,等.好氧反硝化菌株X31的反硝化特性[J].华南理工大学学报,2005,33(7).
[17] 赵惊鸿,黄少斌.一株耐高温好氧反硝化菌的筛选及特性研究[J].环境科学与技术,2015,38(1):6-10.
[18] PATUREAU D,BERNET N,DELGENES J P,et al.Effect of dissolved oxygen and carbon-nitrogen loads on denitrification by an aerobic consortium[J].Applied Microbiology & Biotechnology,2000,54(4):535-542.
[19] HUANG H K,TSENG S K.Nitrate reduction byCitrobacterdiversusunder aerobic environment[J].Applied Microbiology & Biotechnology,2001,55(1):90-94.
