CuO/γ-Al2O3非均相过氧化氢催化氧化苯酚的研究*
2016-03-13许杨晨
罗 平 陈 灵 许杨晨 沈 亮
(南京工业大学环境学院,江苏 南京 210009)
CuO/γ-Al2O3非均相过氧化氢催化氧化苯酚的研究*
罗 平 陈 灵 许杨晨 沈 亮
(南京工业大学环境学院,江苏 南京 210009)
研究CuO/γ-Al2O3非均相过氧化氢催化氧化苯酚废水的各种影响因素与动力学规律,结果表明:(1)反应存在最佳pH及过氧化氢加入量(即pH为4~5、过氧化氢加入量为0.097 1 mol/L);温度对苯酚转化速率影响很大,温度升高,苯酚转化速率加快。(2)动力学研究得到CuO/γ-Al2O3非均相过氧化氢催化氧化体系的模型方程,同时得到该反应的活化能为91.84 kJ/mol。
非均相催化氧化 苯酚 反应动力学方程 活化能
苯酚及其衍生物是水体中最常见的污染物,苯酚又是许多大分子芳香族化合物氧化过程的中间产物,大量存在于炼油、煤炭、皮革、油漆、制药和钢铁等工业污水中,它们的毒性很强且难被生物所降解,被列为优先污染物。近年来,对难降解含酚废水的有效处理已成为水处理领域的研究热点[1-6]。催化湿式氧化技术是最有效去除水中有毒、有害、难降解有机物的方法之一。非均相催化氧化苯酚反应是一个非常复杂的过程,受多种因素的影响和制约。近年来,人们针对此类污染物,运用不同催化剂,在不同反应条件下进行了大量实验研究[7-11],但这些研究多在一定的温度、压力下进行。本研究考察了常温常压下,以CuO/γ-Al2O3为催化剂、以过氧化氢为氧化剂,探讨不同条件对苯酚非均相催化氧化的影响,并给出动力学方程,确定反应活化能。
1 实验部分
1.1 催化剂的制备
采用等体积浸渍法制备催化剂。将粒径为60~80目的γ-Al2O3浸入一定量的Cu(NO3)2溶液中,室温(20 ℃左右)浸渍,浸渍后的催化剂样品在100 ℃下恒温干燥12 h。最后,于马弗炉中一定温度下焙烧,制得CuO/γ-Al2O3[12]。
对制得的催化剂通过比表面积测定仪及X射线衍射仪进行表征。结果表明,在一定温度下,CuO物种在γ-Al2O3上处于高分散状态[13]。根据课题组前期制备实验研究,本研究选取700 ℃焙烧、铜负载量为3%(质量分数)的催化剂进行后续实验。
1.2 非均相催化氧化实验
实验配制350 mg/L苯酚溶液为模拟废水,将其置于烧杯中,调节pH,加入一定量催化剂与氧化剂,搅拌,反应,考察溶液中苯酚转化率。
苯酚浓度采用美国Agilent 1100型高效液相色谱测定,色谱分析条件为:色谱柱为ZORBOX Eclipse XDB-C18 4.6 mm×250.0 mm×5 μm;检测器为二极管阵列检测器(DAD),实验选用检测波长为270 nm;流动相为乙腈/水(体积比50∶50)。
苯酚转化率按式(1)计算。
(1)
式中:Xph为苯酚转化率,%;c0、ct分别为起始、t时刻的苯酚质量浓度,mg/L。
2 结果与讨论
以CuO/γ-Al2O3为催化剂的非均相过氧化氢催化氧化机制可以认为:有机物和过氧化氢分子首先扩散到催化剂表面的活性中心被吸附,然后过氧化氢在铜的催化作用下均裂产生·OH,·OH引发自由基反应氧化降解有机物,降解产物从催化剂内表面脱附,扩散到水溶液中[14]。·OH的产生受多种因素的影响和制约,如pH、过氧化氢加入量、污染物起始浓度、温度等。
2.1 pH的影响
在苯酚起始质量浓度为350 mg/L、催化剂加入量为4 g/L、过氧化氢加入量为0.058 2 mol/L、室温的条件下,控制反应中pH保持在3~<4、4~<5、5~<6、6~<7不同范围进行非均相催化氧化实验,考察pH对苯酚转化的影响,结果如图1所示。从图1可以看出,pH对苯酚转化速率有显著影响,在pH为4~5时,苯酚转化速率最快,pH过高或过低都不利于反应的进行。

图1 pH对苯酚转化的影响Fig.1 Effect of the pH on phenol conversion
对比不同pH下的苯酚转化率曲线,可观察到曲线呈现“S”型特征。表明该非均相催化氧化反应是典型的具有诱导期的自由基催化反应[15]。在所有反应中均有诱导期存在,经过诱导期后,进入快速反应阶段,苯酚转化率快速提高。由图1可看出,不同pH条件下,“S”型曲线的诱导期有明显变化,pH为4~5时,诱导期最短,可推断该pH条件最有利于·OH的生成。
在反应过程中发现,溶液的pH在不断变化。开始时溶液pH迅速下降,苯酚转化速率越快,pH下降的起始时间越早,程度越大,需不断补充碱以使溶液保持在一定的pH范围。当反应进行到一定程度后,溶液pH逐渐缓慢上升。这种现象证实了苯酚氧化过程中氧化中间产物中间酸的产生。在苯酚转化的反应过程中,苯酚首先被转化为中间酸,导致溶液pH下降,一段时间以后,中间酸被进一步氧化,由于中间酸难降解,该氧化过程速率较慢,故溶液中pH缓慢上升。
2.2 过氧化氢加入量的影响
在苯酚起始质量浓度为350 mg/L、催化剂加入量为4 g/L、pH为4~5、室温的条件下,考察0.01~0.12 mol/L范围内过氧化氢加入量对苯酚转化的影响,结果见图2。

图2 过氧化氢加入量对苯酚转化的影响Fig.2 Effect of hydrogen peroxide concentration on phenol conversion
若过氧化氢将苯酚完全矿化,其化学计量关系为氧化1 mol苯酚需过氧化氢14 mol,则在本实验中所需过氧化氢理论加入量为0.058 2 mol/L。图2显示,当使用的过氧化氢加入量不小于理论加入量时,270 min时苯酚转化率超过99%;当过氧化氢加入量为0.097 1 mol/L时,99%苯酚转化只需180 min,苯酚转化速率大大提高。当过氧化氢加入量不足时,苯酚转化率较低且反应的诱导期增加。当过氧化氢加入量较低时,随着过氧化氢加入量的增加,苯酚转化率大大提高,这是由于过氧化氢加入量增加使·OH量大大增加的结果。当过氧化氢加入量达到一定程度后,其加入量继续增加,对苯酚转化反应影响不大。0.116 0 mol/L的过氧化氢并没有促进苯酚的降解,这可能是由于过量过氧化氢的存在导致HO2·产生,HO2·反应活性较低,无法氧化降解苯酚。因此,最佳过氧化氢加入量为0.097 1 mol/L。
2.3 苯酚起始浓度的影响
在催化剂加入量为4 g/L、pH为4~5、过氧化氢加入量为0.330 0 mol/L、室温的条件下,考察苯酚起始浓度对苯酚转化的影响,结果见图3。由图3可以看出,不同苯酚起始质量浓度的苯酚转化率均可达到99%以上。尽管CHOU等[16]与DUBEY等[17]均有报道,在非均相催化氧化反应过程中,高浓度有机物会阻碍自由基氧化。但在本实验中,制备的催化剂活性没有随着苯酚起始浓度的增加而降低,苯酚起始浓度增加,其在氧化过程中对催化剂表面自由基的抑制不显著。

图3 苯酚起始质量浓度对苯酚转化的影响Fig.3 Effect of the intial phenol concentration on phenol conversion
2.4 温度的影响
在苯酚起始质量浓度为350 mg/L、催化剂加入量为4 g/L、过氧化氢加入量为0.058 2 mol/L、pH为4~5的条件下,考察温度对苯酚转化的影响,结果见图4。由图4可以看出,随着温度的增加,苯酚转化反应的诱导期缩短,苯酚转化速率加快。
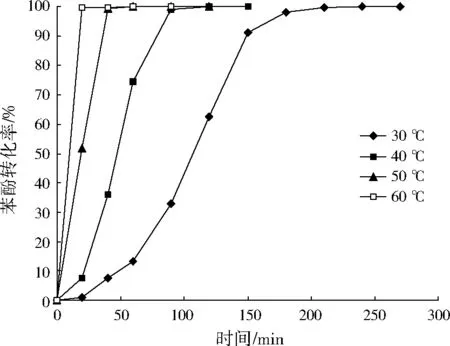
图4 温度对苯酚转化的影响Fig.4 Effect of reaction temperature on phenol conversion
2.5 苯酚非均相催化氧化
在苯酚起始质量浓度为350 mg/L、催化剂加入量为4 g/L、过氧化氢加入量为0.058 2 mol/L、pH为4~5、室温的条件下,以COD去除率为指标,考察非均相催化氧化反应对苯酚的矿化效果。由图5可以看出,随着时间的延长,COD去除率逐渐增加,480 min时COD去除率达到69%。在反应过程中发现,反应溶液颜色先由清彻透明逐渐变为棕褐色,随着反应的进行,棕褐色再渐渐变淡,表明溶液中有中间产物醌类物质的生成,与文献[18]报道一致。该文献认为,苯酚在反应中首先被氧化为氢醌和儿茶酚,然后被氧化为o-苯醌、p-苯醌,最后中间产物进一步被氧化。
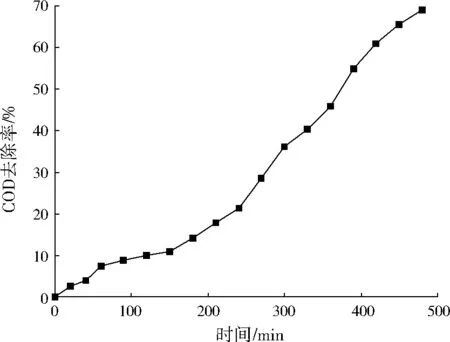
图5 苯酚的非均相催化氧化反应Fig.5 Catalytic oxidation reaction on phenol
根据课题组前期实验,将3次使用过的催化剂通过700 ℃灼烧再生使用,COD去除率最终仍可达62%,催化剂活性基本可恢复原有水平,催化剂的稳定性较好[19]。
2.6 动力学研究
参照非均相高温高压湿式催化氧化(CWAO)的动力学模型[20],采用指数型经验模型对苯酚转化过程进行拟合:
(2)
式中:rph为苯酚转化速率,mmol/(L·min);Cph为水样中苯酚摩尔浓度,mmol/L;t为时间,min;k为反应系数,mmol1-a-b/(L1-a-b·min);CH2O2为水样中过氧化氢摩尔浓度,mmol/L;a、b为反应级数。
在一定温度下,k为常数,对式(1)两边取对数可得:

(3)



表1 不同T下的k
(4)
研究温度对苯酚转化速率的影响,即温度对k的影响。则式(4)转化为:
(5)
对式(5)两边积分,以Cph-t作图,可得一直线。通过直线的斜率可计算出绝对温度(T,K)下的k,结果见表1。
根据表1,以lnk-1/T作图,结果如图6所示。lnk与1/T的关系接近直线,说明k与T的关系符合Arrhenius关系。由直线的斜率可求出反应的活化能为91.84 kJ/mol。

图6 lnk与1/T的关系Fig.6 Effect of reaction temperature on the rate constant
3 结 论
(1) 苯酚非均相催化氧化反应是具有诱导期的自由基催化反应;反应过程存在最佳pH及过氧化氢加入量(即pH为4~5、过氧化氢加入量为0.097 1 mol/L);不同起始浓度的苯酚均可以被完全降解;温度对苯酚转化速率影响很大,温度升高,苯酚转化速率加快。

[1] CHOWDHURY P,MOREIRA J,GOMAA H,et al.Visible-solar-light-driven photocatalytic degradation of phenol with dye-sensitized TiO2:parametric and kinetic study[J].Ind. Eng. Chem. Res.,2012,51(12):4523-4532.
[2] LEFEVRE S,BOUTIN O,FERRASSE J H,et al.Thermodynamic and kinetic study of phenol degradation by a non-catalytic wet air oxidation process[J].Chemosphere,2011,84(9):1208-1215.
[3] PIWOWAR K,BLACHA GRZECHNIK A,BERNAS P,et al.Phenol degradation in heterogeneous system generating singlet oxygen employing light activated electropolymerized phenothiazines[J].Applied Surface Science,2015,359:426-431.
[4] 张峰,李文奇,冯传平,等.光催化电化学联合降解水中苯酚的研究[J].环境工程学报,2011,5(10):2161-2166.
[5] 伍波,李鹏,张波,等.负载型粒子电极电催化氧化苯酚的研究[J].中国环境科学,2015,35(8):2426-2432.
[6] 张则光,马岩龙,叶世超.膜分散萃取法处理含酚废水的实验研究[J].现代化工,2011,31(3):37-39.
[7] FU Dongmei,ZHANG Feifang,WANG Lianzhi,et al.Simultaneous removal of nitrobenzene and phenol by homogenous catalytic wet air oxidation[J].Chinese Journal of Catalysis,2015,36(7):952-956.
[8] 姜勇,解强,张婷婷.活性炭载体对TiO2/AC光催化降解苯酚影响研究[J].工业水处理,2011,31(8):28-31.
[9] 万家峰,王海涛,高铭晶,等.Fe2O3/γ-Al2O3催化剂用于降解苯酚的非均相Fenton反应研究[J].化工环保,2012,32(2):28-31.
[10] HARTMANN M,KULLMANN S,KELLER H.Wastewater treatment with heterogeneous Fenton-type catalysts based on porous materials[J].J. Mater. Chem.,2010,20(41):9002-9017.
[11] 高晓明,付峰,吕磊.自制Cu-Bi2WO6的表征及其对苯酚的光催化降解[J].化工环保,2012,31(2):181-184.
[12] 罗平,徐南平.铜系催化剂的研制及其在H2O2催化氧化中的应用研究[J].水处理技术,2006,32(12):44-46.
[13] 罗平,范益群.CuO/γ-Al2O3的制备及其湿式催化氧化性能研究[J].环境工程学报,2009,3(5):782-786.
[14] 何莼,奚红霞,张娇,等.沸石和活性炭为载体的Fe3+和Cu2+型催化剂催化氧化苯酚的比较[J].离子交换与吸附,2003,19(4):289-296.
[15] ARENA F,GIOVENCO R,TORRE T,et al.Activity and resistance to leaching of Cu-based catalysts in the wet oxidation of phenol[J].Applied Catalysis B:Environmental,2003,45(1):51-62.
[16] CHOU B,TSAI J L,CHENG S.Cu-substituted molecular sieves as liquid phase oxidation catalysts[J].Microporous and Mesoporous Materials,2001,48(1/2/3):309-317.
[17] DUBEY A,RIVES V,KANNAN S.Catalytic hydroxylation of phenol over ternary hydrotalcites containing Cu,Ni and Al[J].Journal of Molecular Catalysis A:Chemical,2002,181(1/2):151-160.
[18] ZRNCEVIC S,GOMZI Z.CWPO:an environmental solution for pollutant removal from wastewater[J].Ind. Eng. Chem. Res.,2005,44(16):6110-6114.
[19] 罗平,范益群.双氧水催化氧化中Cu/γ-Al2O3催化剂的稳定性研究[J].环境工程学报,2011,5(8):1745-1749.
[20] LIOU R M,CHEN S H,HUNG M Y,et al.Fe(Ⅲ) supported on resin as effective catalyst for the heterogeneous oxidation of phenol in aqueous solution[J].Chemosphere,2005,59(1):117-125.
StudyonphenoldegradationbyCuO/γ-Al2O3heterogeneoushydrogenperoxidecatalyticoxidationprocess
LUOPing,CHENLing,XUYangchen,SHENLiang.
(CollegeofEnvironment,NanjingTechUniversity,NanjingJiangsu210009)
The various factors and dynamics in heterogeneous CuO/γ-Al2O3hydrogen peroxide catalytic oxidation were investigated by using phenol as target organic. The results showed that there was an optimum pH (4-5) and optimal H2O2concentration (0.097 1 mol/L) in the catalytic oxidation reaction. The oxidation temperature had great influence on reaction rate,which accelerated the reaction rate by the increase of the temperature. The kinetics model equation in catalytic oxidation system with heterogeneous CuO/γ-Al2O3catalysts was acquired. The activation energy (91.84 kJ/mol) was calculated meanwhile.
heterogeneous catalytic oxidation; phenol; kinetics model equation; activation energy
罗 平,女,1973年生,硕士,副研究员,主要从事污染治理与资源化方面的研究工作。
*国家“863计划”项目(No.2012AA03A606)。
10.15985/j.cnki.1001-3865.2016.12.002
编辑:黄 苇 (
2016-06-21)
