纤维素降解真菌DF14101的筛选与鉴定
2016-03-08邹潇潇易子霆孙前光鲍时翔黄惠琴
邹潇潇, 易子霆,2, 孙前光, 鲍时翔, 黄惠琴*
(1.中国热带农业科学院 热带生物技术研究所,海南 海口 571101;2.海南大学 环境与植物保护学院,海南 海口 570228)
纤维素降解真菌DF14101的筛选与鉴定
邹潇潇1, 易子霆1,2, 孙前光1, 鲍时翔1, 黄惠琴1*
(1.中国热带农业科学院 热带生物技术研究所,海南 海口 571101;2.海南大学 环境与植物保护学院,海南 海口 570228)
纤维素是植物细胞壁的主要成分,也是人类宝贵的天然可再生资源之一。由于纤维素不易降解,严重限制了生物质废弃物中纤维素的有效利用。从海口、儋州、屯昌市郊的森林、农田以及香蕉园采集土壤和腐烂秸秆样品中,筛选获得1株产纤维素酶能力较强的真菌DF14101。在以香蕉秸秆粉为碳源的培养基中,28 ℃、180 r/min培养5 d时,该菌株发酵液的内切葡聚糖酶酶活(CMCase)为43.98 U/mL,滤纸酶活(FPA)为14.05 U/mL。结合形态学特征和ITS序列系统发育分析结果,将该菌株鉴定为草酸青霉(Penicilliumoxalicum)。
纤维素酶;筛选;鉴定;草酸青霉
纤维素是植物细胞壁的主要成分,自然界每年通过光合作用合成的纤维素超过1 000亿t[1],是人类宝贵的天然可再生资源之一。但由于纤维素的理化性质非常稳定,自然条件下难以降解,严重限制了生物质废弃物中纤维素的有效利用。纤维素由吡喃型D-葡萄糖以β-1, 4糖苷键结合而成。纤维素酶是降解β-1, 4-糖苷键的酶类的总称,包括内切葡聚糖水解酶、外切葡聚糖水解酶和β-葡萄糖苷酶等组分[2-3]。纤维素酶来源广泛,自然界中的细菌、真菌、放线菌等微生物都具有产生纤维素酶的种类[4]。相对于细菌和放线菌,真菌具有生长速度快、产纤维素酶活性高、酶系组成全面等优点,而且在生长过程中真菌菌丝的穿透作用会对作物秸秆造成机械破坏效果;同时,真菌还可以分泌大量胞外酶降解纤维素,这些特性使得产纤维素酶真菌被广泛应用于工业生产。海南省位于我国最南端,属热带季风性气候,常夏无冬,光照充足,雨量充沛。特殊的热带生态环境蕴藏着丰富的微生物资源,其中不乏产纤维素酶能力强的微生物。此外,海南省也是我国高效农业和海洋生产大省,每年产生的农作物和大型海藻类生物质废弃物数量相当可观,这些都是纤维素的宝贵来源。但长期以来,大量的农业废弃物和海藻藻体废弃物多以焚烧或堆积于田间、滩头的方式进行处理,不仅对周边环境造成了污染,也是资源的极大浪费。如果可以提高纤维素的降解效率,不但可以解决环境污染问题,还有利于改善农村生态环境、增加农民收入,具有良好的经济、社会和生态效益。因此,本研究旨在从海南丰富的热带微生物资源中筛选出产纤维素酶能力强的真菌,为纤维素的可再生利用奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品来源 从海口、儋州、屯昌市郊的森林、农田以及香蕉园采集土壤和腐烂秸秆,置于洁净塑料袋,及时带回实验室进行菌株分离,剩余样品置4 ℃冰箱保存备用。
1.1.2 培养基 CMC-Na(羧甲基纤维素钠)琼脂培养基:(NH4)2SO42.0 g,MgSO4·7H2O 0.5 g,KH2PO41.0 g,NaCl 0.5 g,CMC-Na 20.0 g,pH 7.2,琼脂20.0 g ,蒸馏水1 000 mL。加入青霉素、链霉素使终浓度为100 U/mL,以抑制细菌生长,便于真菌分离。滤纸条培养基:(NH4)2SO41 g,KH2PO41 g,MgSO4·7H2O 1.7 g,NaCl 0.5 g,蒸馏水1 000 mL。向试管中加入培养基5 mL,并垂直放入瓦特曼滤纸(6 cm×1 cm),部分露出液面。液体发酵培养基:香蕉秸秆粉 30 g,(NH4)2SO41.4 g,KH2PO42.0 g,CO(NH2)20.3 g,CaCl20.3 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 5.0 mg,ZnSO4·7H2O 1.4 mg,MnSO4·H2O 1.6 mg,CoCl22.0 mg,pH 7.2,蒸馏水1 000 mL。PDA培养基:称取200 g去皮的马铃薯切块,加水煮沸20~30 min,过滤,定容至1 000 mL,加入葡萄糖 20 g,琼脂20 g。
1.2 方法
1.2.1 产酶菌株的初步筛选 称取样品5 g,磨碎后加入45 mL灭菌水,充分震荡20 min,制备成样品原液。梯度稀释后涂布于羧甲基纤维素钠(CMC-Na)琼脂平板,28 ℃倒置培养3~5 d。挑取生长快、菌落形态不同的真菌进行划线纯化后,点接到新的CMC-Na琼脂平板,28 ℃倒置培养5 d,用0.1%刚果红染液对培养平板染色,再用1 mol/L NaCl溶液进行脱色[5],测量并计算透明水解圈与菌落直径比值(Hc)。同时将菌株接种到放置于滤纸条培养基中的滤纸条上(露在上面部分),28 ℃、180 r/min培养5 d,观察滤纸条的溃烂程度。选择透明水解圈/菌落直径比大、滤纸溃烂程度高的菌株进行复筛。
1.2.2 产酶菌株的复筛 将初筛得到的活性菌株接种到以香蕉秸秆粉为碳源的液体发酵培养基中,接种量为2%。180 r/min、28 ℃培养5 d后,取发酵液,4 000 r/min离心10 min,测上清液(初酶液)的羧甲基纤维素(CMC)酶活、滤纸纤维素(FPA)酶活[6]。①羧甲基纤维素(CMC)酶活的测定:取0.5 mL粗酶液,加入2 mL 1% CMC溶液(溶于pH 6.8 磷酸盐缓冲液),50 ℃恒温水浴60 min。加入1.5 mL DNS试剂,混合均匀,置于沸水浴中加热10 min。冷却后用蒸馏水稀释至25 mL。空白对照测定时,取0.5 mL粗酶液,先加DNS试剂1.5 mL,后加2 mL 1%CMC溶液,其余步骤相同。540 nm波长测定其吸光值,测量3次取平均值。②滤纸纤维素(FPA)酶活的测定:取0.5 mL粗酶液,在试管中加入2 mL pH 6.8 磷酸盐缓冲液和1条1.0 cm×6.0 cm去淀粉处理的定性滤纸,50 ℃恒温水浴60 min。加入1.5 mL DNS试剂,混合均匀,置于沸水浴中加热10 min。冷却后用蒸馏水稀释至25 mL。空白对照测定时,取0.5 mL粗酶液,先加DNS试剂1.5 mL,再加2 mL pH 6.8磷酸盐缓冲液和定性滤纸,其余步骤同上。540 nm波长测定吸光值,测量3次取平均值。酶活定义:在反应温度50 ℃、pH 4.8的条件下,1 mL酶液在1 min内使底物产生1 μg葡萄糖所需酶量定义为一个酶活单位(U/mL)。
1.2.3 真菌菌株降解香蕉秸秆实验 将真菌菌株接种于以香蕉秸秆为唯一碳源的液体发酵培养基,接种量2%,摇瓶培养16 d,称取残留物质干重,并计算测量香蕉秸秆干重的失重率:失重率(%)=(Mck-M)/M×100%,其中,Mck:对照发酵后香蕉秸秆干重(g);M:处理的样品发酵后香蕉秸秆干重(g)。
1.2.4 菌株分类鉴定 ①形态鉴定:将菌株点接到PDA固体培养基上,28 ℃培养,观察菌落形态。待菌株产孢后挑取菌体于载玻片上,用棉兰染液染色后置于显微镜下观察。菌株形态鉴定参照文献[7-8]提供的方法进行。②ITS序列测定及其系统发育分析:利用TIANGEN公司的基因组DNA提取试剂盒提取菌株基因组DNA,以提取的DNA为模板,扩增菌株的ITS序列,引物为Pf(5′-AACCTGGTTGATCCTGCCAGT-3′)、Pr(5′-CGACGGGCGGTGTGTAC-3′)[9]。PCR产物经1%琼脂糖凝胶电泳检测,合格样品送上海生工生物工程有限公司测序。将测得序列于NC-BI中进行BLAST比对(http://ncbi.nlm.nih.gov/blast),选取同源性高的菌株序列利用Clustal X2.1进行多序列比对,在MEGA 5.0软件中采用Neighbor-Joining法构建进化树[10]。
2 结果与分析
2.1 菌株的筛选
利用CMC-Na固体培养基从采集的样品中分离到104株具有纤维素降解能力的真菌,其中40株透明水解圈/菌落直径(Hc)在1.30~2.85之间,相对酶活较高,用于进一步液体发酵产酶复筛。通过液体产酶复筛获得5株FPA、CMC酶活较高的真菌(表1)。其中,菌株DF14101的两种酶活力均较高,其发酵液的CMC酶活力为43.98 U/mL、FPA酶活力为14.05 U/mL。观察滤纸条降解情况,发现滤纸条被折断,降解程度较高。
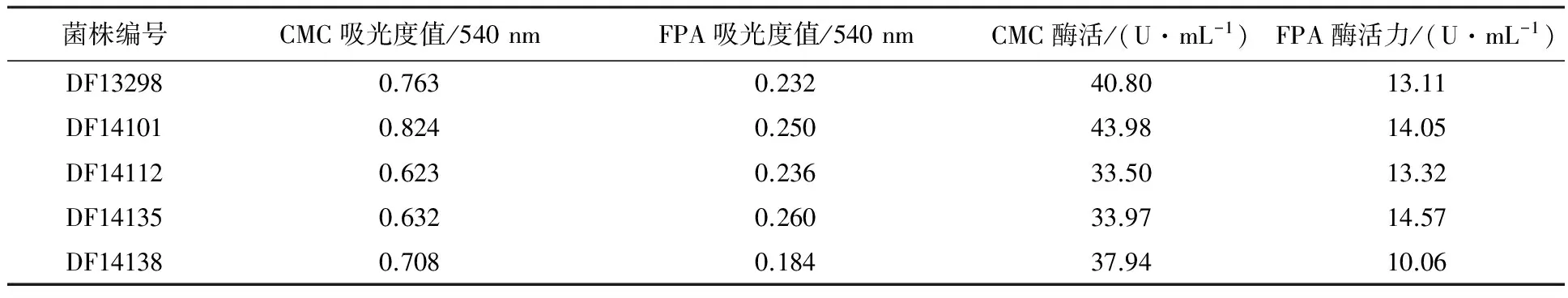
表1 菌株发酵液纤维素酶活力
2.2 菌株DF14101降解秸秆能力测试
通过产纤维素酶真菌的初筛和复筛,发现菌株DF14101产CMC和FPA酶能力均较强,为进一步验证该菌株降解秸秆的能力,将菌株DF14101接种到以香蕉秸秆为唯一碳源的液体发酵培养基中,摇瓶培养16 d,测量香蕉秸秆干重的失重率。以未接种产纤维素能力的菌株为对照。实验结果表明,菌株DF14101发酵后,香蕉秸秆干重的失重率达29.18%(表2),说明该菌株具有较好的秸秆降解的能力。
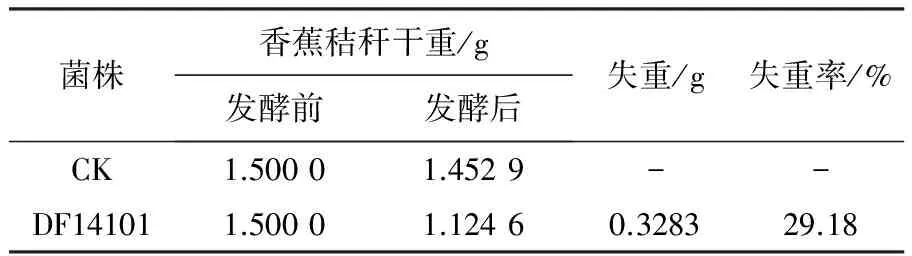
表2 降解秸秆实验
2.3 菌株DF14101的分类鉴定
2.3.1 形态特征 菌株DF14101在蛋白质、PDA培养基上生长迅速,初生菌丝白色,菌落蓝绿色,培养后期有水滴渗出,大量产孢,无可溶性色素。帚状枝单轮生,较紧密;分生孢子椭圆形、链状(图1)。根据菌落特征和显微结构特征,初步鉴定DF14101隶属于半知菌纲、丛梗孢目、丛梗孢科、青霉属。
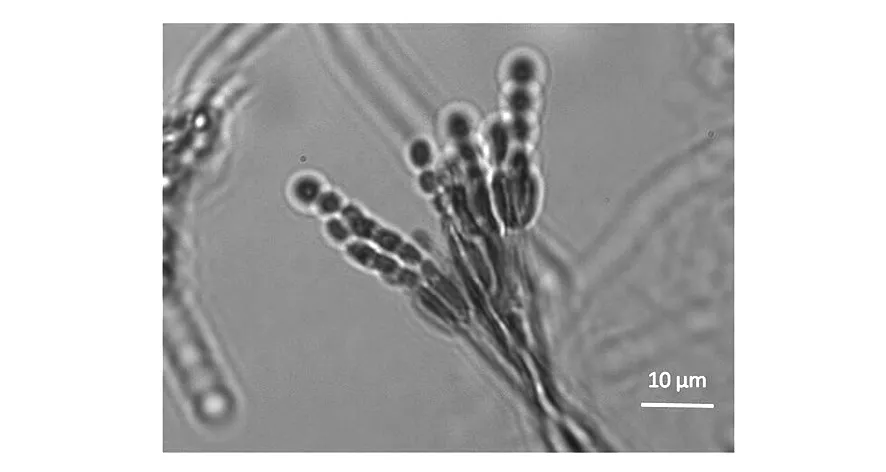
图1 菌株DF14101的产孢结构Fig.1 Sporogenous structure of strain DF14101
2.3.2 ITS序列测定及其系统发育分析 通过测序获得菌株DF14101的ITS序列为533 bp,将所得ITS序列提交至GenBank数据库进行BLAST同源性比对,结果显示,与菌株同源性高的菌株均为青霉属,与PenicilliumoxalicumB7(JN676114)同源性最高,ITS序列相似性达100%。选择同源性较高的相关菌株在MEGA5.0中利用Neighbor-joining法构建系统发育树(图2),菌株DF14101与P.oxalicum的菌株处在同一分支,表明它们的亲缘关系最近。对菌株DF14101与P.oxalicumB7的形态进行比较,发现它们的特征基本一致:菌丝、分生孢子梗有横隔,光滑,基部无足细胞,顶端不形成膨大的顶囊,分生孢子梗不对称分支、扫帚状,分生孢子椭圆形,光滑。因此,结合菌株形态特征和ITS系统发育分析,鉴定菌株DF14101为Penicilliumoxalicum(草酸青霉)。
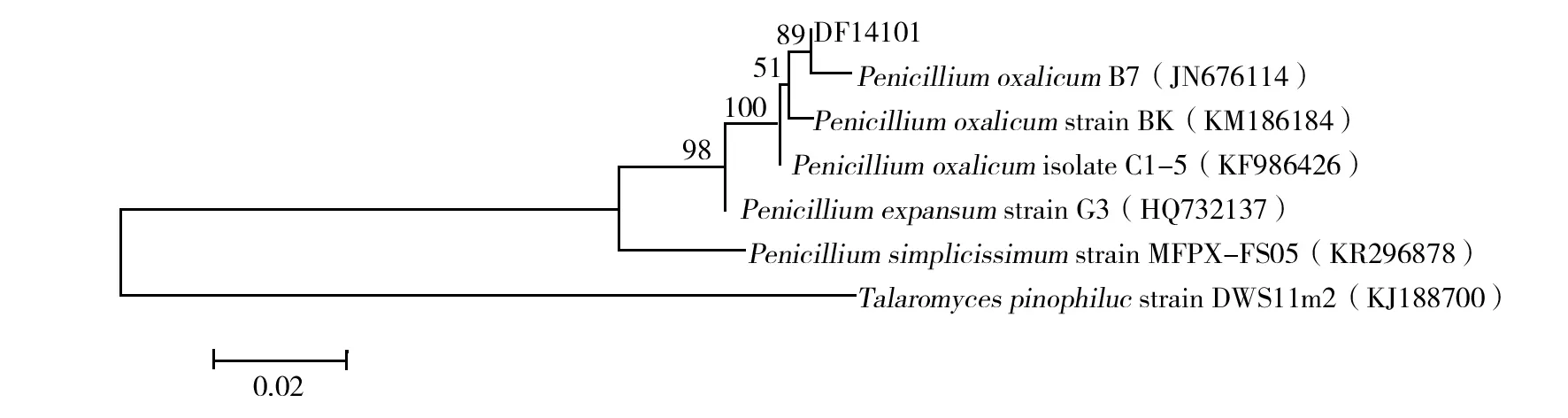
图2 基于ITS序列构建的DF14101菌株与相关菌株的系统发育树Fig.2 Phylogenetic tree of stain DF14101 and related strains based on ITS sequences
3 讨 论
纤维素酶来源广泛,自然界中很多微生物都能产生纤维素酶。虽然从各种自然环境中分离到了大量的产纤维素微生物,但它们普遍酶活力低,酶系组成不全,不能用于工业生产[11]。因而,产纤维素酶微生物的筛选是生物法降解纤维素的首要问题。透明水解圈法是分离纤维素菌株的常用方法[12-13],产酶愈多,透明水解圈愈大;产酶越快,透明水解圈出现越早。该方法因观察方便而得到广泛应用。本研究中首先用CMC-Na固体培养基对产纤维素酶真菌进行快速筛选,结合透明水解圈法测定了各菌株纤维素酶的相对酶活,为避免漏掉那些产酶量小但酶活高的菌株,实验中还测定了菌株对滤纸条的降解率,结合两种方法筛选到40株相对酶活较高的菌株。通过液体发酵对产酶菌株进行复筛,获得了最优菌株DF14101。
传统的真菌鉴定以形态鉴定为主,但由于形态描述具有主观性,缺乏统一标准,不同培养条件对真菌形态也有影响,对形态鉴定造成了一定的困扰。因此,研究者在形态鉴定的同时,又引入了分子鉴定的手段。本研究结合形态鉴定和分子鉴定两种手段,将菌株DF14101鉴定为草酸青霉。
目前广泛应用的产纤维素酶真菌有木霉(Trichderm)、曲霉(Aspergillus)、青霉(Penicillium)、根霉(Rhizopus)等[4]。其中,里氏木霉(Trichodermareesei)因具有产生大量纤维素酶的能力而得到广泛地研究和应用[14],但其产生的β-葡萄糖苷酶的活力很低,限制了其对纤维素的降解效率。研究发现,青霉能分泌较全的降解纤维素的聚糖酶系。与木霉相比,青霉能产生较多的β-葡萄糖苷酶,且其生长速度也比木霉快[15-16],因而青霉具有明显的商业价值和应用潜力。当前研究较多的降解纤维素青霉有斜卧青霉(P.decumbens)、绳状青霉(P.funiculosum)和微紫青霉(P.janthinellum)等[17-20],但是对草酸青霉的研究报道很少。因此,本研究筛选和鉴定出的草酸青霉高活性产纤维素酶菌株,为农业生物质废弃物和大型海藻中纤维素的有效降解提供了新的菌种资源。
[1] Zhang Y H P, Himmel M E, Mielenz J R. Outlook for cellulose improvement: Screening and selection strategies[J]. Biotech Adv, 2006, 24(5):452-481.
[2] 陈燕勤,毛培宏,曾宪贤. 细菌纤维素酶结构和功能的研究[J]. 化学与生物工程, 2004, 21(6):4-6.
[3] 吴显荣,穆小民. 纤维素酶分子生物学研究进展及趋向[J]. 生物工程进展, 1994, 14(4): 25-27.
[4] 张传富,顾文杰,彭科峰,等. 微生物纤维素酶的研究现状[J]. 生物信息学, 2007, 5(1): 34-36.
[5] 高建民,翁海波,席宇,等. 一株嗜热嗜酸纤维素酶高产霉菌分离鉴定及其酶学性质研究[J]. 微生物学通报, 2007, 34(4): 715-718.
[6] Coward-Kelly G, Aiello-Mazzari C, Kim S, et al. Suggested improvements to the standard filter paper assay used to measure cellulose activity[J]. Biotechnol Bioeng, 2003, 82(6): 745-749.
[7] 戴芳澜. 真菌的形态和分类[M]. 北京:科学出版社,1987.
[8] 魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979.
[9] 吴碧文,胡永华,方哲,等. 抗MRSA海绵真菌的分离及菌株W0707的鉴定[J]. 中国海洋药物, 2006, 25(1): 39-43.
[10]Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees[J]. Mol Biol Evol, 1987, 4(6): 406-425.
[11]蒋倩婷,宋斌,闫文娟. 产纤维素酶菌株选育技术研究进展[J]. 江苏农业科学, 2011, 39(6): 584-587.
[12]Herdrick CW, Doyle D, Hugley B. A new solid medium for enumerating cellulose-utilizing bacteria in soil[J].Appl Environ Microb, 1995, 61(5): 2016-2019.
[13]高榕,邓迎达. 高生产效率纤维素酶菌株初筛方法的研究[J]. 纤维素科学与技术, 2004, 12(3): 20-24.
[14]Seidl V, Seiboth B.Trichodermareesei: Genetic approaches to improving strain efficiency[J]. Biofuels, 2010, 1(2):343-335.
[15]Gusakov A V. Alternatives toTrichodermareeseiin biofuel production[J]. Trends in Biotechnology, 2011, 29(9):419-425.
[17]Liu Y T, Luo Z Y, Long C N, et al. Cellulase production in a new mutant strain ofPenicilliumdecumbensML-017 by solid state fermentation with rice bran[J]. New Biotechnology, 2011, 28(6):733-737.
[18]Castro A M D, Leite S G F, Pereira N. Cellulases fromPenicilliumfuniculosum: production, properties and application to cellulose hydrolysis[J]. Journal of Industrial Microbiology & Biotechnology, 2010, 37(2):151-158.
[19]Singhvi M S, Adsul M G, Gokhale D V. Comparative production of cellulases by mutants ofPenicilliumjanthinellumNCIM 1171 and its application in hydrolysis of Avicel and cellulose[J]. Bioresource Technology, 2011, 102(11):6569-6572.
[20]Gusakov A V, Sinitsyn A P. Cellulases fromPenicilliumspeciesfor producing fuels from biomass[J]. Biofuels, 2012, 3(4):463-477.
欢迎订阅《微生物学杂志》
Screening and Identification of a Cellulose-Degrading Fungus DF14101
ZOU Xiao-xiao1, YI Zi-ting1, 2, SUN Qian-guang1, BAO Shi-xiang1, HUANG Hui-qin1
(1.Inst.ofTropicalBiosci. &Biotech.,CATAS,Haikou,Hainan571101; 2.Coll.ofEnviron’t&PlantProtect.,HainanUni.,Haikou,Hainan570228)
Cellulose is the major ingredient of plants’ cell walls, and is one of the valuable natural renewable resources for human beings. The difficulty of cellulose degradation severely limits the effective utilization of bio-waste. Adding cellulolytic microorganism during the composting process of plant stalks, can effectively improve degradation rate of fibers. Strain DF14101 with cellulose degrading capability was screened out from soil and the rotten stalks on CMC-Na agar. The endoglucanase (CMCase) activity and filter paper activity (FPA) of the strain were at 43.98 U/mL and 14.05 U/mL respectively, when cultured in medium with banana stalk powder as a carbon source for five days at 180 r/min and 28 ℃. Combined with the results of morphological characteristics with phylogenetic analysis based on ITS sequences, strain DF14101 was identified asPenicilliumoxalicum.
cellulase; screening; identification;Penicilliumoxalicum
公益性行业(农业)科研专项(201303094);海洋公益性行业科研专项(2014050402);海南省科技兴海专项(XH201408);
邹潇潇 女,博士。研究方向为微生物资源应用研究。E-mail:zouxiaoxiao@itbb.org.cn
易子霆 男,硕士研究生。研究方向为微生物资源与利用。E-mail:648241879@qq.com。前两位作者为并列第一作者。
2016-02-21;
2016-04-07
Q939
A
1005-7021(2016)06-0068-05
10.3969/j.issn.1005-7021.2016.06.011
中央级公益性科研院所基本科研业务费专项资金(ITBB2015ZD08,ITBB2015RC07)
* 通讯作者。女,博士,研究员。研究方向为微生物资源与利用。E-mail:huanghq21@163.com
