putA与vgb基因对反式-4-羟基-L-脯氨酸产量的影响
2016-03-07张胜利刘合栋张震宇孙付保夏紫薇
张胜利, 林 凡, 刘合栋, 张震宇*, 孙付保, 夏紫薇
(1.江南大学 生物工程学院,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;3.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122)
putA与vgb基因对反式-4-羟基-L-脯氨酸产量的影响
张胜利1,2,3, 林 凡1,2,3, 刘合栋1,2,3, 张震宇*1,2,3, 孙付保1,2,3, 夏紫薇1
(1.江南大学 生物工程学院,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;3.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122)
反式-4-羟基-L-脯氨酸是在自然界中分布最广泛的一种羟脯氨酸,在医药、化工、食品和美容业等领域有广泛应用。为了在生物转化法生产反式-4-羟基-L-脯氨酸的过程中减少菌体对底物脯氨酸的降解,利用Red/ET同源重组系统敲除putA基因,并比较野生型菌株与缺失型菌株在不同培养基中的反式-4-羟基-L-脯氨酸产量,再引入vgb基因,考察该基因对反式-4-羟基-L-脯氨酸产量的影响。结果表明:putA基因的缺失能阻止菌体降解脯氨酸;碳源充足的情况下,GC培养基更有利于反式-4-羟基-L-脯氨酸的生产;putA基因缺失型菌株能将被消耗的脯氨酸全部转化为反式-4-羟基-L-脯氨酸;vgb基因的存在能显著提高反式-4-羟基-L-脯氨酸的产量。
反式-4-羟基-L-脯氨酸;大肠杆菌;生物转化;基因敲除;透明颤菌血红蛋白
羟基-L-脯氨酸, 也叫羟脯氨酸(Hydroxyproline,Hyp),是亚氨基酸L-脯氨酸羟基化后的产物。根据羟脯氨酸羟基所在位置不同,可形成4种立体异构体,分别是反式-4-羟基-L-脯氨酸、顺式-4-羟基-L-脯氨酸、反式-3-羟基-L-脯氨酸和顺式-3-羟基-L-脯氨酸。其中反式-4-羟基-L-脯氨酸(trans-4-hydroxy-L-proline,4-THOP)在自然界最为常见,在许多领域已发现其重要用途。在医药方面,4-THOP已大量应用于碳青霉烯类抗生素、消炎药等医药的合成[1];在化工合成方面,4-THOP是合成多种化合物的必不可少的手性原料[2][3];在家禽养殖中添加4-THOP,可防止因甘氨酸合成不足而造成的营养不良[4];同时,4-THOP在新生儿食品营养方面可作为营养物质来补充甘氨酸、丙酮酸和葡萄糖[5];在美容业方面,4-THOP具有消除氧化剂和调整细胞氧化还原状态的作用,因此许多高档护肤品中都添加有羟脯氨酸,以期保养皮肤和延缓衰老[6]。因此,4-THOP作为稀有氨基酸产品,在医药保健、材料化工、动物饲料、食品营养和护肤美容等行业都具有广泛的应用领域和广阔的市场空间,大力推进羟脯氨酸产品的研究开发具有显著的商业价值。
目前4-THOP的生产方法主要有胶原水解法和生物转化法。传统的水解提取法主要从富含胶原的生物组织中提取4-THOP[7-9],这种生产方法逐步暴露出生产和纯化步骤多、杂酸含量高、产率低、成本高、原料利用率低、环境污染大、废水废渣难处理等弊端[10]。随着环保压力增加和原料价格上涨,传统的水解提取法将会逐步淡出市场。相对应地,随着工业生物技术的蓬勃发展,微生物合成法却日益展现出水解提取法无法比拟的独特优势。生物转化法通过L-脯氨酸-反式-4-羟化酶,将外源添加的[11-13]或细胞自身积累的[14]游离脯氨酸(Pro)羟基化为4-THOP,见图1。因其高度的立体及结构选择性、原材料来源广泛、整体生产成本低的优点,正逐渐成为4-THOP生产的主要方法[15]。1961年,Katz等[16]发现游离羟脯氨酸作为前体物参与链霉菌放线菌素的合成,即羟脯氨酸可经微生物酶代谢合成。1995年,Matsuoka等[17]筛出一株分泌4-THOP的真菌,经鉴定 该 真 菌 为 Clonostachys cylindrospora SANK 14591,在以脯氨酸为底物的发酵液中23℃培养9 d,4-THOP的积累量为13.8 mg/L。Shibasaki等[11]将指孢囊菌RH1(Dactylosporangium sp.RH1)中的脯氨酸-4-羟化酶基因置于强启动子的调控下,在大肠杆菌中表达并在发酵罐中发酵100 h后,4-THOP的积累量达到可工业化发酵水平(41 g/L)。

图1 从L-脯氨酸到反式-4-羟基-L-脯氨酸的生物转化过程Fig.1 Biotransformation process from L-proline to trans-4-hydroxy-L-proline
作者所在实验室率先在国内开展生物转化法生产4-THOP的研究,将脯氨酸-4-羟化酶基因(hypt4基因)置于一个强组成型启动子的控制下,构建出不用添加诱导剂,将外源脯氨酸高效转化为4-THOP的重组大肠杆菌[12],并对该菌株进行发酵条件的优化,使得4-THOP的终产量达到42.5 g/L[12-13]。大肠杆菌中putA基因表达的蛋白质具有脯氨酸脱氢酶活性,是脯氨酸降解途径中的关键酶,Shibasaki等[11]在利用大肠杆菌W1485生产4-THOP的过程中,发现野生型菌株中脯氨酸被消耗完,但4-THOP的产量只有被消耗脯氨酸的87%,而以putA基因缺失型大肠杆菌作为宿主菌,发酵生产4-THOP时,则能将被消耗的脯氨酸全部转化为4-THOP,终产量为41 g/L。所以有必要敲除putA基因来阻止大肠杆菌降解脯氨酸,以实现被消耗的脯氨酸完全转化为4-THOP。另外,从脯氨酸到4-THOP的生物转化过程中,需要氧分子参与,见图1。如果提高细胞内的溶氧量,则有可能会提高4-THOP的产量,而且透明颤菌 (Vitreoscilla sp.)血红蛋白(VHb)已被克隆到多种微生物中,并成功提高了其氧气摄入能力[18]。目前,尚没有将透明颤菌血红蛋白应用于4-THOP生产研究的相关报道。李玮等[19]通过改造脯氨酸-4-羟化酶分子结构,提高了该酶催化效率;Yi等[20]使用T7启动子控制脯氨酸-4-羟化酶基因在大肠杆菌BL21(DE3)中表达,通过提高脯氨酸-4-羟化酶的表达量,增强4-THOP的生产能力。
基于此,作者在实验室已构建的4-THOP生产菌株的基础上,拟敲除大肠杆菌中编码脯氨酸降解途径中关键酶的putA基因,然后构建透明颤菌血红蛋白基因 (vgb基因)与脯氨酸-4-羟化酶基因(hypt4基因)共表达质粒,在摇瓶水平上探讨putA基因与vgb基因对外源添加的脯氨酸的有效转化率及4-THOP产量的影响。
1 材料与方法
1.1 实验材料
1.1.1 菌种与质粒 本研究所用菌种及质粒见表1。

表1 所用菌种、质粒及它们的来源Table 1 Strains and plasmids used in this study
1.1.2 主要酶及试剂 Taq DNA聚合酶、Pfu DNA聚合酶、1 kb DNA Ladder、质粒小量提取试剂盒、DNA胶回收试剂盒、胰蛋白胨、氨苄青霉素(Amp)、卡那霉素(Kan):购自生工生物工程(上海)有限公司;L-阿拉伯糖、电转感受态用甘油:购自BBI;T4 DNA连接酶、PrimerSTAR HS DAN聚合酶、限制性内切酶及DL5000 DNA Marker:购自Takara公司;酵母提取物:购自Oxoid公司;其他试剂:均购自国药集团化学试剂有限公司。
1.1.3 引物 所用引物的合成均由生工生物工程(上海)有限公司合成。所用的敲除及鉴定用引物序列见表2。

表2 敲除和鉴定用引物Table 2 Primers for deletion and identification
1.1.4 培养基
1)LB培养基:胰蛋白胨 10 g/L,酵母提取物 5 g/L,氯化钠10 g/L。固体培养基添加1.5 g/dL琼脂粉。
2)M9培养基:Na2HPO46 g/L,KH2PO43 g/L,NH4Cl 1 g/L,NaCl 0.5 g/L,CaCl23 mg/L,MgSO41 mmol/L,脯氨酸2 g/L。固体培养基添加1.5 g/dL琼脂粉。
3)LBP培养基:胰蛋白胨10 g/L,酵母提取物 5 g/L,氯化钠10 g/L,脯氨酸10 g/L。
4)GT培养基:葡萄糖 10 g/L,甘油 5 g/L,胰蛋白胨 8 g/L,(NH4)2SO45 g/L,K2HPO41 g/L,NaCl 2 g/L,MgSO40.2 g/L,CaCl20.015 g/L,FeSO43 mmol/L。
5)GC培养基:葡萄糖 8 g/L,甘油 10 g/L,玉米浆 8 g/L,(NH4)2SO413 g/L,K2HPO41.5 g/L,NaCl 2 g/L,MgSO40.3 g/L,CaCl20.015 g/L,FeSO44 mmol/L。
氨苄青霉素和卡那霉素的质量浓度分别为100 μg/mL和50 μg/mL。
1.2 实验方法
1.2.1 大肠杆菌基因组DNA的提取 大肠杆菌基因组的提取方法参见文献[23]。
1.2.2 基因敲除用打靶片段的制备 以pKD4为模板,P1、P2为引物,PrimerSTAR HS DNA聚合酶进行PCR扩增,Dpn I处理后对PCR产物进行切胶回收,以胶回收产物作为打靶片段敲除大肠杆菌W3110的putA基因。
以大肠杆菌W3110 putA::kan的基因组为模板,Y1、Y2为引物,Taq和Pfu DNA聚合酶以1∶1的比例混匀进行PCR扩增,对PCR产物进行切胶回收,以胶回收产物作为敲除大肠杆菌BL21(DE3)putA基因的打靶片段。
1.2.3 大肠杆菌putA基因的敲除 大肠杆菌W3110和BL21(DE3)putA基因的敲除方法参见文献[24],验证用菌落PCR的引物为Y1、Y2。
1.2.4 野生型菌株及缺失型菌株对脯氨酸的消耗分别挑取大肠杆菌 W3110、W3110ΔputA、BL21(DE3)、BL21(DE3)ΔputA的单菌落,接种于LB培养基中,37℃、220 r/min过夜培养。按照1%的接种体积分数接种于新的30 mL的LBP培养基中(250 mL的摇瓶),接种后取样测定脯氨酸的初始浓度,37℃、220 r/min培养24 h后,取样测定生物量(以OD600表示)及脯氨酸的残留量,每种菌做3个平行样。1.2.5 putA基因的缺失对4-THOP的影响 分别挑 取 大 肠 杆 菌 W3110/pUHT4、W3110ΔputA/ pUHT4、BL21 (DE3)/pUHT4、BL21(DE3)ΔputA/ pUHT4的单菌落,接种于含有氨苄青霉素的LB培养基中,待OD600大约为1.5左右时,按6%的接种体积分数接种于GT和GC培养基 (250 mL的摇瓶装液量30 mL,并添加60 uL的600 g/L的脯氨酸母液,脯氨酸的初始浓度约为10 mmol/L)中,取样测定脯氨酸的初始浓度,35℃、220 r/min培养24 h后,取样测定生物量(以OD600表示)、脯氨酸的残留量及4-THOP的产量,每种菌做3个平行样。
1.2.6 vgb基因与hypt4基因共表达质粒的构建
透明颤菌血红蛋白基因(vgb基因)序列见GenBank accession no.M30794.1,利用自身的溶氧诱导型启动子控制基因的表达。为了便于基因操作,在透明颤菌血红蛋白基因溶氧诱导启动子前插入EcoR I酶切位点,同时,在血红蛋白基因终止密码子后插入Nde I酶切位点。该基因片段由上海旭冠合成,将合成后的基因及pUHT4质粒同时进行EcoR I和Nde I双酶切,胶回收双酶切产物,用T4 DNA连接酶于16℃过夜连接,将连接产物转化至大肠杆菌JM109中。挑单菌落用V1、V2为引物做菌落PCR,挑取PCR条带正确的菌落培养,提取质粒做单双酶切验证。选择菌落PCR及单双酶切均正确的质粒,送上海生工测序,序列正确的即为含有vgb基因与hypt4基因的共表达质粒pUHVT4。
1.2.7 透明颤菌血红蛋白对4-THOP的影响 将pUHVT4质粒分别转化至大肠杆菌W3110ΔputA及大肠杆菌BL21(DE3)ΔputA菌株中,可获得重组大肠杆菌W3110ΔputA/pUHVT4、BL21(DE3)ΔputA/ pUHVT4。分别挑取大肠杆菌W3110ΔputA/pUHT4、W3110ΔputA/pUHVT4、BL21(DE3)ΔputA/pUHT4、BL21(DE3)ΔputA/pUHVT4的单菌落,接种于含有氨苄青霉素的LB培养基中,待OD600大约为1.5左右时,按6%的接种体积分数接种于GT和GC培养基中,250 mL的摇瓶装液量30 mL,并添加60 uL的600 g/L的脯氨酸母液,脯氨酸的初始浓度约为10 mmol/L,35℃、220 r/min培养24 h后,取样测定生物量(以OD600表示)和4-THOP的产量。每种菌做3个平行样。
1.2.8 脯氨酸及4-THOP的定量测定 脯氨酸的定量测定参见文献[25];4-THOP的定量测定参见文献[26]。
2 结果与分析
2.1 大肠杆菌中putA基因的敲除
大肠杆菌中putA基因表达的蛋白质具有脯氨酸脱氢酶及吡咯啉-5-羧酸脱氢酶活性,在脯氨酸的降解途径中起关键作用,因此在使用大肠杆菌生产4-THOP的过程中,有必要敲除putA基因,打断大肠杆菌的脯氨酸降解途径,使得被消耗的脯氨酸全部转化为4-THOP。作者采用Red/ET同源重组系统敲除putA基因,首先制备出打靶片段。
以pKD4为模板,P1、P2为引物,扩增出一段两端分别与大肠杆菌putA基因两端序列同源的,中间为卡那霉素抗性基因的DNA片段,经0.8 g/dL的琼脂糖凝胶电泳检测,片段大小与理论值1 595 bp一致(图2(a)),在经过Dpn I处理及胶回收后,所得的产物即可作为大肠杆菌W3110的putA基因敲除用打靶片段。
对于大肠杆菌BL21(DE3)的putA基因的敲除,采用长同源臂的打靶片段,以大肠杆菌W3110 putA::kan菌株的基因组为模板,Y1、Y2为引物,扩增出一段DNA片段,经0.8 g/dL的琼脂糖凝胶电泳检测,片段大小与理论值2 188 bp一致(图2(b)),经过胶回收后,所得的产物即可作为大肠杆菌BL21(DE3)的putA基因敲除用打靶片段。
将打靶片段通过电转化至含有pKD46的大肠杆菌电转感受态细胞中,涂布于含有卡那霉素的LB平板上。然后将长出的单菌落点在M9P平板和新的含有卡那霉素的LB平板上,取能在含有卡那霉素的LB平板上生长但不能在M9P平板上生长的单菌落,做菌落PCR鉴定,电泳检测PCR产物大小。若以大肠杆菌野生型菌株为菌落PCR模板时,扩增出的条带理论大小为4 574 bp;若卡那霉素抗性基因替代putA基因整合到大肠杆菌的基因组上时,扩增出的条带理论大小为2 188 bp。通过平板筛选及菌落PCR鉴定可以证明putA基因被成功敲除。再将质粒pCP20转化到已丢失pKD46的阳性重组子中,通过热诱导完成卡那霉素抗性基因的消除及pCP20质粒的丢失,并以Y1、Y2为引物做菌落PCR,以进一步确认卡那霉素抗性基因的消除。若卡那抗性基因被从基因组上消除时,扩增出的条带理论大小为814 bp,结果见图3(大肠杆菌W3110)和图4(大肠杆菌BL21(DE3))。可以看出,各个条带的大小均与理论值一致,即实现了大肠杆菌W3110及BL21(DE3)中putA基因的敲除。
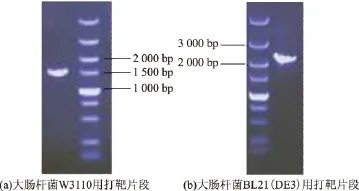
图2 putA基因敲除用打靶片段的电泳分析Fig.2 Electrophoresis analysis of PCR products

图3 大肠杆菌W3110野生型菌株及 putA基因缺失型菌株PCR电泳图谱Fig.3 Identification of E.coli W3110 putA knockout by colony PCR

图4 大肠杆菌BL21(DE3)野生型菌株及putA基因缺失型菌株PCR电泳图谱Fig.4 Identification of E.coli BL21(DE3)putA knockout by colony PCR
2.2 野生型菌株与putA基因缺失型菌株对脯氨酸消耗的比较
为了测定putA基因的缺失对大肠杆菌消耗脯氨酸的影响,对大肠杆菌W3110、W3110ΔputA和大肠杆菌BL21(DE3)、BL21(DE3)ΔputA分别在LBP培养基中培养。结果表明,大肠杆菌W3110和BL21(DE3)均能消耗脯氨酸,而其对应的putA缺失型菌株则不能消耗脯氨酸,即putA基因的敲除确实能打断大肠杆菌的脯氨酸降解途径,结果见图5。由于野生型菌株能利用脯氨酸,所以生物量 (以OD600表示)要远大于缺失型菌株的,而且因为摇瓶培养时水分的蒸发导致了缺失型菌株的脯氨酸残留量比脯氨酸初始含量高一些。在相同的培养条件下,W3110与BL21(DE3)的野生型菌株消耗了基本相同的脯氨酸 (分别为 (34.37±0.59)mmol/L,(35.16±3.52)mmol/L),但 W3110的生物量却比BL21(DE3)的低 (OD600分别为4.85±0.19,5.86± 0.09),说明相比于W3110,BL21(DE3)能更有效的利用碳源。
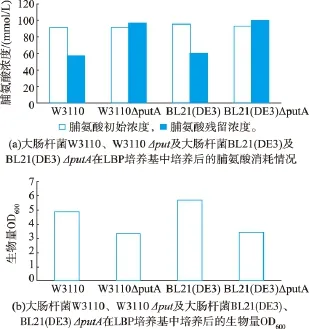
图5 大肠杆菌野生型菌株与对应的缺失型菌株的对脯氨酸消耗及生物量的比较Fig.5 Comparation of proline consumption and biomass between wild types and mutants
2.3 putA基因的缺失对脯氨酸转化及4-THOP产量的影响
将含有脯氨酸-4-羟化酶基因的质粒pUHT4分别导入到野生型菌株与缺失型菌株后,将重组菌株接种于GT与GC培养基中 (250 mL的摇瓶装液量30 mL,接种时加入60 uL的600 g/L的脯氨酸母液,使培养基中脯氨酸浓度大概为10 mmol/L),然后在35℃、220 r/min的摇床中摇瓶发酵24 h,测定putA基因的缺失对外源添加的脯氨酸的转化率及4-THOP产量的影响,结果见图6。putA基因缺失型菌株不能降解脯氨酸,Shibasaki等[11]发现putA基因缺失菌株能将被消耗的脯氨酸全部转化为4-THOP,所以putA基因缺失型菌株的脯氨酸有效转化率(即4-THOP的产量与被消耗的脯氨酸量的比值)的理论值应为100%。相同条件下,野生型菌株的生物量及4-THOP的产量均大于缺失型菌株的,但同时消耗的脯氨酸也增多,野生型菌株消耗的脯氨酸未能完全转化为4-THOP,缺失型菌株则能将消耗的脯氨酸全部转化为4-THOP,即野生型菌株的脯氨酸有效转化率远远低于缺失型菌株的,见表3。无论是生物量还是4-THOP的产量都是最高的;W3110的生物量和4-THOP的产量均远远低于相同条件下的BL21(DE3)的量。这些摇瓶发酵结果说明:大肠杆菌 BL21(DE3)比W3110更适合用于4-THOP的生产;在碳源供应充足的情况下,GC培养基比GT培养基更有利于脯氨酸向4-THOP的转化;野生型菌株的生物量及4-THOP的产量均大于其对应的缺失型菌株的,但这却是建立在降解外源添加的脯氨酸的基础上才得以实现,putA基因缺失型菌株能有效阻止菌体降解脯氨酸,使得被消耗的脯氨酸全部的转化为4-THOP。
2.4 构建vgb基因与hypt4基因共表达质粒
vgb基因在其自身的溶氧诱导型启动子的调控下,能在环境溶氧浓度较低的情况下表达出VHb蛋白,将外界环境中的氧气转运至菌体细胞内,从而提高菌体的氧气摄入能力。vgb基因与pUHT4质粒的连接产物,转化大肠杆菌JM109,对长出的单菌落用V1、V2为引物进行菌落PCR验证,结果见图7。vgb基因及其溶氧诱导型启动子的大小为575 bp,色氨酸串联启动子(Ptrp2)大小为225 bp,脯氨酸-4-羟化酶基因(hypt4基因,在Ptrp2的调控之下)的大小为819 bp,因此PCR条带大小为理论值一致。

表3 脯氨酸的有效转化率Table 3 Effective transformation rate of proline
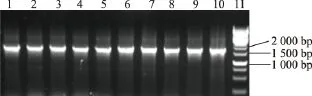
图7 重组质粒pUHVT4的菌落PCR验证Fig.7 Identification of recombinant plasmid pUHVT4 by colony PCR
对菌落PCR验证正确的菌落提取质粒,分别用EcoR I单酶切、EcoR I和BamH I双酶切、Nde I和BamH I双酶切,结果见图8。pUC19质粒大小为2 686 bp,各个酶切条带大小与理论值一致。pUHVT4的质粒电泳谱见图9。
2.5 vgb基因对脯氨酸转化及4-THOP产量的影响
将构建好的羟化酶基因及vgb基因的共表达质粒pUHVT4和只含羟化酶基因的pUHT4质粒分别转化进大肠杆菌W3110和BL21(DE3)的putA基因缺失型菌株中,将重组菌株接种于GT与GC培养基中(250 mL的摇瓶装液量30 mL,接种时加入60 uL的600 g/L的脯氨酸母液,使培养基中脯氨酸浓度大概为10 mmol/L),然后在35℃、220 r/min的摇床中摇瓶发酵24 h,比较vgb基因对4-THOP产量的影响,结果见图10。在GT培养基中培养的菌株,其生物量比GC培养中培养的低,但4-THOP产量却较GC培养基的高;在相同的培养基中,含有vgb基因的生物量比未携带vgb基因的菌株的稍高,但4-THOP的产量却远远高于未携带vgb基因的菌株的。对于大肠杆菌W3110ΔputA,vgb基因在GT培养基中使4-THOP的产量提高了20%,在GC培养基中4-THOP的产量提高了25%;对于大肠杆菌BL21(DE3)ΔputA,在GT培养基中4-THOP的产量提高了31%,在GC培养基中4-THOP的产量提高了27%。且在GT培养基中,大肠杆菌BL21(DE3)ΔputA/pUHVT4的4-THOP产量为 (0.94± 0.07)mmol/L,而大肠杆菌W3110 ΔputA/pUHVT4的产量为(0.12±0.004)mmol/L,脯氨酸的实际转化率 (即4-THOP的产量与脯氨酸初始浓度的比值)则分别为9.4%与1.2%;在GC培养基中,大肠杆菌BL21 (DE3) ΔputA/pUHVT4 和 W3110ΔputA/ pUHVT4的 4-THOP的产量分别为 (0.76±0.03)mmol/L和(0.05±0.01)mmol/L,相对应的脯氨酸实际转化率分别为7.6%与0.5%。由摇瓶发酵结果可知,vgb基因在大肠杆菌中的表达确实能提高4-THOP的产量。

图8 pUHVT4的酶切验证Fig.8 Identification of pUHVT4 by restriction enzymes digestion
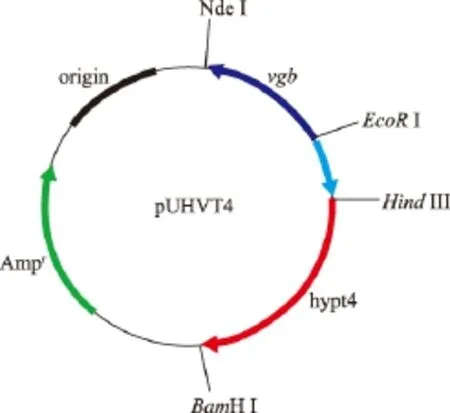
图9 质粒pUHVT4的示意图Fig.9 Sketch map of plasmid pUHVT4

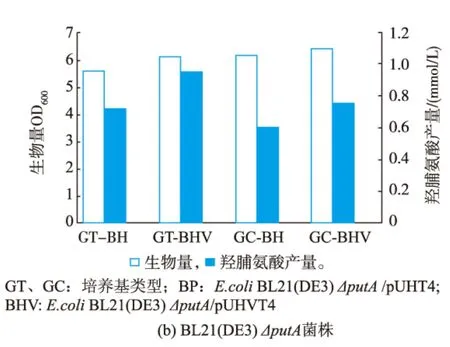
图10 vgb基因对4-THOP产量的影响Fig.10 Effect of vgb gene on 4-THOP yield
3 结语
作者成功敲除了大肠杆菌 W3110和BL21(DE3)的 putA基因,并比较了野生型菌株和putA基因缺失型菌株在GT与GC培养基中的生长状况及4-THOP的产量。结果发现,W3110菌株的4-THOP产量远远低于BL21(DE3)菌株的,即W3110不适合用于生产4-THOP;野生型菌株在GC培养基中培养时4-THOP产量要高于在GT培养基中培养的产量,对于putA基因缺失型菌株则相反;野生型菌株的4-THOP产量比putA基因缺陷型菌株的高,但这是以降解脯氨酸为代价的,导致野生型菌株的脯氨酸有效转化率远远低于缺失型菌株的,putA基因缺失型菌株能将被消耗的脯氨酸完全转化为4-THOP。
作者成功构建了vgb基因与hypt4基因共表达质粒pUHVT4,并导入大肠杆菌W3110和BL21(DE3)的putA基因缺失型菌株中,在GT与GC培养基中比较了vgb基因的表达对菌株生物量及4-THOP产量的影响。结果发现,vgb基因的表达对生物量的增加有正向的作用,但并不明显;对4-THOP的产量的增加则有极为明显的促进作用,4-THOP的产量至少增加了20%。说明vgb基因适合用于大肠杆菌,并能提高4-THOP的产量。
作者在摇瓶水平上探讨了对putA与vgb基因对4-THOP产量的影响,下一步将以大肠杆菌BL21(DE3)ΔputA/pUHVT4为生产菌株,采用GC培养在发酵罐水平进行小试,以确定其将外源添加的脯氨酸转化为4-THOP的生产可行性。
参考文献:
[1]REMUZON P.Trans-4-hydroxy-L-proline,a useful and versatile chiral starting block[J].Tetrahedron Letters,1996,52(44):13803-13835.
[2]VIJAY K A,RAMA R K.Trans-4-hydroxy-l-proline:a novel starting material for N-alkylpyrroles synthesis[J].Tetrahedron Letters,2011,52(25):3237-3239.
[3]REDDY V P,KUMAR A V,RAO K R.New strategy for the synthesis of N-aryl pyrroles:Cu-catalyzed C-N cross-coupling reaction of trans-4-hydroxy-l-proline with aryl halides[J].Tetrahedron Letters,2011,52(7):777-780.
[4]WU G,BAZER F W,BURGHARDT R C,et al.Proline and hydroxyproline metabolism:implications for animal and human nutrition[J].Amino Acids,2011,40(4):1053-1063.
[5]WU G,BAZER FW,DAVIST A,etal.Arginine metabolismand nutrition in growth,health and disease[J].Amino Acids,2009,37(1):153-168.
[6]LAM M,SULINDRO M.Aging skin[J].Anti-Aging Research Brief,Academy of Anti-Aging Research MMIII,2001(1):1-8.
[7]施强,桑立红,王在震.从骨胶中提取L-羟基脯氨酸和L-脯氨酸[J].食品科学,1998,19(10):26-29. SHI Qiang,SANG Lihong,WANG Zaixia.Extracting L-hydroproline and proline from boneglue[J].Food Science,1998,19(10):26-29.(in Chinese)
[8]高焕春,李文英.从骨胶水解液中分离L-羟脯氨酸和L-脯氨酸[J].天津轻工业学院学报,1997,2:33-37. GAO Huanchun,LI Wenying.Isolating L-hydroproline and proline from hydrolytic liquor of boneglue[J].Journal of Tianjin University of Light Industry,1997,2:33-37.(in Chinese)
[9]吕红线.从骨胶中制备L-羟脯氨酸的研究[J].山东轻工业学院学报,1997,11(4):53-56. LV Hongxian.Study on L-HYP preparation from osseocolla[J].Journal of Shandong Institute of Light Industry,1997,11(4):53-56.(in Chinese)
[10]张自强,赵东旭,杨新林.羟脯氨酸的研究与开发[J].氨基酸与生物资源,2006,28(1):55-58. ZHANG Ziqiang,ZHAO Dongxu,YANG Xinlin.Research and development of hydroproline[J].Amino Acids&Biotic Resources,2006,28(1):55-58.(in Chinese)
[11]SHIBASAKI T,MORI H,OZAKI A.Enzymatic production of trans-4-hydroxy-L-proline by regio-and stereospecific hydroxyproline of L-proline[J].Biosci Biotechnol Biochem,2000,64(4):746-750.
[12]刘合栋,袁春伟,张震宇.脯氨酸-4-羟化酶在大肠杆菌中的密码子优化表达及对反式-4-羟脯氨酸生物合成的作用[J].生物加工过程,2014,12(6):44-51. LIU Hedong,YUAN Chunwei,ZHANG Zhenyu,et al.Expression of codon optimized proline-4-hydroprolase in Escherichia coli and its effect on trans-4-hydroxyproline biosynthesis[J].Chinese Journal of Bioprocess Engineering,2014,12(6):44-51.(in Chinese)
[13]袁春伟,何艳春,张胜利,等.重组大肠杆菌BL21(pUC19-Hyp)产羟脯氨酸的补料分批培养[J].生物加工过程,2014,12(4):43-48. YUAN Chunwei,HE Yanchun,ZHANG Zhenyu,et al.Production of hydroproline by fed-batch culture of novel recombinant Escherichia coli BL21(pUC19-Hyp)[J].Chinese Journal of Bioprocess Engineering,2014,12(4):43-48.(in Chinese)
[14]SHIBASAKI T,HASHIMOTO S,MORI H,et al.Construction of a novel hydroxyproline-producing recombinant Escherichia coli by introducing a proline 4-hydroxylase gene[J].J Biosci Bioeng,2000,90(5):522-525.
[15]BACH T M H,TAKAGI H.Properties,metabolisms,and applications of(L)-proline analogues[J].Applied Microbiology and Biotechnology,2013,97(15):6623-6634.
[16]KATZE,PROCKOP D J,UNDENFRIEND S.Precursors ofthe hydroxyproline and ketoproline in actinomycin[J].The Journal of Biological Chemistry,1962,237(5):1585-1588.
[17]MATSUOKA T,SERIZAWA N,HOSOYA T,et al.Microbial process for the production of trans-4-hydroxy-L-proline[P].美国专利:US 5334517.1994-08-02.
[18]ZHANG L,LI Y,WANG Z,et al.Recent developments and future prospects of Vitreoscilla hemoglobin application in metabolic engineering[J].Biotechnology Advances,2007,25(2):123-136.
[19]李玮,张金秀,王立安,等.一种编码高活性反式-4-羟基-L-脯氨酸羟化酶的基因片段及其应用[P].中国专利:201310235337.6,2013-09-04.
[20]YI Y,SHENG H,LI Z,et al.Biosynthesis of trans-4-hydroxyproline by recombinant strains of Corynebacterium glutamicum and Escherichia coli[J].BMC biotechnology,2014,14:44.
[21]张君,方宏清.大肠杆菌BL21(DE3)lpxM突变株的构建[J].生物技术通讯,2006,17(4):489-492. ZHANG Jun,FANG Hongqing.Construction of a mutant E.coli BL21(DE3)with inactivated lpxM[J].Letters in Biotechnology,2006,17(4):489-492.(in Chinese)
[22]康振,耿艳平,祁庆生,等.好氧发酵生产琥珀酸工程菌株的构建[J].生物工程学报,2008,24(12):2081-2085. KANG Zhen,GENG Yanping,QI Qingsheng,et al.Construction of engineered Escherichia coli for aerobic succinate production [J].Chin J Biotech,2008,24(12):2081-2085.(in Chinese)
[23]AUSUBEL F M,BRENT R,KINGSTON R E,et al.精编分子生物学实验指南第五版[M].金由辛,包慧中,赵丽云,等,译.北京:科学出版社,2008:55.
[24]DATSENKO K A,WANNER B L.One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J]. Proceedings of the National Academy of Sciences of the United States of America,2000,97(12):6640-6645.
[25]职明星,李秀菊.脯氨酸测定方法的改进[J].河南科技学院学报,2005,33(4):10-12. ZHI Mingxing,LI Xiuju.Improvement on the method for measuring proline content[J].Plant Physiology Journal,2005,33(4):10-12.(in Chinese)
[26]KOIKE K,LI Y,SEO M,et al.Free 4-Hydroxyproline content in serum of bedridden aged people is elevated due to fracture[J]. Biological and Pharmaceutical Bulletin,2000,23(1):101-103.
Effects of putA and vgb Genes on trans-4-Hydroxy-L-Proline Production
ZHANG Shengli1,2,3, LIN Fan1,2,3, LIU Hedong1,2,3, ZHANG Zhenyu*1,2,3, SUN Fubao1,2,3, XIA Ziwei1
(1.SchoolofBiotechnology,Jiangnan University,Wuxi214122,China;2.Key Laboratory ofIndustrial
Biotechnology of the Ministry of Education,Jiangnan University,Wuxi 214122,China;3.Key Laboratory of
Carbohydrate Chemistry and Biotechnology of Ministry of Education,Jiangnan University,Wuxi 214122,China)
Trans-4-hydroxy-L-proline iswidely distributed in nature and applied in the pharmaceutical,chemical,food and cosmetic products.In order to interrupt the bacterial degradation of proline during the biosynthesis process of trans-4-hydroxy-L-proline,putA gene was deleted using Red/ET homologous recombination system.Wild types and mutants were cultured in GT and GC media,and the trans-4-hydroxy-L-proline yields were compared to obtain the optimal strain and medium.On the other hand,vgb gene was introduced into the cell and its effecton trans-4-hydroxy-L-proline production was studied.The results show that the knockout of putA gene can prevent the degradation of proline,and with an adequate supply of the carbon source,GC medium is better for producing trans-4-hydroxy-L-proline than GT medium.Moreover,all of theconsumed proline can be transformed to trans-4-hydroxy-L-proline in putA deletion mutants.By contrast,the presence of vgb gene can significantly improve trans-4-hydroxy-L-proline production.
trans-4-hydroxy-L-proline,Escherichia coli,biotransformation,gene knockout,Vitreoscilla hemoglobin
Q 815
A
1673—1689(2016)12—1307—10
2015-02-03
国家自然科学基金项目(30800018,30970058);江苏省自然科学基金项目(BK2012554);高等学校博士学科点专项科研基金项目(200802951036);工业生物技术教育部重点实验室主任基金项目(KLIB-ZR200801)。
*通信作者:张震宇(1976—),男,江苏张家港人,理学博士,教授,硕士研究生导师,主要从事重要微生物产品的制备及发酵工艺方面的研究。E-mail:zhangzy@jiangnan.edu.cn
