异戊二烯生物合成研究进展
2016-03-07张雯雯曾日中杨礼富顾金刚
张雯雯, 曾日中, 杨礼富*, 顾金刚
(1.中国农业科学院农业资源与农业区划研究所 中国农业微生物菌种保藏管理中心,北京 100081;2. 中国热带农业科学院橡胶研究所 农业部橡胶树生物学与遗传资源利用重点实验室,海南 儋州 571737;3.海南大学 环境与植物保护学院,海南 海口 570100)
异戊二烯生物合成研究进展
张雯雯1,2,3, 曾日中2, 杨礼富2*, 顾金刚1*
(1.中国农业科学院农业资源与农业区划研究所 中国农业微生物菌种保藏管理中心,北京 100081;2. 中国热带农业科学院橡胶研究所 农业部橡胶树生物学与遗传资源利用重点实验室,海南 儋州 571737;3.海南大学 环境与植物保护学院,海南 海口 570100)
异戊二烯(isoprene),又名2-甲基-1、3-丁二烯,是最简单的类异戊二烯化合物,是橡胶的重要前体物质,在精细化工如香料、新型农药等方面应用广泛。异戊二烯主要依赖化石燃料合成,但生产成本较高、易污染环境,生物法合成异戊二烯具有巨大的潜在应用价值,本文综述了生物法合成异戊二烯的主要途径与研究进展。
异戊二烯;生物合成;MVA途径;MEP途径
类异戊二烯化合物广泛存在于自然界中,其中异戊二烯(2-甲基-1、3-丁二烯)是最简单的类异戊二烯化合物[1],在常温下是一种无色、易挥发、有刺激性气味的油状液体,沸点较低(34 ℃),能与乙醇、乙醚和丙酮等有机溶剂混溶。异戊二烯含有共轭双键[2],是萜烯类物质生物合成的共同前体,化学性质非常活泼,能与多种化合物发生共聚合反应,用于合成橡胶、弹性体、类异戊二烯药物等重要的化工原料和药物[3-4]。在工业生产中,异戊二烯主要通过萃取精馏法和共沸精馏法[5]从C5馏分中分离,虽然化学合成和分离的技术在不断地改进和成熟,但是随着石油的逐渐耗尽及不可再生性,材料短缺将会成为工业生产异戊二烯的瓶颈。利用微生物发酵[6]能够得到单体异戊二烯,具有成本低廉、产量较高、生产周期较短、污染少等优点,已经成为近年来该领域研究学者颇为关注的生产方法。据文献报道,产异戊二烯的野生菌中以杆菌产量最大,但产量很低不能满足工业生产[7]。因此通过基因工程手段改造菌株代谢途径,实现异戊二烯的大规模生产有着极为乐观的前景。
1 异戊二烯的生物合成途径
生物合成异戊二烯主要有两条途径[8]:甲羟戊酸(mevalonate pathway,MVA)途径和甲基赤藓糖醇磷酸(2-C-methyl-D-erythritol 4-phosphate,MEP)途径。MVA途径由Lynen等[9]发现,并由Newman等[10]阐明。该途径主要存在于真核生物、古菌和高等植物的细胞质基质[11-12]中,主要合成倍半萜、甾醇等三萜以及一些多萜化合物。在MVA途径发现后的30多年里,人们普遍认为所有的生物都能够通过该途径合成萜类物质。1999年,Rohmer等[13]发现了合成萜类物质的另一条途径——甲基赤藓糖醇磷酸(MEP)途径,并由Lichtenthaler[14]阐明,也称为1-脱氧-D-木酮糖-5-磷酸(1-deoxy-D-xylulose-5-phosphate pathway,DXP)途径。该途径主要存在于大多数细菌、绿藻和高等植物的叶绿体[13,15]内,主要合成单萜、二萜以及类胡萝卜素、叶绿素、质体醌等多萜化合物。一些真细菌和高等植物的质体中同时存在[16-17]这两条途径。将葡萄糖转换为IPP时,MVA途径和MEP途径在化学计算、能量损耗和氧化/还原平衡等方面存在较大差异[18],其中,MVA途径能量损耗较少,而MEP途径具有较高的理论收率。此外,构建MVA代谢途径的大肠埃希菌和MEP途径的蓝细菌均能合成异戊二烯[19]。
1.1 MVA途径
两分子乙酰CoA (acetyl coenzyme A, AcCoA)在乙酰乙酰CoA硫解酶(acetoacetyl-CoA thiolase,AtoB)的作用下形成乙酰乙酰CoA(acetoacetyl-CoA,AACoA),经过羟甲基戊二酸CoA合酶(hydroxymethylglutaryl-CoA synthase, HMGS)催化形成3-羟基-3-甲基戊二酰CoA(hydroxymethylglutaryl-CoA, HMG-CoA),然后再在羟甲基戊二酰CoA还原酶(hydroxymethylglutaryl-CoA reductase, HMGR)的作用下与两分子NADPH生成甲羟戊酸(mevalonate,MVA),再经甲羟戊酸激酶(mevalonate kinase,MK)的催化作用,形成甲羟戊酸-5-磷酸(mevalonate-5-phosphate,MVAP),接着在磷酸甲羟戊酸激酶(phosphomevalonate kinase,PMK)催化作用下生成甲羟戊酸-5-二磷酸(mevalonate-5-diphosphate,MVAPP),再经甲羟戊酸焦磷酸脱羧酶(mevalonate pyrophosphate decarboxylase,MPD)催化形成异戊烯基焦磷酸(isopentenyl diphosphate, IPP),以IPP为前体合成异戊二烯(图1)。
1.2 MEP途径
DXP途径开始于糖酵解的中间产物——丙酮酸(pyruvate)和甘油醛-3-磷酸(glyceraldehyde-3-phosphate,G3P)。丙酮酸和G3P通过1-脱氧-D-木酮糖-5-磷酸合酶(1-deoxy-D-xylulose-5-phosphate synthase, DXS)缩合形成DXP,DXP在脱氧木酮糖磷酸盐还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoisomerase, IspC)的作用下还原为MEP,随后由4-二磷酸胞苷-2-C-甲基-D-赤藓糖醇合酶(4-diphosphocytidyl-2-C-methyl-D-erythritol synthase,IspD)、4-二磷酸胞苷-2-C-甲基-D-赤藓糖醇激酶(4-diphosphocytidyl-2-C-methyl-D-erythritol kinase,IspE)、2-C-甲基-D-赤藓糖醇2,4-环焦磷酸合成酶(2-C-methyl-D-erythritol 2,4-cyclodiphosphate synthase,IspF)、1-羟基-2-甲基-2-(E)-丁烯基-4-焦磷酸合酶(1-hydroxy-2-methyl-2-(E)-butenyl 4-diphosphate synthase,IspG)、1-羟基-2-甲基2-(E)-丁烯基-4-焦磷酸还原酶(1-hydroxy-2-methyl-butenyl 4-diphosphate reductase,IspH)编码的5种酶催化连续反应,使DXP转化为IPP和二甲基烯丙基焦磷酸(dimethylallyl diphosphate, DMAPP)。IPP及其异构体DMAPP可通过由isopentenyl pyrophosphate isomerase(Idi)编码的异戊烯基二磷酸异构酶(isopentenyl phosphate isomerase, IPI)进行相互转换。异戊二烯合成酶(isoprene synthase, IspS)催化DMAPP形成异戊二烯(Isoprene)(图1)。
MVA途径和MEP途径分别通过相关的酶系进行催化还原合成异戊二烯。IPP和DMAPP是异戊二烯和其他类异戊二烯(如甾醇、类胡萝卜素、长醇)生物合成的通用前体,其中IPP 是两条途径的共同中间体,两条途径所产生的IPP可以穿过质体膜互为对方所用[8],但IPP如何跨膜传递的机理尚不清楚。IPP在异戊烯基焦磷酸异构酶(isopentenyl pyrophosphate isomerase,Idi)的作用下部分转化为双键异构体DMAPP,从而合成异戊二烯。IspS催化DMAPP合成异戊二烯,已从银白杨(Populusalba)[20]、银白杨×欧洲山杨(P.alba×P.tremula)、越南葛藤(Puerariamontana)[21]等植物中克隆和鉴定,但迄今没有原核生物IspS序列的相关报道。
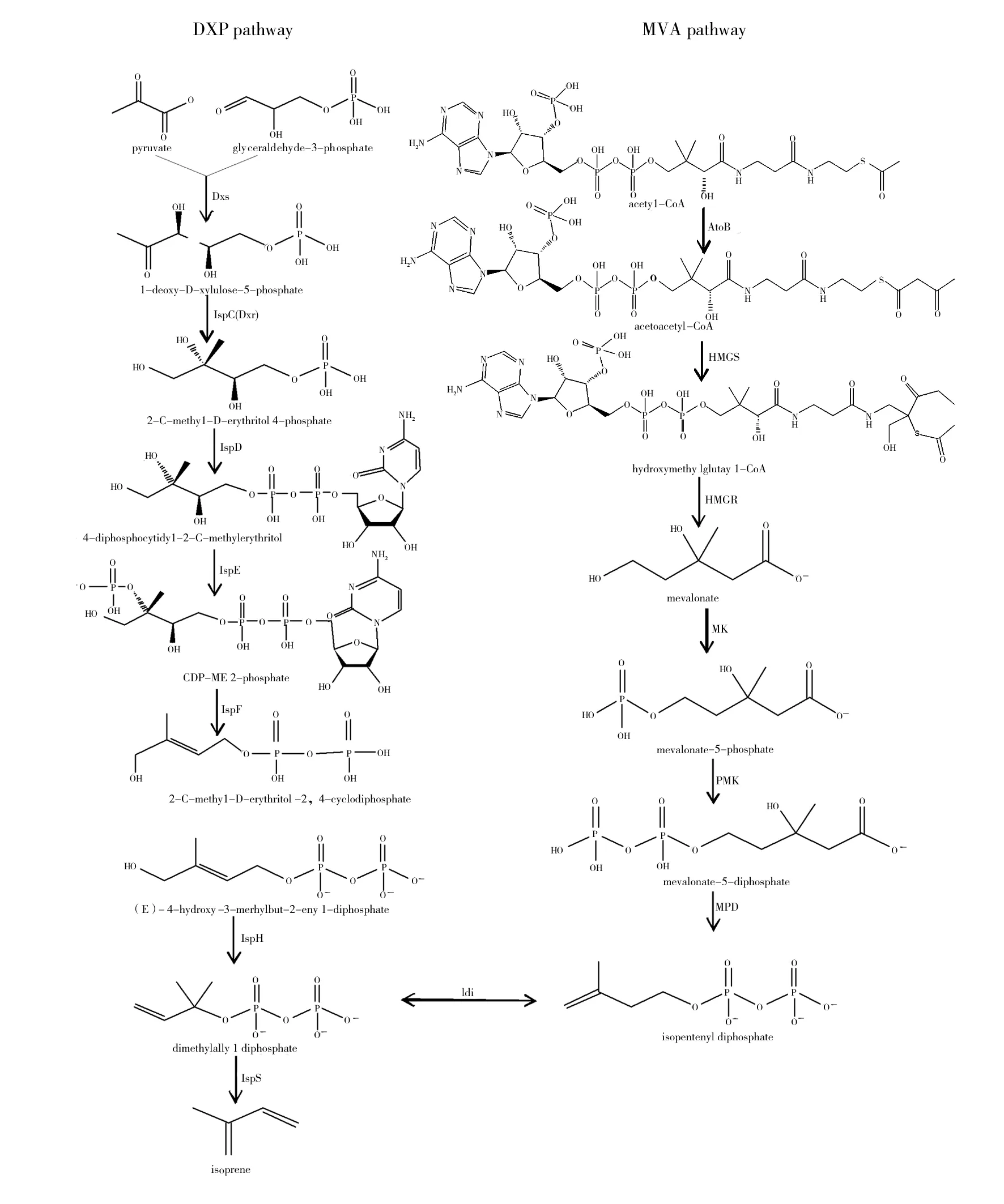
图1 异戊二烯生物合成途径Fig.1 Pathways of isoprene biosynthesis
2 植物合成异戊二烯
植物挥发的众多有机碳氢化合物中,主要成分为异戊二烯,它的合成和释放对全球变化和环境污染有着极其重要的作用。自从首次报导[22]植物能够产生并释放异戊二烯以来,陆续发现很多种绿色植物[23]具有释放这种挥发性化合物的能力,如金叶刺槐(RobiniapseudoacaciaL.)、欧洲黑杨(PopulusnigraL.)、白柳(SalixalbaL.)、锦熟黄杨(BuxussempervirensL.)等。植物主要通过叶片释放异戊二烯,其产生与光照、温度以及叶片的生长紧密相关。研究发现,植物产异戊二烯是即时产生即时释放的,没有专门的贮藏组织,且不能从叶绿体中分离到完整的异戊二烯合成系统。异戊二烯的生物合成主要依赖新固定的碳水化合物,同时受叶绿体ATP水平的控制。目前,在植物中发现并分离纯化一种产异戊二烯酶——异戊二烯合成酶(Isoprene synthase,IspS)。Silver等[24]利用欧洲山杨叶中提取的活性物质,以二甲基丙烯基二磷酸为原料合成了异戊二烯,提取的活性物质pH=8时,活性较高。异戊二烯在大气中的年均排放量与甲烷相当,收集大气中的异戊二烯作为一种可持续的新能源却鲜有报道,但由于其收集难度大、太阳能转化效率低[25],因此目前很难利用植物体大规模生产异戊二烯。
3 微生物合成异戊二烯
微生物具有个体小、生长快、能够利用可再生底物资源等优点,因此利用微生物发酵生产异戊二烯,具有成本低廉、产量较高、生产周期较短、环境污染少等优点。合成异戊二烯的野生型菌株种类较多,但是含量较少,并不能满足生产需求,因此,迫切需要绿色环保高产的异戊二烯生物合成技术与手段。
3.1 合成异戊二烯的微生物
Kuzma等[7]通过气相色谱-质谱(GC-MS)联用仪检测发现,Bacillusamyloliquefaciens、B.subtilis、Acinetobactercalcoaceticus等细菌均能产生异戊二烯,其中,芽胞杆菌产异戊二烯的能力最强,在LB培养基中的平均浓度为8.5 nmol/(g·h)。普遍来说,处于对数期的细菌产生的异戊二烯量多于稳定期。细菌在不同培养基(如M9、M9T、2×SG、LB)中异戊二烯的产量不同,其中在LB培养基中产量相对较高。在搅拌发酵罐中培养芽胞杆菌时,加入新鲜的培养基能够恢复异戊二烯的高生产速率。此外,有氧和无氧条件下都会产生异戊二烯,芽胞杆菌产异戊二烯的最适温度为45 ℃,该温度也是山杨叶片释放异戊二烯[26]以及催化IspS活性的最适温度。Scholler等[27]利用GC-MS检测到26株放线菌共产生120多种挥发性有机物,并发现其中的22株放线菌能够产生异戊二烯,但是并没有检测异戊二烯释放量。Berenguer等[28]发现Eurotiumamstelodami(阿姆斯特丹散囊菌)也能合成异戊二烯。
细菌中芽胞杆菌产异戊二烯的含量相对较多,因此,Wagner等[29]通过研究B.subtilis6051野生型菌株在生长阶段以及孢子形成阶段合成异戊二烯的独特模式,发现生长在葡萄糖-蛋白胨培养基上的B.subtilis6051产生异戊二烯分为三个阶段:①葡萄糖的分解代谢和羟基丁酮的分泌;②羟基丁酮的分解代谢;③孢子形成初期。B.subtilis6051在孢子形成时期产生的异戊二烯量达到峰值,根据该结果建立了研究异戊二烯代谢机制的实验系统。
3.2 高效异戊二烯菌株的构建
野生型微生物菌株产异戊二烯量少,虽然芽胞杆菌具有较强的产异戊二烯能力,但无法满足工业生产的要求。因此可通过基因工程和代谢工程手段高效率生产异戊二烯的菌株,从而提高异戊二烯产量。可在对微生物异戊二烯的代谢网络和代谢途径深入研究的基础上,通过基因工程手段提高参与异戊二烯合成的关键酶和辅助因子的活性,获得高产异戊二烯的菌株,通过优化发酵条件实现生物橡胶单体异戊二烯的规模化生产。
3.2.1E.coli的基因修饰 大肠埃希菌作为一种模式生物,拥有MEP途径,但由于缺乏异戊二烯合成酶基因,野生型的大肠埃希菌不具有合成异戊二烯的功能,可通过MEP途径合成萜类化合物。大肠埃希菌的发酵工艺能够实现基因工程菌株的低成本大规模生产。因此,从可再生资源的角度考虑,可通过基因工程手段构建大肠埃希菌合成异戊二烯的合成途径,从而提供一个异戊二烯生产系统。
Miller等[30]首次从白杨中分离到异戊二烯合成酶(IspS)的完整功能性基因,并在E.coli中成功表达,携带异戊二烯合成酶基因的大肠埃希菌菌株可在发酵罐中生产异戊二烯。
苏思正等[31]将来源于银白杨的IspS基因按照E.coli密码子偏爱性进行优化,并克隆到表达载体上,在E.coliBL21(DE3)中异源表达,采用镍柱亲和层析纯化重组蛋白并测定IspS活性,并通过摇瓶发酵实验对重组菌产异戊二烯进行进一步研究。结果表明,IspS能够在E.coli中高效表达,重组菌的异戊二烯产量达到 60 μg/L。
Zhao 等[32]将IspS基因转化到E.coli中,构建出合成异戊二烯的MEP途径,通过过度表达dxs和dxr可使异戊二烯的产量提高到314 mg/L。Yang 等[33]通过在大肠埃希菌中引入MVA途径(来源于酿酒酵母)和异戊二烯合成酶基因(来源于银白杨)生产异戊二烯。将来源于不同生物体中的异戊二烯合成酶基因导入E.coli进行表达,结果显示,外源的异戊二烯合成酶基因有利于异戊二烯的产生,且对菌体的生长无明显抑制作用,其中来源于银白杨的异戊二烯合成酶基因表达产物的酶活性最高。将酿酒酵母的MVA途径的上下游途径基因转入大肠埃希菌表达,摇瓶发酵和分批补料发酵结果表明,在分批补料发酵中异戊二烯的产量达到532 mg/L,是目前为止生物合成异戊二烯的最高产量。Ilmena 等[34]通过基因挖掘技术分离出新的异戊二烯合成酶并在大肠埃希菌中成功表达。通过序列同源性搜索、多重序列比对以及构建系统发育树找出编码异戊二烯合成酶的候选基因,克隆IspS基因并诱导其在大肠埃希菌中进行功能性表达。结果显示,来自于甘薯、芒果、杜英的三种酶具有异戊二烯合成酶活性,其中,甘薯异戊二烯合成酶产生的异戊二烯量最多、速率最快。
3.2.2B.subtilis的基因修饰 枯草芽胞杆菌是一种革兰阳性、产孢、杆状土壤细菌,底物范围广、代谢潜力大、生长速率较高,且能在严苛的环境下(如低pH、高温、高盐浓度)存活,能利用戊糖、己糖、木质纤维素为底物,产异戊二烯能力比细菌更高,因此被作为过表达异戊二烯的宿主。同时,枯草芽胞杆菌已被美国食品药物管理局列入GRAS认证(Generally Recognized as Safe)。Wagner等[35]为了追踪B.subtilis中异戊二烯的代谢途径,用13C-和2H-标记的方法以及利用GC-MS对释放的异戊二烯进行分析检测,证明了与异戊二烯生物合成途径相关的如下证据:①[13C]I来自于[13C]pyruvates;②一定浓度的辛代他汀抑制HMGR而不抑制B.subtilis;③B.subtilis基因组中无HMGR基因序列(MVA途径必须存在的基因);④亮氨酸(Leu)的降解可能作为合成异戊二烯的碳骨架,但在5,5,5-[2H3]-Leu或isoprophyl-[2H7]-Leu中并没有检测到重氢,而当氨基酸降解时,可形成异戊二烯。这些证据表明,B.subtilis中存在MEP代谢途径中的关键酶基因,B.subtilis通过MEP途径生物合成异戊二烯。Julsing等[36]对B.subtilis中参与MEP途径的相关基因进行基因敲除,然后测试突变菌株的异戊二烯产量。结果表明,部分突变菌株合成异戊二烯的能力降低,如dxs-,dxr-,IspD-,IspE-,IspF-,IspH-;部分突变菌株合成异戊二烯的能力无明显改变,如IspS-;还有部分突变株几乎不再合成异戊二烯,如IspG-,IdiⅠ-,IdiⅡ-。Xue等[37]通过对B.subtilis中的DXP途径进行基因修饰提高异戊二烯的产量。通过过表达dxs、dxr、dxs和dxr共同过表达,以及SigB的缺失突变,表明dxs过表达可增加异戊二烯产量,dxr过表达时产量不变。此外热、盐、氧化应激诱导异戊二烯的产生,而乙醇则抑制异戊二烯的产生。
4 展 望
目前为止,任何数据库中都没有原核生物的ispS序列。现有的异戊二烯合成酶都是从植物中分离纯化,细菌中的异戊二烯合成酶基因还未被鉴定。可通过构建微生物的异戊二烯合成酶基因文库,分离纯化出细菌的IspS序列,提高异戊二烯合成酶的表达效率。进一步通过分离得到的IspS序列设计探针,高效快速地筛选产异戊二烯的微生物,解决合成异戊二烯的原料问题。异戊二烯的生物合成方法主要依靠自然界中存在的萜类代谢途径的酶系,可通过基因敲除手段或基因突变技术获得合成异戊二烯途径中的关键酶,从而通过反馈调节代谢途径流向,更多地积累异戊二烯。在野生型菌株中,很多蛋白不能或者只能微量表达,导致异戊二烯低产,想要实现异戊二烯的工业化生产,可通过代谢工程手段获得高效率生产异戊二烯的生产菌株,并通过对微生物细胞内异戊二烯在细胞内的代谢网络和代谢途径进行深入研究,拟定出一整套加强和完善代谢过程中关键酶和辅助因子的方案,进而通过基因工程手段改造并获得高产异戊二烯的生产菌株,最后通过发酵法实现生物橡胶单体异戊二烯的规模化生产。进一步研究利用代谢工程手段改造菌株代谢途径,完善生产工艺和技术体系从而实现异戊二烯的大规模生产。
[1] Rohmer M, Seemann M, Horbach S. Glyceraldehyde 3-phosphate and pyruvate as precursors of isoprenic units in an alternative non-mevalonate pathway for terpenoid biosynthesis[J].American Chemical Society, 1996,118(11): 2564-2566.
[2] 岳鹏. 异戊二烯的生产技术及市场分析[J]. 炼油与化工, 2006, 17(2): 3-5.
[3] Kesselmeier J, Staudt M. Biogenic volatile organic compounds (VOC): an overview on emission, physiology and ecology[J]. Journal of atmospheric chemistry, 1999, 33(1): 23-88.
[4] Stephanopoulos G. Challenges in engineering microbes for biofuels production[J]. Science, 2007, 315(5813): 801-804.
[5] 李东风, 马立国. 裂解碳五馏分分离技术的研究进展[J]. 石油化工, 2007, 36(8): 755-762.
[6] Lindberg P, Park S, Melis A. Engineering a platform for photosynthetic isoprene production in cyanobacteria, usingSynechocystisas the model organism[J]. Metabolic Engineering, 2010, 12(1): 70-79.
[7] Kuzma J, Marshall MN, Pollock WH, et al. Bacteria produce the volatile hydrocarbon isoprene[J]. Current Microbiology, 1995, 30(2): 97-103.
[8] Kuzuyama T. Mevalonate and nonmevalonate pathways for the biosynthesis of isoprene units[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(8): 1619-1627.
[9] Lynen F. Biosynthetic pathways from acetate to natural products[J]. Pure and Applied Chemistry, 1967, 14(1): 137-168.
[10]Newman JD, Chappell J. Isoprenoid biosynthesis in plants: carbon partitioning within the cytoplasmic pathway [J]. Critical Reviews in Biochemistry and Molecular Biology, 1999, 34 (2): 95-106.
[11]Goldstein J, Brown M. Regulation of the mevalonate pathway[J]. Nature, 1990, 343(6257): 425-430.
[12]Bloch K. Sterol molecule: structure, biosynthesis, and function[J]. Steroids,1992, 57(8): 378-383.
[13]Rohmer M. The discovery of a mevalonate-independent pathway for isoprenoid biosynthesis in bacteria, algae and higher plants[J]. Natural Product Reports, 1999, 16: 565-574.
[14]Lichtenthaler HK. The 1-deoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plant[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1999, 50: 47-65.
[15]Lichtenthaler HK. Non-mevalonate isoprenoid biosynthesis: enzymes, genes and inhibitors[J]. Biochemical Society Transactions, 2000, 28(6): 785-789.
[16]Takagi M, Kuzuyama T, Takahashi S, Seto H. A gene cluster for the mevalonate pathway fromStreptomycessp. strain CL190[J]. Journal of Bacteriology, 2000, 182(15): 4153-4157.
[17]Kuzuyama T, Takagi M, Takahashi S, et al. Cloning and characterization of 1-deoxy-D-xylulose 5-pHospHate synthase fromStreptomycessp. strain CL190, which uses both the mevalonate and nonmevalonate pathways for isopentenyl diphosphate biosynthesis[J]. Journal of Bacteriology, 2000,182(4): 891-897.
[18]Steinbüchel A. Production of rubber-like polymers by microorganisms[J]. Current Opinion Microbiology, 2003, 6(3): 261-270.
[19]Cervin MA, Whited GM, Chotani GK, et al. Compositions and methods for producing isoprene[P]. United States Patent, 2012, 12/335, 071.
[20]Sasaki K, Ohara K, Yazaki K. Gene expression and characterization of isoprene synthase fromPopulusalba[J]. FEBS Letters, 2005, 579(11): 2514-2518.
[21]Sharkey TD, Yeh S, Wiberley AE, et al. Evolution of the isoprene biosynthetic pathway in kudzu[J]. Plant Physiology, 2005, 137(2): 700-712.
[22]Sanadze JA. Emission of organic matters by leaves ofRobiniapseudoacaciaL.[J]. Soobshch Akad Nauk Gruz SSR, 1957, 19: 83.
[23]Sharkey TD, Yeh S. Isoprene emission from plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 2001, 52:407-436.
[24]Silver GM, Fall R. Enzymatic synthesis of isoprene from dimethylallyl diphosphate in aspen leaf extracts[J]. Plant Physiology, 1991, 97(4): 1588-1591.
[25]Melis A. Solar energy conversion efficiencies in photosynthesis: minimizing the chlorophyll antennae to maximize efficiency[J]. Plant Science, 2009, 177(4): 272-280.
[26]Monson RK, Jaeger CH, Fall R, et al. Relationships among isoprene emission rate, photosynthesis, and isoprene synthase activity as influenced by temperature[J]. Plant Physiology, 1992, 98(2): 1175-1180.
[27]Scholler CE, Gurtler H, Pedersen R, et al. Volatile Metabolites from Actinomycetes[J]. Journal of Agriculture and Food Chemistry, 2002, 50(9): 2615-2621.
[28]Berenguer J A, Calderon V, Herce M D, et al. Spoilage of a bakery product by isoprene-producing molds[J]. Revista de Agroquimica y Tecnologia Alimentos(spain), 1991, 31(4): 580-583.
[29]Wagner WP, Marshall MN, Fall R. Three distinct phases of isoprene formation during growth and sporulation ofBacillussubtilis[J]. Journal of Bacteriology, 1999, 181(15): 4700-4703.
[30]Miller B, Oschinski C, Zimmer W. First isolation of an isoprene synthase gene from poplar and successful expression of the gene inEscherichiacoli[J]. Rapid Communication, 2001, 213(3): 483-487.
[31]苏思正, 刘建忠, 杨建明, 等. 异戊二烯合成酶(IspS)在大肠杆菌中的表达及其产异戊二烯的研究[J]. 生物加工过程, 2011, 9(3): 6-10.
[32]Zhao YR, Yang JM, Qin B, et al. Biosynthesis of isoprene inEscherichiacolivia methylerythritol phosphate (MEP) pathway[J]. Applied Microbiology and Biotechnology, 2011, 90(6): 1915-1922.
[33]Yang JM, Zhao G, Sun YZ, et al. Bio-isoprene production using exogenous MVA pathway and isoprene synthase inEscherichiacoli[J]. Bioresource Technology, 2012, 104: 642-647.
[34]Ilmena M, Ojaa M, Huuskonen A, et al. Identification of novel isoprene synthases through genome mining and expression inEscherichiacoli[J]. Metabolic Engineering, 2015, 31: 153-162.
[35]Wagner WP, Helmig D, Fall R. Isoprene biosynthesis inBacillussubtilisvia the methylerythritol phosphate pathway[J]. Journal of Natural Products, 2000, 63(1): 37-40.
[36]Julsing MK, Rijpkema M, Woerdenbag HJ, et al. Functional analysis of genes involved in the biosynthesis of isoprene inBacillussubtilis[J]. Applied Microbiology and Biotechnology, 2007, 75(6): 1377-1384.
[37]Xue JF,Ahring BK. Enhancing Isoprene Production by Genetic Modification of the 1-Deoxy-D-Xylulose-5-Phosphate Pathway inBacillussubtilis[J]. Applied and Environmental Microbiology, 2011,77(7): 2399-2405.
Advances in Isoprene Biosynthesis
ZHANG Wen-wen1, 2, 3, ZENG Ri-zhong2, YANG Li-fu2, GU Jin-gang1
(1.Inst.ofAgric.Res. &Reg.Planning,ChineseAcad.ofAgric.Sci.,Agric.Cult.Collect’nofChina,Beijing100081; 2.KeyLab.ofBiol.&Gen.Res.ofRubberTree,RubberRes.Inst.,ChineseAcad.ofTrop’lAgric.Sci.,Danzhou571737; 3.Coll.ofEnviron't&PlantProtect.,HainanUni.,Haikou570100)
Isoprene (2-methyl-1, 3-butadiene) being the simplest member of the isoprenoids, is an important precursor in the synthetic rubber and widely used for perfume or spices and new pesticides. Isoprene is relied mainly on fossil fuel, yet high cost production and environment pollutivesome. Biosynthesis of isoprene possesses huge potential application value. This paper reviewed the main biosynthesis pathway and advances in isoprene.
isoprene; biosynthesis; MVA pathway; MEP pathway
张雯雯 女,硕士研究生。研究方向为微生物资源。E-mail:m15501856091@163.com
* 通讯作者。顾金刚 男,研究员。研究方向为微生物资源。E-mail:gujingang@caas.cn
2016-01-29;
2016-03-02
Q939.9
A
1005-7021(2016)06-0098-06
10.3969/j.issn.1005-7021.2016.06.017
杨礼富 男,博士,研究员,硕士生导师。研究方向为微生物生理生化与分子生物学。E-mail:ylfri@126.com
