模拟人体尿道插管法行小鼠尿动力学检测*
2016-03-05胡海峰邢莎莎张汉超杨亚飞
陈 林, 杨 进△, 胡海峰, 邢莎莎, 张汉超, 喻 备, 杨亚飞
(成都大学附属医院1泌尿外科,2中心实验室,四川 成都 610081)
·实验技术·
模拟人体尿道插管法行小鼠尿动力学检测*
陈林1,杨进1△,胡海峰1,邢莎莎2,张汉超1,喻备1,杨亚飞1
(成都大学附属医院1泌尿外科,2中心实验室,四川 成都 610081)
[摘要]目的: 国际上传统的小鼠尿动力学检测方法为膀胱造瘘法。该传统方法破坏膀胱连续性,与临床上广泛采用的经尿道法有明显的差异。本研究寻找到合适的小鼠导尿管材,拟探讨模拟人体经尿道插管法行小鼠尿动力学检测的优势和应用价值。方法: 雌性小鼠8只,选择小儿留置针软芯进行导尿,并作为测压管和膀胱灌注管,经三通外接微量泵以及压力感受器。直肠测压采用硬膜外麻醉导管,外套乳胶手套小指末端一截制成球囊,然后导入小鼠直肠。结果: 该方法成功收集到以下尿动力学指标:膀胱基础压力(BBP)、膀胱漏尿点压(BLPP)、最大排尿压(MVP)、膀胱最大容量(MBC)、残余尿量(PVR)、排尿量(VV)、排尿效率(EV)和膀胱顺应性(BC)。结论: 本研究首次成功模拟人体经尿道插管法,实现小鼠尿动力学检测,成功避免膀胱造瘘对小鼠尿动力学的影响,检测后的小鼠能够长期生存,可以顺利进行后续分子和基因实验。
[关键词]小鼠; 尿动力学; 膀胱造瘘术; 尿道插管术
目前国际上关于尿动力学的研究已经深入到基因和分子水平,小鼠因其基因敲除方法成熟而成为研究者通常选择的研究对象[1],但小鼠的尿道较细,缺乏精细的管材进行导尿测压,国际上传统的小鼠尿动力学检测方法为膀胱造瘘法[2-4]。该传统方法破坏膀胱连续性,且与人体的经尿道插管法有明显的差异。最新的研究结果发现膀胱造瘘法与尿道插管法检测大鼠尿动力时,膀胱最大放电频率、膀胱压力以及膀胱最大容量(maximum bladder capacity,MBC)等重要指标有显著差异[5]。本课题拟在前期寻找到适合小鼠导尿的管材基础上,探讨模拟人体经尿道插管法行小鼠尿动力学检测的优势和应用价值。
材料和方法
1研究对象
雌性SPF级C57BL/6J小鼠8只,8~10周龄,体重22~25 g,购自成都达硕实验动物有限公司,合格证号SCXK(川)2015-030。
2主要试剂和仪器
小鼠导尿管为小儿留置针(26G);测压导管为连续硬膜外麻醉导管及三通转换接头;尿动力学检查仪为Laborie产品;微量注射泵(长沙健源医疗科技有限公司JZB-1800D型);麻醉药乌拉坦为Sigma产品。
3尿动力学检测方法
小鼠称重后, 腹腔注射25%尿烷(1.0 g/kg)麻醉[6],仰卧位平放小鼠。将小儿留置针去除针芯,注射生理盐水排气,丁卡因胶浆润滑表面后行小鼠导尿。导尿手法为:一手拿显微镊,钳夹尿道外口,向上提起以绷直尿道,另一手拿留置针轻轻插入尿道,进针约1~1.2 cm。导尿成功后,空针抽吸排空小鼠膀胱,联接延长管及三通,三通外接测压管和微量注射泵。直肠测压参考国内邝兆进等[7]的方法, 采用硬膜外麻醉导管,外套乳胶手套小指末端制成球囊,然后导入小鼠直肠1.5 cm(图1)。管道连接成功后体内置零,然后开启微量注射泵向膀胱内灌注生理盐水,泵水速度为1 mL/h。观察膀胱和直肠压力变化,记录膀胱基础压力(basal bladder pressure,BBP),同时检查小鼠有无尿液溢出,此时的压力为膀胱漏尿点压(bladder leak point pressures,BLPP)。停止灌注并记录灌注时间及最大膀胱排尿压(maximum voiding pressure,MVP)。排尿结束后以1 mL注射器抽出膀胱内残余尿。腹压漏尿点压(abdomen leak point pressure,ALPP)的检测方法是在灌注至膀胱最大容量一半时,缓缓按压小鼠上腹部以模拟Valsalva动作,观察有无尿液溢出,若有尿液溢出,记录此时的膀胱压力。若没有尿液溢出,继续灌注并测压,重复上述实验3次。检测完毕后,用碘伏消毒尿道外口及肛门。
4膀胱测压指标
BBP;BLPP;ALPP;最大排尿压(maximum voiding pressure,MVP);膀胱最大容量(maximum bladder capacity,MBC),即灌注量(infused volume)=灌注时间×灌注速度;残余尿量(post-void residual urine volu-me,PVR);排尿量(voiding volume, VV) =MBC-PVR;排尿效率(efficiency of voiding,EV)=VV/MBC×100%;膀胱顺应性(bladder compliance,BC)= MBC/BLPP。

Figure 1.Urethral catheterization and anal intubation on the mouse.
图1小鼠尿道和直肠插管测压
5统计学处理
用EXCEL软件对资料进行统计分析,计量资料均采用均数±标准差(mean±SD)表示。
结果
1经尿道插管法对小鼠膀胱压力曲线的影响
经尿道插管法检测到小鼠膀胱压力曲线如图2,在充盈到膀胱容量一半时按压小鼠上腹部模拟Valsalva动作,腹腔压力仍然呈一水平曲线,提示腹腔压力检测不灵敏。相反,膀胱压力却有明显升高,但始终无尿液溢出,提示未到达排尿所需压力水平。此时继续灌注膀胱,当灌注压力达到最大膀胱容量时,逼尿肌开始收缩,膀胱压力明显升高,达到BLPP水平后即有尿液排出,膀胱压力随之逐渐下降,压力曲线呈周期性峰型。继续灌注膀胱,进入下一个排尿周期。
2经尿道插管法测定小鼠尿动力指标及结果
8只小鼠均采用尿道插管法完成尿动力指标检测,除ALPP未测出,其余指标均良好收集。实验测得小鼠BBP介于8~15 cmH2O,BLPP介于35~46 cmH2O,MVP介于42~62 cmH2O,MBC介于0.10~0.14 mL,PVR介于0.04~0.06 mL,VV介于0.06~0.10 mL,EV介于53.85%~71.43%,BC介于2.17~4.00 mL/cmH2O。上述尿动力学指标见表1。

Figure 2.Urodynamic curves of the mouse.
图2小鼠尿动力学曲线
表1经尿道插管法测得小鼠尿动力学指标
Table 1.The mouse urodynamic indexes tested by urethral catheterization method (Mean±SD.n=8)
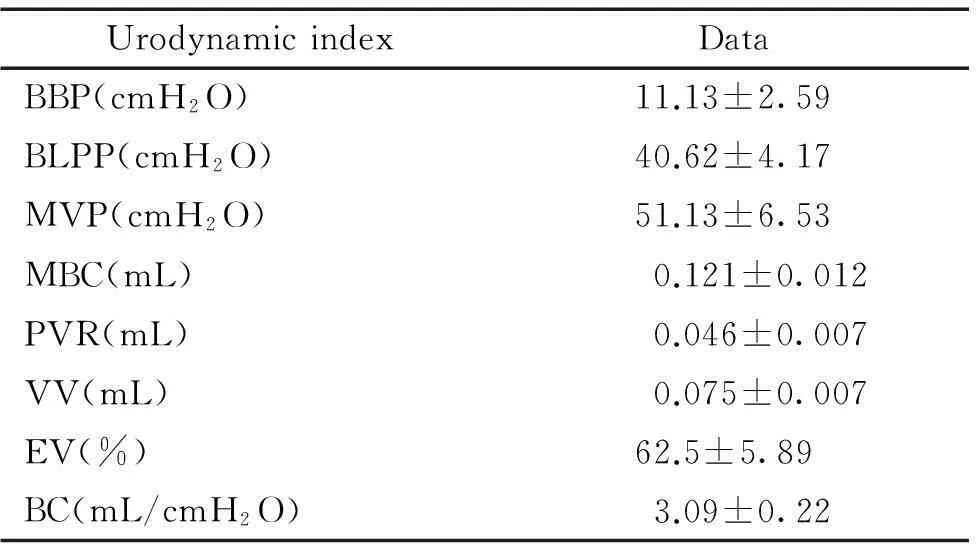
UrodynamicindexDataBBP(cmpO)11.13±2.59BLPP(cmpO)40.62±4.17MVP(cmpO)51.13±6.53MBC(mL)0.121±0.012PVR(mL)0.046±0.007VV(mL)0.075±0.007EV(%)62.5±5.89BC(mL/cmpO)3.09±0.22
BBP: basal bladder pressure; BLPP: bladder leak point pressure; MVP: maximum voiding pressure; MBC: maximum bladder capacity; PVR: post-void residual urine volume; VV: voiding volume; EV: efficiency of voiding; BC: bladder compliance.
讨论
以往有关尿动力学的研究多选择兔或大鼠作为研究对象,因为稍大的动物其尿道直径更大,方便导尿行尿动力学检测[8-10],但缺点是兔和大鼠购买及饲养成本高,造模周期长,且缺乏一些深入研究的成熟模型,如基因敲除模型。因此,研究者们把目光投向更小的实验动物小鼠,小鼠基因敲除方法成熟可以进行更加深入的研究[1],但小鼠的尿道较细,缺乏精细的管材进行导尿测压,国际上传统的小鼠尿动力学检测方法为膀胱造瘘法[2-4]。该传统方法破坏膀胱连续性,与人体的经尿道插管法有明显的差异。赖焕玲等[5]对2组大鼠行膀胱造瘘法或尿道插管法检测尿动力学和膀胱放电频率,发现造瘘法测得的膀胱最大放电频率明显低于插管法,MBC也显著下降,但膀胱压力指标比插管法高。由此可见,2种方法的检测结果存在较大差异,如果用膀胱造瘘法的动物实验结果指导临床研究无疑会产生较大偏差,在临床上不可能让患者做膀胱造瘘手术后再行尿动力学检查。
因此,本文在学者们深入基因水平研究时钟爱的研究对象小鼠身上模拟人体经尿道插管法行尿动力学检测。经检索国内外文献,未发现可借鉴的实验方法。本研究经反复实验和探索,发现小儿留置针为可用之材,结合临床上使用的微量泵,可成功模拟人体尿道插管法行小鼠尿动力学检测,检测指标包括膀胱基础压力、膀胱漏尿点压、最大排尿压、膀胱容量、残余尿量、顺应性等,其中膀胱容量指标MBC和压力指标MVP较国外学者Franken等[3]采用膀胱造瘘法测定11~13周龄C57BL/6J小鼠高。分析原因,可能与膀胱造瘘时结扎造瘘管导致膀胱壁部分缺损有关,小鼠膀胱容量本属微量,这部分容量损失不容忽视。同时,膀胱造瘘损伤膀胱顶部,该区域是膀胱起搏细胞Cajal间质细胞集中的区域,它们的损伤必然会影响膀胱逼尿肌的协调性和收缩力[11-12]。这从膀胱压力曲线的区别也能证明,国外学者Aro等[4]测得膀胱周期内压力曲线存在双峰或多峰,表明逼尿肌存在不稳定收缩,而本研究均为单峰(图2)。
但是,本研究测得的排尿效率较低,最低值甚至仅为53.85%,最高值也只有71.43%,提示残余尿量较高。国际上普遍认为,残余尿量超过膀胱容量的20%就证明存在膀胱出口梗阻[13]。显然,本研究中所使用的小儿留置针软芯作为小鼠导尿管材,仍然存在明显缺陷,更加精细的小鼠导尿管材有待开发。本研究的另一不足之处是,当按压小鼠上腹部模拟Valsalva动作时,膀胱压力有波动,但直肠测压并无变化,提示该测压装置灵敏度差。人工自制的直肠测压管不能满足精细实验的需要,尚需进一步改进。
综上所述,采用小儿留置针软芯能够实现小鼠尿动力学的检测。经文献分析,这是在国际上属首次模拟人体尿道插管法检测小鼠尿动力,该方法的微创性与可重复性显而易见,值得在未来尿控领域的研究尝试使用。但是目前的小鼠导尿管和直肠测压装置还有待改进,相信未来会有工业化产品出现。
[参考文献]
[1]Kanno Y, Mitsui T, Kitta T, et al. The inflammatory cytokine IL-1β is involved in bladder remodeling after bladder outlet obstruction in mice[J]. Neurourol Urodyn, 2015 Jan 3. doi: 10.1002/nau.22721. [Epub ahead of print]
[2]Uvin P, Everaerts W, Pinto S, et al. The use of cystometry in small rodents: a study of bladder chemosensation[J]. J Vis Exp, 2012(66): e3869.
[3]Franken J, Gevaert T, Uvin P, et al. Urodynamic changes in mice with experimental autoimmune encephalomyelitis correlate with neurological impairment[J]. Neurourol Urodyn, 2015 Mar 1. doi: 10.1002/nau.22742. [Epub ahead of print]
[4]Aro E, Bastman S, Andersson KE, et al. Is there a peripheral site of action contributing to the voiding effects of α2-adrenoceptor agonists and antagonists? [J]. World J Urol, 2015, 33(3):433-440.
[5]赖焕玲,梁志健,吴清和,等. 不同灌注速度及方法对大鼠膀胱容量、压力及神经传入电活动测定的影响[J]. 中国病理生理杂志, 2015, 31(2):379-384.
[6]孙双权,陈忠,叶章群,等. 两种大鼠膀胱测压方法的比较[J]. 中国比较医学杂志, 2008, 18(7):50-53.
[7]邝兆进,操红缨,黄萍,等. 两种不同膀胱测压方法对不同年龄大鼠尿动力测定的影响[J]. 中国药理学通报, 2012, 28(4):581-583.
[8]Schneider MP, Hughes FM Jr, Engmann AK, et al. A novel urodynamic model for lower urinary tract assessment in awake rats[J]. BJU Int, 2015, 115 (Suppl 6): 8-15.
[9]Tu H, Cao N, Gu B, et al. Serotonin (5-HT)2A/2C receptor agonist (2,5-dimethoxy-4-idophenyl)-2-aminopropane hydrochloride (DOI) improves voiding efficiency in the diabetic rat[J]. BJU Int, 2015, 116(1):147-155.
[10]Corona-Quintanilla DL, López-Juárez R, Zempoalteca R, et al. Anatomic and functional properties of bulboglandularis striated muscle support its contribution as sphincter in female rabbit micturition[J]. Neurourol Urodyn, 2015 May 11. doi: 10.1002/nau.22788. [Epub ahead of print]
[11]Di Benedetto A, Arena S, Nicotina PA, et al. Pacemakers in the upper urinary tract[J]. Neurourol Urodyn, 2013, 32(4):349-353
[12]Kanai A, Fry C, Hanna-Mitchell A, et al. Do we understand any more about bladder interstitial cells?-ICI-RS 2013[J]. Neurourol Urodyn, 2014, 33(5):573-576.
[13]Wein AJ, Kavoussi LR,Novick AC, et al. Campbell-Walsh urology[M]. 10th ed. Philadelphia: Saunders Elsevier, 2012:1845.
(责任编辑: 陈妙玲, 罗森)
Simulation of human urethral catheterization to implement urodynamic testing in miceCHEN Lin1, YANG Jin1, HU Hai-feng1, XING Sha-sha2, ZHANG Han-chao1, YU Bei1, YANG Ya-fei1
(1DepartmentofUrology,2CentralLaboratory,AffiliatedHospitalofChengduUniversity,Chengdu610081,China.E-mail: 360273177@qq.com)
[ABSTRACT]AIM: Cystostomy is the traditionary method for detecting urodynamic indexes in mice, which destroys the continuity of the bladder, and there are significant differences between this method and the clinically used trans-urethral method. This study aims to develop an appropriate urethral catheter to investigate the advantages and application value of transurethral method for urodynamic test. METHODS: A pediatric intravenous catheter was used for urethral catheterization on 8 female mice, and linked to connect the catheter to baroreceptor and micropump. The epidural catheter was also used as manometry tube. RESULTS: Using this method, the following urodynamic indicators has been successfully captured: basal bladder pressure (BBP), bladder leak point pressure (BLPP), maximum voiding pressure (MVP), maximum bladder capacity (MBC), post-void residual urine volume (PVR), voiding volume (VV), efficiency of voiding (EV) and bladder compliance (BC). CONCLUSION: This is the first successful simulation used in human body to achieve mouse urodynamic testing through the urethra catheter, which avoids the impact of cystostomy on urodynamics in mice, and the mice are able to keep long-term survival after tests for the follow-up molecular and genetic experiments.
[KEY WORDS]Mice; Urodynamics; Cystostomy; Urethral catheterization
doi:10.3969/j.issn.1000- 4718.2016.02.032
[中图分类号]R33-33
[文献标志码]A
通讯作者△Tel: 028-86432662; E-mail: 360273177@qq.com
*[基金项目]国家自然科学基金资助项目 (No. 81500577); 四川省卫生厅课题(No. 090112; No. 100073); 成都大学青年基金资助项目(No. 2080515062)
[收稿日期]2015- 09- 02[修回日期] 2015- 10- 27
[文章编号]1000- 4718(2016)02- 0381- 04
