叶酸对去卵巢大鼠抗氧化酶、一氧化氮合酶和一氧化氮的影响
2016-03-05王海敏汤旭磊王朝旭
王海敏, 汤旭磊, 王朝旭
(兰州大学第一医院内分泌科,甘肃 兰州 730000)
叶酸对去卵巢大鼠抗氧化酶、一氧化氮合酶和一氧化氮的影响
王海敏#,汤旭磊△,王朝旭
(兰州大学第一医院内分泌科,甘肃 兰州 730000)
[摘要]目的: 观察叶酸对去卵巢大鼠抗氧化酶、一氧化氮合酶和一氧化氮的影响。方法: 40只3月龄健康雌性SD大鼠,随机分成5组:假手术组、去卵巢组、二乙基己烯雌酚(0.03 mg·kg-1·d-1)组、低剂量(5 mg·kg-1·d-1)叶酸组和高剂量(20 mg·kg-1·d-1)叶酸组。各组大鼠于术后1周开始灌胃给药,假手术组和去卵巢组给予蒸馏水,10周后,取L5椎体和右股骨行骨密度(BMD)检测;测定血浆和骨匀浆总抗氧化能力(TAC)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、一氧化氮合酶(NOS)和一氧化氮(NO)水平。结果: 与假手术组比较,去卵巢组大鼠L5椎体和股骨BMD显著降低(P<0.01),血浆GSH-Px、NO和骨匀浆TAC、GSH-Px、NOS及NO水平明显降低(P<0.01),MDA浓度升高显著(P<0.01);与去卵巢组大鼠比较,高剂量叶酸组大鼠L5椎体和股骨BMD增加(P<0.01),骨匀浆TAC、GSH-Px、NOS和NO水平升高(P<0.01),MDA浓度降低(P<0.01),血浆GSH-Px和NO水平升高。结论: 去卵巢大鼠体内抗氧化酶、NOS和NO水平降低,氧化应激参与了去卵巢大鼠骨质疏松的发生;高剂量叶酸能提升去卵巢大鼠腰椎和股骨BMD,提高其体内抗氧化酶、NOS和NO水平,改善氧化应激,这可能是高剂量叶酸防治去卵巢大鼠骨质疏松的机制之一。
[关键词]叶酸; 骨密度; 谷胱甘肽过氧化物酶; 一氧化氮合酶; 一氧化氮
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)多发于中老年女性,以雌激素缺乏为主要原因,伴发体内抗氧化酶系、一氧化氮合酶(nitric oxide synthase,NOS)及一氧化氮(nitric oxide,NO)异常[1]。近年来,叶酸(folic acid,FA)与骨质疏松或骨密度(bone mineral density,BMD)的相关性引起了人们的高度关注,但研究结果仍存在争议[2-3]。本研究利用去卵巢(ovariectomy,OVX)大鼠骨质疏松模型,观察叶酸对去卵巢大鼠抗氧化酶、NOS、NO 及腰椎和股骨BMD的影响,以探讨叶酸对骨质疏松症可能的作用及机制,为临床骨质疏松的防治提供新思路。
材料和方法
1材料
1.1动物3月龄健康SPF级雌性SD大鼠40只,体重(200±20)g,购于甘肃中医学院实验动物中心,实验动物使用许可证号:SYXK(甘)2004-0006。
1.2药物与试剂叶酸片剂购自天津飞鹰制药有限公司;二乙基己烯雌酚(diethylstilbestrol,DES)片剂由合肥久联制药有限公司生产;总抗氧化能力(total antioxidant capacity,TAC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)、NOS和NO试剂盒为南京建成生物工程研究所产品。
1.3实验设备LUNAR公司双能X线骨密度仪;四川分析仪器厂721型分光光度计;Heraeus型台式高速冷冻离心机;北京赛多利斯仪器系统有限公司生产的万分之一电子天平。
2方法
2.1分组及建立动物模型3月龄SPF组雌性SD大鼠40只,随机分成假手术(sham)组、OVX组、DES组、低剂量叶酸(low-dose FA)组和高剂量叶酸(high-dose FA)组,每组8只。各组大鼠在SPF环境条件下适应性喂养1周后,以戊巴比妥钠(40 mg/kg)腹腔注射麻醉,取下腹部正中切口,切开皮肤、肌肉,进入腹腔,完整摘除双侧卵巢,假手术组只切除卵巢周围与其大小相似的一小脂肪团,保留双侧卵巢[4]。
2.2药物干预所有大鼠在SPF级环境下常规饲养,术后1周开始灌胃给药,叶酸和DES片剂研磨成细粉末由蒸馏水配成相应浓度的混悬液用于灌胃,假手术组和去卵巢组灌服蒸馏水,DES组给予0.03 mg·kg-1·d-1;低剂量叶酸组给予叶酸5 mg·kg-1·d-1,高剂量叶酸组给予叶酸20 mg·kg-1·d-1。每周称体重1次调整给药剂量,共给药10周[5]。术后第3周高剂量叶酸组死亡1只,术后第4周叶酸低剂量组死亡1只,术后第6周DES组死亡1只,以上3组均在次日喂药时发现,死因不详。
2.3测定骨密度药物干预10周末,剖取L5椎体和右股骨,剔除周围附着的肌肉及结缔组织,使用LUNAR双能X线骨密度仪测定离体的股骨和腰椎BMD(g/cm2)。
2.4检测血浆指标心脏采血,置于肝素抗凝管内,于30 min内3 000 r/min离心10 min,取上清液,于-20 ℃保存。严格按照相应试剂盒说明书进行操作,检测血浆TAC、GSH-Px、MDA、NOS和NO的浓度。
2.5检测骨匀浆指标剖取L3和L4椎体,剔除周围附着的软组织,将腰椎体研磨成糊状,加入冷生理盐水,4 ℃ 2 000 r/min,离心10 min,收集上清液,置于Eppendorf管内,-20 ℃保存,严格按照相应试剂盒说明书进行操作,检测TAC、GSH-Px、MDA、NOS和NO的浓度。
3统计学处理
采用SPSS 13.0统计软件进行统计学分析,实验数据以均数±标准差(mean±SD)表示。多组间均数比较用单因素方差分析(one-way ANOVA),组间两两比较用Bonferroni法检验,以P<0.05为差异有统计学意义。
结果
1腰椎和股骨BMD的检测结果
与假手术组比较,去卵巢组大鼠腰椎和股骨BMD均显著降低(P<0.01);DES可显著提高去卵巢大鼠腰椎和股骨的BMD(P<0.01),其中股骨的BMD接近假手术组,腰椎的BMD低于假手术组(P<0.05);高剂量叶酸组大鼠腰椎和股骨的BMD较去卵巢组显著升高(P<0.01),但仍低于DES组和假手术组(P<0.01);低剂量叶酸组腰椎和股骨的BMD与去卵巢组水平相当,差异无统计学意义,见表1。
2血浆TAC、GSH-Px和MDA的检测结果
与假手术组比较,去卵巢组大鼠血浆的GSH-Px水平明显降低(P<0.01),MDA的浓度显著增高(P<0.01),TAC的差异无统计学显著性;DES可显著提高去卵巢大鼠血浆GSH-Px的水平(P<0.01),降低MDA的浓度(P<0.01);与去卵巢组比较,低剂量叶酸组大鼠血浆的MDA浓度降低(P<0.01),TAC和GSH-Px差异无统计学意义(P>0.05);高剂量叶酸组大鼠血浆的GSH-Px水平明显升高(P<0.01),接近假手术组水平,MDA的浓度降低(P<0.01),高于假手术组(P<0.01),见表2。
表1各组大鼠腰椎和股骨BMD的比较
Table 1.The BMD of lumbar vertebra and femur in various groups (g/cm2. Mean±SD)

GroupnLumbarvertebraFemurSham80.087±0.0050.151±0.005OVX80.064±0.005△△0.126±0.005△△Diethylstilbestrol70.081±0.004△**0.147±0.004**Low-doseFA70.064±0.007△△##0.131±0.007△△##High-doseFA70.073±0.003△△**##0.137±0.003△△**##
△P<0.05,△△P<0.01vssham group;**P<0.01vsOVX group;##P<0.01vsdiethylstilbestrol group.
表2各组大鼠血浆TAC、GSH-Px和MDA的比较
Table 2.Comparison of plasma TAC, GSH-Px and MDA in various groups (Mean±SD)
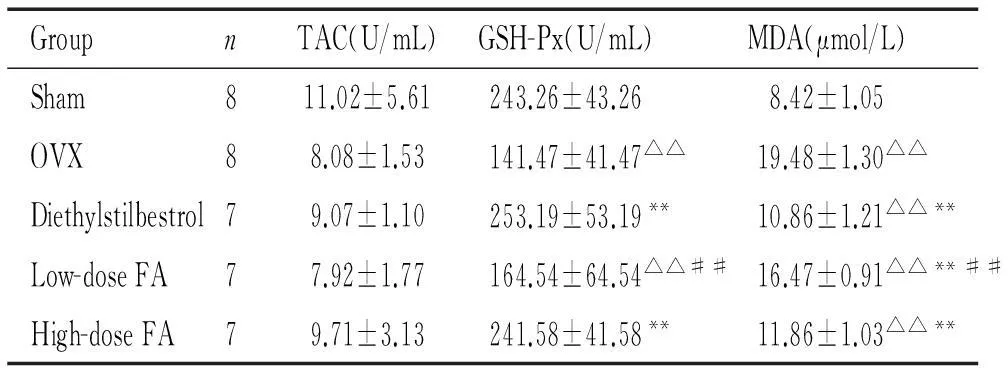
GroupnTAC(U/mL)GSH-Px(U/mL)MDA(μmol/L)Sham811.02±5.61243.26±43.268.42±1.05OVX88.08±1.53141.47±41.47△△19.48±1.30△△Diethylstilbestrol79.07±1.10253.19±53.19**10.86±1.21△△**Low-doseFA77.92±1.77164.54±64.54△△##16.47±0.91△△**##High-doseFA79.71±3.13241.58±41.58**11.86±1.03△△**
△△P<0.01vssham group;**P<0.01vsOVX group;##P<0.01vsdiethylstilbestrol group.
3血浆NOS和NO的检测结果
与假手术组比较,去卵巢组大鼠血浆NO浓度降低显著(P<0.01),NOS浓度的差异无统计学显著性(P>0.05);DES可显著提高去卵巢大鼠血浆NO 的水平(P<0.01),高剂量叶酸可升高去卵巢大鼠血浆NO的水平(P<0.05);低剂量叶酸组NO的水平与去卵巢组相近,差异无统计学显著性(P>0.05),见表3。
表3各组大鼠血浆NOS和NO的比较
Table 3.Comparison of plasma NOS and NO in various groups (Mean±SD)
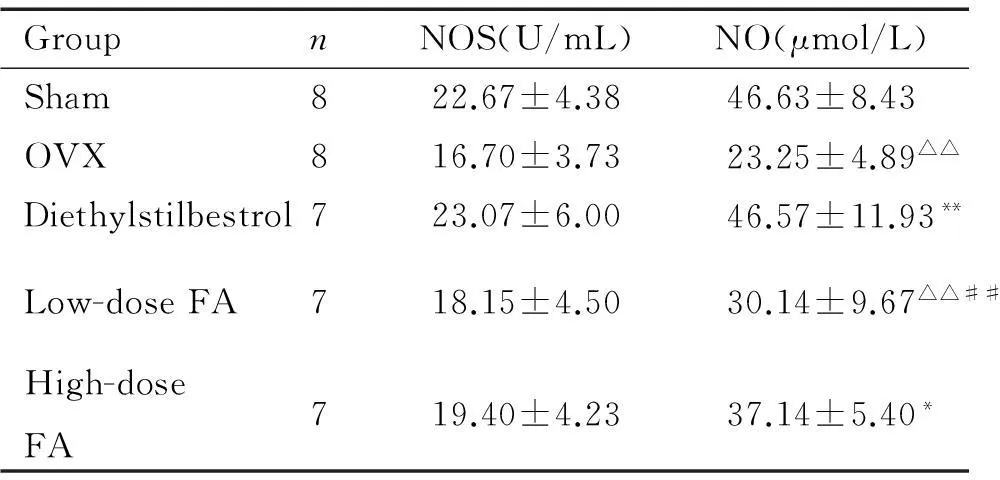
GroupnNOS(U/mL)NO(μmol/L)Sham822.67±4.3846.63±8.43OVX816.70±3.7323.25±4.89△△Diethylstilbestrol723.07±6.0046.57±11.93**Low-doseFA718.15±4.5030.14±9.67△△##High-doseFA719.40±4.2337.14±5.40*
△△P<0.01vssham group;*P<0.05,**P<0.01vsOVX group;##P<0.01vsdiethylstilbestrol group.
4骨匀浆TAC、GSH-Px和MDA的检测结果
与假手术组比较,去卵巢组大鼠骨匀浆TAC和GSH-Px的水平明显降低(P<0.01),MDA的浓度显著增高(P<0.01);DES和高剂量叶酸可明显提升去卵巢大鼠骨匀浆TAC和GSH-Px的水平(P<0.01),降低MDA浓度(P<0.01),并接近假手术组水平;与去卵巢组比较,低剂量叶酸组骨匀浆GSH-Px的水平增高(P<0.05),但仍低于DES组和假手术组(P<0.05),MDA的浓度降低(P<0.05),TAC差异无统计学意义,见表4。
表4各组大鼠骨匀浆TAC、GSH-Px和MDA的比较
Table 4.Comparison of bone homogenate TAC, GSH-Px and MDA in various groups (Mean±SD)

GroupnTAC(U/mg)GSH-Px(U/mg)MDA(μmol/g)Sham817.91±5.56132.83±26.7113.31±26.70OVX89.76±2.41△△52.76±16.46△△24.71±6.18△△Diethylstilbestrol716.01±3.60**141.89±34.70**14.91±2.70**Low-doseFA711.24±3.88△△#91.22±34.10△*#20.51±3.39△△#High-doseFA715.39±3.20**115.97±40.82**15.33±2.85**
△P<0.05,△△P<0.01vssham group;*P<0.05,**P<0.01vsOVX group;#P<0.05vsdiethylstilbestrol group.
5骨匀浆NOS和NO的检测结果
与假手术组比较,去卵巢组大鼠骨匀浆NOS和NO浓度均显著降低(P<0.01);DES和高剂量叶酸可明显提高去卵巢大鼠骨匀浆NOS和NO的浓度(P<0.01),并使两者接近假手术组;低剂量叶酸组骨匀浆NOS和NO的浓度均与去卵巢组相近,差异无统计学显著性,见表5。
表5各组大鼠骨匀浆NOS和NO的比较
Table 5.Comparison of bone homogenate NOS and NO in various groups (Mean±SD)
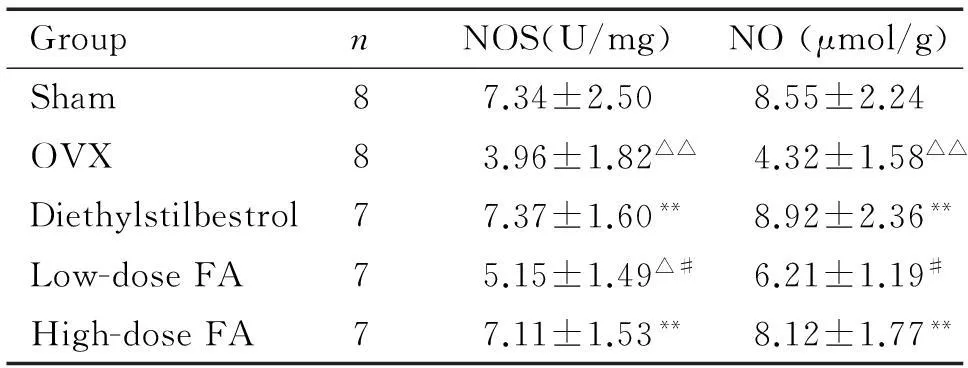
GroupnNOS(U/mg)NO(μmol/g)Sham87.34±2.508.55±2.24OVX83.96±1.82△△4.32±1.58△△Diethylstilbestrol77.37±1.60**8.92±2.36**Low-doseFA75.15±1.49△#6.21±1.19#High-doseFA77.11±1.53**8.12±1.77**
△P<0.05,△△P<0.01vssham group;**P<0.01vsOVX group;#P<0.05vsdiethylstilbestrol group.
讨论
绝经后骨质疏松症是中老年妇女的多发病,其病因和发病机制复杂。研究发现,雌激素缺乏伴随的抗氧化酶活性降低,氧化与抗氧化失衡,引发的氧化应激在骨质疏松病理过程中具有重要的作用[6]。
Muthusami等[7]利用动物实验研究发现,去卵巢大鼠股骨骨组织匀浆中抗氧化酶系如超氧化物歧化酶(superoxide dismutase SOD)、GSH-Px 及谷胱甘肽S转移酶(glutathione S-transferase,GST)水平降低,脂质过氧化产物MDA和H2O2水平升高,提示去势诱导氧化应激。Maggio等[8]分别对75名老年骨质疏松女性和健康女性进行的一项横断面研究发现,老年骨质疏松女性组血抗氧化物如维生素C、E、A和抗氧化酶系如SOD和GSH-Px 活性较之健康女性对照组降低,且这些抗氧化物和抗氧化酶与股骨颈骨密度具有明显的相关性。上述研究从不同角度表明,绝经雌激素缺乏所致的抗氧化酶系活性降低,氧化应激,与骨质疏松具有密切的联系。
机体中存在多种抗氧化物,包括抗氧化大分子、抗氧化小分子和酶等,可以清除体内产生的各种活性氧,以阻止活性氧诱导的氧化应激的产生,一个体系内的各种抗氧化大分子、抗氧化小分子和酶的总体水平,体现了该体系内的总抗氧化能力。
本研究结果显示,与假手术组大鼠比较,去卵巢组大鼠血浆的GSH-Px水平明显降低,MDA的浓度显著增高,TAC的浓度差异无统计学意义,腰椎骨匀浆TAC和GSH-Px的活性明显降低,MDA生成增加,腰椎和股骨的BMD均显著降低,提示去卵巢大鼠体内抗氧化酶活性及总的抗氧化能力降低,存在氧化应激,氧化应激可能参与了骨质疏松的发生,与前人研究结果相近[7-8]。给予不同剂量叶酸干预治疗10周,低、高剂量叶酸(5 mg·kg-1·d-1)均可增强去卵巢大鼠血浆和腰椎骨匀浆GSH-Px的活性,同时降低去卵巢大鼠体内MDA浓度,仅高剂量叶酸可提升去卵巢大鼠骨匀浆TAC水平,并升高去卵巢大鼠腰椎和股骨的BMD。由此推测去卵巢大鼠骨组织局部可能存在多种抗氧化酶和抗氧化分子的活性改变,总的抗氧化能力降低,诱发氧化应激;本研究结果提示,高剂量叶酸可能通过增强去卵巢大鼠体内抗氧化酶活性和总的抗氧化能力,改善机体的氧化应激状态,从而提升去卵巢大鼠的骨密度。
NO是重要的信使物质和效应分子,由NOS催化,以L-精氨酸和分子氧为底物,经过电子氧化反应生成。近年来发现,NOS和 NO在骨质疏松的病理生理过程中发挥着重要的作用。NOS是生成内源性NO的主要限速物质,破骨细胞及破骨细胞前体、成骨细胞和骨细胞均能表达NOS,现已证实骨组织中NOS存在神经元型、诱导型和内皮细胞型3种亚型。Guo 等[9]报道去卵巢骨质疏松大鼠血浆NO水平降低,股骨eNOS mRNA表达下降,氢水干预治疗,可以防止去卵巢大鼠骨质疏松,原因之一可能与氢水消除雌激素缺乏诱发的氧化应激有关。El-Swefy等[10]在研究高同型半胱氨酸血症与心血管风险时发现,去卵巢大鼠血浆的NO浓度降低,予叶酸干预治疗可增高去卵巢大鼠血浆NO的浓度,并对激素缺乏所致的相关症状发挥有益的作用。本实验结果表明,去卵巢组大鼠腰椎骨匀浆的NOS、NO和血浆的NO较之假手术组明显降低,而高剂量叶酸治疗可以提高去卵巢大鼠腰椎和股骨BMD,并提高去卵巢大鼠骨匀浆NOS、 NO和血浆NO水平。由此提示,高剂量叶酸可提高去卵巢大鼠腰椎和股骨BMD,机制之一可能与调节去卵巢大鼠骨组织局部NOS和 NO的代谢有关。本实验研究的不足之处在于没有对NOS进行分型检测,在今后的实验研究中将从分子水平进一步探究叶酸对NOS亚型的影响,为基础研究和临床应用提供理论依据。
综上所述,去卵巢大鼠体内抗氧化酶、NOS和NO的水平降低,氧化应激参与了去卵巢大鼠骨质疏松的发生;高剂量叶酸能提升去卵巢大鼠腰椎和股骨BMD,提高其体内抗氧化酶、NOS和NO的水平,改善氧化应激,这可能是高剂量叶酸防治去卵巢大鼠骨质疏松的机制之一。本研究利用去卵巢大鼠骨质疏松模型,首次从总体及骨组织局部,探讨不同剂量叶酸干预治疗抗骨质疏松的作用及机制,为临床骨质疏松的防治提供新思路。但是,本研究检测方法局限在生化水平,应进一步在分子水平上深入探讨叶酸抗骨质疏松的作用及机制,提供更精准的理论依据。
[参考文献]
[1]Ozgocmen S, Kaya H, Fadillioglu E, et al. Role of anti-oxidant systems,lipid peroxidation and nitric oxide in postmenopausal osteoporosis[J]. Mol Cell Biochem, 2007,295(1-2):45-52.
[2]Morris MS, Jacques PF, Selhub J. Relation between homocysteine and B-vitamin status indicators and bone mineral density in older Americans[J]. Bone, 2005, 37(2):234-242.
[3]Baines M, Kredan MB, Usher J, et al. The association of homocysteine and its determinants MTHFR genotype,folate, vitamin B12and vitamin B6with bone mineral density in postmenopausal British women[J].Bone, 2007,40(3):730-736.
[4]黎波,张荣华.益骨胶囊对去卵巢骨质疏松大鼠骨组织cbfa-mRNA表达的影响[J].中国病理生理杂志,2008,24(4):759-762.
[5]陈子怡,王连唐,陈东,等.绝经后骨质疏松症模型体视学测量和机理初探[J].中国病理生理杂志,2001,17(10):983-986.
[6]Lean JM, Jagger CJ, Kirstein B,et al.Hydrogen peroxide is essential for estrogen-deficiency bone loss and osteoclast formation[J]. Endocrinology, 2005, 146(2):728-735.
[7]Muthusami S, Ramachandran I, Muthusamy B, et al. Ovariectomy induces oxidative stress and impairs bone antioxidant system in adult rats[J]. Clin Chim Acta, 2005, 360(1-2):81-86.
[8]Maggio D, Barabani B, Pierandrei M, et al. Marked decrease in plasma antioxidants in aged osteoporotic women: results of a cross-sectional study[J]. J Clin Endocrinol Metab, 2003, 88(4):1523-1527.
[9]Guo JD,Li L, Shi YM, et al.Hydrogen water consumption prevents osteopenia in ovariectomized rats[J]. Br J Pharmacol, 2013, 168(6):1412-1420.
[10]El-Swefy SE, Ali SI, Asker ME, et al. Hyperhomocysteinaemia and cardiovascular risk in female ovariectomized rats: role of folic acid and hormone replacement therapy[J]. J Pharm Pharmacol, 2002, 54(3):391-397.
(责任编辑: 卢萍, 罗森)
Effects of folic acid on antioxidant enzyme, nitric oxide synthase and nitric oxide in ovariectomized ratsWANG Hai-min, TANG Xu-lei, WANG Zhao-xu
(DepartmentofEndocrinology,TheFirstHospitalofLanzhouUniversity,Lanzhou730000,China.E-mail:xulei_tang@126.com)
[ABSTRACT]AIM: To observe the effects of folic acid (FA) on antioxidant enzyme, nitric oxide synthase (NOS) and nitric oxide (NO) in ovariectomized (OVX) rats.METHODS: Forty three-month-old female SD rats were randomly divided into 5 groups: sham group, OVX group, diethylstilbestrol group (0.03 mg·kg-1·d-1), low-dose FA group (5 mg·kg-1·d-1) and high-dose FA group (20 mg·kg-1·d-1). Gastric gavage started 1 week after operation and lasted for 10 weeks. The rats in sham group and OVX group were given distilled water instead of FA as controls. At the end of the 10th week, the L5vertebra and right femur were removed for determination of bone mineral density (BMD). The bone homogenates were made using the L3and L4vertebrae. The levels of the total antioxidant capacity (TAC), glutathione peroxidase (GSH-Px), malondialdehyde (MDA), NOS and NO were detected in plasma and bone homogenates.RESULTS: Compared with sham group, the BMD levels in L5vertebra and right femur and the levels of GSH-Px and NO in the plasma were all decreased. The levels of TAC, GSH-Px, NOS and NO in the bone homogenates were also decreased, while the MDA concentration was increased in OVX group (allP<0.01). Compared with OVX group, the levels of TAC, GSH-Px, NOS, NO and BMD of the L5vertebra and right femur were all increased, while the MDA concentration was decreased in high-dose FA group (allP<0.01). CONCLUSION: In female SD rats, ovariectomy leads to a significant reduction of antioxidant enzyme, NOS and NO levels. Oxidative stress is possibly involved in the development of osteoporosis. Protection against osteoporosis by high-dose FA may be linked to improvement of antioxidant enzyme activity, the levels of NOS and NO as well as a reduction of oxidative stress in ovariectomized rats.
[KEY WORDS]Folic acid; Bone mineral density; Glutathione peroxidase; Nitric oxide synthase; Nitric oxide
doi:10.3969/j.issn.1000- 4718.2016.02.028
[中图分类号]R363
[文献标志码]A
通讯作者△Tel: 0931-8356481; E-mail: xulei_tang@126.com
[收稿日期]2015- 05- 21[修回日期] 2015- 12- 07
[文章编号]1000- 4718(2016)02- 0359- 05
# 现工作单位:濮阳市安阳地区医院内分泌科
