BMP-7对高糖环境下肾小管上皮细胞Id2和E2A蛋白表达的影响*
2016-03-05曾令萍张莹莹张昌志吴德佩李圆圆石明隽
曾令萍, 肖 瑛, 张莹莹, 张昌志, 吴德佩, 李圆圆, 石明隽, 郭 兵
(贵州医科大学病理生理学教研室,贵州 贵阳 550025)
BMP-7对高糖环境下肾小管上皮细胞Id2和E2A蛋白表达的影响*
曾令萍,肖瑛△,张莹莹,张昌志,吴德佩,李圆圆,石明隽,郭兵
(贵州医科大学病理生理学教研室,贵州 贵阳 550025)
[摘要]目的: 通过观察高糖环境下给予外源性骨形态发生蛋白-7(BMP-7)对肾小管上皮细胞(NRK-52E)表达分化抑制因子2(Id2)和转录因子E2A的影响,探讨BMP-7减轻高糖诱导的肾小管纤维化病变的可能机制。方法: 将体外培养的肾小管上皮细胞NRK-52E分为3组:对照(control)组、高糖(HG)组和不同浓度BMP-7(10 μg/L和20 μg/L)干预组,HG组和干预组分别设12 h、24 h和48 h 3个时点。Western blot方法检测Id2、E2A、上皮细胞钙粘蛋白(E-cadherin)、α-平滑肌肌动蛋白(α-SMA)和Ⅰ型胶原(Col-Ⅰ)蛋白的表达,real-time PCR方法检测Id2 mRNA的表达。结果: 与control组相比,HG组Id2的mRNA和蛋白水平及E-cadherin的蛋白水平明显下调,E2A、α-SMA和Col-Ⅰ的蛋白水平明显上调(P<0.05);与HG组相比,20 μg/L BMP-7干预组Id2的mRNA和蛋白水平及E-cadherin的蛋白水平均较同时点显著上调,E2A、α-SMA和Col-Ⅰ的蛋白水平显著下调(P<0.05)。相关性分析结果显示,Id2蛋白与E2A蛋白表达呈显著负相关(P<0.05)。结论: BMP-7可阻断高糖诱导的肾小管上皮细胞的纤维化,其机制可能与促进Id2蛋白并抑制E2A蛋白的表达有关。
[关键词]NRK-52E细胞; 高糖; 骨形态发生蛋白-7; 分化抑制因子2; E2A
糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetes mellitus,DM)常见而严重的并发症,进行性发展可导致终末期肾衰竭,深入研究防治DN纤维化病变的发生机制,对疾病的转归具有重要意义。分化抑制因子(inhibitor of differentiation,Id)属于螺旋-环-螺旋(helix-loop-helix,HLH)转录因子家族,因缺乏碱性区域,可以与碱性螺旋-环-螺旋转录因子(basic helix-loop-helix,bHLH)E2A相结合形成异二聚体,从而发挥生物学效应。哺乳动物细胞含4种Id蛋白:Id1、 Id2、Id3和Id4。本课题组前期研究发现,DM大鼠随病程的延长肾组织中Id2蛋白逐渐减少,促进了肾小管上皮-间质转化(epithelial-mesenchymal transition,EMT)及肾间质细胞外基质(extracellular matrix,ECM)的沉积;控制血糖后Id2水平被上调,恢复了Id2对肾纤维化的负调节作用,从而使EMT过程逆转,ECM沉积减轻[1]。另有研究发现骨形态发生蛋白-7(bone morphogenetic protein 7,BMP-7)具有抗纤维化作用,已有研究表明在肝纤维化、肾纤维化和肺纤维化疾病中BMP-7都能明显降低细胞的纤维化水平[2-4]。在小鼠晶状体上皮细胞中过表达BMP-7后可上调Id2、Id3的表达,从而逆转小鼠因损伤诱导的EMT[5]。这些都提示在EMT的发生发展中BMP-7、Id2和E2A之间有着密切的联系,而在高糖环境中三者的关系尚不清楚。本研究旨在观察外源性BMP-7对高糖环境中肾小管上皮细胞Id2和E2A表达的影响,探讨BMP-7减轻高糖状态下肾小管纤维化的作用机制。
材料和方法
1细胞
大鼠肾小管上皮细胞NRK-52E细胞株购于上海中科院细胞库。
2主要试剂
两步法免疫组化检测试剂、辣根过氧化物酶标记羊抗兔IgG、辣根过氧化物酶标记羊抗小鼠IgG、DAB显色试剂盒(北京中杉金桥);I抗稀释液、ECL 显色剂、BCA 蛋白浓度测定试剂盒、二甲基亚砜(dimethyl sulfoxide,DMSO)、牛血清白蛋白(碧云天);苯甲基磺酰氟(phenyl methyl sulfonyl fluoride,PMSF)和RIPA细胞裂解液(索莱宝);PVDF膜、3 mm Whatman滤纸(Millipore);低糖DMEM 培养基、胰酶蛋白、青霉素和链霉素(HyClone);胎牛血清(Gibco);RevertAidTMFirst Strand cDNA Synthesis Kit(Thermo);iQTMSYBR®Green Supermix(Bio-Rad);Id2、E2A抗体(Santa Cruz);rhBMP-7(Sigma);Ⅰ型胶原(collagen Ⅰ,Col-Ⅰ)抗体(北京博奥森);α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、上皮细胞钙黏蛋白(E-cadherin)、β-actin抗体(武汉博士德)。
3主要方法
3.1细胞培养与分组把NRK-52E细胞复苏接种于25 cm2的培养瓶中,用含10% 胎牛血清的DMEM(含5.5 mmoL/L葡萄糖)培养。倒置显微镜下观察,待细胞融合度达80%~90%时进行传代。将状态良好的细胞同步化处理后随机分为3组:对照(control)组:用含有2% 胎牛血清的DMEM (含5.5 mmoL/L葡萄糖)培养,同步化后不予任何处理;高糖(high glucose,HG)组:用含有2% 胎牛血清的DMEM(含25 mmoL/L葡萄糖)培养;10 μg/L和20 μg/L BMP-7干预组:在含有2% 胎牛血清的DMEM(含25 mmoL/L葡萄糖)中加入不同浓度的BMP-7,使其终浓度分别为10 μg/L和20 μg/L。在高糖诱导和BMP-7干预后的12 h、24 h和48 h 3个时点收集RNA或蛋白进行后续实验。
3.2免疫细胞化学染色将NRK-52E细胞接种至铺有22 mm×22 mm盖玻片的6孔板中,生长融合度达80%时,细胞同步化处理,PBS漂洗,细胞固定液固定,3% H2O2浸泡消除内源性过氧化物酶,10% 牛血清白蛋白封闭,予细胞角蛋白18(cytokeratin,CK18; 1∶50)、E-cadherin(1∶100)和α-SMA(1∶300)特异性抗体4 ℃孵育过夜。PBS漂洗后滴加即用型生物素标记的 II 抗,DAB室温显色,苏木素复染,脱水,透明,晾干后,中性树胶封片,显微镜下观察并摄取图像。
3.3Western blot检测目的蛋白弃去细胞培养基后用生理盐水清洗3次,加入细胞蛋白裂解液裂解细胞,12 000 r/min离心10 min,将上清转移置一新的EP管中,取部分蛋白使用BCA试剂盒测定蛋白浓度。然后根据蛋白浓度加入上样缓冲液配制成统一浓度的蛋白样品,煮沸10 min。蛋白经SDS-PAGE分离后,转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,TBST洗膜,分别加入Id2(1∶100)、E2A(1∶300)、E-cadherin(1∶200)、α-SMA(1∶200)和Col-Ⅰ(1∶200)的 I抗,4 ℃孵育过夜,TBST洗膜后加入相应 II 抗室温孵育1 h,ECL显影,压片并分析结果。
3.4Real-time PCR检测Id2 mRNA的表达TRIzol法提取总RNA,核酸蛋白仪检测RNA浓度和纯度后,使用Thermo试剂盒进行逆转录。通过Bio-Rad CFX 96TM荧光定量PCR分析系统进行检测,以β-actin为内参照,目的基因的相对含量以2-△△Ct表示,引物序列和退火温度见表1。
表1PCR引物序列及扩增条件
Table 1.The sequences and conditions of primers used in real-time PCR
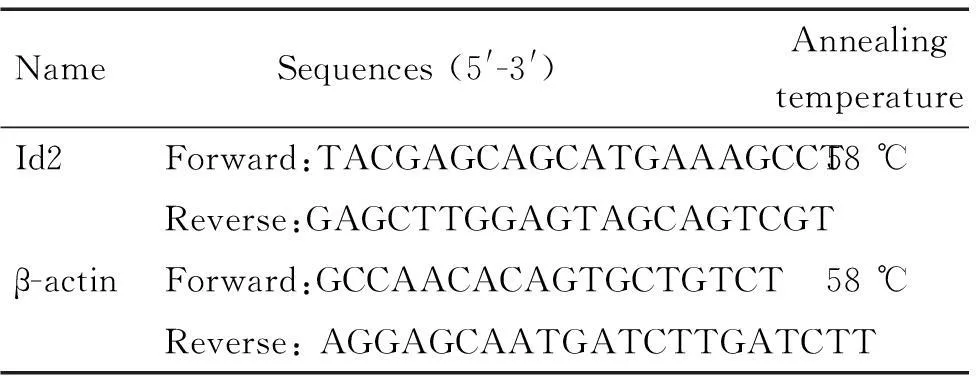
Name Sequences(5'-3')AnnealingtemperatureId2Forward:TACGAGCAGCATGAAAGCCT58℃Reverse:GAGCTTGGAGTAGCAGTCGTβ-actinForward:GCCAACACAGTGCTGTCT58℃Reverse:AGGAGCAATGATCTTGATCTT
4统计学处理
所有数据用SPSS 17.0统计软件分析处理,数据用均数±标准差(mean±SD)表示。多组比较采用单因素方差分析,若方差齐时,采用Bonferroni校正的t检验;若方差不齐时,则采用Games-Howell法检验。以P<0.05为差异有统计学意义。
结果
1NRK-52E细胞中CK-18、α-SMA和E-cadherin的表达
免疫细胞化学结果显示,在培养的NRK-52E细胞中肾小管上皮细胞标志蛋白CK-18、E-cadherin蛋白表达阳性,α-SMA表达阴性,说明培养的细胞为大鼠肾小管上皮细胞,见图1。
2BMP-7对高糖培养不同时点NRK-52E细胞中E-cadherin、α-SMA和Col-Ⅰ蛋白表达的影响
Western blot结果显示,与control组相比,HG组E-cadherin蛋白表达明显减少(P<0.05),以HG刺激24 h组减少最为显著;与HG组比较,10 μg/L BMP-7干预组E-cadherin蛋白仅24 h时增多(P<0.05);而20 μg/L BMP-7干预组E-cadherin蛋白在12 h、 24 h和48 h表达均显著高于同期HG组(P<0.05),24 h达最高峰。

Figure 1.Immunocytochemistry staining of CK-18, E-cadherin and α-SMA in NRK-52E cells (×400).
图1CK-18、E-cadherin和α-SMA在NRK-52E细胞中的表达
α-SMA在control组有少量表达,HG 12 h、24 h和48 h其表达均显著高于control组(P<0.05);加入外源性10 μg/L的BMP-7干预后,HG 12 h和24 h组α-SMA的表达显著低于同期HG组(P<0.05),而20 μg/L BMP-7干预组,各时点的α-SMA的表达均显著低于同期HG组(P<0.05)。
在control组Col-I有少量表达,HG 12 h、24 h和48 h其表达均显著高于control组(P<0.05);加入外源性BMP-7(10 μg/L或20 μg/L)后,Col-Ⅰ的蛋白表达较同期HG组均下调(P<0.05),见图2。
3BMP-7对高糖培养不同时点NRK-52E细胞中Id2 mRNA和蛋白表达的影响
Real-time PCR和Western blot结果显示,与control组相比,HG组Id2的mRNA和蛋白表达显著降低(P<0.05);20 μg/L BMP-7干预组,各时点Id2的mRNA和蛋白的表达较同期HG组明显上调(P<0.05);而在10 μg/L BMP-7干预组,Id2的mRNA和蛋白仅在24 h时点表达显著上调(P<0.05),见图3。
4BMP-7对高糖培养不同时点NRK-52E细胞中E2A蛋白表达的影响
Western blot结果显示,与control组相比,HG 12 h、24 h和48 h组E2A的表达均明显增多(P<0.05);BMP-7干预组(10 μg/L和20 μg/L)组各时点E2A表达较同期HG组均明显下调(P<0.05),见图4。
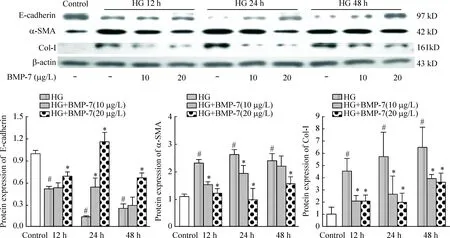
Figure 2.The effects of BMP-7 on the protein expression of E-cadherin, α-SMA and Col-I in NRK-52E cells under different conditions. Mean±SD.n=3.#P<0.05vscontrol group;*P<0.05vsHG group.
图2BMP-7对高糖培养不同时点NRK-52E细胞中E-cadherin、α-SMA 和Col-Ⅰ蛋白表达的影响

Figure 3.The effects of BMP-7 on the mRNA and protein expression of Id2 in NRK-52E cells under different conditions. Mean±SD.n=3.#P<0.05vscontrol group;*P﹤0.05vsHG group.
图3BMP-7对高糖培养不同时点NRK-52E细胞中mRNA和Id2蛋白表达的影响
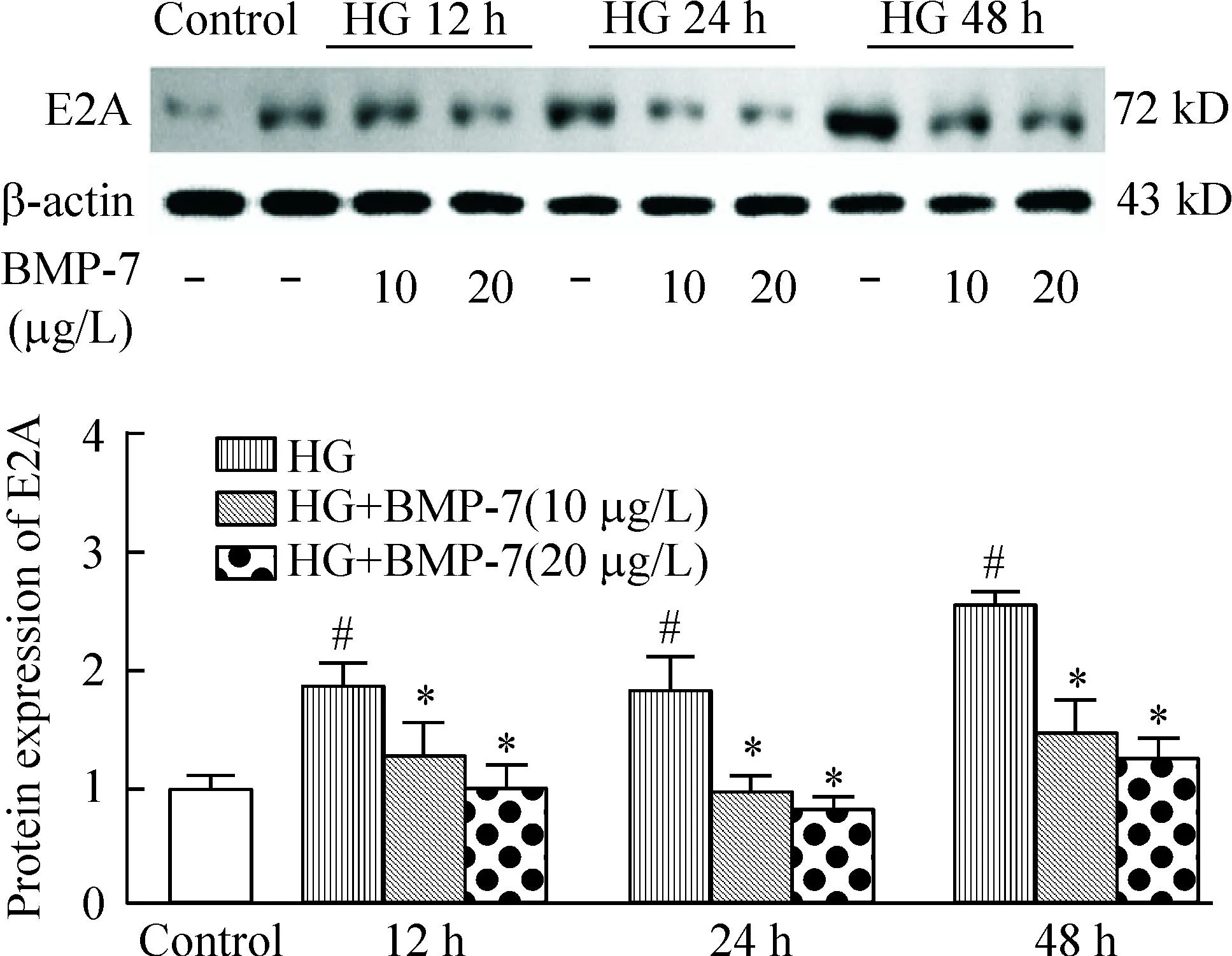
Figure 4.The effects of BMP-7 on the protein expression of E2A in NRK-52E cells under different conditions. Mean±SD.n=3.#P<0.05vscontrol group;*P<0.05vsHG group.
图4BMP-7对高糖培养不同时点NRK-52E细胞中E2A蛋白表达的影响
5高糖条件下不同时点NRK-52E细胞中Id2蛋白与E2A蛋白表达量的相关性分析
相关性分析结果显示,Id2蛋白与E2A蛋白表达呈显著负相关,在12 h、24 h和48 h这3个时点的相关系数分别为-0.869、-0.957和-0.991(P<0.05),见图5。
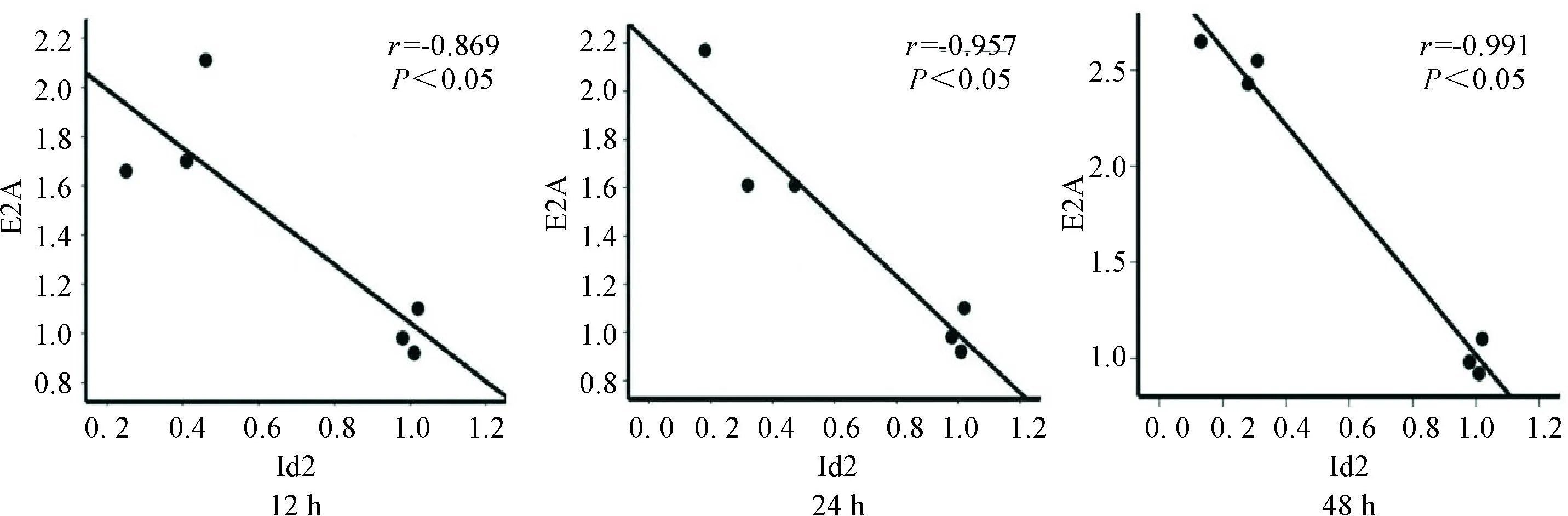
Figure 5.Correlation analysis between Id2 and E2A protein expression at different time points in NRK-52E cells under high glucose conditions.
图5高糖条件下不同时点NRK-52E细胞中Id2蛋白与E2A蛋白表达量的相关性分析
讨论
大量研究表明,肾小管上皮细胞发生EMT后伴随ECM的生成增多和降解减少,是肾小管间质纤维化包括DN发生发展的重要机制之一[6]。本研究显示,高糖培养NRK-52E细胞12 h、24 h和48 h后,肾小管上皮细胞标志性蛋白E-cadherin的表达显著减少,间充质细胞标志性蛋白α-SMA的表达明显增多,并伴有Col-Ⅰ的高表达,这表明在高糖持续刺激下NRK-52E细胞发生了EMT,同时合成和分泌大量ECM。这与本课题前期研究结果一致[7]。
Id 蛋白是一种广泛存在于哺乳动物细胞中的核转录因子的负调控蛋白,属于HLH 转录因子家族特别成员,哺乳动物含有4种Id因子(Id1~Id4),119~199 个氨基酸残基。Id蛋白缺乏碱性DNA结合区,可以与bHLH形成异二聚体,抑制bHLH与DNA及其它组织特异性bHLH转录因子结合,抑制细胞分化并促进细胞的增殖[8]。目前有研究发现,Id2与一些脏器纤维化有关,并且有维持细胞正常生物学形态和抑制转分化的作用。过表达Id2可以维持肺泡上皮细胞表型,减轻肺纤维化[9]。在肝星状细胞中,通过逆转录病毒感染Id2可显著抑制α-SMA和Col-Ⅰ的mRNA表达,调节肝星状细胞的转分化[10]。目前国内外学者研究Id2在肿瘤、免疫系统及纤维化疾病中的作用机制时,都涉及到bHLH家族转录因子E2A基因[11-13]。E2A基因(又称TCF3,免疫球蛋白增强子结合因子E12/E47,ITF1)可以编码2种不同类型的蛋白产物,分别为E47和E12。已有研究证明E12和E47抑制E-cadherin表达并且可以调控α-SMA的表达[14-15]。免疫抑制剂环孢菌素A诱导人肾小管上皮细胞HK-2发生EMT过程中E2A表达逐渐增多;另外过表达E2A后α-SMA表达增多,E-cadherin表达减少,表明E2A在环孢菌素A诱导的EMT进展中有着重要作用[16]。Kondo等[11]研究发现TGF-β1诱导小鼠乳腺上皮细胞NMuMG的过程中能与E2A相互作用的Id蛋白表达下调,E2A产物增多并直接抑制E-cadherin表达,最终发生EMT。本研究显示,高糖刺激NRK-52E细胞后,Id2的蛋白和mRNA表达减少而E2A表达增多,且二者呈显著的负相关并伴随E-cadherin的表达显著减少,α-SMA的表达明显增多及Col-Ⅰ的增多,提示高糖环境中Id2和E2A蛋白参与了肾小管上皮细胞EMT的发生过程。
BMP-7作为一种成骨蛋白,属于TGF-β超家族中的一员,是维持肾脏正常发育的重要因子。本课题组前期研究发现,高糖刺激肾小管上皮细胞,BMP-7的蛋白和mRNA表达显著减少[17]。相反,Wang等[18]运用基因转染动物在DN病程中过表达BMP-7,可减轻尿蛋白的含量,改善肾功能,减少肾间质Col-Ⅰ及FN的沉积。Veerasamy等[19]也发现外源性的BMP-7可以通过Smad1/5信号通路上调Id2的表达来抑制TGF-β1刺激人近端肾小管上皮细胞后引起的α-SMA增多。然而,在高糖状态下,肾小管上皮细胞Id2和E2A表达变化是否受到BMP-7调节,目前还不清楚。因此,我们体外培养肾小管上皮细胞,在高糖环境中同时加入不同剂量的BMP-7(10 μg/L和20 μg/L),并设12 h、24 h和48 h 3个时点,观察BMP-7对高糖状态下Id2和E2A表达的影响。结果显示,BMP-7可以显著逆转同时点高糖诱导的Id2的mRNA和蛋白下调及E2A蛋白的上调,使E-cadherin蛋白表达上调,而α-SMA和Col-Ⅰ蛋白表达下调,提示Id2的mRNA和蛋白减少及E2A蛋白增多,可能是高糖状态下肾小管上皮细胞发生EMT,肾间质出现ECM沉积的原因之一,而BMP-7可能通过Smad1/5信号通路诱导Id2表达,抑制E2A活性,恢复E-cadherin的表达,减轻肾小管上皮细胞的EMT,减少肾间质ECM的沉积,减轻肾纤维化病变。但是Id2是直接还是通过某些机制调控E2A的还不清楚,需要进一步研究。
[参考文献]
[1]文菁颖,苏博,肖瑛,等. DM大鼠肾组织Id2蛋白表达变化与纤维化病变发生发展关系的研究[J]. 贵阳医学院学报, 2015, 40(4):330-336.
[2]Yang G, Zhu Z, Wang Y, et al. Bone morphgenetic protein inhibits silica-induced pulmonary fibrosis in rat[J]. Toxicol Lett, 2013, 220(2):103-108.
[3]Wang SL, Yang CQ, Qi XL, et al. Inhibitory effect of bone morphogenetic protein-7 on hepatic fibrosis in rats[J]. Int J Clin Exp Pathol, 2013, 6(5):897-903.
[4]Wang Z, Zhao J, Zhang J, et al. Protective effect of BMP-7 against aristolochic acid-induced renal tubular epithelial cell injury[J]. Toxicol Lett, 2010, 198(3):348-357.
[5]Saika S, Ikeda K, Yamanka O, et al. Adenoviral gene transfer of BMP-7, Id2, or Id3 suppresses injury-induced epithelial-to-mesenchymal transition of lens epithelium in mice[J]. Am J Physiol Cell Physiol, 2006, 290(1):C282-C289.
[6]Galichon P, Finianos S, Hertig A. EMT-MET in renal disease:should we curb our enthusiasm?[J]. Cancer Lett, 2013, 341(1):24-29.
[7]石春花,石明隽,王圆圆,等. MG132对高糖条件下肾小管上皮细胞SnoN蛋白表达及纤维化效应的影响[J]. 中国病理生理杂志, 2015, 31(1):64-68.
[8]Ling F, Kang B, Sun XH. Id proteins:small molecules, mighty regulators[J]. Curr Top Dev Biol, 2014, 110:189-216.
[9]Yang J, Velikoff M, Agarwal M, et al. Overexpression of inhibitor of DNA-binding 2 attenuates pulmonary fibrosis through regulation of c-Abl and Twist[J]. Am J Pathol, 2015, 185(4):1001-1012.
[10]Tajima K, Terai S, Takami T, et al. Importance of inhibitor of DNA binding/differentiation 2 in hepatic stellate cell differentiation and proliferation[J]. Hepatol Res, 2007, 37(8):647-655.
[11]Kondo M, Cubillo E, Tobiume K, et al. A role for Id in the regulation of TGF-β-induced epithelial-mesenchymal transdifferentiation[J]. Cell Death Differ, 2004, 11(10):1092-1101.
[12]Masson F, Ghisi M, Groom JR, et al. Id2 represses E2A-mediated activation of IL-10 expression in T cells[J]. Blood, 2014, 123(22):3420-3428.
[13]Patel D, Morton DJ, Carey J, et al. Inhibitor of differentiation 4 ( ID4) :from development to cancer[J]. Biochim Biophys Acta, 2015, 1855(1):92-103.
[14]Peinado H, Marin F, Cubillo E, et al. Snail and E47 repressors of E-cadherin induce distinct invasive and angiogenic propertiesinvivo[J]. J Cell Sci, 2004, 117(13):2827-2839.
[15]Kumar MS, Hendrix JA, Johnson AD, et al. Smooth muscle alpha-actin gene requires two E-boxes for proper expressioninvivoand is a target of class I basic helix-loop-helix proteins[J]. Circ Res, 2003, 92(8):840-847.
[16]Slattery C, McMorrow T, Ryan MP. Overexpression of E2A proteins induces epithelial-mesenchymal transition in human renal proximal tubular epithelial cells suggesting a potential role in renal fibrosis[J]. FEBS Lett, 2006, 580(17):4021-4030.
[17]肖瑛,方开云,石明隽,等. P38MAPK介导高糖下调肾小管上皮细胞表达BMP-7[J]. 中国病理生理杂志, 2010, 26(9):1759-1763.
[18]Wang S, de Caestecker M, Kopp J, et al. Renal bone morphogenetic protein-7 protects against diabetic nephropathy[J]. J AM Nephrol, 2006, 17(9):2504-2512.
[19]Veerasamy M, Phanish M, Dockrell ME. Smad mediated regulation of inhibitor of DNA binding 2 and its role in phenotypic maintenance of human renal proximal tubule epithelial cells[J]. PLoS One, 2013, 8(1):e51842.
(责任编辑: 陈妙玲, 余小慧)
Effects of BMP-7 on Id2 and E2A expression in NRK-52E cells exposed to high glucoseZENG Ling-ping, XIAO Ying, ZHANG Ying-ying, ZHANG Chang-zhi, WU De-pei, LI Yuan-yuan, SHI Ming-jun, GUO Bing
(DepartmentofPathophysiology,GuizhouMedicalUniversity,Guiyang550025,China.E-mail:yxhx20060725@126.com)
[ABSTRACT]AIM: To investigate the effects of bone morphogenetic protein 7 (BMP-7) on the expression of transcription factor E2A and inhibitor of differentiation 2 (Id2) in the renal tubule epithelial cells(NRK-52E)exposed to high glucose, and to explore its possible mechanism of improving renal tubular fibrosis induced by high glucose. METHODS: The NRK-52E cells were divided into control group, high glucose (HG) group and high glucose with different doses of BMP-7 (10 μg/L and 20 μg/L) group. The cells in HG group and BMP-7 group were cultured for 12 h, 24 h and 48 h. The protein expression of Id2, E2A, E-cadherin, α-smooth muscle actin (α-SMA) and collagen-I was detected by Western blot. In addition, the mRNA expression of Id2 was detected by real-time PCR. RESULTS: Compared with control group, the mRNA and protein levels of Id2 and the protein level of E-cadherin were down-regulated, while the protein levels of E2A, α-SMA and collagen-I were up-regulated in HG group (P<0.05). Compared with HG group, the mRNA and protein levels of Id2 and the protein level of E-cadherin were significantly up-regulated, while the protein expression of E2A, α-SMA and collagen-I was significantly down-regulated in 20 μg/L BMP-7 group (P<0.05). The correlation analysis showed that the Id2 protein level was negatively correlated with the E2A protein level (P<0.05). CONCLUSION: BMP-7 may intercept the process of renal tubule fibrosis induced by high glucose via promoting the expression of Id2 and inhibiting the expression of E2A at protein level.
[KEY WORDS]NRK-52E cells; High glucose; Bone morphogenetic protein-7; Inhibitor of differentiation 2; E2A
doi:10.3969/j.issn.1000- 4718.2016.02.022
[中图分类号]R363; R 573.1
[文献标志码]A
通讯作者△Tel: 0851-8174011; E-mail: yxhx20060725@126.com
*[基金项目]国家自然科学基金资助项目(No. 81360116);贵州省科学技术基金(黔科合J字[2011]2120号);贵州省卫生厅科学技术基金项目(黔卫发[2013]71号)
[收稿日期]2015- 08- 28[修回日期] 2015- 12- 08
[文章编号]1000- 4718(2016)02- 0321- 06
