神经干细胞过表达Hsp75降低Aβ介导的神经毒性*
2016-03-05林继宗陈庆状贾思远马艳姣
王 艳, 林继宗, 陈庆状, 贾思远, 马艳姣, 王 勇△
(1南方医科大学珠江医院药剂科,广东 广州 510282;2广东省中西医结合医院药事管理科,广东 佛山 528200;3中山大学附属第三医院肝胆外科,广东 广州 510630;4广州市中西医结合医院药剂科,广东 广州 510800;5南方医科大学珠江医院烧伤科,广东 广州 510282)
神经干细胞过表达Hsp75降低Aβ介导的神经毒性*
王艳1, 2,林继宗3,陈庆状4,贾思远5,马艳姣1,王勇1△
(1南方医科大学珠江医院药剂科,广东 广州 510282;2广东省中西医结合医院药事管理科,广东 佛山 528200;3中山大学附属第三医院肝胆外科,广东 广州 510630;4广州市中西医结合医院药剂科,广东 广州 510800;5南方医科大学珠江医院烧伤科,广东 广州 510282)
[摘要]目的: 应用腺病毒为载体在体外过表达热休克蛋白75(Hsp75),研究Hsp75蛋白过表达对神经干细胞在Aβ诱导神经毒性中的作用,并初步探讨其作用机制。方法: 体外培养小鼠神经干细胞C17.2,实验分为对照组、Aβ处理组、腺病毒阴性感染组和腺病毒Hsp75过表达感染组。使用荧光显微镜观察腺病毒的感染情况并进行细胞免疫鉴定;倒置相差显微镜观察各组神经干细胞的形态;MTT法检测细胞活力;流式细胞术检测细胞凋亡率;Western blot检测Hsp75和活化型caspase-3蛋白水平。结果: 荧光显微镜观察和Western blot检测表明腺病毒成功感染神经干细胞并高效表达Hsp75蛋白。此外,腺病毒感染不会导致细胞形态改变及细胞分化,同时也不会影响细胞活力。与对照组比较,Aβ处理组及腺病毒阴性感染组细胞存活率显著降低(P<0.05),细胞凋亡率及活化型caspase-3蛋白水平显著增高(P<0.05);然而,Hsp75过表达能显著提高神经干细胞的存活率,减少细胞凋亡和降低活化型caspase-3蛋白水平(P<0.05)。结论: Hsp75过表达对Aβ诱导损伤的C17.2细胞具有明显保护作用,其机制可能是与抑制caspase-3途径依赖的细胞凋亡有关。
[关键词]热休克蛋白75; C17.2神经干细胞; 细胞凋亡
阿尔茨海默病(Alzheimer’s disease,AD)又称老年痴呆症,是一种以认知功能进行性下降和情感障碍为特点的中枢神经退行性疾病,其病理特征主要表现为细胞外β-淀粉样蛋白(amyloid β-protein,Aβ)沉积形成老年斑及胞内tau蛋白过度磷酸化引起纤维缠结[1-2]。大量研究证实,Aβ对脑细胞产生的神经毒性在AD病理形成过程中发挥了重要的作用[3- 4]。因此,保护神经细胞拮抗Aβ诱导的神经毒性成为治疗AD的重要途径。
热休克蛋白75(heat shock protein 75,Hsp75)是一个主要定位于线粒体,分子量约为75 kD的分子伴侣,对细胞存活、增殖及线粒体功能的维护具有重要的作用。近年来研究表明,Hsp75是一个抗凋亡蛋白,特别是在心肌细胞及肿瘤细胞中都已证实具有抗凋亡的作用[5-6],但Hsp75过表达对保护神经干细胞拮抗Aβ诱导的细胞损伤尚未明确。本研究应用腺病毒载体在C17.2神经干细胞过表达人Hsp75基因,以探讨Hsp75对Aβ诱导神经干细胞损伤的保护作用,为下一步的基因工程化神经干细胞移植治疗AD奠定了基础。
材料和方法
1实验材料
重组腺病毒为本课题前期实验包装,滴度为1×1013PFU/L;C17.2神经干细胞由上海交通大学金卫林教授馈赠;DMEM、胎牛血清、马血清购于Gibco;Hsp75、MAP2、GFAP和MBP多克隆抗体、nestin小鼠单克隆抗体均购自Abcam;活化型caspase-3(cleaved caspase-3)抗体购自CST;β-actin和α-tubulin小鼠单克隆抗体购于碧云天生物技术研究所;Aβ1-42购于USBiological。
2主要方法
2.1神经干细胞培养、实验分组和处理C17.2细胞培养于含10%胎牛血清、5%马血清的DMEM高糖培养基中,孵育于37 ℃、5% CO2培养箱中,取对数生长期的细胞用于实验。实验共分为4组:对照组(control组):细胞于正常培养基生长;Aβ处理组(C17.2+Aβ组):用含10 μmol/L Aβ1-42的培养基培养神经干细胞;腺病毒阴性感染组(Ad-GFP+Aβ组): 感染了对照腺病毒的神经干细胞置于含10 μmol/L Aβ1-42的培养基中生长;腺病毒Hsp75过表达感染组(Ad-Hsp75+Aβ组): 感染了携带Hsp75基因腺病毒的神经干细胞,用含10 μmol/L Aβ1-42的培养基处理。以上所有分组的处理时间均为36 h。
2.2腺病毒感染神经干细胞接种密度为每孔2×105个C17.2神经干细胞于6孔板,12 h后去除培养基,PBS洗3次,添加感染复数为100的病毒液和1 mL无血清的高糖培养基培养,2 h后,换正常培养基继续培养36 h于荧光显微镜下观察GFP表达情况,拍片。
2.3Hsp75和cleaved caspase-3蛋白水平的检测用细胞裂解液裂解细胞,离心后取蛋白上清,BCA法测蛋白的含量,进行10% SDS聚丙烯酰胺凝胶电泳,10 V恒压半干转膜1 h,5%脱脂奶粉室温封闭2 h,过夜孵育Hsp75多克隆抗体和β-actin小鼠单克隆抗体,之后用辣根过氧化物酶结合的 II 抗结合,ECL法显色后扫描。
2.4细胞形态学观察、免疫鉴定和活力的检测按上述感染方法,腺病毒感染细胞36 h后,于倒置相差显微镜下观察细胞的形态,拍片。接着用4%多聚甲醛固定,10%山羊血清封闭,滴加nestin的I 抗过夜孵育。次日,依次滴加罗丹明山羊抗小鼠IgG的II抗和DAPI室温孵育,荧光显微镜下观察拍照。干细胞分化为神经元、星形胶质细胞和少突胶质细胞的检测方法参照上述干细胞nestin免疫鉴定,只需把 I 抗分别换为MAP2、GFAP、MBP。细胞活力检测方法参照下面细胞存活率的检测。
2.5细胞存活率和凋亡的检测接种于96孔板的C17.2细胞实验处理36 h后,吸弃培养基,PBS洗3次,于每孔加入5 g/L的MTT溶液20 μL,37 ℃培养箱中避光孵育4 h,弃去上清液,加入150 μL的二甲基亚砜(DMSO),振荡混匀使结晶充分溶解,以酶标仪于490 nm波长处检测A值。将接种于6孔板的细胞分别实验处理后用无EDTA的胰酶消化收集细胞。制成单细胞悬液收集后1 000 r/min离心5 min,弃掉上清液,加入500 μL的结合缓冲液、5 μL的Annexin V-APC染色液混匀,室温避光孵育15 min;再加入10 μL的7-AAD染色液,用流式细胞仪检测C17.2细胞的凋亡率。
3统计学处理
数据使用SPSS 13.0 统计软件分析,结果使用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析。方差齐时采用SNK法;方差不齐时则采用Dunnett’s T3法。以P<0.05为差异有统计学意义。
结果
1腺病毒感染后GFP荧光蛋白的观察和Hsp75过表达的鉴定
腺病毒感染神经干细胞36 h 后,在荧光显微镜下观察到GFP大量表达,证实C17.2细胞已被病毒感染(图1)。提取总蛋白进行Western blot实验,结果显示Ad-Hsp75过表达感染组与正常组和腺病毒阴性感染组Ad-GFP相比,Hsp75蛋白表达量明显增加,说明了腺病毒Ad-Hsp75感染的神经干细胞Hsp75基因可以有效表达,见图2。
2腺病毒感染后细胞形态学观察、免疫鉴定和活力的检测
腺病毒感染36 h后,在倒置相差显微镜下观察,腺病毒感染组(Ad-GFP和Ad-Hsp75)的细胞形态与对照组的细胞形态一样。均呈现为细胞形态不规则、呈扁平的形态,细胞边界不清,并与邻近的细胞相互接触,证实了腺病毒的感染不会改变细胞的正常形态;此外,MTT结果显示3组的细胞活力无显著差异,证实了腺病毒感染C17.2细胞不会影响细胞活力,见图3。在荧光显微镜下观察到所有细胞均表达nestin,然而3组细胞均不表达MAP2、GFAP和MBP,说明了腺病毒的感染不会导致C17.2神经干细胞的分化,见图4。
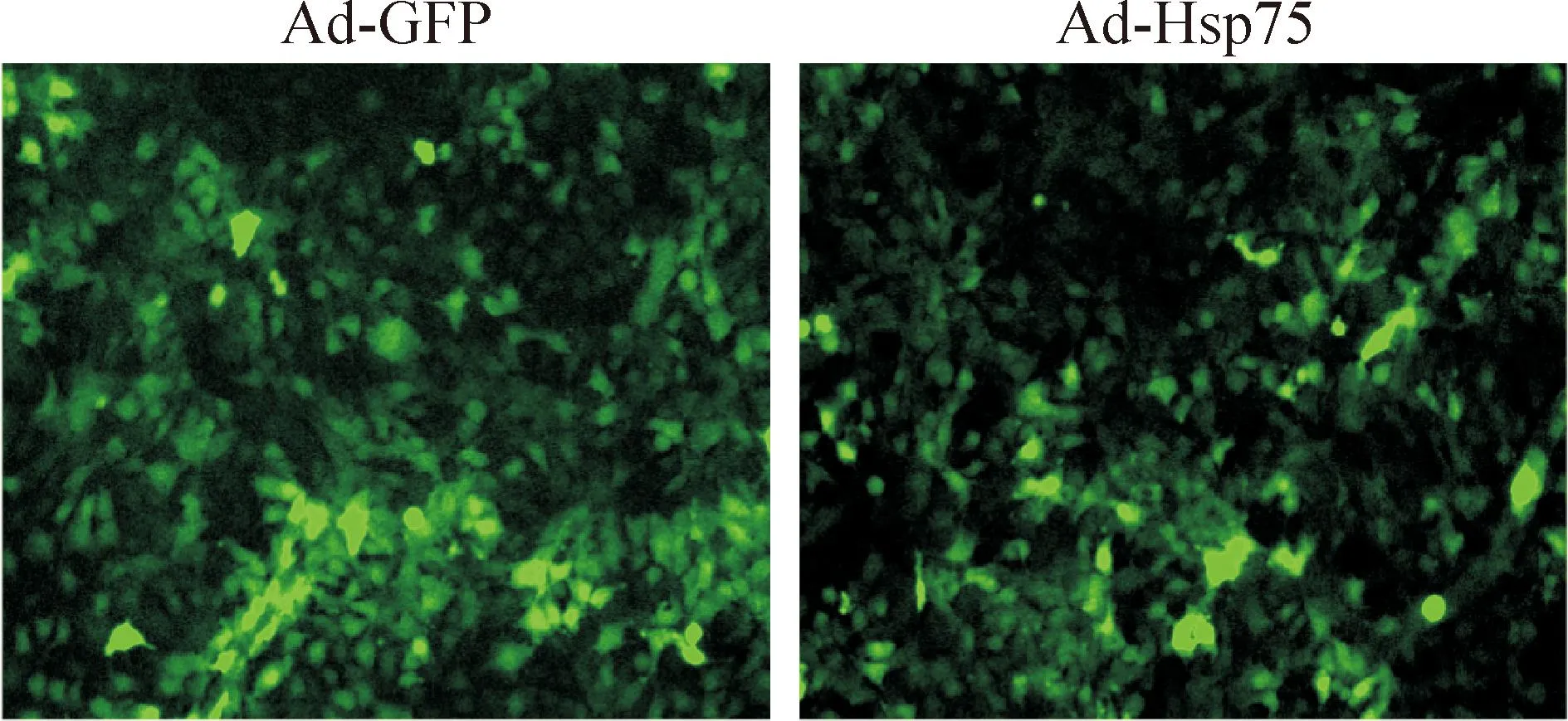
Figure 1.GFP expression in C17.2 neural stem cells after adenovirus transfection (×100).
图1腺病毒感染C17.2神经干细胞的GFP表达
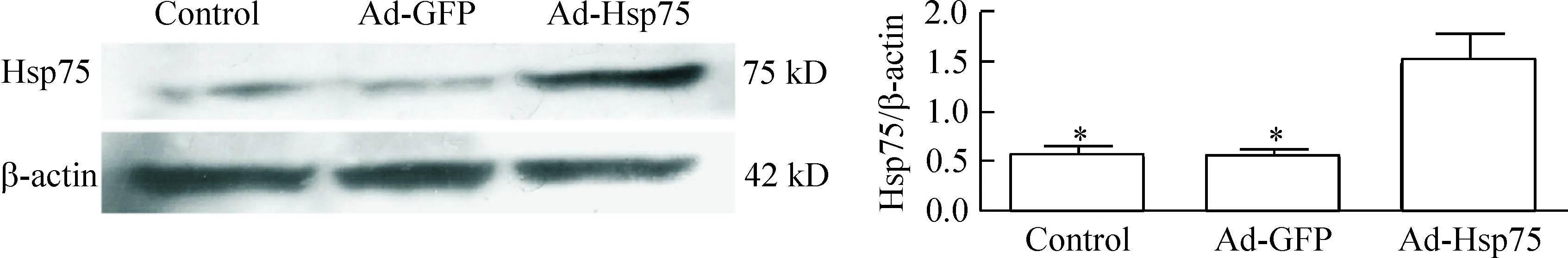
Figure 2.The expression of Hsp75 protein in the cells. Mean ±SD.n=3.*P<0.05vsAd-Hsp75 group.
图2Hsp75蛋白在细胞中的表达

Figure 3.The morphology and viability of C17.2 neural stem cells. A: the morphology of the cells was observed under inverted phase-contrast microscope (×200); B: the cell viability was detected by MTT assay after transfection. Mean±SD.n=3.
图3C17.2神经干细胞的形态学观察和细胞活力检测
3Hsp75过表达对Aβ诱导C17.2细胞存活率和凋亡率的影响
如图5所示,与对照组比较,未感染的神经干细胞和感染了对照腺病毒的神经干细胞经Aβ处理后,细胞存活率下降,凋亡率明显增加(P<0.05);用过表达Hsp75腺病毒感染神经干细胞后,能够明显逆转Aβ引起的细胞活性降低及凋亡增加(P<0.05)。
4Hsp75过表达对cleaved caspase-3蛋白水平的影响
从Western blot实验结果可见,对照组神经干细胞cleaved caspase-3蛋白的水平非常低,而用Aβ处理的2个神经干细胞组(C17.2+Aβ和Ad-GFP+Aβ),其cleaved caspase-3表达水平明显增加,与对照组相比均差异显著(P<0.05)。用过表达Hsp75腺病毒感染后,cleaved caspase-3水平明显下降(P<0.05),见图6。
讨论
大量研究已经证实,AD患者颅内微环境改变与Aβ有关,Aβ在脑内产生神经毒性抑制了神经细胞的生成[7-8]。我们的前期实验结果也证实Aβ1-42不仅能直接影响神经干细胞的增殖,更通过小胶质细胞加强抑制了神经干细胞的增殖与分化[9]。由于C17.2神经干细胞与原代神经干细胞生理功能具有许多相似之处,且同样具有多潜能分化的功能,在一定的条件下能诱导分化为神经元、星形胶质细胞和少突胶质细胞这3种细胞,被认为是研究神经干细胞的一种工具细胞[10],因此我们采用此细胞建立模型,研究其过表达Hsp75以对抗Aβ介导的神经毒性。
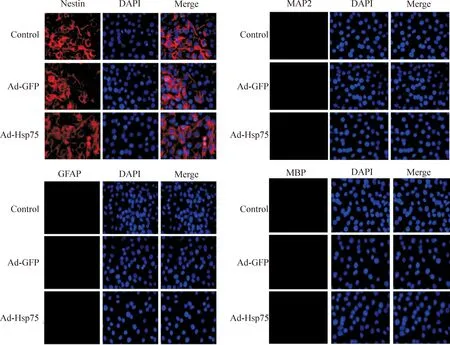
Figure 4.The immunofluorescence identification of C17.2 neural stem cells (×400).
图4C17.2神经干细胞的免疫荧光鉴定
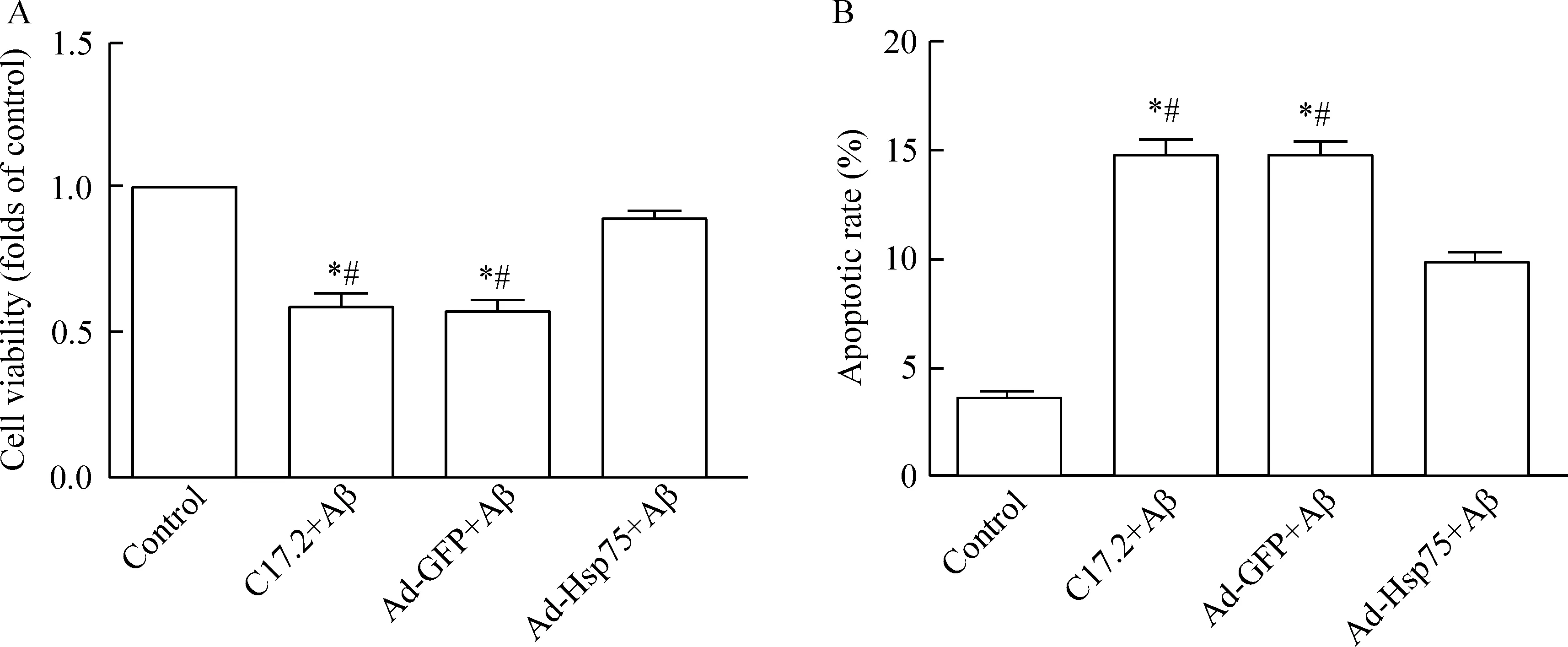
Figure 5.The neural stem cell viability and apoptotic rate in different groups. A: the cell viability was detected by MTT assay; B: the cells were double stained with Annexin V-APC and 7-AAD and analyzed by flow cytometry. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsAd-Hsp75+Aβ group.
图5各组细胞存活率和凋亡率的检测
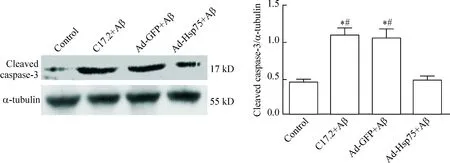
Figure 6.The protein levels of cleaved caspase-3 in different groups. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsAd-Hsp75+Aβ group.
图6各组cleaved caspase-3的蛋白水平
Hsp75是一种线粒体分子伴侣,研究已经证实其在脑和心脏中过表达能维护线粒体的正常功能,对维持细胞内环境的稳定起着重要的作用。Hsp75过表达能够逆转缺氧引起心肌细胞的凋亡[5],也能够降低脑缺血所引起的损伤[11]。然而,Hsp75过表达在保护神经干细胞免受Aβ诱导神经毒性的作用及其机制还尚未清楚。实验中我们选取C17.2神经干细胞作为Hsp75基因感染的靶细胞,进一步去探讨Hsp75过表达在保护神经干细胞免受Aβ诱导神经毒性中的作用。因为神经干细胞是一群相对静止的细胞,利用脂质体转染的效率低、毒性较大,因此我们选用了高感染效率、低毒性的腺病毒去感染神经干细胞;考虑到C17.2细胞是一种具有多潜能分化的干细胞,在实验中我们对感染前后的细胞进行了相关免疫鉴定。实验结果表明,腺病毒感染C17.2神经干细胞,感染率较高;通过Western blot 检测发现感染了Hsp75基因的神经干细胞能够高效表达Hsp75蛋白;同时腺病毒感染后不会改变细胞的正常形态和诱导神经干细胞的分化,而且细胞的活性也不受影响,证实了腺病毒感染C17.2神经干细胞是一种可行且安全的方法。AD患者脑内神经细胞增殖受到抑制,很大程度上是由于脑内Aβ诱导神经毒性加速了神经细胞的坏死和凋亡;细胞的凋亡涉及到凋亡调控因子半胱氨酸蛋白酶,其中激活型caspase-3是凋亡过程中的最终执行者,caspase-3的活化程度直接反映了细胞的凋亡程度。我们的实验结果显示,Hsp75过表达能够提高C17.2神经干细胞的存活率,减少细胞凋亡率;同时也下调了cleaved caspase-3蛋白的表达,说明Hsp75过表达能够逆转Aβ诱导神经干细胞的凋亡。
综上所述,Hsp75 过表达能够保护神经干细胞免受Aβ介导的神经毒性,其机制可能与抑制细胞的凋亡有关。此外,Hsp75过表达对于保护神经干细胞的具体机制有待于下一步的研究。
[参考文献]
[1]Mattson MP. Pathways towards and away from Alzheimer’s disease[J]. Nature, 2004, 430(7000):631-639.
[2]Gomez-Isla T, Hollister R, West H, et al. Neuronal loss correlates with but exceeds neurofibrillary tangles in Alzheimer’s disease[J]. Ann Neurol, 1997, 41(1):17-24.
[3]葛宇松,尹琳,滕伟禹,等. β-淀粉样蛋白诱导大鼠海马神经元凋亡及海马亲环素A表达的变化[J]. 中华神经医学杂志, 2012, 11(4):337-341.
[4]Sadigh-Eteghad S, Sabermarouf B, Majdi A, et al. Amyloid-beta: a crucial factor in Alzheimer’s disease[J]. Med Princ Pract, 2014, 24(1):1-10.
[5]Xiang F, Huang YS, Shi XH, et al. Mitochondrial chaperone tumour necrosis factor receptor-associated protein 1 protects cardiomyocytes from hypoxic injury by regulating mitochondrial permeability transition pore opening[J]. FEBS J, 2010, 277(8):1929-1938.
[6]Costantino E, Maddalena F, Calise S, et al. TRAP1, a novel mitochondrial chaperone responsible for multi-drug resistance and protection from apoptotis in human colorectal carcinoma cells[J]. Cancer Lett, 2009, 279(1):39-46.
[7]Mazur-Kolecka B, Frackowiak J. Neprilysin protects human neuronal progenitor cells against impaired development caused by amyloid-beta peptide[J]. Brain Res, 2006, 1124(1):10-18.
[8]Greenberg DA, Jin K. Neurodegeneration and neurogenesis: focus on Alzheimer’s disease[J]. Curr Alzheimer Res, 2006, 3(1):25-28.
[9]韦美丹,林继宗,朱宁,等. Aβ1-42作用的小胶质细胞对体外培养的神经干细胞生存的影响[J]. 中国病理生理杂志, 2012, 28(4):683-688.
[10]Lundqvist J, El AJ, Svensson C, et al. Optimisation of culture conditions for differentiation of C17.2 neural stem cells to be used forinvitrotoxicity tests[J]. Toxicol In Vitro, 2013, 27(5):1565-1569.
[11]Voloboueva LA, Duan M, Ouyang Y, et al. Overexpression of mitochondrial Hsp70/Hsp75 protects astrocytes against ischemic injuryinvitro[J]. J Cereb Blood Flow Metab, 2008, 28(5):1009-1016.
(责任编辑: 林白霜, 罗森)
Over-expression of Hsp75 in neural stem cells reduced Aβ-mediated neurotoxicityWANG Yan1, 2, LIN Ji-zong3, CHEN Qin-zhuang4, JIA Si-yuan5, MA Yan-jiao1, WANG Yong1
(1DepartmentofPharmacy,ZhujiangHospital,SouthernMedicalUniversity,Guangzhou510282,China;2DepartmentofPharmacy,GuangdongHospitalofIntegratedChineseandWesternMedicine,Foshan528200,China;3DepartmentofHepatobiliarySurgery,TheThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China;4DepartmentofPharmacy,GuangzhouHospitalofIntegratedChineseandWesternMedicine,Guangzhou510800,China;5DepartmentofBurn,ZhujiangHospital,SouthernMedicalUniversity,Guangzhou510282,China.E-mail:yongwh2005@163.com)
[ABSTRACT]AIM: To investigate the effect of heat shock protein 75 (Hsp75) over-expression on Aβ-induced neurotoxicity in the neural stem cells and to explore its mechanism. METHODS: An adenovirus-mediated Hsp75 over-expression vector was usedinvitro. The mouse neural stem cell C17.2 was culturedinvitroand divided into control group, Aβ group, negative adenovirus vector transfection group and Hsp75 over-expression adenovirus vector transfection group. The transfection and cellular immune identification were detected by fluorescence microscopy. The cell morphology was observed under inverted phase-contrast microscope. The cell viability and apoptosis were detected by MTT assay and flow cytometry, respectively. Hsp75 over-expression and cleaved caspase-3 protein level were measured by Western blot. RESULTS: Observation by fluorescence microscopy indicated that C17.2 cells were successfully transfected andHsp75 gene was effectively expressed in the neural stem cells after transfection. In addition, the morphology and viability of the cells did not change and these cells did not differentiate after transfection. As compared with control group, the cell viability in Aβ group and negative adenovirus vector transfection group was significantly decreased (P<0.05), and the cell apoptotic rate and cleaved caspase-3 level (P<0.05) were increased. As compared with Aβ group and negative adenovirus vector transfection group, Hsp75 over-expression significantly increased the cell viability, and decreased the cell apoptosis and cleaved caspase-3 level (P<0.05). CONCLUSION: Hsp75 over-expression protects the neural stem cells against Aβ-induced injury. The mechanism may be related to inhibiting caspase-3 pathway-dependent apoptosis.
[KEY WORDS]Heat shock protein 75; C17.2 neural stem cells; Apoptosis
doi:10.3969/j.issn.1000- 4718.2016.02.019
[中图分类号]R363
[文献标志码]A
通讯作者△Tel: 020-61643555; E-mail: youngwp005@163.com
*[基金项目]广东省自然科学基金资助项目(No. S2012010008199; No. S2013010015546)
[收稿日期]2015- 01- 05[修回日期] 2015- 11- 25
[文章编号]1000- 4718(2016)02- 0302- 05
