咪达普利对氯化铵所致急性肺损伤大鼠血气、MDA及AngⅡ、CD54蛋白表达的影响
2016-03-05黄丛富郝雪琴刘传发王婷婷温小利陶中蓉
黄丛富, 郝雪琴, 邓 雯, 刘传发, 王婷婷, 温小利, 陶中蓉
(河南科技大学动物科技学院药学系,河南 洛阳 471003)
咪达普利对氯化铵所致急性肺损伤大鼠血气、MDA及AngⅡ、CD54蛋白表达的影响
黄丛富,郝雪琴△,邓雯,刘传发,王婷婷,温小利,陶中蓉
(河南科技大学动物科技学院药学系,河南 洛阳 471003)
[摘要]目的: 本研究通过复制氯化铵致大鼠肺损伤模型,研究咪达普利对肺损伤大鼠动脉血气、MDA、肺形态学和AngⅡ、CD54蛋白表达的影响。方法: 将30只雄性大鼠随机分为3组:空白对照组、肺损伤模型组和药物组。对照组大鼠腹腔注射生理盐水2 mL/kg;肺损伤模型组大鼠腹腔注射等量6%氯化铵;药物组大鼠在注射6%氯化铵后,每天1次灌胃咪达普利(3 mg/kg),连续灌胃7 d;在实验第7天,用2%的戊巴比妥钠麻醉,采集腹主动脉血和腹腔静脉血样本;肺组织经4%多聚甲醛灌注、固定、脱水、透明、浸蜡、包埋和切片。ELISA法测定血清TNF-α和IL-6水平,化学发光法测定血清MDA含量,HE染色观察肺部形态学变化,免疫组织化学染色法观察肺组织AngⅡ和CD54蛋白表达。结果: 与对照组相比,模型组PaCO2明显升高(P<0.05),血清TNF-α、IL-6和MDA浓度显著增加(P<0.01),氯化铵腹腔注射的肺损伤模型组大鼠出现肺水肿、肺炎、肺泡壁瘀血、肺泡腔出血和肺泡壁增生等损伤,肺组织AngⅡ和CD54蛋白表达明显增高(P<0.01);与模型组比较,药物组PaCO2明显降低(P<0.05),血清TNF-α、IL-6和MDA浓度以及肺组织AngⅡ、CD54蛋白表达显著降低(P<0.01)。结论: 咪达普利可显著改善氯化铵所致肺损伤大鼠血气,抑制脂质过氧化和血清炎症细胞因子,降低肺组织AngⅡ和CD54蛋白表达。
[关键词]咪达普利; 急性肺损伤; 氯化铵
急性肺损伤(acute lung injury,ALI)是指由各种肺内外致病因素中的心源性以外的因素导致的急性、进行性缺氧性呼吸衰竭,并伴随一系列严重的肺部炎症过程[1-2]。作为临床急症之一,其发病迅速,病因复杂,抢救困难,致死率高。ALI的病因多达百余种,可以分为直接病因和间接病因。溺水、误吸入毒物、肺挫伤和肺感染等构成直接病因;脓毒血症、肺部外的严重创伤、休克、外科手术、重症胰腺炎和全身严重感染等构成了间接病因[3]。急性肺损伤加重则发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)。目前的治疗手段多为对症治疗,尚未有特效药物。有研究表明,咪达普利(imidapril)对吸入性肺炎有较好的预防作用,它通过抑制血管紧张素转换酶(angiotensin-converting enzyme,ACE)活性阻断血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)的生成[4],从而起到预防和缓解损伤肺、消除炎症反应的作用。因此,本实验进一步研究了咪达普利对ALI的治疗作用以及对血气指标、丙二醛(malondialdehyde,MDA)、AngⅡ和CD54蛋白表达及相应炎症因子的影响。
材料和方法
1实验动物分组及模型制备
30只SPF级雄性SD大鼠,由华中科技大学同济学院实验动物中心提供,合格证号为SCXK(鄂)2010-0007,饲养于河南科技大学动物牧场,大鼠笼和所用器皿等均严格消毒,将SD大鼠雄鼠随机平均分成3组:对照组、模型组和药物组。对照组大鼠腹腔注射生理盐水2 mL/kg;肺损伤模型组大鼠腹腔注射等量6% NH4Cl[5-6];药物组大鼠在注射6% NH4Cl 后,每天1次灌胃咪达普利(3 mg/kg),连续灌胃7 d;在实验第7天,用2 %的戊巴比妥钠麻醉,采集腹主动脉血和腹腔静脉血样本;肺组织经4%多聚甲醛灌注、固定、脱水、透明、浸蜡、包埋和切片。
2观察指标与实验方法
2.1血气及TNF-α、IL-6和MDA浓度的测定采集的动脉血在洛阳市中心医院呼吸科于37 ℃下测定pH、PaCO2、PaO2、Na+、K+、Ca2+、Hct等参数;静脉血在3 000 r/min离心分离血清后用ELISA试剂盒特异性显色,用多功能酶标仪测定TNF-α和IL-6的浓度,化学发光法测定MDA浓度。
2.2HE染色取固定好的大鼠肺脏用手术刀修块,从低到高梯度乙醇脱水,二甲苯透明,石蜡包埋后切片,染色前将切片于60 ℃烘箱烤片30 min,二甲苯中脱蜡,从高到低梯度乙醇浸泡复水,苏木精染液染色5 min,自来水稍洗,1%盐酸乙醇溶液分化5~10 s,自来水洗返蓝,0.5%伊红(水溶性)染色2 min,由低到高梯度乙醇脱水,二甲苯透明,中性树胶封片,在显微镜下观察并拍照。
2.3免疫组化染色将制作好的切片60 ℃烤片1 h,二甲苯脱蜡,高浓度乙醇到低浓度乙醇水化,3% H2O2溶液封闭内源性过氧化物酶;电磁炉进行热抗原修复暴露抗原决定簇,冷却后PBS冲洗2~3次,于湿盒中用5%的BSA室温封闭非特异性蛋白20 min,甩去余液,滴加 I 抗,4 ℃孵育过夜;PBS水洗3次,II 抗37 ℃孵育30 min;PBS水洗后滴加SABC复合物37 ℃反应20 min,DAB显色后双蒸水终止反应,滴加苏木精染液对细胞核进行衬染,1%盐酸乙醇分化并用自来水蓝化,由低到高梯度乙醇脱水、二甲苯透明后中性树胶封片,在显微镜下观察。
2.4图像处理采用Image-Pro Plus 6.0图像分析软件,每组免疫组化后的肺切片选取8张图片,获取肺组织AngⅡ和CD54蛋白表达的积分吸光度(IA)。
3统计学处理
各组计量资料以均数±标准误(mean±SEM)表示,采用SPSS 19.0软件进行统计分析。多组间比较采用单因素方差分析(one-way ANOVA),多重比较用Tukey法,以P<0.05为差异有统计学意义。
结果
1咪达普利对急性肺损伤大鼠血气指标的影响
与对照组比较,氯化铵诱导的急性肺损伤模型大鼠PaCO2明显升高(P<0.05);与模型组比较,咪达普利药物组能明显降低氯化铵诱导的急性肺损伤模型大鼠的PaCO2(P<0.05),见表1。
2咪达普利对急性肺损伤大鼠血清TNF-α、IL-6和MDA浓度的影响
与对照组比较,氯化铵诱导的急性肺损伤模型大鼠血清中TNF-α、IL-6和MDA的浓度显著增加(P<0.01);与模型组比较,咪达普利药物组能显著降低大鼠血清中TNF-α、IL-6和MDA的浓度(P<0.01),见图1、表2。
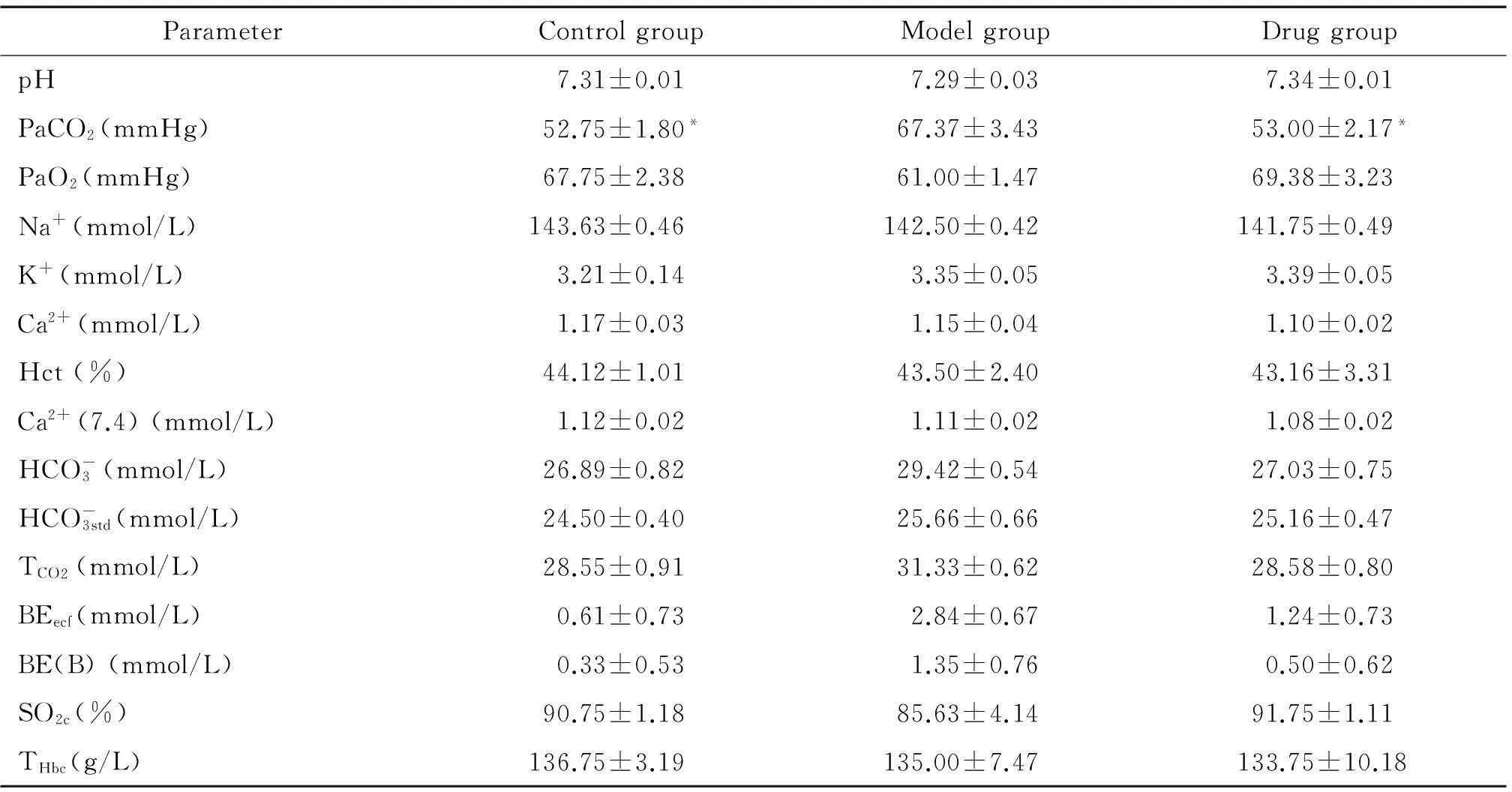
表1 各组血气指标测定结果
*P<0.05vsmodel group.
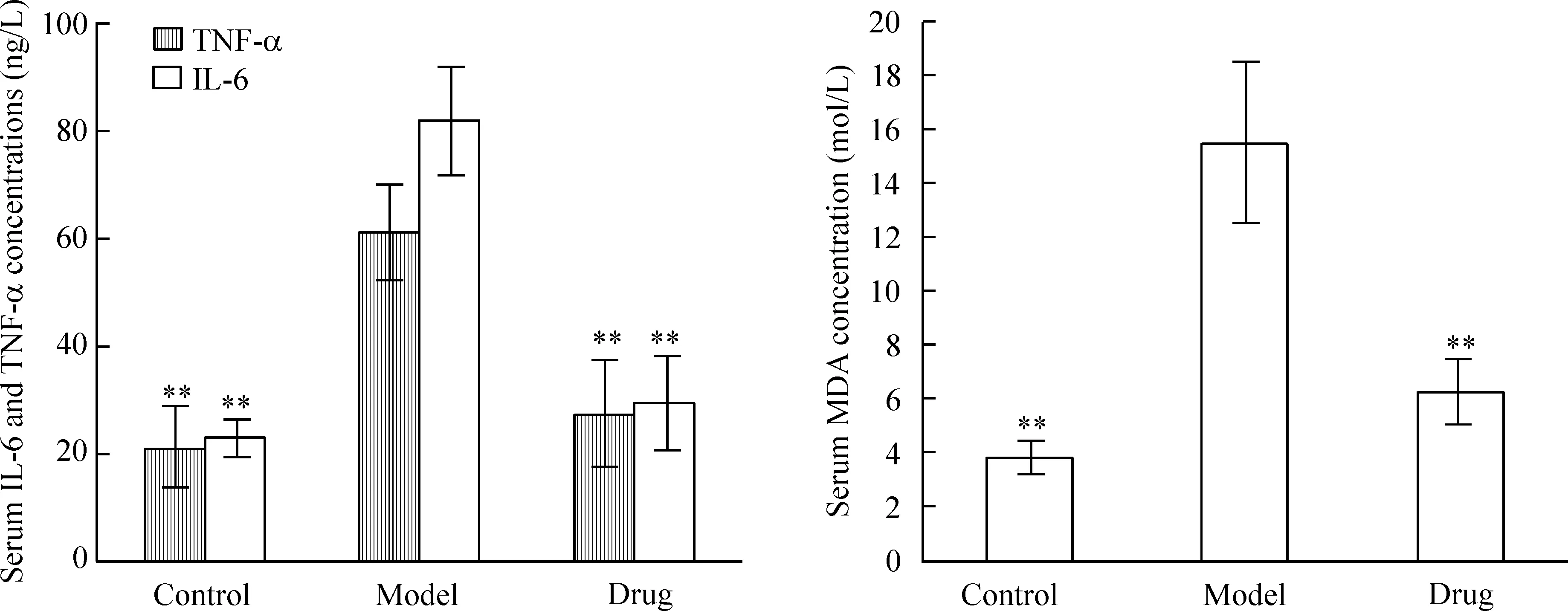
Figure 1.Comparison of serum concentrations of TNF-α, IL-6 and MDA in each group. Mean±SEM.n=10.**P<0.01vsmodel.
图1各组血清中TNF-α、IL-6和MDA浓度的比较
3咪达普利对急性肺损伤形态学的影响
肺组织形态学检查结果显示,与对照组相比,肺损伤模型组支气管周围蓝染细胞聚集较多,以I型肺泡上皮细胞和毛细血管内皮细胞损伤为主,肺泡间质水肿伴大量炎症细胞渗出,可见实变及肺泡塌陷及透明膜形成,有明显的炎症细胞(单核巨噬细胞、淋巴细胞和白细胞)浸润,尤其是在支气管附近,而且在肺泡壁内有大量红细胞,瘀血严重,另外,肺泡壁厚度也明显增加,有增生现象;与肺损伤模型组相比,药物治疗组I型肺泡上皮细胞和毛细血管内皮细胞损伤程度减轻,药物组肺泡壁的厚度明显变小,而且厚度与对照组相当,增生现象减弱或消失,肺泡腔和肺泡壁中的红染相对较少,红细胞渗出不太明显,出血或瘀血现象在一定程度上得到控制,见图2。
4咪达普利对急性肺损伤大鼠肺组织AngⅡ表达的影响
免疫组化染色后经苏木精衬染,可见蓝紫色细胞核。与对照组相比,模型组大鼠肺组织棕色颗粒表达最多,表现为胞体外形肥大,突起变短增粗,染色加深;药物组阳性表达相对较少,棕色颗粒数目有很大程度地下降,见图3。
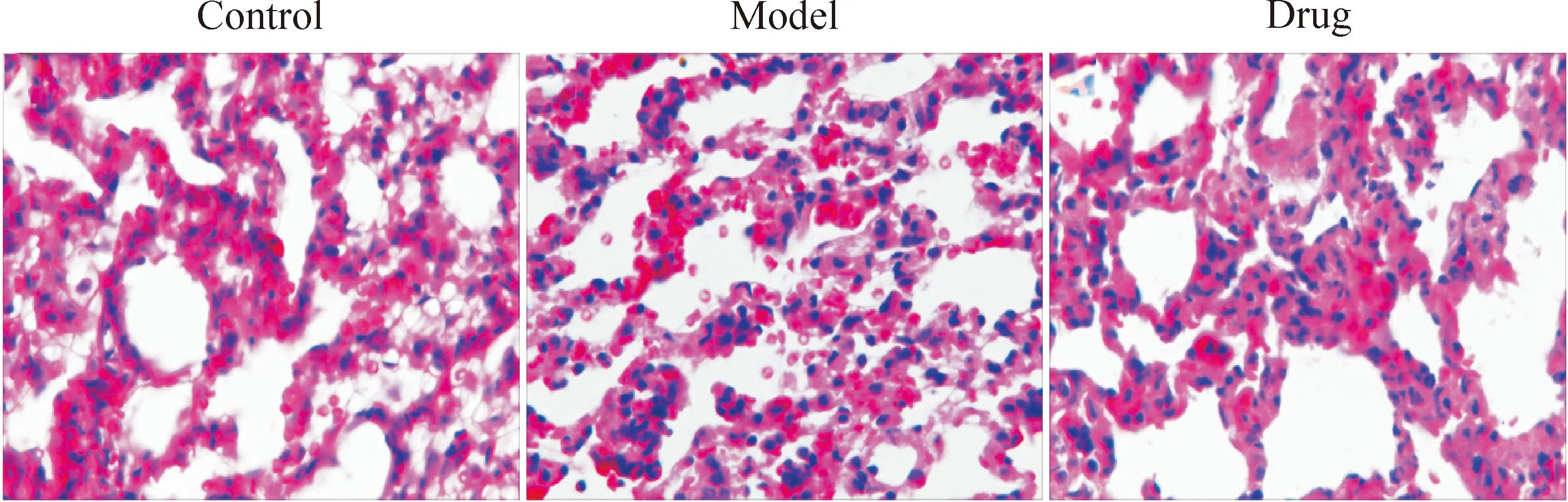
Figure 2.Morphology change of lung tissue in each group (HE staining,×400).
图2各组大鼠肺脏形态学损伤表现
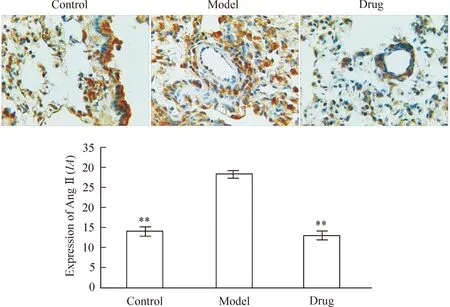
Figure 3.Immunohistochemical detection for Ang Ⅱ expression in lung (×400). Mean±SEM.n=10.**P<0.01vsmodel.
图3免疫组化显示肺脏Ang Ⅱ的表达
5咪达普利对急性肺损伤CD54蛋白表达的影响
免疫组化染色图片显示,CD54蛋白主要分布于肺血管内皮细胞和支气管上皮细胞的胞膜和胞浆中,经免疫组化染色,细胞核蓝染,核周围呈现棕染。对照组出现少量的棕染;模型组染色加深,阳性表达增多,药物组阳性表达相对较少,棕色颗粒数目有很大程度的下降。与对照组相比,氯化铵模型组CD54蛋白阳性表达显著增多(P<0.01);与氯化铵组相比,咪达普利组CD54蛋白阳性表达显著减少(P<0.01),表明用氯化铵腹腔注射大鼠引发炎症反应使肺组织中的CD54蛋白表达增多,而咪达普利灌胃大鼠减轻炎症反应而使得肺组织中CD54蛋白表达减少,见图4。
讨论
随着人口中国老龄化的加大和突发新发疾病的增多,ALI/ARDS作为危重病领域的难题,寻找更多更有效的治疗途径已经激发了研究者们的浓厚兴趣。ALI/ARDS引发局部肺组织水肿、充血、出血及凝血[7],肺泡塌陷,肺毛细血管膜损伤及伴随肺间质的纤维化,临床表现呼吸频数增加,呼吸窘迫,顽固性低氧血症,胸部X线显示双肺弥漫性浸润,易并发多器官衰竭[8]。与正常组相比,ALI/ARDS模型血清中TNF-α含量明显升高。TNF-α作为巨噬细胞的功能蛋白,能够特异性反映巨噬细胞分布的变化。TNF-α对肺脏有一定的毒性,它能够增加肺组织血管通透性,活化内皮细胞,组织中TNF-α浓度的增加使肺组织损伤加剧[9-10]。因此,在组织病理学层面,观察肺组织形态的变化,测定巨噬细胞的分布和细胞因子的浓度,能够了解肺部组织的炎症和损伤情况。
早期的ALI病理表现为肺血气屏障通透性增高,肺泡与肺间质内积聚有大量的水肿液,水肿液中含多种炎症细胞,其中中性粒细胞占主要成分。附着在损伤的血管内皮细胞表面的中性粒细胞,逐渐移向肺间质和肺泡腔中,并释放大量炎症细胞因子(TNF-α、IL-6等)和过氧化物等,这些炎症介质进一步诱导了肺损伤。除此之外,凝血和纤溶发生的紊乱也加重了ALI的病程,引发血管栓塞以及微循环结构受损[7]。

Figure 4.Immunohistochemical detection for CD54 protein expression in lung (×400). Mean±SEM.n=10.**P<0.01vsmodel.
图4免疫组化显示肺脏CD54蛋白的表达
本实验中,血气指标显示,我们构建的模型组PaCO2有所升高(P<0.05),动脉血液中CO2分压的升高说明肺脏气体交换效率降低,影响机体换气功能;同时300>P/F>200(PO2/FiO2≈ 278,FiO2=0.21),实验应用NH4Cl 8 h后取组织,损伤建立时间小于1周,依据柏林诊断标准[11-13],该模型已构成轻度ALI,实验建模成功。在药物组,PaCO2明显降低,表明肺脏气体交换能力得到一定改善。咪达普利对ALI引发的PaCO2升高产生了明显的缓解作用,这可能是咪达普利通过抑制脂质过氧化和肺部炎症反应,提高血氧结合比,从而改善肺部功能。

通过免疫组化实验,我们发现模型组AngⅡ和CD54阳性表达比对照组显著增多(P<0.01)。NH4Cl使血管通透性增加,引发水肿、充血和出血,这些炎症变化使血浆中的单核细胞透过血管壁进入肺组织中转变为AM,肺组织中的AM大量聚集,AngⅡ和CD54阳性表达增多。咪达普利组AngⅡ和CD54表达与模型组相比显著降低,可能的原因是咪达普利在体内代谢成咪达普利拉,后者抑制了ACE活性,使AngⅡ生成减少[17],AngⅡ对AP-1和NF-κB的激活能力相应减弱,NF-κB对细胞因子、黏附分子等基因转录的促进作用相应减弱,使单核细胞转变成AM的数量减少[18-19]。
综上所述,NH4Cl增加血管壁通透性,导致组织水肿、充血、出血、炎症细胞(巨噬细胞)渗出增多,I型肺泡上皮细胞和毛细血管内皮细胞损伤,AngⅡ和CD54蛋白表达增高;炎症使肺泡壁增厚,血气交换降低,同时激活了RAS,使肺部脂质过氧化增强,MDA生成增多。咪达普利通过发挥ACEI作用,降低RAS活性,抑制脂质过氧化和肺部炎症反应,使单核细胞向AM转化减少,血氧结合比提高,肺功能得到一定程度改善。
[参考文献]
[1]Acosta-Herrera M, Lorenzo-Diaz F, Pino-Yanes M, et al. Lung transcriptomics during protective ventilatory support in sepsis-induced acute lung injury[J]. PLoS One, 2015, 10(7):e0132296.
[2]Xu YL, Liu YL, Wang Q, et al. Intravenous transplantation of mesenchymal stem cells attenuates oleic acid induced acute lung injury in rats[J]. Chin Med J (Engl), 2012, 125(11):2012-2018.
[3]Yan X, Wu L, Li B, et al. Cyanidin-3-O-glucoside attenuates acute lung injury in sepsis rats[J]. J Surg Res, 2015,199(2):592-600.
[4]Yoneda H, Ueta K, Nagasaki M, et al. Involvement of heparan sulfate in the renoprotective effects of imidapril, an angiotensin-converting enzyme inhibitor, in diabetic db/db mice[J]. J Recept Signal Transduct Res, 2014, 34(1):21-25.
[5]刘秋平, 卢晓昭, 王黎明, 等. 骨髓间充质干细胞对氯化铵致大鼠急性肺水肿防治作用的研究[J]. 中国急救医学, 2013,33(8 Suppl): 25-27.
[6]薛敬礼, 史崇敏, 章金涛, 等. 不同方法诱发大鼠肺水肿动物模型的比较研究[J]. 河南医学研究,2006,15(2):109-111.
[7]刘又宁,解立新. 急性肺损伤/急性呼吸窘迫综合征近年来国内研究进展[J]. 中华结核和呼吸杂志,2004,27(1):8-10.
[8]Mokra D, Kosutova P. Biomarkers in acute lung injury[J]. Respir Physiol Neurobiol, 2015, 209:52-58.
[9]蔡杰,谭利平,冯佳,等.益气养阴方对肺间质化大鼠肺组织TNF-α、TGF-β1和IFN-γ mRNA水平的影响[J]. 细胞与分子免疫学杂志,2015,31(7):894-897.
[10]王文军,罗志建,代丽,等. 急性肺损伤大鼠肺组织骨桥蛋白表达及骨桥蛋白对TNF-α、IL-10表达的影响[J]. 中国免疫学杂志, 2011, 27(3):261-264.
[11]乔莉,马元,张劲松. 急性呼吸窘迫综合征:柏林标准[J]. 中华急诊医学杂志, 2012, 21(9):952-957.
[12]俞森洋. 对急性呼吸窘迫综合征诊断新标准(柏林定义)的解读和探讨[J]. 中国呼吸与危重监护杂志, 2013, 12(1):1-4.
[13]喻文亮. 急性呼吸窘迫综合征柏林标准解读[J]. 中国小儿急救医学, 2014, 21(8):473-477.
[14]袁伟锋,李理,徐虹,等. 肿瘤坏死因子受体-抗体融合蛋白对小鼠肺组织氧化损伤的保护作用[J]. 中华结核和呼吸杂志, 2012, 35(6):435-439.
[15]Risso K, Kumar G, Ticchioni M, et al. Early infectious acute respiratory distress syndrome is characterized by activation and proliferation of alveolar T-cells[J]. Eur J Clin Microbiol Infect Dis, 2015, 34(6):1111-1118.
[16]Milberg JA, Davis DR, Steinberg KP, et al. Improved survival of patients with acute respiratory distress syndrome (ARDS): 1983-1993[J]. Jama, 1995, 273(4):306-309.
[17]Chen R, Iwai M, Wu L, et al. Important role of nitric oxide in the effect of angiotensin-converting enzyme inhibitor imidapril on vascular injury[J]. Hypertension, 2003, 42(4):542-547.
[18]柴婵娟,杨志明,康玉明,等. NF-κB信号通路介导AngⅡ诱导THP-1巨噬细胞表达MMP-9[J]. 中国病理生理杂志, 2009, 25(12):2334-2337.
[19]孟莹,李旭,蔡绍曦,等. 血管紧张素Ⅱ对肺泡巨噬细胞NF-κB信号通路的影响[J]. 中华急诊医学杂志, 2009, 18(5):471-474.
(责任编辑: 陈妙玲, 罗森)
Effects of imidapril on blood gas, oxidative stress and inflammatory factors in rats with acute lung injury induced by ammonium chlorideHUANG Cong-fu, HAO Xue-qin, DENG Wen, LIU Chuan-fa, WANG Ting-ting, WEN Xiao-li, TAO Zhong-rong
(DepartmentofPharmacy,CollegeofAnimalScienceandTechnology,HenanUniversityofScienceandTechnology,Luo-yang471003,China.E-mail:haohaoxq@139.com)
[ABSTRACT]AIM: In this study, the rat lung injury model was induced by ammonium chloride for studying the effect of imidapril on blood gas, serum TNF-α, IL-6 and MDA concentrations, and AngⅡ and CD54 protein expression in rat lung tissue. METHODS: Male rats were randomly divided into 3 groups: control group, lung injury model group and drug group. The rats in control group were given saline (2 mL/kg), while the rats in lung injury model group were given 6% ammonium chloride (2 mL/kg). In drug group, imidapril (3 mg·kg-1·d-1) was given to the rats once daily for 1 week by intragastric gavage after given 6% ammonium chloride. On the 7th day, the rats were anesthetized with 2% so-dium pentobarbital. Abdominal aorta blood, venous blood and lung tissue were collected. The blood gas indexes and serum TNF-α, IL-6 and MDA concentrations were determined. The lung tissues were fixed and sliced, and the expression of AngⅡ and CD54 proteins was detected by immunohistochemistry. RESULTS: The PaCO2increased in lung injury model group compared with control group and drug group (P<0.05).The expression of AngⅡ and CD54, and the concentrations of TNF-α, IL-6 and MDA also increased significantly (P<0.01) in model group. Pulmonary edema, inflammation, alveolus congestion, hemorrhage and hyperplasia in model group were obvious compared with control group and drug group. CONCLUSION: Imidapril improves blood gas indexes, and reduces lipid peroxidation and inflammatory responses in the rats with lung injury induced by ammonium chloride.
[KEY WORDS]Imidapril; Acute lung injury; Ammonium chloride
doi:10.3969/j.issn.1000- 4718.2016.02.015
[中图分类号]R363
[文献标志码]A
通讯作者△Tel: 0379-64280319; E-mail: haohaoxq@139.com
[收稿日期]2015- 08- 06[修回日期] 2015- 10- 09
[文章编号]1000- 4718(2016)02- 0278- 06
