MicroRNA-132通过调控胆碱能通路减轻肺泡巨噬细胞炎症反应*
2016-03-05李东海曾振国彭菲菲钱克俭
刘 芬, 李 勇, 赵 宁, 李东海, 江 榕, 曾振国, 邵 强, 彭菲菲, 王 燕, 钱克俭△
(南昌大学第一附属医院1重症医学科,2肿瘤科,3神经外科,江西 南昌 330006)
MicroRNA-132通过调控胆碱能通路减轻肺泡巨噬细胞炎症反应*
刘芬1,李勇2,赵宁1,李东海3,江榕1,曾振国1,邵强1,彭菲菲1,王燕1,钱克俭1△
(南昌大学第一附属医院1重症医学科,2肿瘤科,3神经外科,江西 南昌 330006)
[摘要]目的: 探讨microRNA-132(miR-132)通过调控胆碱能通路减轻肺泡巨噬细胞炎症反应的作用机制。方法: 向大鼠肺泡巨噬细胞NR8383中转染miR-132 mimic、mimic阴性对照(NC)、miR-132 inhibitor或inhibitor NC,转染后用脂多糖(LPS)和(或)乙酰胆碱(ACh)处理细胞;采用real-time PCR检测乙酰胆碱酯酶(AChE)的mRNA表达;采用Western blot检测细胞中AChE、信号转导及转录激活因子3(STAT3)和磷酸化STAT3(p-STAT3),以及细胞浆和细胞核中核因子κB(NF-κB)蛋白的改变;采用AChE活性测试盒检测细胞上清液中AChE活性的改变;采用免疫荧光检测NF-κB的核移位变化。结果: 上调或下调miR-132不影响AChE的mRNA相对表达水平;上调miR-132可使AChE蛋白及活性的水平均显著降低(P<0.05),下调miR-132可使AChE蛋白及活性的水平均显著升高(P<0.05)。当给予LPS+ACh作用时,miR-132 mimic组对NF-κB p65核移位的抑制作用较mimic NC组更强(P<0.05),miR-132 inhibitor组较inhibitor NC组更弱(P<0.05);miR-132 mimic组对STAT3及p-STAT3蛋白的抑制作用较mimic NC组更强(P<0.05)。结论: miR-132通过调控胆碱能通路减轻肺泡巨噬细胞炎症反应的作用机制可能是miR-132靶向作用AChE,抑制AChE对ACh的水解作用,从而增强ACh的抗炎作用,抑制NF-κB及STAT3的活化。
[关键词]MicroRNA-132; 乙酰胆碱酯酶; 乙酰胆碱
MicroRNAs(miRNA)是一类内源性非编码小RNAs,可以通过与靶基因mRNA特定位点结合而影响该mRNA的稳定性或抑制蛋白的翻译,参与转录后水平的调控[1]。近年来研究显示microRNAs在调控炎症反应中起着重要的作用,其中microRNA-132(miR-132)参与调控病毒感染免疫反应以及免疫刺激物如脂多糖(lipopolysaccharide,LPS)诱导的免疫细胞炎症反应[2-3]。我们的前期研究[4]发现在LPS诱导的大鼠肺泡巨噬细胞中,miR-132的表达随着LPS刺激时间延长而逐步升高;在体外培养环境,单独给予LPS刺激时上调或下调miR-132不影响肺泡巨噬细胞炎症因子的释放,但当加入胆碱能抗炎通路的重要递质乙酰胆碱(acetylcholine,ACh)后, miR-132可增强ACh对LPS诱导的肺泡巨噬细胞炎症反应的抗炎作用。因此我们推测miR-132通过调控胆碱能通路减轻肺泡巨噬细胞炎症反应,但其中具体的分子作用机制尚不十分明确。本研究通过向肺泡巨噬细胞转染miR-132 mimic及miR-132 inhibitor,观察miR-132靶基因乙酰胆碱酯酶(acetylcholinesterase,AChE)的表达及活性的改变,并在转染肺泡巨噬细胞后给予LPS刺激或LPS+ACh作用,观察ACh作用下游的2条主要信号通路即核因子κB(nuclear factor-κB,NF-κB)和信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)的改变,以探讨miR-132通过调控胆碱能通路减轻肺泡巨噬细胞炎症反应的作用机制。
材料和方法
1主要材料
大鼠肺泡巨噬细胞NR8383购自中国科学院细胞库;Ham’s F-12K培养基购自Sigma;胎牛血清购自Gibco;miR-132 mimic、miR-132 inhibitor、mimic阴性对照(negative control,NC)和inhibitor NC购自Invitrogen;PowerFectTMsiRNA转染试剂购自SignaGen;LPS和ACh购自Sigma;PrimeScript® 逆转录试剂盒和SYBR实时荧光定量试剂盒购自TaKaRa;RIPA裂解液购自上海碧云天;核抽提试剂盒购自Active Motif;山羊抗AChE多克隆抗体购自Abcam;兔抗NF-κB p65多克隆抗体和山羊抗核纤层蛋白B(lamin B)多克隆抗体购自Santa Cruz;STAT3小鼠单克隆抗体和兔抗磷酸化STAT3(p-STAT3)多克隆抗体购自CST;β-actin小鼠单克隆抗体购自Anbo;辣根过氧化物酶标记兔抗山羊IgG、山羊抗兔IgG和山羊抗小鼠IgG购自北京中衫金桥;Alexa Fluor® 488标记驴抗兔IgG购自Life Technologies;4’, 6-二脒基-2-苯基吲哚(4’, 6-diamidino-2-phenylindole,DAPI)购自Roche;AChE活性测试盒购自南京建成。
2主要方法
2.1细胞培养大鼠肺泡巨噬细胞NR8383使用含15%胎牛血清的Ham’s F-12K培养基,置于37 ℃、5% CO2的培养箱中培养,根据细胞生长情况,2~3 d换液 1 次。
2.2细胞转染取对数生长期NR8383细胞在转染前24 h接种至6孔板。向细胞中转染miR-132 mi-mic、mimic NC、miR-132 inhibitor或inhibitor NC,转染步骤按照PowerFectTMsiRNA转染试剂说明书进行。
2.3实验分组将转染了miR-132 mimic、mimic NC、miR-132 inhibitor或inhibitor NC的NR8383细胞用LPS和(或)ACh处理。细胞转染24 h后,给予LPS刺激的浓度为1 mg/L,ACh在LPS刺激前5 min加入,浓度为10 μmol/L。刺激12 h后收集各组细胞沉淀及细胞上清液,用于后续检测。
2.4Real-time RCR转染后24 h收集各组细胞,采用TRIzol法提取细胞的总RNA,通过分光光度计及琼脂糖凝胶电泳检测所提总RNA的浓度及完整性。参照PrimeScript® 逆转录试剂盒说明书,采用10 μL反应体系,将RNA用逆转录反应合成cDNA。将获得的cDNA使用SYBR实时荧光定量试剂盒进行扩增反应,采用20 μL反应体系,AChE 的上游引物为5’-AAA CAT GCA GAA GAT GAG GAT-3’,下游引物为5’-GAC CAC TAT AGC AAG CAG GAA C-3’;β-actin的正向引物为5’-TAC TGC CCT GGC TCC TAG CA-3’,逆向引物为5’-TGG ACA GTG AGG CCA GGA TAG-3’。选取β-actin作为内参照,采用2-ΔΔCt方法计算各组AChE的mRNA相对表达量。
2.5Western blot实验离心收集各组细胞,采用RIPA裂解液提取细胞总蛋白,用于检测AChE、STAT3、p-STAT3蛋白及内参照β-actin蛋白;采用核抽提试剂盒提取细胞浆蛋白和细胞核蛋白,用于检测NF-κB p65蛋白及内参照β-actin、lamin B蛋白。通过BCA法测定蛋白浓度,10% SDS-PAGE垂直凝胶电泳分离蛋白,后电转移至硝酸纤维素膜上,经5%脱脂奶粉封闭1 h,孵育相应 I 抗过夜 [AChE(1∶200),NF-κB p65(1∶500),STAT3(1∶500),p-STAT3(1∶500),β-actin(1∶3 000),lamin B(1∶100)]。孵育相应辣根过氧化物酶标记的 II 抗后,经化学发光法显影,曝光,分析各条带灰度值。
2.6AChE活性的检测转染后24 h收集各组细胞上清液,参照AChE活性测试盒检测各组细胞上清液中AChE的活性变化,于酶标仪412 nm处测定吸光度。
2.7免疫荧光观察将肺泡巨噬细胞接种至细胞爬片,根据分组给予相应处理。4%多聚甲醛固定20 min后PBS漂洗,0.2% Triton X-100透膜处理5 min,PBS漂洗后置入含5%牛血清蛋白的PBS中封闭1 h,NF-κB p65的 I 抗(1∶50)4 ℃孵育过夜,PBS漂洗后Alexa Flour 488标记的 II 抗室温避光孵育1 h,PBS漂洗,加入细胞核染色液DAPI染核2 min,PBS漂洗后滴加防荧光淬灭剂封片,通过荧光显微镜观察,采用Image-Pro Plus软件进行分析,高倍镜视野(×400)计数总细胞和NF-κB p65核染色阳性细胞。
3统计学处理
用SPSS 17.0统计软件进行数据分析。数据以均数±标准差(mean±SD)表示,组间均数比较采用独立样本t检验或单因素方差分析。以P<0.05为差异有统计学意义。
结果
1调控miR-132对肺泡巨噬细胞AChE表达及活性的影响
在肺泡巨噬细胞中分别转染miR-132 mimic及miR-132 inhibitor 24 h后,检测细胞中AChE mRNA、蛋白水平及细胞上清液中AChE活性的改变,结果发现上调或下调miR-132不影响AChE的mRNA相对表达水平;而miR-132 mimic组与mimic NC组相比,AChE蛋白及活性水平均显著降低(P<0.05);反之,miR-132 inhibitor组与inhibitor NC组相比,AChE蛋白及活性水平均显著升高(P<0.05),见图1。
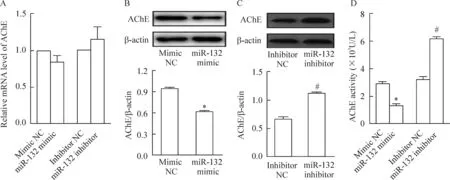
Figure 1.The effect of miR-132 on the expression and activity of AChE in alveolar macrophages. Mean±SD.n=3.*P<0.05vsmimic NC group;#P<0.05vsinhibitor NC group.
图1调控miR-132对肺泡巨噬细胞AChE表达及活性的影响
2调控miR-132联合ACh对肺泡巨噬细胞NF-κB核移位的影响
在肺泡巨噬细胞中分别转染miR-132 mimic及miR-132 inhibitor 24 h后,给予LPS(1 mg/L)刺激或LPS+ACh(10 μmol/L)作用12 h,通过免疫荧光和Western blot检测肺泡巨噬细胞中NF-κB p65的核移位情况及细胞核内外NF-κB p65蛋白的改变,结果显示在肺泡巨噬细胞未给予LPS刺激时,NF-κB p65主要分布在细胞胞浆中;当给予LPS刺激时,miR-132 mimic组和mimic NC组的NF-κB p65均从胞浆向细胞核移位,但两组之间差异无统计学显著性;而当给予LPS+ACh作用时,miR-132 mimic组和mimic NC组的NF-κB p65的核移位均受抑制,但miR-132 mimic组对NF-κB p65核移位的抑制作用较mimic NC组更强(P<0.05)。miR-132 inhibitor组与inhibitor NC组相比,NF-κB p65核移位的情况在给予LPS刺激时两组之间差异无统计学显著性,但在给予LPS+ACh作用时,miR-132 inhibitor组对NF-κB p65核移位的抑制作用较inhibitor NC组更弱(P<0.05),见图2。
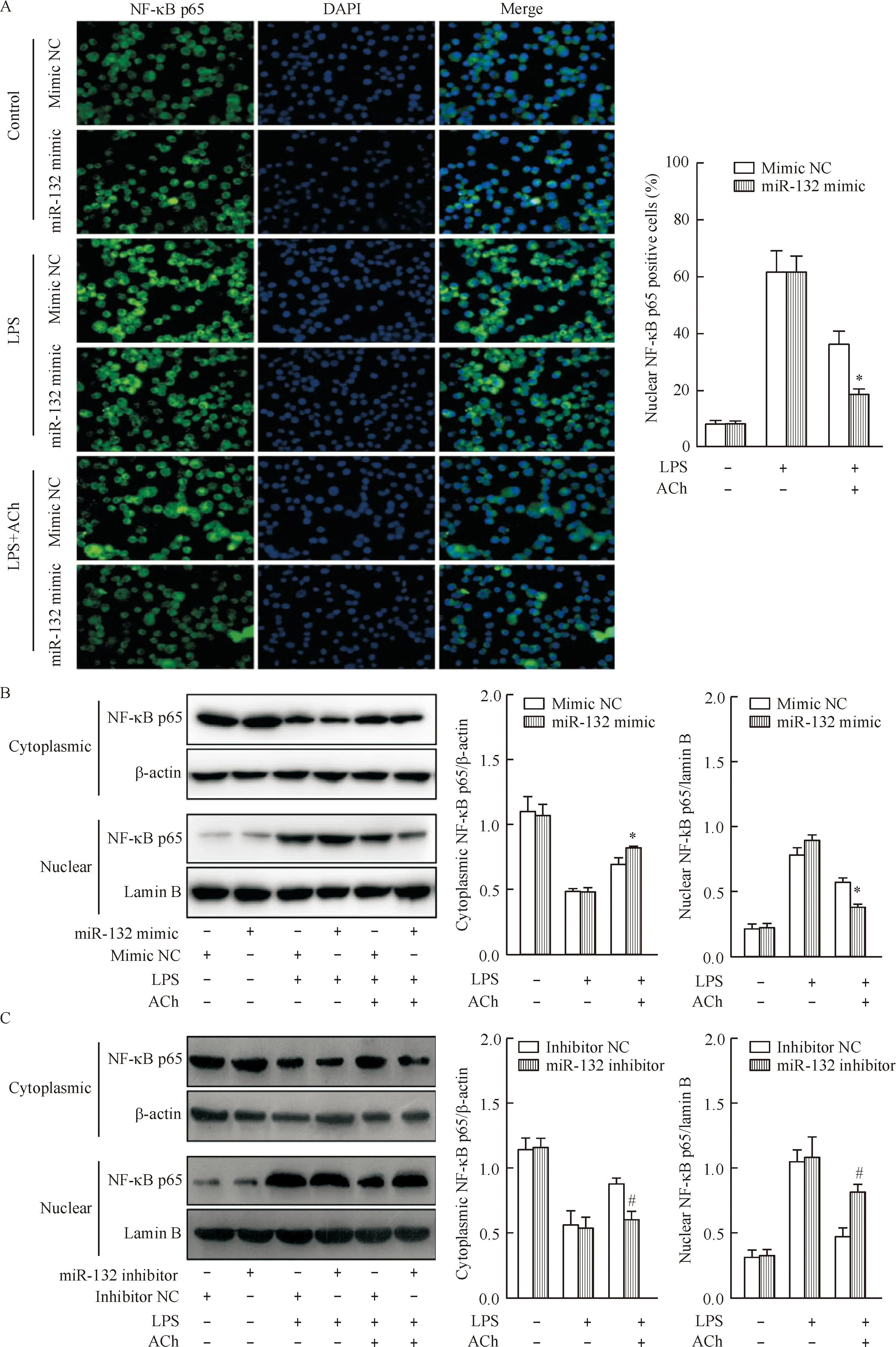
Figure 2.The regulatory effect of miR-132 combined with ACh on NF-κB nuclear translocation in the alveolar macrophages. A: immunofluorescence detection of NF-κB p65 (green) nuclear translocation (×400). The cell nuclei were stained by DAPI (blue). NF-κB nuclear translocation was expressed as the percentage of nuclear NF-κB p65 positive relative to total cells. B, C: detection of nuclear and cytoplasmic NF-κB p65 levels by Western blot. Mean±SD.n=3.*P<0.05vsmimic NC group;#P<0.05vsinhibitor NC group.
图2调控miR-132联合ACh对肺泡巨噬细胞NF-κB核移位的影响
3调控miR-132联合ACh对肺泡巨噬细胞STAT3活化的影响
在肺泡巨噬细胞中转染miR-132 mimic 24 h后,给予LPS(1 mg/L)刺激或LPS+ACh(10 μmol/L)作用12 h,检测细胞中STAT3蛋白及其磷酸化水平的变化,结果显示在给予LPS刺激后,肺泡巨噬细胞中STAT3蛋白及p-STAT3的蛋白含量均增加,但miR-132 mimic组和mimic NC组之间差异均无统计学显著性;ACh的加入可抑制LPS诱导的STAT3及p-STAT3蛋白的增加,其中miR-132 mimic组对STAT3及p-STAT3蛋白的抑制作用较mimic NC组更强,见图3。

Figure 3.The regulatory effect of miR-132 combined with ACh on STAT3 activation in the alveolar macrophages. Mean±SD.n=3. NC: negative control.*P<0.05vsmimic NC group.
图3调控miR-132联合ACh对肺泡巨噬细胞STAT3活化的影响
讨论
脓毒症时细菌毒素如LPS释放入血引发肺部炎症级联放大,导致脓毒症肺损伤,肺泡巨噬细胞作为主要的肺内炎症始动细胞在脓毒症肺损伤中起着重要的作用[5]。文献报道及我们的前期研究表明microRNAs参与调控肺泡巨噬细胞的炎症反应[6-7],miR-132是其中之一,但其调控肺泡巨噬细胞炎症反应的具体机制尚不十分清楚。MicroRNA主要的作用机制是通过与靶基因mRNA的3’非翻译区域(untranslated region,UTR)的特异序列结合,在转录后水平调控靶基因的表达。 Shaked等[8]通过研究证实miR-132可靶向作用AChE mRNA的3’UTR,增强大脑通过胆碱能通路调控全身炎症反应的能力,另有研究表明miR-132通过靶向作用AChE参与改善人类炎症性肠病的炎症反应[9],以及参与介导压力应激诱导的小鼠认知障碍[10]。本研究也发现在肺泡巨噬细胞中调控miR-132不影响AChE mRNA的相对表达水平,但上调miR-132可降低AChE蛋白及活性的水平,下调miR-132可增加AChE蛋白及活性水平,提示miR-132在肺泡巨噬细胞中可靶向作用AChE,从转录后水平调控AChE的表达。
AChE是一种特异性催化水解神经递质ACh的酶,近年研究发现迷走神经释放的ACh可与巨噬细胞上的α7烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7nAChR)相互作用,通过细胞内NF-κB及Janus激酶2(Janus kinase 2, JAK2)/STAT3信号通路,减少肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等促炎因子的释放,形成一条胆碱能抗炎通路调控机体的炎症反应[11-12]。鉴于ACh由迷走神经分泌,在体外细胞培养环境中缺乏,因此我们在肺泡巨噬细胞中加入外源性ACh,以便研究miR-132调控胆碱能通路的机制。本研究的结果发现在肺泡巨噬细胞中上调miR-132并加入ACh后,可抑制LPS诱导的NF-κB p65的核移位,以及抑制STAT3及p-STAT3蛋白的增加,并且其抑制作用强于ACh的作用。目前的研究认为NF-κB及JAK2/STAT3这2条信号通路是ACh最主要的抗炎机制,其中NF-κB通路的激活对TNF-α等促炎因子的产生具有重要的作用,研究表明[13]胆碱受体激动剂尼古丁可通过激活α7nAChR后抑制NF-κB的活化,从而抑制巨噬细胞促炎因子的分泌,与本研究结果相符。而对JAK2/STAT3信号通路目前的研究存在争议,有报道[14]认为LPS刺激RAW264.7细胞后通过激活STAT3的磷酸化而诱导白细胞介素 1β(interleukin-1β,IL-1β)和白细胞介素6(interleukin-6,IL-6)的生成,而加入尼古丁后通过抑制STAT3蛋白及p-STAT3的水平,从而抑制炎症因子的产生,与我们的研究结果一致。另外也有研究[15]发现在LPS刺激的腹腔巨噬细胞中尼古丁呈剂量依赖的方式增加STAT3的磷酸化及细胞因子信号传导抑制蛋白3(suppressor of cytokine signaling 3,SOCS3)的表达,与我们的结果相反,原因可能与多种炎症因子之间相互作用激活有关。
综上所述,miR-132调控胆碱能通路减轻肺泡巨噬细胞炎症反应的作用机制,与miR-132通过靶向作用AChE,抑制AChE对ACh的水解作用,从而增强ACh的抗炎作用,抑制NF-κB及STAT3的活化有关。
[参考文献]
[1]Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2):281-297.
[2]Lagos D, Pollara G, Henderson S, et al. miR-132 regulates antiviral innate immunity through suppression of the p300 transcriptional co-activator[J]. Nat Cell Biol, 2010, 12(5):513-519.
[3]蓝琳友,洪溪屏,蔡元晖. MicroRNA-132转染对脂多糖诱导的肺泡巨噬细胞炎症反应的作用[J]. 中国病理生理杂志, 2014, 30(12):2190-2194.
[4]刘芬,江榕,李勇,等. 微小RNA-132在脂多糖诱导大鼠肺泡巨噬细胞炎症反应中的表达变化[J]. 中华危重病急救医学, 2014, 26(2):80-83.
[5]Guirgis FW, Khadpe JD, Kuntz GM, et al. Persistent organ dysfunction after severe sepsis: a systematic review[J]. J Crit Care, 2014, 29(3):320-326.
[6]Zeng Z, Gong H, Li Y, et al. Upregulation of miR-146a contributes to the suppression of inflammatory responses in LPS-induced acute lung injury[J]. Exp Lung Res, 2013, 39(7):275-282.
[7]张建国,陈晓娟,丁成志,等. MicroRNA-146a调控肺泡巨噬细胞炎症反应的机制[J]. 中华急诊医学杂志, 2015, 24(4):413-415.
[8]Shaked I, Meerson A, Wolf Y, et al. MicroRNA-132 potentiates cholinergic anti-inflammatory signaling by targeting acetylcholinesterase[J]. Immunity, 2009, 31(6):965-973.
[9]Maharshak N, Shenhar-Tsarfaty S, Aroyo N, et al. MicroRNA-132 modulates cholinergic signaling and inflammation in human inflammatory bowel disease[J]. Inflamm Bowel Dis, 2013, 19(7):1346-1353.
[10]Shaltiel G, Hanan M, Wolf Y, et al. Hippocampal microRNA-132 mediates stress-inducible cognitive deficits through its acetylcholinesterase target[J]. Brain Struct Funct, 2013, 218(1):59-72.
[11]Borovikova LV, Ivanova S, Zhang M, et al. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin[J]. Nature, 2000, 405(6785):458-462.
[12]Su X, Matthay MA, Malik AB. Requisite role of the cholinergic α7 nicotinic acetylcholine receptor pathway in suppressing Gram-negative sepsis-induced acute lung inflammatory injury[J]. J Immunol, 2010, 184(1):401-410.
[13]Yoshikawa H, Kurokawa M, Ozaki N, et al. Nicotine inhibits the production of proinflammatory mediators in human monocytes by suppression of I-κB phosphorylation and nuclear factor-κB transcriptional activity through nicotinic acetylcholine receptor α7[J]. Clin Exp Immunol, 2006, 146(1):116-123.
[14]Sun Y, Li Q, Gui H, et al. MicroRNA-124 mediates the cholinergic anti-inflammatory action through inhibiting the production of pro-inflammatory cytokines[J]. Cell Res, 2013, 23(11):1270-1283.
[15]de Jonge WJ, van der Zanden EP, The FO, et al. Stimulation of the vagus nerve attenuates macrophage activation by activating the Jak2-STAT3 signaling pathway[J]. Nat Immunol, 2005, 6(8):844-851.
(责任编辑: 陈妙玲, 罗森)
MicroRNA-132 inhibits inflammation of alveolar macrophages by regulating cholinergic anti-inflammatory pathwayLIU Fen1, LI Yong2, ZHAO Ning1, LI Dong-hai3, JIANG Rong1, ZENG Zhen-guo1, SHAO Qiang1, PENG Fei-fei1, WANG Yan1, QIAN Ke-jian1
(1DepartmentofCriticalCareMedicine,2DepartmentofOncology,3DepartmentofNeurosurgery,TheFirstAffiliatedHospitalofNanchangUniversity,Nanchang330006,China.E-mail:qiankejianicu@163.com)
[ABSTRACT]AIM: To investigate the role of microRNA-132 (miR-132) on alveolar macrophage inflammation. METHODS: Rat alveolar macrophage cell line NR8383 was transfected with miR-132 mimic, mimic negative control (NC), miR-132 inhibitor, or inhibitor NC. The cells were divided into transfection group, transfection + lipopolysaccharide (LPS) group, and transfection + LPS + acetylcholine (ACh) group. The mRNA expression of acetylcholinesterase (AChE) was detected by real-time PCR. The protein levels of AChE, signal transducer and activator of transcription 3 (STAT3) and phosphorylated STAT3 (p-STAT3) in the cells, and nuclear factor-κB (NF-κB) in the cytoplasm and nucleus were analyzed by Western blot. The activity of AChE in the culture supernatant was measured by AChE activity assay kit. The nuclear translocation of NF-κB was detected by immunofluorescence assay. RESULTS: Up-regulation or down-regulation of miR-132 had no effect on the mRNA expression of AChE. However, up-regulation of miR-132 decreased the protein level of AChE compared with mimic NC group (P<0.05). Transfection with miR-132 inhibitor increased the protein expression of AChE compared with inhibitor NC group (P<0.05). In the alveolar macrophages treated with LPS+ACh, the inhibition of nuclear translocation of NF-κB p65 in miR-132 mimic group was more effective than that in mimic NC group (P<0.05). The inhibitory effect in miR-132 inhibitor group was weaker than that in inhibitor NC group (P<0.05). The inhibitory effect of miR-132 mimic on the protein levels of STAT3 and p-STAT3 was stronger than that of mimic NC (P<0.05). CONCLUSION: miR-132 in LPS-stimulated alveolar macrophages reinforced ACh-mediated anti-inflammatory reaction by targeting AChE to suppress ACh hydrolyzation, which was related to the suppression of NF-κB and STAT3 activation.
[KEY WORDS]MicroRNA-132; Acetylcholinesterase; Acetylcholine
doi:10.3969/j.issn.1000- 4718.2016.02.012
[中图分类号]R392.12
[文献标志码]A
通讯作者△Tel: 0791-88692533; E-mail: qiankejianicu@163.com
*[基金项目]国家自然科学基金资助项目(No.81101410;No.81460292);江西省自然科学基金资助项目(No.20122BAB205002)
[收稿日期]2015- 08- 10[修回日期] 2015- 12- 04
[文章编号]1000- 4718(2016)02- 0261- 06
