芝麻叶腺毛显微结构及干旱条件下腺毛分泌物的变化
2016-03-03李瑞航郎丹莹郝小虎王军卫张海洋
苏 适 李瑞航 郎丹莹 张 柯 郝小虎 刘 研 王军卫张海洋 徐 虹,3,*
1西北农林科技大学生命科学学院, 陕西杨凌 712100;2西北农林科技大学农学院, 陕西杨凌 712100;3西北农林科技大学旱区作物逆境生物学国家重点实验室, 陕西杨凌 712100;4河南省农业科学院芝麻研究中心, 河南郑州 450002
芝麻叶腺毛显微结构及干旱条件下腺毛分泌物的变化
苏适1李瑞航1郎丹莹1张柯1郝小虎1刘研1王军卫2,3张海洋4徐虹1,3,*
1西北农林科技大学生命科学学院, 陕西杨凌 712100;2西北农林科技大学农学院, 陕西杨凌 712100;3西北农林科技大学旱区作物逆境生物学国家重点实验室, 陕西杨凌 712100;4河南省农业科学院芝麻研究中心, 河南郑州 450002
摘要:通过扫描电镜观察芝麻苗期叶片表面腺毛的显微结构, 以二氯甲烷作为溶剂提取腺毛分泌物, 并用GC/MS鉴定正常和干旱条件下不同芝麻品种叶片腺毛次生代谢物的差异。结果显示, 苗期芝麻叶片表面存在非腺体腺毛、长柄腺毛、短柄腺毛及无柄黏液毛等多种腺毛类型, 叶表面气孔属于毛茛型; 芝麻叶腺毛分泌物包含多种组分, 其中峰面积>2%的组分是主要代谢物, 主要由酯类及直链饱和烷烃物质组成, 且品种间具有显著差异; 干旱条件下, 分泌物的组分显著改变, 抗旱性较强的冀9014有10个组分的相对含量高于其他品种, 这些组分包含三十六烷与三十四烷类物质。上述结果表明, 用GC/MS鉴定芝麻叶表面腺毛分泌物是可行的, 分泌物组分可以反映品种间的差异, 并能揭示干旱条件对芝麻代谢的影响。可以认为, 芝麻腺毛与腺毛分泌物组分在芝麻种质资源鉴定及抗旱种质选育中具有重要的应用价值。
关键词:芝麻叶片; 腺体腺毛; 腺毛分泌物; 干旱条件; GC/MS
第一作者联系方式: E-mail: ssuusshhii@126.com, Tel: 15891397093
芝麻在我国已有2000多年的种植历史, 分布广泛, 是我国四大食用油料作物之一, 种子含油量高
达61%, 也是传统的优势出口创汇作物, 具有较高的应用价值[1-2]。防渍、抗旱、保苗是保证芝麻高产、稳产和提高品质的关键措施[3-6]。近年来, 国内外已有较多关于芝麻抗旱性研究的报道[4-14]。芝麻是一种较耐旱的油料作物, 但在萌发期和苗期对干旱极为敏感。苗期干旱, 显著减缓芝麻植株的生长发育, 表现为根系发育缓慢、叶片数减少、叶面积减小、株高变矮、生物量降低[5-6]。我国芝麻各种植区域气候差异较大, 江淮流域主产区在播种出苗期、苗期和盛花期存在季节性干旱, 西北、华北、华南等地区会发生地域性干旱, 在播种出苗期可能造成大幅度减产[7]。芝麻苗期生长相关的性状指标, 如萌发率、相对成苗率、根长与芽长、根与芽的干重、相对含水量、可溶性糖、膜透性与脯氨酸含量等, 均被作为抗旱性鉴定和评价的指标[6,10,13-14]。但目前国内外还没有一个统一的芝麻抗旱性鉴定指标体系, 抗旱品种资源的鉴定工作也急需受到关注。
植物叶片表面的腺毛(glandular trichomes)具有防御和保护的功能, 并能分泌许多次生代谢物, 在生物与非生物胁迫抗性中起到积极的作用。一些植物腺毛分泌物具有极高的药用价值, 备受植物学家与植物生理学家的关注[15-20]。近年来, 研究人员已从代谢组学、基因组学、蛋白质组学等多个方面对植物腺毛进行了研究[21], 已建立起较完善的方法体系, 在阐明腺毛次生代谢途径、克隆腺毛特异表达基因、以及腺毛的生理生化功能研究方面奠定了良好的基础[22-24]。
关于芝麻叶表面腺毛研究的报道最早见于1908 年, Solereder[25]报道了芝麻叶表皮存在二细胞头部的黏液毛(mucilage hairs), 现在看来应归于无柄腺毛类。李焜章[26]、AbdulRahaman和Oladele[27]先后报道指出, 芝麻叶表面分布有长柄与短柄非腺体腺毛(nonglandular trichomes), 长柄腺体腺毛(long-capitate glandular, 包括单细胞或多细胞头部uniseriate or multiseriate), 短柄腺体腺毛(short-capitate glandular)、无柄腺毛(peltate glandular)及星状腺毛(stallate) 等, 并指出下表皮腺毛密度大于上表皮, 多细胞分泌头部的每个细胞分泌的成分不同。
本文用叶片失水率以及模拟干旱对细胞膜造成的伤害率作为抗旱性鉴定指标[28-31], 对4个芝麻品种的抗旱性初步鉴定, 观察芝麻叶片表面腺体腺毛的结构, 并利用GC/MS系统检测腺毛分泌物中的次生代谢物组分, 研究了干旱处理对芝麻叶腺毛次生代谢的影响。
1 材料与方法
1.1试验材料
主栽芝麻品种豫芝11、郑芝98N09、冀9014、中油1134, 农家品种荣县黑芝麻, 以及M-1突变株系, 种子均由河南省农业科学院芝麻研究中心张海洋研究员惠赠。
1.2芝麻材料种植与处理
优选籽粒饱满的芝麻种子, 清水漂洗后置培养皿内, 每皿约100粒, 加盖后于25℃下暗中萌发。待2~3 d后种皮破裂、胚根伸长0.5~1.0 cm时用镊子将幼芽移至装好营养土的直径7 cm营养钵中, 每钵4~5棵种子, 放在光照培养箱中培养。待长出3对真叶时间苗移栽, 每个营养钵留2棵幼苗, 继续培养至长出4对真叶、株高约12~15 cm时即可取材,用于扫描电镜观察及对抗旱性初步鉴定。干旱处理即持续10 d不浇水, 待叶子出现萎蔫时结束。
1.3芝麻抗旱性测定
用叶片失水率及干旱处理对细胞膜的伤害率作为抗旱鉴定指标[28-31], 初步鉴定豫芝11、郑芝98N09、冀9014和荣县黑芝麻4个品种的抗旱性。参考Clarke[29]、侯建华等[30]、张木清等[32]的方法测定叶片失水率。待芝麻幼苗长至4对真叶、株高约12~15 cm时, 取第3对真叶, 将叶柄插入蒸馏水饱和3 h, 剪去叶柄称重。2 min称一次, 24 h后以70℃杀青、50℃烘5~6 h至恒重、称重计算饱和含水量及失水率, 绘制失水动态曲线。
每个品种测量6株, 取平均值。
参考改进的Sullivan等[28]和高俊风[31]的方法测定膜伤害率。取第3对真叶, 将叶柄插入40%PEG溶液(水势是–1.8 MPa)渗透胁迫4 h, 用直径1 cm打孔器打叶圆片, 测定电导率。

式中, L1为叶片煮沸杀死前外渗液电导值; L2为叶片煮沸杀死后外渗液电导值。

式中, C1为正常生长条件下叶片煮沸杀死前外渗液电导值; C2为正常生长条件下叶片煮沸杀死后外渗液电导值; T1为干旱胁迫条件下叶片煮沸杀死前外渗液电导值; T2为干旱胁迫条件下叶片煮沸杀死后外渗液电导值。
1.4叶片表皮腺毛显微结构的观察
取每个芝麻品种的第2对真叶, 用酒精消毒的
单面刀片切下5个面积为5 mm2的无主脉小块, 清水漂洗后用吸水纸吸干水分, 在4%的戊二醛溶液中固定, 4℃过夜。再经过漂洗(用pH 6.8的PBS缓冲液浸洗4次, 每次10 min)、脱水(将样品分别浸于浓度梯度为30%、50%、70%、80%和90%乙醇中, 每浓度浸没时间为15~10 min, 再浸于100%乙醇中1次、100%丙酮中2次, 每次30 min)、置换(用乙醇异戊酯置换2次, 原丙酮液留一半加置换液, 每次置换20 min)等一系列样品处理过程。之后用CO2临界点干燥仪(HITACHI HCP-2)干燥样品, 将样品黏贴于导电胶置E-1045型离子溅射镀膜仪样品台,喷镀金铂合金镀层, 用日本电子JSM-6360LV型扫描电镜观察。
1.5叶片表皮腺体腺毛分泌物的提取
用控水干旱处理与正常生长的材料分别提取叶片表皮腺体腺毛分泌物, 参考改进的孔光辉[33]方法。用二氯甲烷(分析纯)作为浸提剂, 以无水硫酸钠(化学纯)去除杂质, 旋转蒸发仪浓缩样品。所有操作均在通风橱中进行。
具体步骤如下。先称取芝麻叶片7 g, 准备3只盛有200 mL二氯甲烷的烧杯, 将叶片依次在3只烧杯中浸洗, 每只烧杯浸洗4次, 每次停留2 s, 每次需等叶片表面的二氯甲烷挥发干净再浸洗下次; 用二氯甲烷润洗烧杯, 合并3只烧杯内的二氯甲烷提取液与润洗液, 并用50 g无水硫酸钠过滤; 将滤液用旋转蒸发仪在40℃下减压浓缩至2 mL, 浓缩液用一次性滤膜过滤纯化, 低温避光保存。
1.6用GC/MS检测腺毛内含物组分变化
取浓缩纯化后的提取液1 μL, 用岛津GCMSQP2010型气相色谱-质谱联用仪检测。气相色谱柱为Rxi-5 MS 30 m, 0.25 mm ID, 0.25 μm。色谱程序是,分流进样, 分流比为30∶1, 载气为氦气, 流速为1 mL min–1; 进样口温度250℃; 起始柱温60℃, 保持1 min, 按5℃ min–1速度升温至250℃保持30 min。质谱条件是, 离子源温度180℃, 接口温度260℃,溶剂切割时间3 min, 扫描范围m/z: 50~600 amu (原子质量单位), 用随机软件GCMS solution 2.0分析组分。
2 结果与分析
2.1叶片表皮腺毛显微结构
2.1.1芝麻叶表皮气孔结构表皮细胞呈不规则型, 气孔被周围3~5个表皮细胞包裹, 属毛茛型, 这是胡麻科的典型特征[26]。几个品种间差异不大, 但上下表皮的气孔差异显著, 如图版I所示。上表皮的气孔细胞陷于周围的表皮细胞内(图版I, A~D、G),而下表皮的气孔细胞突出于周围的表皮细胞(图版I, E、F、H), 且下表皮的气孔密度大于上表皮(图版I, G、H)。
2.1.2芝麻叶表皮腺毛的不同类型分别观察鉴定出非腺体腺毛、长柄腺毛、短柄腺毛和无柄腺毛等多种类型, 根据分泌细胞头部和柄部的差异又可将各种类型分成不同亚类(表1), 不同品种间的腺毛类型有显著差异, 上下表皮的腺体分布也显著不同,下表皮的腺体密度大于上表皮(图版II, A~D)。
非腺体腺毛、长柄腺毛和短柄腺毛在上下表皮都有分布, 而无柄的黏液毛仅分布在下表皮。所有品种中都有单细胞头部的长柄腺毛、二细胞头部的短柄腺毛与四细胞头部的无柄腺毛(图版II, E~H),针状非腺体腺毛仅出现在冀9014与荣县黑芝麻中(图版II, A~B、H)。M-1株系腺毛类型比较特殊, 有柱状单列毛及多细胞头部的长柄和短柄腺毛(图版III, A~B)。类型最丰富的是分泌型无柄腺毛, 可分为无包被及有包被两种类型, 根据头部分泌细胞数目又可分为不同亚类(图版II, G; 图版III, C~F)。分泌细胞分泌后, 细胞表现出萎缩特征(图版II, F; 图版III, E)。
2.2四个芝麻品种苗期的抗旱性比较
从失水动态曲线(图1)可以看出, 荣县黑芝麻的叶片失水最快、保水性最差; 其他3个品种在8 h内郑98N09的失水速率相对较低, 失水较慢; 10~24 h 冀9014的失水速率相对较低, 失水最慢, 保水力最强。可以初步确定, 保水力依次为冀9014>郑芝98N09 >豫芝11>荣县黑芝麻。
用40%PEG处理离体芝麻叶片4 h后, 用电导率法计算膜的伤害率, 结果荣县黑芝麻的15.0395%>豫芝11的5.3447%>郑芝98N09的2.3284%>冀9014 的0.0088% (原始数据见附表1), 这与失水动态曲线的结果基本吻合。结合上述两项抗旱指标的鉴定结果, 我们初步认为, 抗旱性为冀9014>郑芝98N09>豫芝11>荣县黑芝麻。
2.3叶片腺毛分泌物的代谢组学分析
如图2所示, 品种间及同一品种在干旱胁迫与正常生长条件下的质谱图均表现差异。


图1 室温下4个品种叶片的失水动态曲线Fig. 1 Water loss dynamic curve of sesame seedling leaves in room temperature

图2 正常生长条件(A)与干旱条件下(B)的芝麻叶腺毛分泌物组分总离子流图比较Fig. 2 TIC chromatogram of secretion components of sesame glandular trichomes under normal (A) and drought conditions (B)

表2 GC/MS检测芝麻腺毛分泌物的组分数Table 2 Component number in secretions of sesame glandular trichomes tested by GC/MS
分析质谱数据, 共检出154类有机物, 包括饱和烷烃类(34)、酯类(26)、苯环类(22)、醇类(14)、带有官能团的烷烃类(26)、醛酮类(14)、及其他醚类酸酐类物质(18), 具体物质名称详见附表2。每一类物质, 根据保留时间及质谱图的差异, 又可分为多个结构相近的衍生物。
可以将所有检测到的物质分为三类(表2), 即正常与干旱条件下都能检测到的组分、正常条件下存在但干旱条件下未检测到的组分及干旱条件诱导产生的新组分。在所有腺毛分泌物组分中, 峰面积大于2%的组分数较少, 但各组分含量之和占到所有组分含量的63%~78%, 是主要的次生代谢物。
2.4正常生长条件下几个品种腺毛分泌物组分比较
在正常生长条件下, 4个品种共有的组分有33个,
包括烷烃类物质和酯类物质。相对其他品种, 每个品种中都存在特有或缺失的组分, 其中荣县黑芝麻与其他品种相比差异较大。
荣县黑芝麻特有的组分有7个, 分别是(Z)-9-甲基-5-十五烯、二乙基亚硝胺、2-乙酰丁酸内酯、正癸酸酐、1,1’-双(1-甲基-1,3-丙二基)环己烷、二十七烷醇和二十五烷醇。与其他3个品种相比, 荣县黑芝麻缺失的组分有12个, 分别是邻-异丙基苯、2-乙基对二甲苯、1,2,3,4-四甲基苯、1,2,4,5-四甲基苯、1,2,3,5-四甲基苯、1-乙基-2,4,5-三甲基苯、5-甲基茚满、1-甲基-4-异丁基苯、萘、2-甲基奈、十六烷酸甲酯和十七烷基己酸酯。特别是在保留时间10~13 min范围内, 荣县黑芝麻缺失多个苯环类组分。在荣县黑芝麻中还有8个组分的相对含量比其他品种要高(图2-A), 主要是二(三甲基甲硅烷基)乙炔, 保留时间29.092; 三十四烷, 保留时间34.194和37.877;二十四烷, 保留时间47.000; 正三十烷, 保留时间41.607; 五十四烷, 保留时间54.009、55.630和59.641。
冀9014特有的组分有3个, 分别是1,2,3,4,5-五甲基苯、2-环己基十二烷与顺式-环氧乙烷辛酸-3-辛基甲酯。豫芝11与郑芝98N09的物质组成比较接近, 2个品种特有的组分都是三反油酸甘油酯与十九烷基-2-乙基丁酸酯, 并且几个保留时间在60 min以后的组分, 主要包括十七烷基己酸酯和(顺)9-十八碳烯酸-2,3-双(乙酰氧基)丙基酯的含量均显著高于冀9014与荣县黑芝麻(图2-A)。
荣县黑芝麻与其他3个品种相比有较大的组分差异, 揭示栽培种在选育后有共同的特征。而豫芝11与郑芝98N09的组分接近, 可能与生长的自然环境或种质来源相近有关。上述结果揭示出芝麻叶片腺毛的分泌物组分具有品种特异性, 利用这些特有组分可以鉴定品种或研究芝麻种质资源的多样性。
2.5干旱条件下几个品种的组分比较
与正常生长条件下相比, 干旱条件下芝麻叶片腺毛分泌物的组分发生了显著变化, 组分总数减少,干旱抑制一些组分的表达, 又诱导一些新组分的产生(表2)。4个品种共有的组分有41个, 大多是甲基苯类、直链饱和烷烃类及酯类物质。
冀9014的总离子流图与别的品种相比差异较大, 在保留时间30~60 min的10个烷烃组分峰面积显著高于其他品种(图2-B和表3), 其中第1、第7、第8组分在干旱条件下上调表达, 其余7个组分是干旱条件下诱导表达的新组分, 这些新组分主要是三十四烷与三十六烷类物质, 其中相对含量最高的是三十四烷(组分4)。
干旱条件下, 不同品种中出现了特有组分, 这些组分大多在正常条件下是没被检测到的。冀9014特有的组分有十六烷、龙涎香脂和15-Isobutyl-(13.alpha.H)-isocopalane; 荣县黑芝麻特有组分有二十三烷醇、二十五烷醇、二十六烷醇及2,3-二甲基十九烷; 豫芝11特有组分是二乙基亚硝胺、4-环己基-十二烷、环氧乙烷辛酸-3-辛基甲酯与2,2,4-三甲基-3-(3,8,12,16-四甲基-十七碳-3,7,11,15-四烯基)-环己醇; 郑芝98N09特有的组分是五甲基苯和二十八烷基乙酸酯。
从上述结果看出, 干旱条件下叶片腺毛次生代谢途径发生改变, 腺毛分泌物组分会对干旱条件做出积极响应, 不同品种间的组分变化有差异。在抗旱性相对较强的冀9014中, 干旱处理诱导碳原子数大于20的直链饱和烷烃上调表达或产生新组分, 新组分主要是三十四烷与三十六烷。
2.6峰面积大于2%的组分分析
峰面积大于2%的物质包括正常与干旱条件下共有组分, 正常生长条件下特有组分, 及干旱处理后诱导产生的组分(表4)。这些组分主要是酯类与饱和烷烃类物质, 在荣县黑芝麻中还出现了特有的烷醇类物质(十七烷醇、二十五烷醇、二十三烷醇)、双(三甲基硅烷基)乙炔及四甲基苯。
不同品种中酯类与饱和烷烃的相对含量不同,根据峰面积>2%组分中酯类/烷烃类物质相对含量的比值, 可以将4个品种分为两组(图3)。郑芝98N09与豫芝11中的酯类物质相对含量高, 而冀9014与荣县黑芝麻中烷烃类物质含量较高。干旱处理后,只有豫芝11中是酯类物质含量增加, 其余3个品种均是烷烃类物质含量增加, 特别是在冀9014中, 酯类/烷烃类物质比值最低。
在所有的酯类物质中, 含量最高的是保留时间在65 min后出现的2个9-十八碳烯酸-(2,3-双乙酰氧基)-丙基酯类物质(图2), 该组分在郑芝98N09与豫芝11中干旱处理后含量增加, 而在冀9014与荣县黑芝麻中干旱处理后含量下降, 表现出品种间的差异(表5)。9-十八碳烯酸-(2,3-双乙酰氧基)丙基酯应是油酸(即9-十八碳烯酸)的衍生物, 腺毛分泌物中该物质含量高, 可能与芝麻叶中含有油酸、亚油酸等十八碳不饱和脂肪酸有关[34]。



表5 品种间9-十八碳烯酸-(2,3-双乙酰氧基)-丙基酯2个组分的含量比较Table 5 Content comparison of two(Z)-9-octadecenoic acid 2,3-bis(acetyloxy) propyl ester components among sesame cultivars
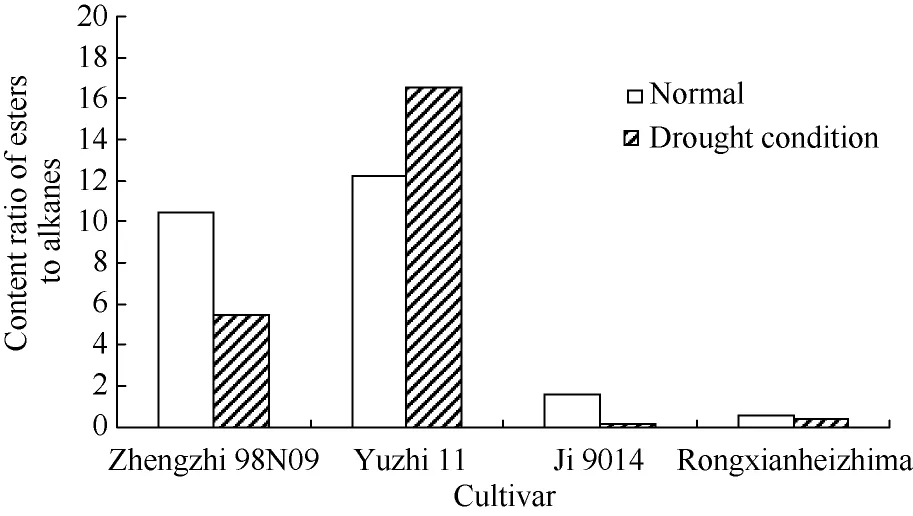
图3 峰面积大于2%的组分中酯类/烷烃类物质相对含量的比值Fig. 3 Content ratio of easters to alkanes in the components with peak area more than 2%

表6 峰面积大于2%的烷烃类物质组成比较Table 6 Comparison of alkanes components with peak area >2%
面积大于2%的烷烃类物质主要是碳原子大于30以上的偶数直链饱和烷烃(表6)。正常条件下, 郑芝98N09与豫芝11中的烷烃相对含量较高的都是三十四烷, 而在冀9014与荣县黑芝麻中烷烃相对含量较高的是五十四烷。干旱处理后, 郑芝98N09与豫芝11中的烷烃主要有两种组分, 冀9014与荣县黑芝麻中分别检测到5个烷烃组分, 相对含量最高的都是三十六烷, 三十四烷次之。上述结果揭示出品种间在烷烃代谢途径上存在差异, 对干旱条件的响应也显著不同, 可以根据烷烃组分的不同, 将这4
个芝麻品种分为两组, 郑芝98N09与豫芝11一组, 冀9014与荣县黑芝麻归为另一组。
3 讨论
对芝麻腺毛结构的研究已有一些相关报道[25-27],但关于芝麻腺毛分泌物组分的研究较少。本文观察到一些新的芝麻叶表面腺毛结构, 特别是各种无柄腺毛(即黏液毛)[25-26], 但没有发现已报道的星状腺毛[27]。无柄腺毛是胡麻科的分类特征[26], 本文所观察到的无柄腺毛II类腺毛(图版III), 是否属于芝麻腺毛的特有结构, 还有待进一步鉴定。不同类型的腺毛在上下叶表面以及品种间的分布是有差异的,这些腺毛的结构特征与分布特点可以用来区分不同的种质资源或生态类型, 有可能作为一个形态特征用于芝麻的育种及资源鉴定。
芝麻叶表面腺毛大多是腺体腺毛, 具有可分泌的头部, 对腺毛分泌物组分及其代谢途径的研究有助于以腺毛分泌物为育种目标对芝麻进行遗传修饰[15-16]。本文研究结果揭示了芝麻腺毛分泌物组分具有品种特异性, 而且会对外界环境条件的改变做出积极响应。芝麻腺毛分泌物主要组分是碳原子数大于30的偶数碳直链饱和烷烃及各种酯类物质。在酯类物质中, 9-十八碳烯酸-2,3-双乙酰氧基-丙基酯是含量最高的一类, 是所有品种共有的、在干旱处理前后都能被检测到的组分, 可以被认为是芝麻腺毛分泌物的特征物质。
此外, 本文提取腺毛分泌物的溶剂是二氯甲烷[33],而二氯甲烷也可以提取叶表面的蜡质成分[35], 那本文所鉴定出的分泌物组分中是否也包含了芝麻叶表面的蜡质组分呢?因为蜡质的化学组分主要有脂肪族饱和烷烃类化合物和环状化合物两类, 在干旱条件下, 植物表面的蜡质也会增加[36], 这些都与本文干旱诱导饱和烷烃增加的结果颇为相近。
经过对芝麻蜡质相关文献[37-38]的分析和比较表明, 本文所检测到的组分不属于蜡质。Kim等[37-38]用氯仿作为溶剂提取芝麻叶片的表面蜡质, 检测出蜡质主要由C25、C26、C27、C28、C29、C30、C31、C32、C33、C34和C35烷, 以及C30、C32和C34醛组成, 主要的组分是C27、C29、C31、C33和C35奇数碳烷烃, 干旱条件下芝麻蜡质中的烃类和醛类组分含量都增加。本文所鉴定的腺毛分泌物组分主要由烷烃与酯类物质组成, 醛类物质相对较少, 烷烃类包括C10、C12、C14、C15、C16、C17、C18、C20、C21、C22、C24、C30、C34、C36、C40、C54、 C60烷, 及个别带官能团的烷烃, 其中以C30、C34、C36、C40、C54、C60等碳原子数大于30的偶数碳饱和烷烃为主要组分。个别醛酮类组分, 如壬醛、2-叔丁基-5-甲基-(1,3)二恶烷-4-酮、正十四醛、棕榈醛、(Z)-9-十六碳烯醛等, 含量都较低。可以看出, 本文所鉴定出的芝麻叶腺毛分泌物组分与蜡质组分显著不同。
干旱处理后, 4个品种的抗旱性存在差异, 其腺毛分泌物酯类/烷烃类物质含量的比值、以及烷烃类物质的组成都发生了变化, 揭示腺毛内部的次生代谢途径发生了改变。在抗旱品种冀9014中, 烷烃组分中三十六烷的含量最高、三十四烷次之, 而且有10个烷烃组分显著高于其他品种, 也主要是三十六烷与三十四烷, 揭示烷烃类物质在芝麻腺毛分泌物中起着重要的作用, 会对外界干旱条件做出积极的响应。但是, 荣县黑芝麻腺毛分泌物烷烃组分的变化模式与冀9014相近, 它却是一个对干旱敏感的品种。分析原因发现, 荣县黑芝麻中有57个组分是正常条件下表达但在干旱条件下消失的(表2), 这些组分的峰面积总和加起来达到所有正常组分的62.96%, 是4个品种中最高的, 反映出腺毛代谢途径的变化。推测荣县黑芝麻中不仅是腺毛内部的次生代谢, 其他组织的代谢也都受到了干旱的影响, 最终表现出整体植株对外界干旱条件的敏感。
4 结论
芝麻苗期叶片表面有多种非腺体腺毛与腺体腺毛结构, 腺体腺毛的分泌物包含多种组分, 主要是酯类与直链饱和烷烃类物质, 具有品种特异性, 可用于芝麻的品种资源鉴定。干旱处理显著改变了分泌物的组分, 三十六烷与三十四烷在芝麻对水分亏缺的响应过程中起积极作用。
References
[1] 张世卿, 张水成. 芝麻素研究进展. 氨基酸和生物资源, 2005, 27(3): 17–21
Zhang S Q, Zhang S C. Development of study on sesamin. Amino Acids & Biotic Resour, 2005, 27(3): 17–21 (in Chinese with English abstract)
[2] 杨湄, 黄凤洪. 中国芝麻产业现状与存在问题、发展趋势与对策建议. 中国油脂, 2009, 34(1): 7–12
Yang M, Huang F H. Situation, problem, development trend and suggestion of sesame industry in China. China Oils Fats, 2009, 34(1): 7–12 (in Chinese with English abstract)
[3] 刘红艳, 赵应忠. 我国芝麻生产·育种现状及展望. 安徽农业科学, 2005, 33: 2475–2476
Liu H Y, Zhao Y Z. The present situation and prospect of sesame
breeding and production in China. J Anhui Agric Sci, 2005, 33: 2475–2476 (in Chinese with English abstract)
[4] 严寒, 许本波, 赵福永, 何勇, 姚晓鼎, 田志宏. 脱落酸和水杨酸对干旱胁迫下芝麻幼苗生理特性的影响. 干旱地区农业研究, 2008, 26: 163–166
Yan H, Xu B B, Zhao F Y, He Y, Yao X D, Tian Z H. Effects of abscisic acid and salicylic acid on physiological characteristics of sesame seedlings under drought stress. Agric Res Arid Areas, 2008, 26: 163–166 (in Chinese with English abstract)
[5] Hassanzadeh M, Ebadi A, Panahyan-e-Kivi M, Jamaati-e-Somarin S, Saeidi M, Gholipouri A. Investigation of water stress on yield and yield components of sesame (Seesamum indicum L.) in moghan region. Res J Environ Sci, 2009, 3: 239–244
[6] 孙建, 饶月亮, 乐美旺, 颜廷献, 颜小文, 周红英. 干旱胁迫对芝麻生长与产量性状的影响及其抗旱性综合评价. 中国油料作物学报, 2010, 32: 525–533
Sun J, Rao Y L, Le M W, Yan T X, Yan X W, Zhou H Y. Effect of drought stress on sesame growth and yield characteristics and comprehensive evaluation of drought tolerance. Chin J Oil Crop Sci, 2010, 32: 525–533 (in Chinese with English abstract)
[7] 王晓玲. 水分胁迫对芝麻花期脯氨酸含量的影响. 安徽农学通报, 2007, 13(20): 66–67
Wang X L. Effect of water stress on proline content of sesame florescence. Anhui Agric Sci Bull, 2007, 13(20): 66–67 (in Chinese with English abstract)
[8] 王林海, 张艳欣, 危文亮, 张秀荣. 中国芝麻湿害和旱害发生调查与分析. 中国农学通报, 2011, 27(28): 301–306
Wang L H, Zhang Y X, Wei W L, Zhang X R. Investment of water logging and drought effect on the sesame production in China. Chin Agric Sci Bull, 2011, 27(28): 301–306 (in Chinese with English abstract)
[9] 陈培, 汪强, 赵莉, 田东风. 水分胁迫对芝麻种子萌发特性的影响. 种子, 2012, 31(4): 83–85
Chen P, Wang Q, Zhao L, Tian D F. Effect of water stress on seed germination characteristics of sesame (Sesamum indicum L.). Seed, 2012, 31(4): 83–85 (in Chinese with English abstract)
[10] 黎冬华, 刘文萍, 张艳欣, 王林海, 危文亮, 高媛, 丁霞, 王蕾,张秀荣. 芝麻耐旱性的鉴定方法及关联分析. 作物学报, 2013, 39: 1425–1433
Li D H, Liu W P, Zhang Y X, Wang L H, Wei W L, Gao Y, Ding X, Wang L, Zhang X R. Identification method of drought tolerance and association mapping for sesame (Sesamum indicum L.). Acta Agron Sin, 2013, 39: 1425–1433 (in Chinese with English abstract)
[11] Abraham S S, Jaleel C A, Zhao C X, Somasundaram R, Azooz M M, Mantivannan P, Panneerselvam R. Regulation of growth and metabolism by paclobutrazol and ABA in Sesamum indicum L. under drought condition Global J Mol Sci, 2008, 3: 57–66
[12] Saeidi A E, Tohidi-Nejad F, Ebrahimi G, Nejad M, Shirzadi M H. Investigation of water stress on yield and some yield components of sesame genotypes (Sesamum indicum L.) in Jiroft region. J Appl Sci Res, 2012, 8: 243–246
[13] Bahrami H, Razmjoo J, Jafari A O. Effect of drought stress on germination and seedling growth of sesame (Sesamum indicum L.) cultivars. Intl J Agric-Sci, 2012, 2: 423–428
[14] Molaei P, Ebadi A, Namvar A, Bejandi T K. Water relation, solute accumulation and cell membrane injury in sesame (Sesamum indicum L.) cultivars subjected to water stress. Ann Biol Res, 2012, 3: 1833–1838
[15] Wagner G J. Secreting glandular trichomes: more than just hairs. Plant Physiol, 1991, 96: 675–679
[16] Glas J J, Schimmel B C J, Alba J M, Escobar-Bravo R, Schuurink R C, Kant M R. Plant glandular trichomes as targets for breeding or engineering of resistance to herbivores. Intl J Mol Sci, 2012, 13: 17077–17103
[17] Tissier A. Glandular trichomes: what comes after expressed sequence tags? Plant J, 2012, 70: 51–68
[18] Yadav R K, Sangwan R S, Sabir F, Srivastava A K, Sangwan N S. Effect of prolonged water stress on specialized secondary metabolites, peltate glandular trichomes, and pathway gene expression in Artemisia annua L. Plant Physiol Biochem, 2014, 74: 70–83
[19] Sallets A, Beyaert M, Boutry M, Champagne A. Comparative proteomics of short and tall glandular trichomes of Nicotiana tabacum reveals differential metabolic activities. J Proteome Res, 2014, 13: 3386–3396
[20] He J, Gao Q, Liao T, Zeng Q. An ecological implication of glandular trichome-sequestered artemisinin: as a sink of biotic/abiotic stress-triggered singlet oxygen. PeerJ PrePrints 3:e1026, 2015, https://dx.doi.org/10.7287/peerj.preprints.827v1
[21] Fridman E, Wang J H, Iijima Y, Froehlich J E, Gang D R, Ohlrogge J, Pichersky E. Metabolic, genomic, and biochemical analyses of glandular trichomes from the wild tomato species Lycopersicon hirsutum identify a key enzyme in the biosynthesis of methylketones. Plant Cell, 2005, 17: 1252–1267
[22] Croteau R. Biosynthesis and catabolism of monoterpenoids. Chem Rev, 1987, 87: 929–954
[23] McCaskill D, Gershenzon J, Croteau R. Morphology and monoterpene biosynthetic capabilities of secretory cell clusters isolated from glandular trichomes of peppermint (Mentha piperita L.). Planta, 1992, 187: 445–454
[24] Turner G W, Croteau R. Organization of monoterpene biosynthesis in mentha. Immuno cytochemical localizations of geranyl diphosphate synthase, limonene-6-hydroxylase, isopiperitenol dehydrogenase, and pulegone reductase. Plant Physiol, 2004, 136: 4215–4227
[25] Solereder H. Systematic Anatomy of Dicotyledons. Oxford: Clarendon Press, 1908. pp 611–613
[26] 李焜章. 芝麻(Sesamom indicum L.)营养器官的解剖构造: II.叶的解剖构造. 河南师范大学学报, 1987, 53(1): 89–95
Li K Z. The anatomic structure about the vegetative organ of the Sesamum indicum: II. The leaf anatomy structure. J Henan Norm Univ, 1987, 53(1): 89–95 (in Chinese with English abstract)
[27] Abdulrahaman A A, Oladele F A. Types, densities and frequencies of trichomes in some Nigerian vegetable species. Nig J Pure Appl Sci, 2004, 19: 1653–1658
[28] Sullivan C Y, Ross W M. Selecting for drought and heat resistance in grain sorghum. In: Mussell H, Staples R, eds. Stress Physiology in Crop Plants. New York: John Wiley & Sons, 1979. pp 263–281
[29] Clarke J M, Romagosa I, Jana S, Srivastava J P, McCaig T N. Relationship of excised-leaf water loss rate and yield of durum
wheat in diverse environments. Can J Plant Sci, 1989, 69: 1075–1081
[30] 侯建华, 吕凤山. 玉米苗期抗旱性鉴定研究. 华北农学报, 1995, 10(3): 89–93
Hou J H, Lü F S. A study on drought resistance identification of maize Seedlings. Acta Agric Boreali-Sin, 1995, 10(3): 89–93 (in Chinese with English abstract)
[31] 高俊凤. 植物生理学实验指导. 北京: 高等教育出版社, 2006. pp 208–209
Gao J F. Experimental Guide for Plant Physiology. Beijing: Higher Education Press, 2006. pp 208–209 (in Chinese)
[32] 张木清, 陈如凯. 作物抗旱分子生理与遗传改良. 北京: 科学出版社, 2005. pp 372–373
Zhang M Q, Chen R K. The Molecular Physiology and Genetic Improvement in Crop Drought Resistance. Beijing: Science Press, 2005. pp 372–373 (in Chinese)
[33] 孔光辉. 烤烟烟叶腺毛分泌物提取方法初探. 中国农学通报, 2006, 22(12): 62–65
Kong G H. Study on the extraction method of leaf trichome exudates in flue-cured tobacco. Chin Agric Sci Bull, 2006, 22(12): 62–65 (in Chinese with English abstract)
[34] 刘利娥, 宋少华, 刘金盾. 芝麻叶营养成分分析. 食品科技, 2012, 37(2): 45–47
Liu L E, Song S H, Liu J D. Analysis of nutritional components in sesame leaves. Food Sci Technol, 2012, 37(2): 45–47 (in Chinese with English abstract)
[35] 李婧婧, 黄俊华, 谢树成. 植物蜡质及其与环境的关系. 生态学报, 2011, 31: 565–574
Li J J, Huang J H, Xie S C. Plant wax and its response to environmental conditions: an overview. Acta Ecol Sin, 2011, 31: 565–574 (in Chinese with English abstract)
[36] 李魏强, 张正斌, 李景娟. 植物表皮蜡质与抗旱及其分子生物学. 植物生理与分子生物学学报, 2006, 32: 505–512
Li W Q, Zhang Z B, Li J J. Plant epicuticular wax and drought resistance as well as its molecular biology. J Plant Physiol Mol Biol, 2006, 32: 505–512 (in Chinese with English abstract)
[37] Kim K S, Park S H, Jenks M A. Changes in leaf cuticular waxes of sesame (Sesamum indicum L.) plants exposed to water deficit. J Plant Physiol, 2007, 164: 1134–1143
[38] Kim M S, Shim K B, Park S H, Kim K S. Changes in cuticular waxes of developing leaves in sesame (Sesamum indicum L.). J Crop Sci Biotech, 2009, 12: 161–167



图版I 芝麻叶上下表皮气孔结构Plate I Stomata microstructure of sesame leaf surface

图版II 芝麻叶表面各种常见腺毛结构Plate II Normal glandular trichomes on the surface of sesame leaves

图版III 芝麻叶表面各种特有腺毛结构Plate III Special glandular trichomes on the surface of sesame leaves
URL: http://www.cnki.net/kcms/detail/11.1809.S.20151008.1403.010.html
Microstructure of Glandular Trichomes on Leaf Surface of Sesame and Changes of Trichome Secretions under Drought Condition
SU Shi1, LI Rui-Hang1, LANG Dan-Ying1, ZHANG Ke1, HAO Xiao-Hu1, LIU Yan1, WANG Jun-Wei2,3, ZHANG Hai-Yang4, and XU Hong1,3,*
1College of Life Sciences, Northwest A&F University, Yangling 712100, China;2College of Agronomy, Northwest A&F University, Yangling 712100, China;3State Key Laboratory of Crop Stress Biology for Arid Area, Northwest A&F University, Yangling 712100, China;4Henan Sesame Research Center, Henan Academy of Agricultural Sciences, Zhengzhou 450002, China
Abstract:We investigated the microstructure of glandular trichome on sesame leaf surface by scan electron microscope and extracted the trichome secretions using dichloromethane as solvent, and the secretion components under normal and drought conditions were measured by GC/MS to compare the secondary metabolites between sesame varieties. The experiment results indicated that, there were non-glandular hairs, long stalk glandular hairs, short stalk glandular hairs and mucilage hairs on the sesame leaves surface, and the stomata belong to the buttercup type. The secretions of glandular hairs contained a variety of components, of which the main fractions with peak area more than 2% were composed of esters and straight chain saturated alkanes mainly, showing notable differences among four sesame cultivars. Under drought condition, the secreted components changed significantly. Ji 9014 with the highest drought resistance among the four cultivars, had ten components, including C36 alkanes and C34 alkanes, which were higher in Ji 9014 than in other tested cultivars. We can conclude that, the GC/MS technique is feasible to identify the glandular trichome secretions, and the secretion components are good index to reveal differences between varieties and the effects of drought condition on metabolic pathway in sesame leaves. Therefor, the glandular hairs and secretion components have important application values in sesame germplasm identification and molecular breeding for drought-resistant sesame.
Keywords:Sesame leaves; Glandular trichome; Secretions of glandular trichome; Drought condition; Gas chromatography-mass spectrometer
收稿日期Received(): 2015-04-20; Accepted(接受日期): 2015-09-06; Published online(网络出版日期): 2015-10-08.
通讯作者*(Corresponding author): 徐虹, E-mail: xuh73@163.com, Tel: 13572445613
DOI:10.3724/SP.J.1006.2016.00278
