离子液体型表面活性剂[Cmim]Br缓蚀性能研究
2016-02-29赵地顺任培兵
刘 静, 赵地顺,刘 冉,王 明,任培兵,2
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.石家庄焦化集团有限责任公司,河北石家庄 050031)
离子液体型表面活性剂[Cmim]Br缓蚀性能研究
刘静1, 赵地顺1,刘冉1,王明1,任培兵1,2
(1.河北科技大学化学与制药工程学院,河北石家庄050018;2.石家庄焦化集团有限责任公司,河北石家庄050031)
摘要:为了研究新型绿色有机代汞缓蚀剂,以N-甲基咪唑和1-溴代十二烷为原料,合成了溴化1-甲基-3-十二烷基咪唑([C12mim]Br)离子液体型表面活性剂,采用电化学方法和失重法研究了[C12mim]Br在酸性锌锰电池电解液中对锌的缓蚀及吸附作用。结果表明,缓蚀效率随着[C12mim]Br浓度的增加而增大,当[C12mim]Br浓度达到8×10-3mol/L时,缓蚀效率趋于稳定。极化曲线表明,[C12mim]Br属于混合型缓蚀剂。热力学参数表明,[C12mim]Br能自发吸附在锌表面形成单分子吸附层,吸附曲线符合Langmuir吸附等温模型,且兼有物理和化学2种吸附机制。
关键词:电化学;离子液体;表面活性剂;电化学技术;缓蚀;吸附
刘静,赵地顺,刘冉,等. 离子液体型表面活性剂[C12mim]Br缓蚀性能研究[J].河北科技大学学报,2016,37(1):70-75.
锌锰电池常用缓蚀剂汞为剧毒物质,污染环境。早在20世纪80年代,汞污染问题就已引起全世界的关注。迄今为止,人们较为系统地研究了锌锰电池代汞缓蚀,并对其缓蚀机理进行了探讨[1-6]。
离子液体具有几乎无蒸气压、溶解性良好、稳定性好等特点[7-8],应用非常广泛[9-11]。近年来,离子液体多被应用在金属防腐中[12-16]。离子液体型表面活性剂也被称为新型功能化离子液体,其活性优于传统表面活性剂,且离子液体黏度大的问题也得到了解决[17-18]。咪唑型离子液体抑制金属腐蚀的作用主要取决于其结构中—C=N—基团和电负性氮原子[19]。本文通过失重实验和电化学方法,考察了已合成的[C12mim]Br离子液体型表面活性剂在酸性锌锰电池电解液中对锌的缓蚀性能及吸附行为,为其作为代汞缓蚀剂应用于锌锰电池奠定基础。
1实验部分
1.1 主要药品
[C12mim]Br,自制;丙酮,分析纯,天津永大试剂有限公司提供;无水乙醇,分析纯,天津永大试剂有限公司提供;ZnCl2,分析纯,天津永大试剂有限公司提供;NH4Cl,分析纯,天津永大试剂有限公司提供;实验所用水为去离子水。
1.2 电解液的配制
酸性锌锰电池电解液:1.14 mol/L的ZnCl2,4.67 mol/L的NH4Cl。
1.3 电化学方法
电化学测试试样为锌电极。将锌片截成10 mm×5 mm小块若干,分别用1 000#,1 500#,3 000#的砂纸打磨,使锌片保持光亮、平整,再分别用水、丙酮冲洗,去除锌片表面的油污。将铜导线截成15 mm长小段若干。非工作面用环氧树脂密封。
电化学测试是在电化学工作站上进行的,仪器型号为上海辰华CHI660B。本实验采用的是三电极体系[20]:铂电极为辅助电极,锌电极为工作电极,每个工作电极暴露在溶液中的面积为0.5 cm2,饱和甘汞电极为参比电极。极化曲线扫描速率为0.01 V/s,扫描范围为-1.6~+0.6 V。电化学阻抗谱频率范围为0.1~105Hz,扰动信号幅值为5 mV。
1.4 失重法
锌片尺寸为20 mm×20 mm×1 mm,面积为4 cm2。用砂纸将锌片打磨至光亮,依次用蒸馏水和无水乙醇洗涤,干燥后分别浸泡在含有不同浓度离子液体的电解液(100 mL)中12 h。然后,去除表面腐蚀产物,干燥后再次称重。每组实验重复3次。通过浸泡前后锌片质量的变化,可计算出离子液体的缓蚀效率。
2结果与讨论
2.1 [C12mim]Br的合成与结构表征
根据文献[21],在250 mL的三口瓶中加入0.06 mol的N-甲基咪唑和30 mL的乙腈,在N2保护下缓慢滴加0.05 mol的1-溴代十二烷,于80 ℃下回流搅拌18 h,减压蒸除乙腈。将残留物用乙酸乙酯洗涤3次,在真空干燥箱内真空干燥24 h,得到白色蜡状固体,即为[C12mim]Br。
1H NMR (500 MHz,CDCl3):δ9.706(s,1H),7.483(s,1H),7.361(s,1H),4,211(t,2H),3.898(t,3H),1.908~1.431(m,2H),1.383~1.016(m,18H),0.894(t,3H)。上述数据与文献[21]相符,为目标产物。
2.2 动电位极化曲线
图1为298.15 K条件下,锌电极在含有不同浓度[C12mim]Br电解液中的极化曲线。由极化曲线拟合得到的电化学参数列于表1。缓蚀效率(Y)根据式(1)计算:

(1)
式中:I0,I分别为空白溶液和添加不同浓度离子液体溶液的腐蚀电流密度。

图1 锌在含有不同浓度[C12mim]Br溶液中的动电位极化曲线Fig.1 Polarization curves for the zinc electrode in electrolyte with various concentrations of [C12mim]Br
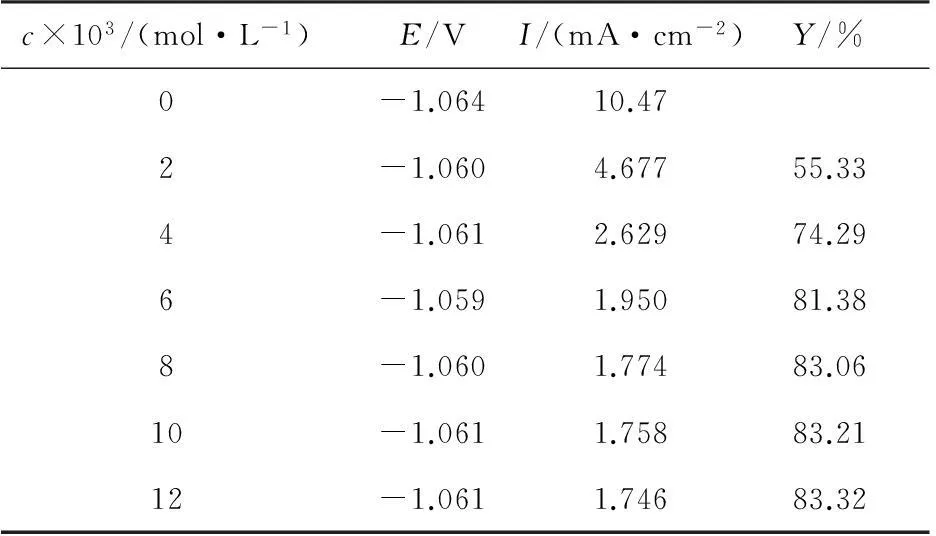
表1 锌在含有不同浓度[C12mim]Br溶液中的电化学参数Tab.1 Parameters of polarization curve of the zinc electrode in electrolyte with different concentrations of [C12mim]Br
从图1和表1可以看出,添加[C12mim]Br离子液体后,Ecorr正移,但不太明显,阴阳极腐蚀电流密度与空白样相比均减小,说明腐蚀反应的阴阳极过程都受到抑制作用,由此可认为[C12mim]Br为混合型缓蚀剂,而且缓蚀效率随着浓度的增加而增大。这是因为[C12mim]Br在锌电极表面形成吸附膜,阻止了腐蚀介质与锌电极的接触,减少锌的腐蚀。
2.3 电化学阻抗谱
图2表示了锌片浸泡在含不同浓度[C12mim]Br电解液中的电化学阻抗谱图。由图2可以看出,阻抗谱图均为近似于半圆的容抗弧,等效电路如图3所示,采用ZSimpwin软件对交流阻抗进行拟合,拟合参数列于表2。
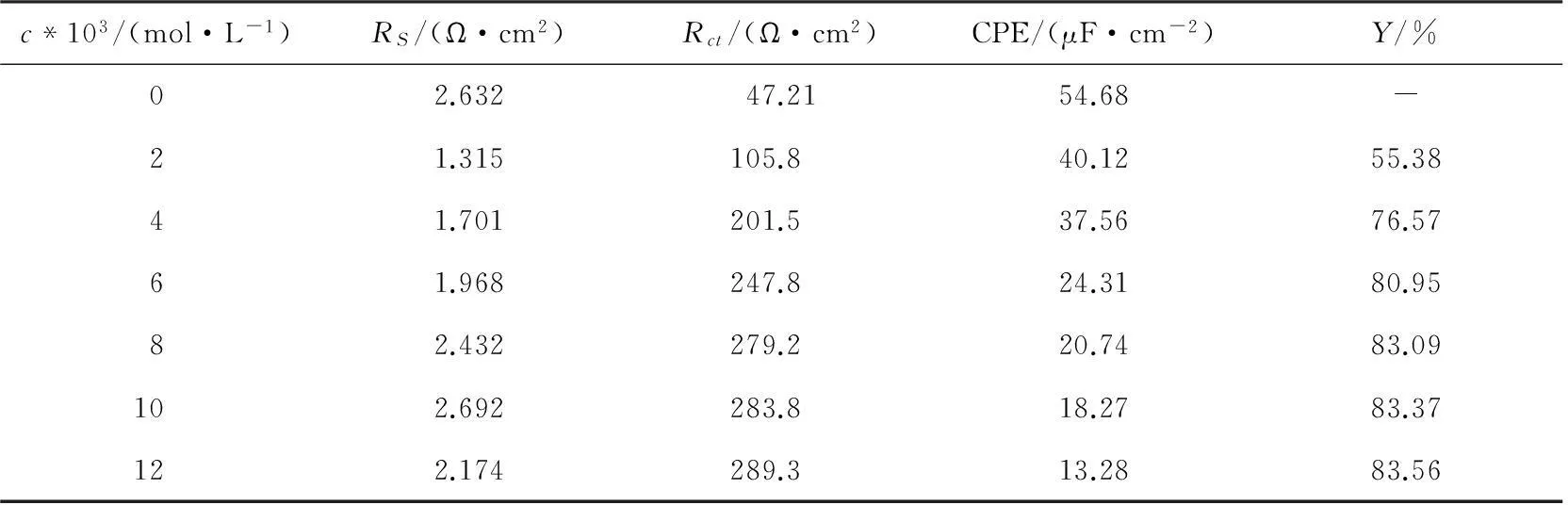
表2 锌在含不同浓度[C12mim]Br溶液中的阻抗谱参数
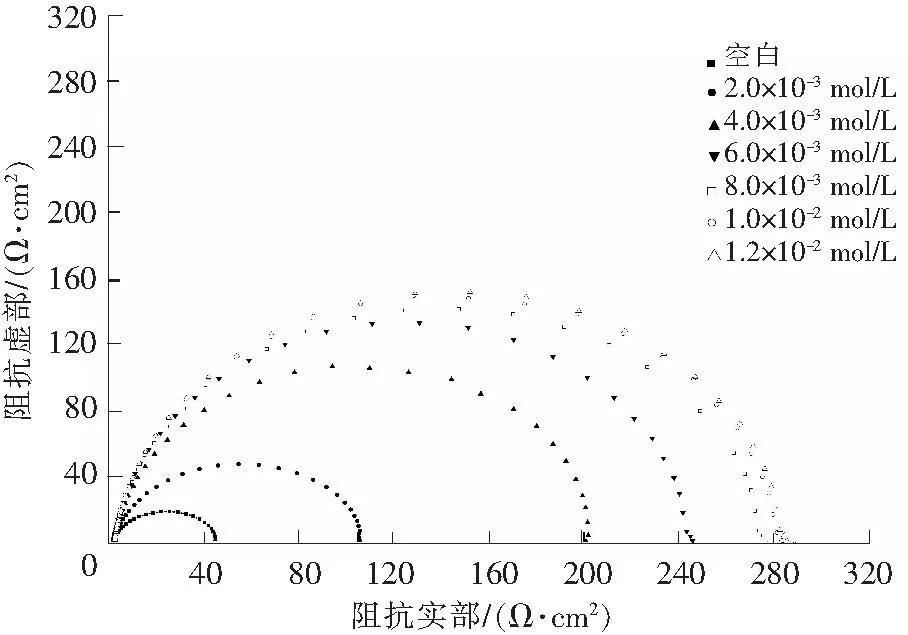
图2 锌浸泡在含有不同浓度[C12mim]Br溶液中的电化学阻抗谱图Fig.2 Impedance spectrum for the zinc electrode in electrolyte with different concentrations of [C12mim]Br
由图2和表2可以看出:加入[C12mim]Br体系的容抗弧半径与空白体系相比明显增大,表明[C12mim]Br离子液体会在锌表面形成保护膜,降低腐蚀速率;还发现随着[C12mim]Br浓度的增加,容抗弧半径逐渐增大,说明[C12mim]Br在锌表面形成的吸附层越来越紧密,抑制了锌的腐蚀。加入[C12mim]Br后,溶液电阻与空白体系相比有变小的趋势,在浓度为1×10-2mol/L时,溶液电阻较空白体系变大,但由于变化趋势不大,所以对电池体系的影响作用较小。
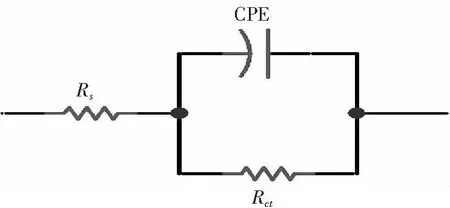
图3 锌电极在电解液中的等效电路图Fig.3 Equivalent circuit for the zinc electrode in electrolyte
缓蚀效率计算公式如下:

(2)
式中:R0,R分别为空白溶液和添加不同浓度离子液体溶液中的电荷转移电阻。
2.4 失重实验
在298.15K条件下,不同浓度的[C12mim]Br在电解液中的腐蚀速率和缓蚀效率如图4所示。锌片的腐蚀速率(v)和[C12mim]Br的缓蚀效率(Y)分别根据式(3)和式(4)计算。
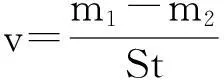
(3)

(4)
式中:m1,m2为锌片在溶液中浸泡前、后的质量,g;S为锌片的表面积,m2;t 为浸泡时间,h;vcorr,vcorr(inh)为锌片浸泡在空白溶液和添加有不同浓度离子液体溶液中的腐蚀速率,mg/(cm2·h)。
由图4可以看出,加入[C12mim]Br后,锌片的腐蚀速率逐渐变小,缓蚀效率逐渐增大,且失重实验测得的缓蚀效率变化趋势与电化学方法测得的变化趋势是一致的。当[C12mim]Br浓度为8×10-3mol/L时,缓蚀效率达到83%以上。继续增加浓度,缓蚀效率变化不大。这可能是因为[C12mim]Br在锌表面的吸附量达到饱和,继续增加浓度,吸附量基本保持不变,故缓蚀效率变化不大[22]。
2.5 缓蚀机理
缓蚀剂在金属表面的缓蚀机理主要分为电化学理论和吸附理论。离子液体型咪唑基表面活性剂的缓蚀作用主要是因为咪唑环和氮原子能够吸附在金属表面,形成定向排列的保护层,同时疏水基团也会形成疏水膜,将腐蚀介质和金属隔离,从而减缓金属的腐蚀。
根据失重实验结果,假设缓蚀剂在锌表面的吸附符合Langmuir吸附等温式:
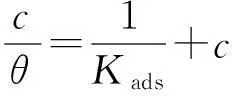
(5)
式中:c为缓蚀剂浓度;θ近似等于缓蚀剂的缓蚀效率值;Kads为吸附平衡常数。c/θ对c作图,结果如图5所示。回归系数和直线斜率都接近1,表明在298.15 K条件下,[C12mim]Br在锌表面的吸附符合Langmuir吸附模型。根据直线拟合可知截距,从而求得Kads。根据式(6)即可知缓蚀剂在锌表面吸附过程中吉布斯自由能的变化量,结果列于表3。
ΔGads=-RTln(55.5Kads)。
(6)
式中:R为气体常数;T为绝对温度。
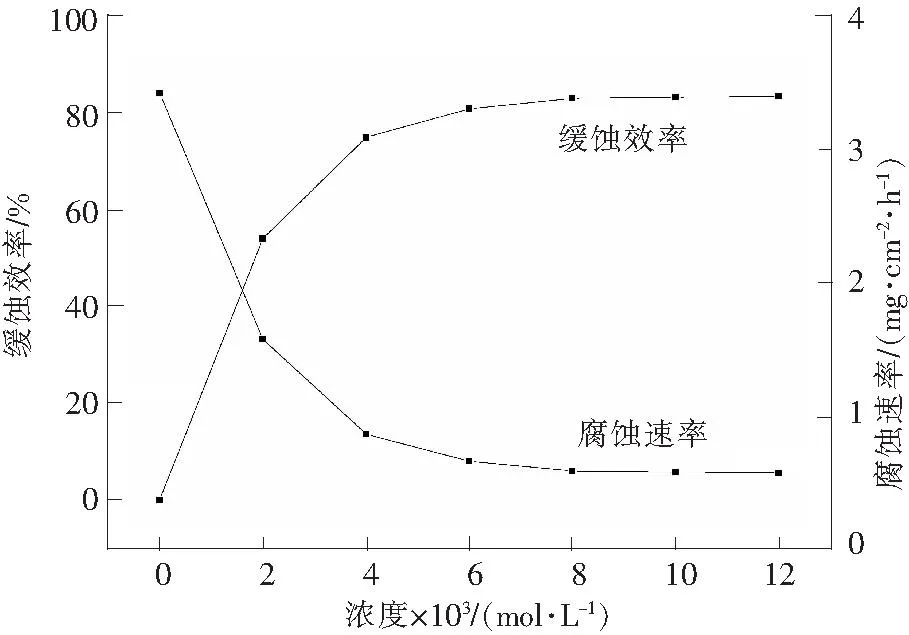
图4 不同浓度的[C12mim]Br在电解液中的腐蚀速率和缓蚀效率Fig.4 Corrosion rate and inhibition efficiency of [C12mim]Brwith various concentrations

图5 [C12mim]Br在锌表面吸附的Langmuir等温线Fig.5 Langmuir adsorption plots for zinc in electrolyte with different concentrations of [C12mim]Br

T/K斜率K/mol-1RΔGads/(kJ·mol-1)298.151.14515770.99145-28.21
由表3可以看出,ΔGads为负值,说明[C12mim]Br在锌片表面的吸附过程为自发的,同时ΔGads的计算值在-40~-20 kJ/mol之间,表明[C12mim]Br在锌表面的吸附为物理吸附和化学吸附共同作用。
3结论
1)通过电化学测试得知[C12mim]Br为混合型缓蚀剂,可同时抑制阴极和阳极的反应过程。
2)[C12mim]Br的缓蚀效率随着其浓度的升高而增大,当浓度达到8×10-3mol/L时,继续增加浓度缓蚀效率变化不明显。
3)298.15 K条件下,[C12mim]Br在锌表面的吸附符合Langmuir吸附等温式,[C12mim]Br在锌表面的吸附是一个自发过程,且兼有物理和化学2种吸附机理。
4)离子液体型表面活性剂有望成为理想的代汞缓蚀剂,但是单独使用时,缓蚀效率仅达到83%,今后可以通过将其与传统表面活性剂进行复配来提高缓蚀效率。
参考文献/References:
[1]李洪仁,马江虹.锌锰电池缓蚀剂的研究与进展[J].沈阳教育学院学报,2003,5(4):116-118.
LI Hongren, MA Jianghong. Zinc corrosion inhibitors used in alkaline zinc-manganese dioxide batteries [J].Journal of Shenyang College of Education, 2003,5(4):116-118.
[2] 赵地顺,刘会茹,徐智策,等.植酸盐缓蚀剂及其机理研究[J].高等学校化学学报,2005,26(2):334-336.
ZHAO Dishun, LIU Huiru, XU Zhice, et al. Plant acid salt inhibitor and its inhibiting mechanism [J]. Chemical Journal of Chinese Universities, 2005,26(2):334-336.
[3] 徐智策,张志艳,张雪梅,等.BiCl3类缓蚀剂及其机理研究[J].河北科技大学学报,2009,30(3):245-248.
XU Zhice, ZHANG Zhiyan, ZHANG Xuemei, et al. Study on BiCl3inhibitor and its mechanism [J]. Journal o f Hebei University of Science and Technology, 2009,30(3):245-248.
[4] ZHANG Dongshe , LI Lidong. Studies of corrosion inhibitors for zinc-manganese batteries: Quinoline quaternary ammonium phenolates[J]. Corrosion Science, 2001,43: 1627-1636.
[5] 赵地顺,刘会茹,徐智策,等.头孢唑类缓蚀剂及其机理研究[J].高等学校化学学报,2004,25(4):725-728.
ZHAO Dishun, LIU Huiru, XU Zhice, et al. Studies on cefazol in salt inhibitor and its inhibiting mechanism [J]. Chemical Journal of Chinese Universities, 2004,25(4):725-728.
[6] 王春芳,刘会茹,徐智策,等.锌锰电池中缓蚀剂的研究 [J].河北工业科技,2002,19(5):67-70.
WANG Chunfang, LIU Huiru, XU Zhice, et al. The study of inhibitiors on zine-manganese cell [J]. Hebei Journal of Industrial Science and Technology,2002,19(5):67-70.
[7] 毛微,李丹东,赵德智,等. 室温离子液体——一种新型的绿色溶剂与催化剂[J]. 石油化工高等学校学报,2003,16(3):9-14.
MAO Wei, LI Dandong, ZHAO Dezhi, et al. Room temperature ionic liquids:A kind of novel green solvents and catalysts [J]. Journal of Petrochemical Universities, 2003,16(3):9-14.
[8] 李汝雄,王建基.绿色溶剂——离子液体的制备与应用[J].化工进展,2002,21(1):43-48.
LI Ruxiong, WANG Jianji. Reseach and application on green solvent:The ionic liquid [J].Chemical Industry and Engineering Progress,2002,21(1):43-48.
[9] OHNO H. Electrochemical Aspects of Ionic Liquids [M]. New York: John W iley & Sons Inc, 2005.
[10] 孙智敏,刘宝友,赵地顺.离子液体在精细化学品合成中的应用[J].精细化工, 2008, 25(3): 212-216.
SUN Zhimin, LIU Baoyou, ZHAO Dishun. Synthesis of fine chemicals in ionic liquids [J]. Fine Chemicals, 2008, 25(3): 212-216.
[11] LI Xueli, SHI Feng, MA Xiangyuan, et al. Selective catalytic form ic acid decomposition for hydrogen generation in ionic liquids [J]. Journal of Fuel Chemistry and Technology, 2010,38(5):543-553.
[12]ZHOU Xin, YANG Huaiyu, WANG Fuhui. [Bmim]BF4ionic liquids as effective inhibitor for carbon steel in alkaline chloride solution [J]. Electrochemical Acta, 2011, 56:4268-4275.
[13]ZHANG Qibo, HUA Yixin. Corrosion inhibition of aluminum in hydrochloric acid solution by alkylimidazolium ionic liquids [J]. Materials Chemistry and Physics,2010,119:57-64.
[14]ZHANG Qibo, HUA Yixin. Corrosion inhibition of mild steel by alkylimidazolium ionic liquids in hydrochloric acid [J]. Electrochemical Acta, 2009,54:1881-1887.
[15]冷菁. 新型离子液体的缓蚀性能研究[D].南京:南京理工大学,2012.
LENG Jing. Research on Corrosion Performance of Ionic Liquids [D]. Nanjing:Nanjing University of Science and Technology, 2012.
[16]SASIKUMAR Y, ADEKUNLE A S, OLASUNKANMI L O, et al. Experimental, quantum chemical and monte carlo simulation studies on the corrosion inhibition of some alkyl imidazolium ionic liquids containing tetrafluoroborate anion on mild steel in acidic medium[J]. Journal of Molecular Liquids, 2015, 211: 105-118.
[17]齐新杰.离子液体型表面活性剂的合成及其表面性能研究[D]. 抚顺:辽宁石油化工大学,2012.
QI Xinjie. The Research on Synthesis and Surface Properties of the Ionic Liquid Surfactant [D]. Fushun:Liaoning Shihua University, 2012.
[18]杨许召,王军,李刚森,等.离子液体型表面活性剂的研究进展[J]. 日用化学工业,2009,39(5):338-343.
YANG Xuzhao, WANG Jun, LI Gangsen, et al. Progress of ionic liquid surfactants [J].China Surfactant Detergent & Cosmetics, 2009,39(5):338-343.
[19]崔美红.含炔基离子液体的合成及性质[D].济南: 济南大学,2012.
CUI Meihong. Synthesis and Properties of Alkynyl Ionic Liquids [D]. Jinan:University of Jinan, 2012.
[20]曹楚南,张鉴清.电化学阻抗谱导论[M].北京:科学出版社,2004.
[21]胡洁.咪唑基表面活性剂的合成与性能研究[D]. 无锡:江南大学,2012.
HU Jie. Synthesis and Properties of Imidazoliun-based Suefactants[D]. Wuxi: Jiangnan University,2012.
[22]刘红,诸林,李林峰,等.盐酸介质中双子表面活性剂对N80钢的吸附缓蚀性能[J].腐蚀科学与防护技术,2014,26(1):30-34.
LIU Hong, ZHU Lin, LI Linfeng, et al. Corrosion inhibition of N80 steel in HCl acid medium by gemini surfactant [J]. Corrosion Science and Protection Technology, 2014,26(1):30-34.
LIUJing,ZHAODishun,LIURan,etal.Corrosioninhibitionperformanceofaionicliquidsurfactant[C12mim]Br[J].JournalofHebeiUniversityofScienceandTechnology,2016,37(1):70-75.
Corrosion inhibition performance of a ionic liquid surfactant [C12mim]Br
LIU Jing1, ZHAO Dishun1, LIU Ran1, WANG Ming1, REN Peibing1,2
(1.School of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China;2. Shijiazhuang Coking and Chemical Group Company Limited, Shijiazhuang, Hebei 050031, China)
Abstract:In order to study the novel green organic mercury-substituting inhibitors, the ionic liquid surfactant 1-methyl-3-dodecyl imidazole bromide ([C12mim]Br) is synthesized withN-methyl imidazole and 1-bromodecane as raw materials. The corrosion inhibition of [C12mim]Br for zinc in zinc-manganese batteries is investigated using electrochemical methods and weight loss methods. The results show that corrosion inhibition efficiency increases with the increase of the concentration of [C12mim]Br, and when the concentration is higher than 8×10-3mol/L, the inhibition efficiency tends to be stable. The polarization curve shows that [C12mim]Br belongs to mixed-type corrosion inhibitor. The thermodynamic parameters show that [C12mim]Br is spontaneously adsorbed on the zinc surface, forming a monomolecular adsorption layer, which fits with Langmuir adsorption isotherm with physical and chemical adsorption mechanism.
Keywords:electrochemistry; ionic liquid; surfactant; electrochemical; corrosion inhibition; adsorption
通讯作者:赵地顺教授。E-mail:zhao_dsh@hebust.edu.cn
作者简介:刘静(1992—),女,河北保定人,硕士研究生,主要从事清洁能源方面的研究。
基金项目:国家级大学生创新创业训练计划项目(201410082002)
收稿日期:2015-07-21;修回日期:2015-09-09;责任编辑:张士莹
中图分类号:TG174.42;O622.6
文献标志码:A
doi:10.7535/hbkd.2016yx01012
文章编号:1008-1542(2016)01-0070-06
