UQCRB基因的原核表达和纯化
2016-02-29孙砚辉张广献邝枣园张晓圆
孙砚辉,张广献,邝枣园,张晓圆,张 韧
(广州中医药大学基础医学院 生化教研室,广东 广州510006)
UQCRB基因的原核表达和纯化
孙砚辉,张广献,邝枣园*,张晓圆,张韧*
(广州中医药大学基础医学院 生化教研室,广东 广州510006)
(ChinJLabDiagn,2016,20:0004)
辅酶Q-细胞色素C还原酶结合蛋白(ubiquinol-cytochrome c reductase binding protein,UQCRB)分子量为13.3-kDa,是基因定位于染色体8q22的线粒体呼吸链复合体Ⅲ的亚单位[1]。离体、在体研究显示UQCRB在血管新生中具有重要作用,UQCRB下调或缺失均会抑制血管新生(Angiogenesis)[2-5]。正常状况下血管新生有利于生长发育、伤口愈合等[6];但在病理状态下,血管新生则与很多疾病的发生相关,如肿瘤、肝纤维化等[7]。UQCRB有望成为治疗血管新生相关疾病的靶向目标[3,5]。本实验室前期研究发现一些中药单体可能通过与UQCRB的相互作用而达到治疗肝病的效果,为进一步研究UQCRB在肝病中的作用机制,我们自行设计引物后完成了UQCRB的克隆、原核表达和纯化及验证,现报道如下。
1材料与方法
1.1材料
1.1.1菌株、细胞及载体DH5α菌株、BL21(DE3)菌株、pET28a(+)菌株、人肝癌SMMC-7721细胞均由本实验室保存。
1.1.2主要试剂与仪器AxyPrep质粒DNA小量试剂盒(美国Axygen公司)、QuickCutTMNhe I限制酶(日本TaKaRa公司)、QuickCutTMXho I限制酶 (日本TaKaRa公司)、His-tag pAb(美国Bioworld)、羊抗兔IgG-HRP(武汉博士德生物工程有限公司)、pMDTM18-T Vector Cloning Kit (日本TaKaRa公司)、ACK5003NT Amicon○RPro Affinity Concentration Kit-Ni-NTA (德国Merck Millipore公司)、RNApure超纯总RNA快速提取试剂盒 (北京艾德莱生物科技有限公司)、PrimeScriptTMII 1st Strand cDNA Synthesis Kit(日本TaKaRa公司)。XO-150超声波细胞破碎仪(南京先欧仪器制造有限公司)、NanoDrop 2000超微量分光光度计(美国Thermo Scientific公司)、TGL-16高速台式冷冻离心机(长沙湘仪离心机仪器有限公司)、BioPhotometer(德国Eppendorf AG)、J1可更换镜头电子取景数字照相机(日本Nikon公司)、DYY-12型电泳仪(北京市六一仪器厂)、TP600 TaKaRa PCR Thermal Cycler Dice(日本TaKaRa公司)、ABSON HtPot50干式恒温仪(合肥艾本森科学仪器有限公司) PowerPAac 3000电泳仪(美国 BIO-RAD公司)
1.2方法
1.2.1UQCRB全长基因的获取首先从人肝癌SMMC-7721细胞提取总RNA,裂解液RL裂解细胞并灭活RNA酶,经去蛋白液RE及漂洗液RW处理后得到总RNA,微量紫外分光光度仪测定。按5×PrimeScript Buffer 2 μl、1×PrimeScript RT Enzyme Mix I0.5 μl、Oligo dT Primer0.5 μl、Random 6 mers 0.5 μl、Total RNA 提取液3.5 μl、RNase Free dH2O 3 μl配制非特异性逆转录反应体系,反转录反应条件:50℃ 15 min;85℃ 5 s。采用自行设计由上海立菲生物技术有限公司合成的特异性引物进行UQCRB全长基因扩增,上游引物5′端加NheI酶切位点、下游引物5′端加XhoI酶切位点。UQCRB forward Primer:5′-GCTAGCATGCGAGATGATACAATATACGA-3′,UQCRB reverse Primer:5′-CTCGAGTTACTTCTTTGCCCATTCTTCT-3′;反应体系为:Premix TaqTMPCR预混液12.5 μl、非特异逆转录产物2 μl、UQCRB forward Primer0.15 μl、UQCRB reverse Primer 0.15 μl、deionized water 10.2 μl;反应条件为:94℃预变性8 min;94℃变性30 s、60℃退火30 s、72℃延伸30 s,共40个循环;72℃再延伸10 min。取一部分PCR产物进行琼脂糖凝胶电泳,剩余部分按1∶3体积加入NaI行UQCRB目的基因纯化。
1.2.2UQCRB克隆载体的构建按UQCRB蛋白基因PCR回收产物4 μl、T载体1 μl、SolutionI 5 μl体系连接UQCRB目的基因与T载体后,将连接产物用于转化DH5α感受态细胞, 37℃培养箱中培养15 h左右,取出后随机挑取阳性菌落行PCR扩增,引物同1.2.1,菌落PCR体系为:Premix TaqTMPCR预混液12.5 μl、UQCRB forward Primer0.15 μl、UQCRB reverse Primer 0.15 μl、deionized water 12.2 μl;反应条件同1.2.1,PCR产物行琼脂糖凝胶电泳。挑取PCR扩增产物UQCRB条带阳性对应的单克隆菌落在液体培养基里培养后,送北京六合华大基因科技股份有限公司测序。
1.2.3PET28a(+)-UQCRB重组蛋白原核表达载体的构建分别对PET28a(+)质粒、T-UQCRB质粒进行NheI、XhoI双酶切,琼脂糖凝胶电泳后,分别割胶回收纯化,将UQCRB全长基因与PET28a(+)载体片段连接后的产物转化BL21(DE3)感受态细胞,37℃培养箱中培养15 h左右取出后随机挑取阳性菌落行PCR扩增,引物同1.2.1,菌落PCR体系同1.2.2;反应条件同1.2.1,PCR扩增阳性的菌落在液体培养基里培养后,送北京六合华大基因科技股份有限公司测序。
1.2.4UQCRB重组蛋白的原核表达将重组质粒的表达菌BL21(DE3)37℃摇培过夜,取过夜培养菌液按1∶20的比例接种于溶菌肉汤培养基中(LB培养基)培养至OD600=0.6-0.8时用IPTG终浓度1 mM 37℃诱导,分别在诱导3 h、4 h、5 h、6 h后收集菌液进行SDS-聚丙烯酰胺凝胶电泳,以寻找最佳诱导时间;并至OD600=0.6-0.8时分别以终浓度0.6 mM、0.8 mM、1.0 mM、1.2 mM IPTG 37℃进行诱导,5 h后收集菌液进行SDS-聚丙烯酰胺凝胶电泳,以寻找最佳IPTG诱导浓度。SDS-聚丙烯酰胺凝胶电泳的配方为:4% SDS-PAGE浓缩胶、15% SDS-PAGE分离胶,电泳后用考马斯亮蓝R-250染色。
1.2.5UQCRB重组蛋白的纯化因为PET-28a质粒上带his标签,采用Ni-NTA树脂亲和层析进行UQCRB蛋白的纯化。Ni-NTA树脂经过Bind Buffer处理后与UQCRB蛋白室温下缓慢振摇孵育60 min,Wash Buffer洗涤3次,用50 mM、80 mM、250 mM咪唑浓度分别洗脱His标签UQCRB融合蛋白,并进行SDS-聚丙烯酰胺凝胶电泳,以寻找最佳咪唑洗脱浓度。
1.2.6UQCRB重组蛋白的westernblot验证IPTG诱导前的菌液、IPTG诱导后的菌液、纯化的蛋白样品以及蛋白Marker进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),300 mA电流恒流转膜后,取出PVDF膜(聚偏二氟乙烯膜polyvinylidene fluoride)依次采用5%脱脂奶粉-TBS封闭液、稀释后的抗His-Tag5%脱脂奶粉-TBS及辣根过氧化物酶标记的稀释二抗溶液进行孵育,显影、定影,室温下晾干将胶片进行扫描。
2结果
2.1UQCRB全长基因的获取
微量紫外分光测定人肝癌SMMC-7721细胞总RNA结果为OD260/OD280为2.02,浓度为142.8 ng/μl,反转录后的PCR扩增产物大小与UQCRB的基因片段大小一致见图1。

图1 UQCRB的逆转录PCR产物注:M:marker;1.反转录后的PCR产物
2.2UQCRB目的基因克隆载体的构建
双酶切后的小片段与UQCRB目的基因片段大小一致,经测序证实序列完全正确。pBSK-UQCRB质粒酶切鉴定结果见图2。
2.3UQCRB蛋白原核表达载体的构建
双酶切后的小片段与UQCRB目的基因片段大小一致,经测序证实序列及阅读框架完全正确。PET28a(+)-UQCRB质粒酶切鉴定结果见图3。
2.4UQCRB蛋白的原核表达
无IPTG诱导组及细胞外液组均未见UQCRB蛋白条带,IPTG诱导组均可见UQCRB蛋白条带,大小与UQCRB蛋白预期相符,8M尿素PBS做为重新悬浮液组UQCRB融合蛋白条带较其他PBS做为重新悬浮液组明显加深加粗,5 h诱导时间效果较理想;随着IPTG诱导浓度的提高,UQCRB融合蛋白条带逐渐加粗。SDS-聚丙烯酰胺凝胶电泳考染结果见图4、图5。

注:M1:1kb marker;M2:2000kb marker; 1:T 载体;2:T-UQCRB质粒;3:T-UQCRB质粒NheI、 XhoI双酶切;4:T-UQCRB质粒XhoI单酶切;5:T-UQCRB质粒NheI单酶切;6:单克隆菌落菌液PCR产物图2 T-UQCRB质粒酶切鉴定

注:M1:2000kb marker; M2:1kb marker;1:PET28a(+)质粒;2:PET28a(+)-UQCRB质粒;3:PET28a(+)-UQCRB质粒NheI、XhoI双酶切;4:PET28a(+)-UQCRB质粒XhoI单酶切;5:PET28a(+)-UQCRB质粒NheI单酶切;6:单克隆菌落菌液PCR产物图3 PET28a(+)-UQCRB质粒酶切鉴定

注:M:marker;1:IPTG诱导组菌液离心后的上清液;2:无IPTG诱导组;3:8M尿素PBS重新悬浮组;4:IPTG诱导3 h组;5:IPTG诱导4 h组; 6:IPTG诱导5 h组;7、IPTG诱导6 h组图4 IPTG诱导His标签UQCRB融合蛋白原核表达时间的优化

注:M:marker;1:0.6 mMIPTG诱导组;2:0.8 mM IPTG诱导组;3:1.0 mM IPTG诱导组;4:1.2 mM IPTG诱导组图5 IPTG诱导His标签UQCRB融合蛋白原核表达IPTG诱导浓度的优化
2.5UQCRB蛋白的纯化
Flow-through里会残留少量UQCRB融合蛋白目的条带,经过3次Wash Buffer洗涤第3次Wash Buffer洗涤液里已见不到其他蛋白杂带,只可见淡的His标签UQCRB融合蛋白目的条带,洗脱UQCRB融合蛋白的50 mM、80 mM直至250 mM咪唑浓度洗脱液里均可见UQCRB融合蛋白。SDS-聚丙烯酰胺凝胶电泳考染结果见图 6。
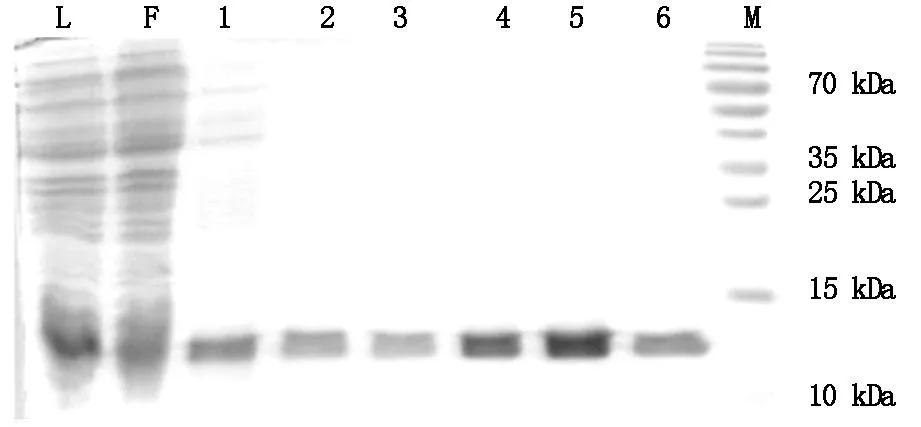
注:M:marker;L:PET28a(+)-UQCRB质粒阳性菌液表达裂解液(lysate);F:flow-through;1:Wash Buffer洗涤液1;2:Wash Buffer洗涤液2;3:Wash Buffer洗涤液3;4:50 mM 咪唑浓度洗脱液;5:80 mM咪唑浓度洗脱液;6:250 mM咪唑浓度洗脱液
2.6UQCRB蛋白的westernblot验证
诱导前样品未见阳性条带,IPTG诱导后样品及纯化蛋白样品均可见阳性条带且与UQCRB重组蛋白大小一致。westernblot结果见图7。
3讨论
本研究根据UQCRB基因特点自行设计引物获得了其全长基因,并根据后续纯化鉴定的需要,选用了含有His标签的pET-28a(+) Vector做为表达载体,采用高效表达的BL21(DE3)做为宿主菌进行了UQCRB重组蛋白的表达和纯化,且通过Westernblot得到了证实。真核基因在大肠杆菌中的表达形式一般可分为细胞内不溶性表达,即以包涵体形式存在;细胞内可溶性表达;蛋白分泌型表达。SDS-PAGE结果证实UQCRB的表达主要为非蛋白分泌型表达,为细胞内可溶性表达,会有部分包涵体形成,但可溶性UQCRB的量可以满足需要,同时我们也对表达的时间及IPTG诱导浓度进行了优化,尽量避免过表达等引起的包涵体形成增多等。我们采用Amicon? Pro Affinity Concentration Kit-Ni-NTA进行纯化并对纯化条件进行了摸索,不仅操作方便、蛋白纯度高,且纯化同时、可以进行浓缩换液等,较比应用透析等浓缩换液方法等大大节省了时间,为进一步研究UQCRB与中药有效成分的相互作用创造了有利条件。

注:M:marker;1:IPTG诱导前的菌液;2:IPTG诱导后的菌液;3:IPTG诱导后纯化的蛋白样品图7 UQCRB蛋白的westernblot验证
参考文献:
[1]Malaney S,Heng HH,Tsui LC,et al.Localization of the human gene encoding the 13.3-kDa subunit of mitochondrial complex III (UQCRB) to 8q22 by in situ hybridization[J].Cytogenet Cell Genet,1996,73(4):297.
[2]Jung HJ,Shim JS,Lee J,et al.Terpestacin inhibits tumor angiogenesis by targeting UQCRB of mitochondrial complex III and suppressing hypoxia-induced reactive oxygen species production and cellular oxygen sensing[J].J Biol Chem,2010,285(15):11584.
[3]Jung HJ,Kim KH,Kim ND,et al.Identification of a novel small molecule targeting UQCRB of mitochondrial complex III and its anti-angiogenic activity[J].Bioorg Med Chem Lett,2011,21(3):1052.
[4]Jung HJ,Kim Y,Chang J,et al.Mitochondrial UQCRB regulates VEGFR2 signaling in endothelial cells[J].J Mol Med (Berl),2013,91(9):1117.
[5]Cho YS,Jung HJ,Seok SH,et al.Functional inhibition of UQCRB suppresses angiogenesis in zebrafish[J].Biochem Biophys Res Commun,2013,433(4):396.
[6]Semenza GL .Hypoxia-inducible factors in physiology and medicine[J].Cell,2012,148(3):399.
[7]Elpek,GO.,Angiogenesis and liver fibrosis[J].World J Hepatol,2015,7(3):377.
摘要:目的为研究UQCRB(ubiquinol-cytochrome c reductase binding protein)与中药的作用机制,本实验室进行了UQCRB基因的克隆、原核表达和纯化。方法提取人肝癌SMMC-7721细胞总RNA,反转录后采用特异引物进行PCR扩增获取UQCRB基因全长,产物纯化后连入T载体测定正确,克隆经NheI、XhoI双酶切后连入PET28a(+)载体,构建PET28a(+)-UQCRB原核表达质粒。在BL21(DE3)宿主菌中表达超声处理后,应用Amicon○RPro Affinity Concentration Kit-Ni-NTA纯化,表达及纯化产物用westernblot验证。结果构建了PET28a(+)-UQCRB表达质粒,经过酶切鉴定和测序鉴定正确。重组UQCRB在BL21(DE3)中的最优表达条件为IPTG 1mM诱导5 h。Westernblot证实了表达和纯化结果。结论重组UQCRB的原核表达和纯化成功,为进一步研究UQCRB的作用奠定了基础。
关键词:UQCRB;克隆;表达;纯化
Prokaryotic expression and purification of UQCRBSUNYan-hui,ZHANGGuang-xian,KUANGZao-yuan,etal.(CollegeofFundamentalMedicalScience,GuangzhouUniversityofChineseMedicine,Guangzhou510006,China)
Abstract:ObjectiveTo study the interaction between UQCRB and traditional Chinese medicine,cloning,prokaryotic expression and purification of UQCRB (ubiquinol-cytochrome c reductase binding protein) was done in our laboratory.MethodsTotal RNA was extracted from SMMC-7721 cells of human liver cancer.The UQCRB full length gene was obtained by PCR amplification after reverse transcription using specific primers and the PCR product was purified and cloned into T vector which was sequenced to be correct.After being digested by Restriction Enzymer NheI and XhoI,it was connected to PET28a (+)to construct prokaryotic expression plasmid of PET28a(+)-UQCRB.UQCRB recombinant protein was expressed in BL21 (DE3) host bacteria and purified Using Amicon○RPro Affinity Concentration Kit-Ni-NTA.Both the products of expression and purification was verified using Westernblot.ResultsExpression plasmid of PET28a(+)-UQCRB was constructed and measured by restriction enzyme digestion identification and sequencing analysis.It was optimal that the expression of recombinant UQCRB in BL21 (DE3) was induced 5 hours with 1mM IPTG.The product of expression and purification was confirmed to be UQCRB recombinant protein by Westernblot.ConclusionSuccess of prokaryotic expression and purification of recombinant UQCRB establishes the foundation of further study for the function of UQCRB.
Key words:UQCRB;Cloning;Expression;purification
(收稿日期:2015-10-15)
作者简介:孙砚辉(1969-),女,博士,讲师。
中图分类号:Q78
文献标识码:A
文章编号:1007-4287(2016)01-0004-04
*通讯作者
基金项目:国家自然科学基金资助项目(81102714)
