微球体的制备及其在修复神经系统损伤研究中的应用
2016-02-24徐美玲张鲁中王晓冬
徐美玲 张鲁中 王晓冬 陈 雪*
1(南通大学医学院组织学与胚胎学教研室,江苏 南通 226001)2(南通大学江苏神经再生重点实验室,江苏 南通 226001)
微球体的制备及其在修复神经系统损伤研究中的应用
徐美玲1张鲁中2王晓冬1陈 雪1*
1(南通大学医学院组织学与胚胎学教研室,江苏 南通 226001)2(南通大学江苏神经再生重点实验室,江苏 南通 226001)
利用组织工程技术制备神经支架应用于神经系统损伤的修复已经成为神经系统再生研究领域的重点,其中利用生物材料以微球体形式,持续缓慢释放活性物质,有利于神经系统再生的微环境改善,也是研究的热点。本文就微球体制备的相关材料、制备方法、检测及在神经系统损伤修复中的作用等进行综述,并进行了总结和展望。
微球体;神经营养因子;神经系统损伤
引言
神经系统损伤的修复一直是困惑人们的难题,尤其是针对中枢神经系统的损伤,而药物治疗,包括生物活性物质的作用,常常是人们尝试的方法。如神经营养因子能够促进神经元的存活和轴突的生长,并在体内被证实能够促进中枢神经系统和周围神经系统的再生[1]。然而,为了保证神经营养因子的安全与高效需要将它们局部、持续地递送到神经系统的损伤部位,这就需要借助药物递送系统。微球体因为具有较高的表面与体积比、可控制的药物释放、较好的生物相容性及生物降解能力等特性已经被广泛地用于药物递送系统[2]。如Honorata等设计了包封NGF的胶原蛋白微球体(见图1),希望通过NGF的长期缓慢释放促进神经损伤组织的修复与再生[3]。采用乳化溶剂蒸发技术等方法制备出微球体,用来包封神经营养因子并将其递送到神经系统的损伤部位,能在较长一段时间内持续缓慢地释放神经营养因子,为损伤的神经组织提供良好的微环境,将有助于神经组织的逐渐修复[4]。本文就微球体制备的相关材料、制备方法、检测及在神经系统损伤修复中的作用等进行综述。
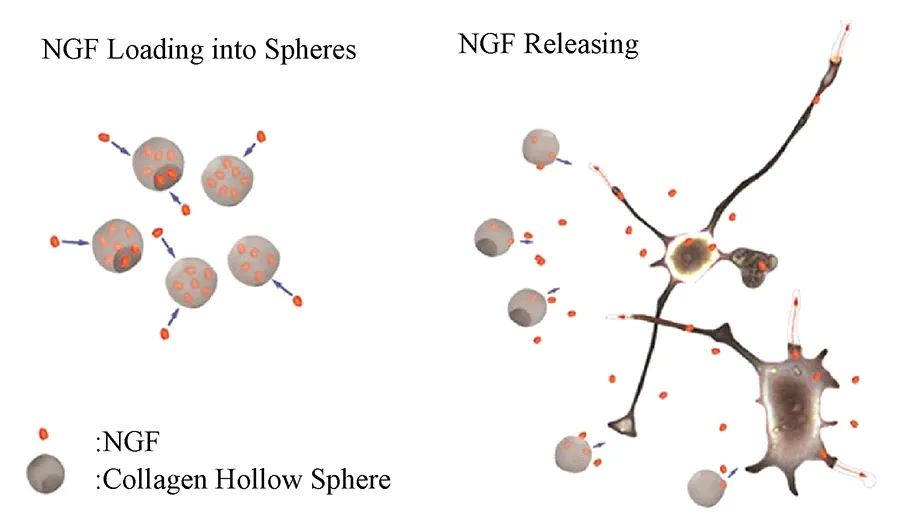
图1 NGF包封到微球体中和NGF的释放示意图[3]Fig.1 Graphical representation of the NGF loading into spheres and NGF releasing[3]
1 材料
1.1 聚合物
用于制备微球体壁材的聚合物种类虽然较多,主要包括天然高分子和合成高分子两大类。其中天然的聚合物主要包括壳聚糖(chitosan)、海藻酸盐(alginate)等,而合成的聚合物主要包括聚乳酸(polylactic acid, PLA)、聚乳酸聚乙醇酸共聚物(poly(lactic-co-glycolic acid),PLGA)等。
1.1.1 壳聚糖
由蟹、虾的外壳及蚕蛹中提取出的甲壳素经过脱乙酰作用后衍生得到壳聚糖[5],它具有极好的生物相容性和生物降解能力,因而被广泛地应用于制备微球体。壳聚糖可溶于酸溶液,避免了使用危险的有机溶剂制备微球体,减小了后期用于体内研究可能产生的毒性风险[6]。且壳聚糖具有阳离子性质,它可以通过静电作用与带负电荷的多聚体及其他大分子紧密地结合在一起,形成微球体,并将携带的神经营养因子递送到体内合适的部位,使其保持稳定的浓度,从而持续发挥神经营养因子的生物活性[7]。Wen等制备了包封神经生长因子(nerve growth factor, NGF)的微球体,并将其固定到胶原蛋白-壳聚糖支架中,用于修复大鼠15mm长的坐骨神经缺损,发现损伤处的运动神经纤维和感觉神经纤维的数量明显增加,表明了微球体持续缓慢的释放NGF可能促进了运动神经和感觉神经的再生[8]。
使用乳化溶剂蒸发技术制备壳聚糖微球体时,神经营养因子是通过物理学静电作用包封到壳聚糖微球体中的,因此神经营养因子可能仅仅与壳聚糖链发生缠绕作用,一旦包封神经营养因子的微球体暴露到释放介质中,壳聚糖链与神经营养因子之间的物理缠绕就会很容易解缠绕,因为壳聚糖和神经营养因子都具有高度的亲水性,从而导致最初显著的爆发式释放[9]。尽管在体外研究神经营养因子从微球体中释放的速率较快,不能满足在体内对神经营养因子长期释放的需求,但是将包封神经营养因子的微球体固定到神经支架中,可能会显著地减少最初爆发式释放的特征,因此,将神经营养因子、微球体、神经支架与靶细胞组合起来[10],作为复合材料应用到神经系统损伤的研究中,将是未来的发展趋势[11]。
1.1.2 海藻酸盐
海藻酸盐是从褐藻中提取出的阴离子线性多糖[12],具有良好的生物相容性和生物降解能力,因此,常被作为载体包封材料用于药物递送系统[13]。使用海藻酸盐制备的微球体具有pH敏感性,粒径适宜,可防止突释等优点,海藻酸盐为阴离子型高分子,遇到阳离子时会产生凝胶层,阻滞药物释放,从而达到缓释作用[14]。Tanihara等用肝素/海藻酸人工细胞外基质包封碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)[15],发现在体外生理条件下,该因子可以持续释放一个多月,并且能够保持较好的生物活性,将其埋置于大鼠体内,可以促进周围组织中新的血管形成,有利于神经系统再生[16]。
1.1.3 聚乳酸
PLA是以乳酸为主要原料聚合形成的聚合物,制备PLA的原料来源充足,且制备过程无污染,可以通过三羧酸循环的方式生物降解为二氧化碳和水,是较为理想的绿色高分子材料,因此,使用PLA制备微球体将是一种很好的选择。Guan等采用乳化溶剂蒸发技术制备了包封洛伐他汀的PLA微球体,并证明了PLA微球体可以显著地延长药物在体内存在的时间,显著地提高药物的生物药效[17]。
1.1.4 聚乳酸聚乙醇酸共聚物
PLGA是由乳酸和羟基乙酸两种单体随机聚合而成的无规共聚物,具有较好的生物相容性、生物降解能力和成囊性,被广泛地应用于生物工程与制药工程[18]。不同的单体比例可以制备出不同类型的PLGA,它们的降解速度也有较大差异,因而可以调控由PLGA制备的微球体的降解速度。PLGA的降解产物是乳酸和羟基乙酸,它们同时也是人体代谢的副产物,因而将PLGA制备成微球体用于蛋白质递送系统时,不会产生毒副作用[19]。Karal-Yilma等采用双乳溶剂蒸发技术制备包封重组人血管内皮生长因子(recombinant human vascular endothelial growth factor,rhVEGF)的PLGA微球体,发现从微球体中释放的rhVEGF能够促进人脐静脉内皮细胞的增殖与迁移,说明释放的rhVEGF的活性得到了保存[20]。Ralph 等设计了4种包封NGF的PLGA微球体,根据它们在体内的释放曲线及其表面形态特征,选择特性粘度为0.4 dL/g,由比例为50∶50的乳酸和乙醇酸组成的PLGA(50∶50 4A)制备的微球体用于大鼠坐骨神经损伤模型研究,效果较好[21]。
1.2 交联剂
交联剂是一种能够使多个线型分子之间相互键合交联成网状结构的物质,它能够调节或促进聚合物分子链间共价键或离子键的形成。制备微球体常用的交联剂主要有两种:一种是物理交联剂,例如三聚磷酸钠(sodium tripolyphosphate,TPP),这种交联剂的交联作用是可逆的;另一种是化学交联剂,例如京尼平(genipin)、戊二醛(glutaraldehyde,GTA),这种交联剂在发挥交联作用时会伴随化学键的形成,因而它的作用是不可逆的。
1.2.1 三聚磷酸钠
TPP是无毒的多聚阴离子,而壳聚糖是多聚阳离子,因此它们可以通过静电力发生相互作用[22]。TPP处理的壳聚糖微球体能够提高它们在药物递送系统中的稳定性[23]。壳聚糖与TPP的不同质量比例对制备微球体的形态大小和数量分布是有较大影响的,一般情况下选择1∶4或者1∶3的质量比例来制备微球体,因为这种比例制备出的微球体形态较好,且大小分布较为均匀,适用于递送NGF等生物活性物质[24]。
1.2.2 京尼平
京尼平是一种可从京尼平苷中获取的天然水溶性双功能交联剂。与戊二醛相比,京尼平的细胞毒性要低很多,且具有很好的生物相容性,适用于局部药物递送系统[25]。Mangkorn等通过油包水型乳化溶剂扩散方法,制备了京尼平交联的包封牛血清白蛋白(albumin from bovine serum,BSA)的壳聚糖微球体,发现BSA的包封并不影响微球体的形状,随着京尼平浓度的增加,微球体的平均尺寸有轻微的增大,而当交联时间增加时,微球体的平均尺寸出现明显变小[26]。
1.2.3 戊二醛
GTA在一定条件下能将线型高分子、单体或预聚物转变成三维网状结构的物质。根据以前的研究,从壳聚糖微球体中释放的药物可以通过使用GTA交联聚合物,从而被很好地控制释放[27]。但GTA具有一定的毒性,可能与多肽和蛋白质发生反应导致蛋白质失活,会对细胞膜产生刺激作用,而且GTA交联的微球体具有高爆发式释放的作用[28]。鉴于GTA的这些缺点,Sun等将GTA和TPP共同作为交联剂,采用两步固定法,使用乳液交联的方法制备包封5-氟尿嘧啶的壳聚糖微球体,使5-氟尿嘧啶的包封率达到78.5%,释放总量达到58.7%[29],说明两步固定法在药物递送系统中具有较好的实用性,可以考虑使用这种方法制备包封修复神经系统损伤相关的神经营养因子的微球体,以发挥较好的递送功能。
1.3 表面活性剂
表面活性剂(surfactant)是指在溶液的表面能定向排列、具有固定的亲水亲油基团的物质,加入少量的该物质到溶液体系中就能够使溶液体系的界面状态发生明显的变化[30]。表面活性剂可分为离子型、非离子型和两性型等[31]。Span80是非离子型表面活性剂,常常以乳化剂的形式在制备微球体中发挥作用。在乳化溶剂蒸发技术中,作为油溶性的乳化剂,Span80通过吸附到乳滴的表面增加了外部油相的粘性,使得较低比率的水从乳滴分散到外部的持续相中,稳定了生成的乳滴,促进了水/油(Water/Oil,W/O)乳液的形成[32]。
2 微球体的常用制备方法
微球体思路如图2所示[3]。首先利用生物材料制备出球状形态较好的微球体,再将生物活性物质包封到微球体内,最后进入体内并使活性物质能长期缓慢释放出来,发挥活性作用,以达到促进损伤组织或病变组织的再生与修复目的。
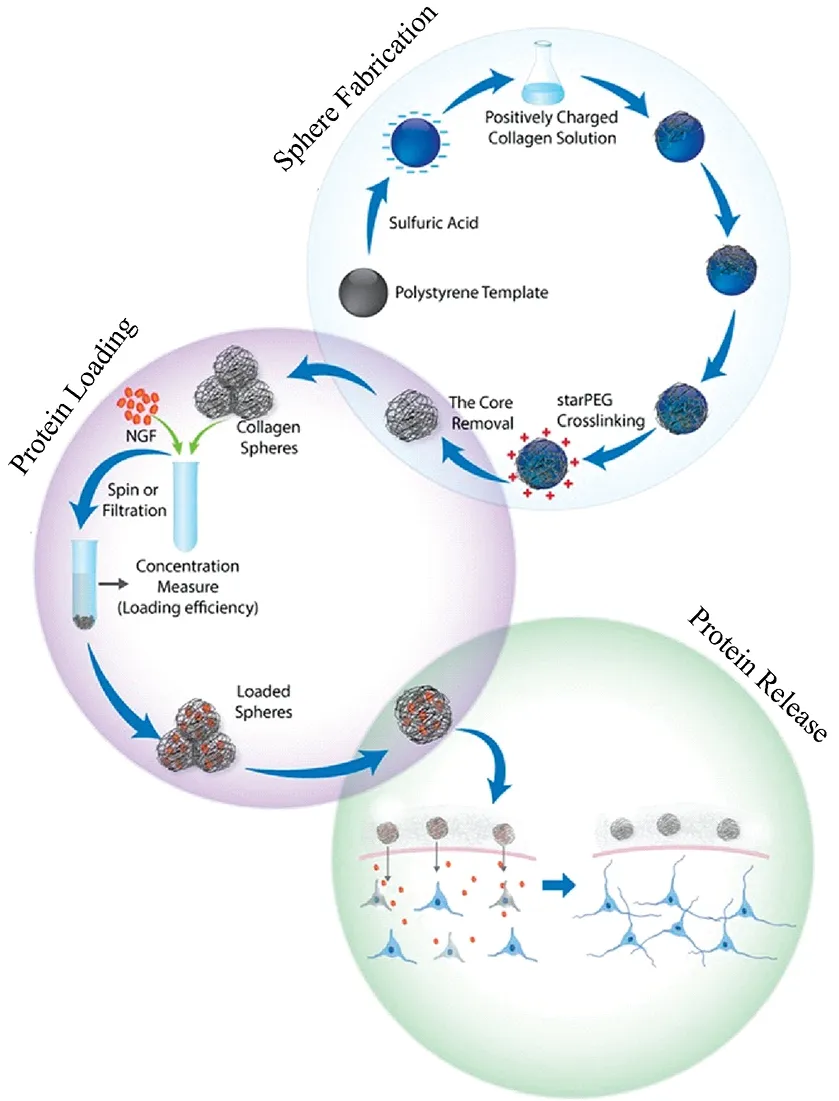
图2 空心胶原蛋白微球体的制备和蛋白质的装载/释放[3]Fig.2 Graphical representation of the fabrication of hollow collagen microspheres and protein loading/release[3]
2.1 乳化溶剂蒸发技术
近年来,用于制备微球体的乳化溶剂蒸发技术已经得到了广泛的应用[33]。利用该技术制备包封神经营养因子的微球体也取得了一定的进展。Cao等采用乳化溶剂蒸发技术制备了PLGA微球体,发现空载的微球体表面形态光滑,而包封NGF的微球体表面相对粗糙且有小孔的存在[34]。Wen等将NGF添加到壳聚糖醋酸溶液中作为水相,含有表面活性剂的液体石蜡作为油相,制备出的NGF壳聚糖微球体表面形态相对粗糙、球状、无空洞或者变形,这种方法制备出的壳聚糖微球体能够缓释有生物活性的NGF,且在体外研究中发现从微球体中释放的NGF,能够维持PC12细胞(pheochromocytoma cells, PC12)的存活及促进其分化为神经细胞的表型,这对神经系统损伤的再生与修复可能有很大帮助作用[24]。
2.2 油包水乳液溶剂扩散的方法
丝素蛋白(silk fibroin,SF)是一种具有生物相容性和生物降解能力的纤维蛋白,被广泛地应用于组织工程和控制释放药物系统[35-36]。热烧结方法[37]、喷雾干燥法[38]等已经被报道可以用来制备SF微球体,但是这些方法在制备的过程中用酒精或加热处理后,需要改变SF基质从水溶性的随机蜷曲形式转变为水不溶性的β-折叠形式。油包水乳液溶剂扩散的方法就用来制备疏水的可生物降解的聚合物。Baimark等采用油包水乳液溶剂扩散的方法制备出具有球状形态且表面比较光滑的丝素蛋白微球体,发现交联过程诱导了SF构象从随机蜷曲形式转变为β-折叠形式,而且当SF的交联度增加时,SF微粒的孔隙度减少,热稳定性增加[39],这种丝素蛋白微球体适用于包封神经营养因子等亲水性的物质,用于修复神经系统损伤。
3 微球体的检测指标
3.1 粒径的尺寸
通过不同的方法制备出的微球体的尺寸分布范围广泛:从几微米到几十微米、甚至几百微米大小的微粒[9, 21]。Zeng等制备出的丝素蛋白壳聚糖微球体的大小分布在70~150 μm,且该微球的颗粒尺寸分布近似高斯分布[40]。Wen等用干法粒度分析仪检测出由不同浓度的TPP交联制备的NGF壳聚糖微球体的平均大小是20.5~31.2 μm[24]。在成年大鼠脊髓横断损伤模型研究中,支架中通道的直径较大时,会产生大量的纤维边缘,减少轴突的再生,支架中通道的直径较小时,有益于轴突再生[41]。因此,用于脊髓损伤修复的支架尺寸一般控制在几百微米范围内[42]。当微球体的尺寸过小时,不适合包封大分子、蛋白质等物质;当微球体的尺寸过大时,微球体可能会阻塞支架通道,阻碍轴突的生长。因此在使用乳化溶剂蒸发技术制备微球体的过程中,会控制采用的溶液浓度和搅拌速度,以获取适当粒径的微球体,用于进一步研究其包封物质的释放机制[43]。
3.2 包封率
包封率(encapsulation efficiency,EE)指被包裹的物质在微球体悬液中占投入的该物质总量的百分比。蛋白质或其他大分子物质包封到微球体中,往往需要检测微球体的包封率[44]。Huang等用TPP作为交联剂制备了包封神经生长因子的壳聚糖微球体,使用NGF ELISA kit 检测了包封率,发现随着TPP浓度的增加,NGF在微球体中的装载量和包封率降低,可能是因为在制备微球体的过程中,带负电荷的TPP首先与带正电荷的壳聚糖反应,当TPP数量过多时,TPP就会与带正电荷的NGF反应,这会影响NGF掺合到壳聚糖中的过程[24]。这些都说明TPP对微球体的包封率具有显著的影响作用,可以通过控制TPP的使用量来选择需要的包封率。
3.3 溶胀指数
微球体的溶胀指数(swelling index,SI)是通过浸泡到磷酸缓冲液中,采用重量分析方法获得的。Liao等发现当TPP与壳聚糖的质量比例由1∶1上升至6∶1时,微球体的溶胀指数显著下降。亲水性聚合物的溶胀指数会严重影响它们的药物释放行为,而且包封药物的聚合物支架的较大SI值通常与药物最初的爆发释放及随后的快速释放相关[7]。SI值过小时,微球体中包封的神经营养因子不容易释放出来,SI值过大时,包封的神经营养因子会出现初期高爆发释放,导致神经营养因子大量流失,后期神经营养因子供应不足。
3.4 降解率
作为递送系统的介质,除了将需要的物质递送到特定的损伤部位外,微球体也需要以恰当的速度降解,为损伤的神经系统提供较大的修复空间。作为制备微球体常用的聚合物,壳聚糖的降解速度较快,添加其他生物材料可以降低其降解速度,从而在体内移植后的较长一段时间内,能够控制神经营养因子的释放数量,使神经营养因子在较长的修复时间内维持稳定的浓度,持续发挥促进损伤修复的作用[45]。此外,壳聚糖的降解产物是壳寡糖,壳寡糖也具有良好的神经细胞的亲和力,它能够支持神经细胞粘附,促进神经细胞的分化和神经突起向外生长[45],这样壳聚糖微球体就能够对修复损伤的神经系统发挥双重功效。
3.5 包封因子的生物活性
微球体在使用之前要用环氧乙烷熏蒸灭菌,然后对其进行毒性检测。从微球体中释放的神经营养因子是否保持了原来的生物活性,是评价微球体功能非常重要的指标之一[46],因此,常常将微球体释放的神经营养因子进行细胞培养,采用MTT法检测细胞的生长情况,从而检测释放出的神经营养因子的生物活性是否受损。Liao等通过对PC12细胞轴突生长进行分析,发现培养于释放NGF培养液中的PC12细胞出现了分化,其轴突的生长超过了胞体长度,说明NGF的活性得到了较好的保存[7]。
3.6 包封因子的缓释
微球体包装活性物质的主要目的就是缓释这些物质,以达到保持较长时间的特定浓度。Huang等使用NGF ELISA kit检测出4种不同类型的壳聚糖微球体中释放的NGF,在12 d时累积释放量达到了70%以上,且都出现明显的最初爆发式释放的特征[7]。这可能和神经系统修复与再生需要的时间较长不相符,但可以通过将微球体固定到神经支架中,延缓NGF的释放速率而改善这一缺点。Sun等检测出NGF从PLGA微球体中的释放可持续90 d,累计释放量达到60%,这满足了神经系统再生周期长的需求。体外研究发现,与直接将神经营养因子加入到支架中相比,使用微球体作为神经营养因子的递送介质后,可以明显减少最初爆发式释放的数量[47]。由于神经系统损伤往往需要较长的修复时间,因此在这段时间内,需要于损伤部位维持稳定的神经营养因子浓度,以促进靶细胞的增殖与迁移及神经元的再生,从而对神经系统损伤修复起到稳定而长效的促进作用。因此用微球体包封神经营养因子,然后固定到支架中,作用于神经系统的损伤部位将是一种较好的方案。
4 结论及展望
近十几年来,微球体作为药物的递送介质,已经有了较多的研究和报道[48],但将神经营养因子包封到微球体中,固定到支架上,持续缓慢释放,发挥对靶细胞的增殖、分化与迁移等起调节作用,共同促进神经系统损伤的再生与修复则是一个新的、需要进一步探索的领域。神经营养因子的生物活性保存条件十分苛刻,这是微球体缓释的关键要素,而这一生物学活性的保护,涉及到因子与生物材料结合过程中的温度、酸碱度及参与微球体形成和包封过程中使用的辅助化学试剂等对其的影响,也关系到因子与微球体的结合程度,能否保证持续缓慢释放。所以,在因子与微球体结合的制作工艺中,就必须考虑到这些问题,尽量避免引起蛋白质失活的化学物质及反应环境。与此同时,因子缓释的时间与剂量是另一个重要的指标,如使用乳化溶剂蒸发技术制备壳聚糖微球体并用静电作用包封神经营养因子时,造成最初显著的因子爆发式释放,但如果将其再与组织工程材料支架结合,就能改善这种不利状况。当然,微球体的降解状况也是需要注意的问题,当微球体以适宜的速度降解时,既能够为神经元的内在延伸提供足够的空间,又能长时间控制释放神经营养因子的时间,最终达到修复神经系统损伤的目的。最后,要注意体外研究的缓释效果,可能与体内的实际情况大相径庭,需要多方面、多指标的验证。总之,只有充分地考虑制备微球体的各项条件,探索出最佳的方案,才能制备出具有较高实用价值的微球体,才能在最佳的修复时间内,帮助损伤的神经系统快速、高效地实现再生,这样也才能使其在未来临床应用中发挥较好作用。
[1] Faroni A, Mobasseri SA, Kingham PJ, et al. Peripheral nerve regeneration: experimental strategies and future perspectives [J]. Adv Drug Deliv Rev, 2015, 82-83: 160-167.
[2] Bile J, Bolzinger MA, Vigne C, et al. The parameters influencing the morphology of poly(varepsilon-caprolactone) microspheres and the resulting release of encapsulated drugs [J]. Int J Pharm, 2015, 494(1): 152-166.
[3] Kraskiewicz H, Breen B, Sargeant T, et al. Assembly of protein-based hollow spheres encapsulating a therapeutic factor [J]. ACS Chem Neurosci, 2013, 4(9): 1297-1304.
[4] Xu Xiaoyun, Yu Hanry, Gao Shujun, et al. Polyphosphoester microspheres for sustained release of biologically active nerve growth factor [J]. Biomaterials, 2002, 23(17): 3765-3772.
[5] Dolgopyatova NV, Novikov VY, Konovalova IN. Influence of the degree of deacetylation on the rate of acid degradation of chitin and chitosan and on the yield of D(+)-glucosamine hydrochloride [J]. Russian Journal of Applied Chemistry, 2011, 84(10): 1826-1829.
[6] Leitgeb M, Herzic K, Podrepsek GH, et al. Toxicity of magnetic chitosan micro and nanoparticles as carriers for biologically active substances [J]. Acta Chimica Slovenica, 2014, 61(1): 145-152.
[7] Liao Chunyan, Huang Junchao, Sun Shaofa, et al. Multi-channel chitosan-polycaprolactone conduits embedded with microspheres for controlled release of nerve growth factor [J]. Reactive & Functional Polymers, 2013, 73(1): 149-159.
[8] Zeng Wen, Rong Mengyao, Hu Xueyu, et al. Incorporation of chitosan microspheres into collagen-chitosan scaffolds for the controlled release of nerve growth factor [J]. PLoS ONE, 2014, 9(7): e101300.
[9] Ko JA, Park HJ, Hwang SJ, et al. Preparation and characterization of chitosan microparticles intended for controlled drug delivery [J]. Int J Pharm, 2002, 249(1-2): 165-174.
[10] Kanno H, Pearse DD, Ozawa H, et al. Schwann cell transplantation for spinal cord injury repair: its significant therapeutic potential and prospectus [J]. Rev Neurosci, 2015, 26(2): 121-128.
[11] Kumar P, Choonara YE, Modi G, et al. Multifunctional therapeutic delivery strategies for effective neuro-regeneration following traumatic spinal cord injury [J]. Curr Pharm Des, 2015, 21(12): 1517-1528.
[12] Wu Chengtie, Zhu Yufang, Chang Jiang, et al. Bioactive inorganic-materials/alginate composite microspheres with controllable drug-delivery ability [J]. J Biomed Mater Res B Appl Biomater, 2010, 94(1): 32-43.
[13] Jain RA. The manufacturing techniques of various drug loaded biodegradable poly(lactide-co-glycolide) (PLGA) devices [J]. Biomaterials, 2000, 21(23): 2475-2490.
[14] Chan L, Jin Y, Heng P. Cross-linking mechanisms of calcium and zinc in production of alginate microspheres [J]. Int J Pharm, 2002, 242(1-2): 255-258.
[15] Chen Bo, He Jianyu, Yang Hao, et al. Repair of spinal cord injury by implantation of bFGF-incorporated HEMA-MOETACL hydrogel in rats [J]. Sci Rep, 2015, 5: 9017.
[16] Tanihara M, Suzuki Y, Yamamoto E, et al. Sustained release of basic fibroblast growth factor and angiogenesis in a novel covalently crosslinked gel of heparin and alginate [J]. J Biomed Mater Res, 2001, 56(2): 216-221.
[17] Guan Qigang, Chen Wei, Hu Xianming. Development of lovastatin-loaded poly(lactic acid) microspheres for sustained oral delivery: in vitro and ex vivo evaluation [J]. Drug Des Devel Ther, 2015, 9: 791-798.
[18] Alcala-Alcala S, Benitez-Cardoza G, Lima-Munoz EJ, et al. Evaluation of a combined drug-delivery system for proteins assembled with polymeric nanoparticles and porous microspheres; characterization and protein integrity studies [J]. Int J Pharm, 2015, 489(1-2): 139-147.
[19] Zheng Caihong, Gao Jianqing, Zhang Ye-ping, et al. A protein delivery system: biodegradable alginate-chitosan-poly(lactic-co-glycolic acid) composite microspheres [J]. Biochem Biophys Res Commun, 2004, 323(4): 1321-1327.
[20] Karal-Yilmaz O, Serhatli M, Baysal K, et al. Preparation and in vitro characterization of vascular endothelial growth factor (VEGF)-loaded poly(D,L-lactic-co-glycolic acid) microspheres using a double emulsion/solvent evaporation technique [J]. J Microencapsul, 2011, 28(1): 46-54.
[21] De Boer R, Knight AM, Spinner RJ, et al. In vitro and in vivo release of nerve growth factor from biodegradable poly-lactic-co-glycolic-acid microspheres [J]. J Biomed Mater Res A, 2010, 95(4): 1067-1073.
[22] Schutz CA, Juillerat-Jeanneret L, Kauper P, et al. Cell response to the exposure to chitosan-TPP//alginate nanogels [J]. Biomacromolecules, 2011, 12(11): 4153-4161.
[23] Nasti A, Zaki NM, De Leonardis P, et al. Chitosan/TPP and chitosan/TPP-hyaluronic acid nanoparticles: systematic optimisation of the preparative process and preliminary biological evaluation [J]. Pharm Res, 2009, 26(8): 1918-1930.
[24] Zeng Wen, Huang Jinghui, Hu Xueyu, et al. Ionically cross-linked chitosan microspheres for controlled release of bioactive nerve growth factor [J]. Int J Pharm, 2011, 421(2): 283-290.
[25] Chen Mei-chin, Liu Chin-tang, Tsai Hung-wen, et al. Mechanical properties, drug eluting characteristics and in vivo performance of a genipin-crosslinked chitosan polymeric stent [J]. Biomaterials, 2009, 30(29): 5560-5571.
[26] Karnchanajindanun J, Srisa-Ard M, Bairnark Y. Genipin-cross-linked chitosan microspheres prepared by a water-in-oil emulsion solvent diffusion method for protein delivery [J]. Carbohydrate Polymers, 2011, 85(3): 674-680.
[27] Jameela SR, Jayakrishnan A. Glutaraldehyde cross-linked chitosan microspheres as a long acting biodegradable drug delivery vehicle: studies on the in vitro release of mitoxantrone and in vivo degradation of microspheres in rat muscle [J]. Biomaterials, 1995, 16(10): 769-775.
[28] Wang Lianyan, Gu Yonghong, Su Zhiguo, et al. Preparation and improvement of release behavior of chitosan microspheres containing insulin [J]. Int J Pharm, 2006, 311(1-2): 187-195.
[29] Sun Yi, Gu Lei, Gao Yuan, et al. Preparation and characterization of 5-Fluorouracil loaded chitosan microspheres by a two-step solidification method [J]. Chem Pharm Bull (Tokyo), 2010, 58(7): 891-895.
[30] Aidarova S, Sharipova A, Kragel J, et al. Polyelectrolyte/surfactant mixtures in the bulk and at water/oil interfaces [J]. Adv Colloid Interface Sci, 2014, 205: 87-93.
[31] Ariyaprakai S, Dungan SR. Influence of surfactant structure on the contribution of micelles to Ostwald ripening in oil-in-water emulsions [J]. J Colloid Interface Sci, 2010, 343(1): 102-108.
[32] Zhan Shiping, Zhou Zhiyi, Wang Weijing, et al. Effect of nonionic compound emulsifiers Tween80 and Span80 on the properties of microencapsulated phase change materials [J]. Journal of Microencapsulation, 2014, 31(4): 317-322.
[33] Niu Xufeng, Feng Qingling, Wang Mingbo, et al. Preparation and characterization of chitosan microspheres for controlled release of synthetic oligopeptide derived from BMP-2 [J]. J Microencapsul, 2009, 26(4): 297-305.
[34] Cao Xudong, Schoichet MS. Delivering neuroactive molecules from biodegradable microspheres for application in central nervous system disorders [J]. Biomaterials, 1999, 20(4): 329-339.
[35] Uebersax L, Mattotti M, Papaloizos M, et al. Silk fibroin matrices for the controlled release of nerve growth factor (NGF) [J]. Biomaterials, 2007, 28(30): 4449-4460.
[36] Zeng Shuguang, Ye Manwen, Qiu Junqi, et al. Preparation and characterization of genipin-cross-linked silk fibroin/chitosan sustained-release microspheres [J]. Drug Des Devel Ther, 2015, 9: 2501-2514.
[37] Jeon JH, Bhamidipati M, Sridharan B, et al. Tailoring of processing parameters for sintering microsphere-based scaffolds with dense-phase carbon dioxide [J]. J Biomed Mater Res B Appl Biomater, 2013, 101(2): 330-337.
[38] Huang YC, Chiang CH, Yeh MK. Optimizing formulation factors in preparing chitosan microparticles by spray-drying method [J]. J Microencapsul, 2003, 20(2): 247-260.
[39] Baimark Y. Morphology and thermal stability of cross-linked silk fibroin microparticles prepared by the water-in-oil emulsion solvent diffusion method [J]. Asia-Pacific Journal of Chemical Engineering, 2012, 7: S112-S117.
[40] Ye Manwen, Zeng Shuguang, Gao Wenfeng, et al. Preparation and characterization of genipin-crosslinked silk fibroin/chitosan controlled-release microspheres[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2014, 34(6): 875-879.
[41] Krych AJ, Rooney GE, Chen B, et al. Relationship between scaffold channel diameter and number of regenerating axons in the transected rat spinal cord [J]. Acta Biomater, 2009, 5(7): 2551-2559.
[42] Wang Minda, Zhai Peng, Chen Xiongbiao, et al. Bioengineered scaffolds for spinal cord repair [J]. Tissue Eng Part B Rev, 2011, 17(3): 177-194.
[43] Niu Xufeng, Feng Qingling, Wang Mingbo, et al. Porous nano-HA/collagen/PLLA scaffold containing chitosan microspheres for controlled delivery of synthetic peptide derived from BMP-2 [J]. J Control Release, 2009, 134(2): 111-117.
[44] Quinlan E, Lopez-Noriega A, Thompson E, et al. Development of collagen-hydroxyapatite scaffolds incorporating PLGA and alginate microparticles for the controlled delivery of rhBMP-2 for bone tissue engineering [J]. J Control Release, 2015, 198: 71-79.
[45] Yang Yumin, Liu Mei, Gu Yun, et al. Effect of chitooligosaccharide on neuronal differentiation of PC-12 cells [J]. Cell Biol Int, 2009, 33(3): 352-356.
[46] Kempen DH, Lu L, Kim C, et al. Controlled drug release from a novel injectable biodegradable microsphere/scaffold composite based on poly(propylene fumarate) [J]. J Biomed Mater Res A, 2006, 77(1): 103-111.
[47] Desai KG, Park HJ. Preparation of cross-linked chitosan microspheres by spray drying: effect of cross-linking agent on the properties of spray dried microspheres [J]. J Microencapsul, 2005, 22(4): 377-395.
[48] Bulut E. Controlled delivery of the popular nonsteroidal anti-inflammatory drug, paracetamol, from chitosan-g-polyacrylamide microspheres prepared by the emulsion crosslinking technique [J]. Artif Cells Nanomed Biotechnol, 19 May, 2015 [Epub ahead of print].
Preparation of Microspheres and its Application in Nervous System′s Injury and Repair
Xu Meiling1Zhang Luzhong2Wang Xiaodong1Chen Xue1*
1(DepartmentofHistologyandEmbryology,MedicalCollegeofNantongUniversity,Nantong226001,Jiangsu,China)2(JiangsuKeyLaboratoryofNeuroregeneration,NantongUniversity,Nantong226001,Jiangsu,China)
Tissue engineering technology has been applied to prepare nerve conduits for repairing nervous system′s injury and has become the focus in the field of nervous system′s regeneration.Using biological materials in the form of microspheres has become main issues. Microspheres can release bioactive substances in a sustained and controlled manner,they improve the microenvironment of nervous system′s regeneration. This paper reviews candidate materials, fabrication techniques, and detection methods for preparing microspheres and discuss the role of microspheres in nervous system′s injury and repair.
microspheres; neurotrophin; nervous system′s injury
10.3969/j.issn.0258-8021. 2016. 04.011
2015-07-30, 录用日期:2016-04-09
国家自然科学基金(81501610,81350030)
R318
A
0258-8021(2016) 04-0470-07
*通信作者(Corresponding author), E-mail: biosnow@163.com
