氧化还原条件对红枫湖沉积物磷释放影响的微尺度分析*
2016-02-23徐洋,陈敬安,王敬富等
氧化还原条件对红枫湖沉积物磷释放影响的微尺度分析*
(1:贵州大学资源与环境工程学院,贵阳 550025)
(2:中国科学院地球化学研究所环境地球化学国家重点实验室,贵阳 550002)
摘要:选取贵州红枫湖为研究对象,在实验室条件下模拟了自然、好氧和厌氧条件下沉积物内源磷的释放过程,联合应用微电极技术和沉积物磷形态分析对沉积物-水界面开展了微尺度观测与研究.结果表明,厌氧条件下红枫湖沉积物总磷含量显著降低,且主要是NaOH提取态磷(NaOH-P)和残渣态磷(rest-P)含量降低所致,厌氧条件下沉积物孔隙水中磷酸盐浓度明显升高,而好氧条件下沉积物孔隙水磷酸盐浓度显著降低,反映厌氧条件显著促进了红枫湖沉积物磷释放.厌氧条件下沉积物内部溶解氧浓度下降、硫还原活动增强可能是导致NaOH-P释放的主要原因.O2浓度的降低加速了沉积物还原作用并产生大量H2S,进而与二价铁离子形成硫化亚铁沉淀,最终导致NaOH-P(Fe-P)释放到孔隙水中.好氧条件向厌氧条件的转换可通过改变沉积物内部pH值分布和微生物活动促使rest-P释放:厌氧条件下,厌氧微生物不仅可以消耗硫酸根产生H2S,导致pH值降低,还可消耗有机质,将有机磷转变为无机磷.上述研究结果表明,沉积物-水界面氧化还原环境可影响沉积物氧渗透深度、pH值分布、微生物活动、硫循环以及有机质降解过程,进而控制沉积物磷的形态转化与释放.联合应用微电极技术和沉积物磷形态分析对湖泊沉积物-水界面开展微尺度观测研究是揭示沉积物内源磷释放机制与控制因素的有效途径。
关键词:氧化还原环境;微电极;微尺度;沉积物内源磷;红枫湖
湖泊富营养化是我国当前面临的最严峻的水环境问题之一[1].磷被认为是造成湖泊富营养化最重要的限制性因子[2].湖泊水体磷来源可分为两类:一是外源输入,如工业废水、城镇生活污水、农业面源污染等;二是内源输入,即湖泊沉积物内源磷释放.随着外源污染物输入逐步得到有效控制,沉积物内源磷释放已成为控制水体富营养化的重要因素。
影响湖泊沉积物磷释放的环境因素众多,其中关键因素主要有温度、pH值、溶解氧、氧化还原电位、生物作用以及扰动等.金相灿等[3]对玄武湖沉积物中磷释放的研究表明,pH值为中性时底泥释磷最少,当偏离中性时,释磷即增加.候立军等[4]在对苏州河底泥内源磷释放的研究中发现当底泥存在微生物作用时,其内源磷的释放量明显高于没有微生物作用时.温度、扰动、氧化还原电位以及溶解氧的变化均会导致沉积物内源磷释放量的改变[5].大量研究表明,溶解氧是沉积物磷释放的关键控制因素,沉积物磷在厌氧条件下易于释放,而好氧条件可抑制沉积物磷的释放.溶解氧对于沉积物内源磷释放的控制主要是通过影响沉积物中的铁锰氧化物、硫的氧化还原以及微生物的新陈代谢来实现[6].好氧条件下,铁锰以氧化物或氢氧化物形式存在,具有较强的磷酸盐吸附能力,可有效阻止沉积物磷向上覆水体释放.厌氧条件下,铁锰氧化物被还原,磷酸盐解吸释放[7-12].深入揭示好氧与厌氧条件下沉积物化学组成和微观结构的差异对阐明沉积物内源磷释放机制和有效控制内源磷释放具有重要意义。
目前,对好氧与厌氧条件下沉积物化学组成的研究往往是将沉积物进行分层取样后再测量[13].这类方法破坏了沉积物内部结构,往往难以反映沉积物真实状况.近年来快速发展的微电极技术可在不破坏沉积物内部结构的前提下获取沉积物化学组成和微观结构信息[14-16],为对比研究好氧与厌氧条件下沉积物的化学组成和微观结构提供了有力手段。
红枫湖是贵州高原中部的一座典型人工深水型水库,但近年来水体富营养化趋势明显,直接威胁着区域供水和生态安全.以往研究已揭示红枫湖底泥具有极高的氮、磷营养盐负荷和内源磷释放风险[17],但对不同氧化还原条件下沉积物的化学组成和微观结构尚缺乏系统对比研究.为此,本文选取贵州红枫湖为研究对象,采用微电极技术深入开展自然、好氧和厌氧条件下沉积物的化学组成和微观结构变化的微尺度研究,以揭示沉积物内源磷释放机制,为湖泊底泥内源污染控制提供科学指导。
1 材料与方法
1.1 研究区概况
红枫湖(26°31′~26°34′N,106°24′~106°43′E)位于清镇市、平坝县和安顺市西秀区境内,是贵州省1958年开始在猫跳河干流上筑坝兴建的一座高原人工河道水库,于1960年5月建成蓄水.红枫湖流域面积1596km2,正常水位海拔1240m时湖泊水面面积57.2km2.湖泊长16km,平均宽4km,最大水深45m,平均水深10.5m,总库容6.01×108m3.红枫湖是目前贵州省中部最大的人工水库,兼具发电、防洪、旅游、工农业用水、饮用水源、水上运动、调节生态环境等多种功能,其主要入湖河流包括羊昌河、猫跳河、麻线河以及桃花源河等[18].选取大坝前深水区(水深25~30m)作为代表性研究点位(图1)。
图1 红枫湖采样点位置Fig.1 Location of sampling site in Lake Hongfeng
利用无扰动沉积物采样器[19]采集沉积物柱芯,现场利用锡箔纸包裹避光并迅速带回实验室.在实验室将沉积物柱芯分别装入自制的有机玻璃容器内,沿容器壁缓慢加入0.45μm滤膜过滤后的湖水静置培养2周,沉积物与上覆水的体积比为1∶7。
1.3 实验方法
将平衡好的沉积物柱芯放入温度为18℃的恒温培养箱(SPX-70BⅢ,TAISITE),在3种不同环境状态下(自然状态、充O2和充N2)进行恒温、避光培养,实验周期为36d,具体处理如下:(1) 对照组:在自然条件下培养,不进行任何处理;(2) 充O2组:使用空气泵连续曝气,维持 DO浓度9.0mg/L;(3) 充N2组:通入纯度为99%的N2,N2通入时间每次为1h,充气后使用凡士林进行密封处理,维持DO浓度<1mg/L。
实验结束后,利用微电极测量系统(丹麦Unisense公司)对不同培养条件下的沉积物-水界面溶解氧、H2S以及pH值进行微尺度剖面测定.O2的穿刺步进设为100μm,测量及响应时间设为16s;H2S以及pH值穿刺步进设为300 μm,测量及响应时间设为20s.测量结束后,将沉积物柱芯按照0~1、1~2、2~3cm、……进行分层取样,离心获得孔隙水,测定孔隙水中的溶解态活性磷(SRP)浓度以及沉积物中磷的赋存形态.孔隙水SRP浓度采用钼锑抗分光光度法(GB 11893-1989)测定,沉积物磷赋存形态采用Hupffer等发展建立的化学连续提取法进行测定(表1)[20]。

表1 沉积物磷赋存形态的化学连续提取方法[20]
1.4 沉积物-水界面O2扩散通量计算
利用Fick第一定律对不同氧化还原状态下的氧气扩散通量进行计算[21]:
(1)
式中,J为物质的扩散通量(nmol/(m2·s));D为扩散系数(m2/s);括号内部表示物质的浓度梯度;负号表示浓度梯度方向与扩散通量方向相反.其中Fick定律的扩散系数D代表单位浓度梯度下的扩散通量,它表示某个组分在介质中扩散的快慢,是物质的一种传递性质.液体中的扩散系数其量级为10-9m2/s,水中的扩散系数常用wilke-chang公式估算[22]:
二是加强行业管理,建立以行业自律为主的会计职业道德管理机构,对出具虚假会计信息的事务所予以重罚,直至取消其执业资格,坚决打击违规者,净化行业空气,重塑行业信用。
(2)
式中,DAB是溶质A在溶剂B中的扩散系数(m2/s);T为溶液的温度(K);μ为溶剂B的粘度(Pa·s);MB为溶剂B的摩尔质量(g/mol);φ为溶剂的缔合参数,水为2.6;VA为溶质A在正常沸点下的分子体积(cm3/mol),由正常沸点下的液体密度来计算。
2 研究结果
2.1 不同培养条件下沉积物孔隙水磷酸盐浓度变化
不同培养条件下,孔隙水中的SRP浓度表现为充N2组>对照组>充O2组(图2).充N2组孔隙水SRP浓度约为0.309mg/L,是对照组的2倍左右,而充O2组的孔隙水SRP浓度仅为0.023mg/L.显然,厌氧使得沉积物孔隙水中磷酸盐浓度明显升高,而好氧条件下沉积物孔隙水磷酸盐浓度显著降低。
2.2 不同培养条件下沉积物磷赋存形态变化
不同培养条件下,沉积物磷赋存形态变化如图3所示.充N2组和充O2组的沉积物总磷(Sum-P)含量与对照组相比均有不同程度的降低,且充N2组降低显著(降低了378.9mg/kg).这种变化主要是由NaOH提取态磷(NaOH-P)和残渣态磷(rest-P)含量降低引起的.NaOH-P是红枫湖沉积物磷最主要的赋存形态,其含量约占总磷含量的57.8%,其次是rest-P,约占22.1%,其余20.1%为NH4Cl提取态磷(NH4Cl-P)、BD提取态磷(BD-P)和HCl提取态磷(HCl-P).充N2条件下,NaOH-P含量明显减少,而孔隙水中SRP浓度有较大的升高(图2),说明NaOH-P释放进入孔隙水和上覆水.充O2条件下,沉积物总磷含量略有降低,NaOH-P含量略微降低是导致此现象的主要原因.与充N2条件不同的是,充O2条件下,沉积物孔隙水中SRP浓度(0.023mg/L)明显低于对照组(0.151mg/L)。
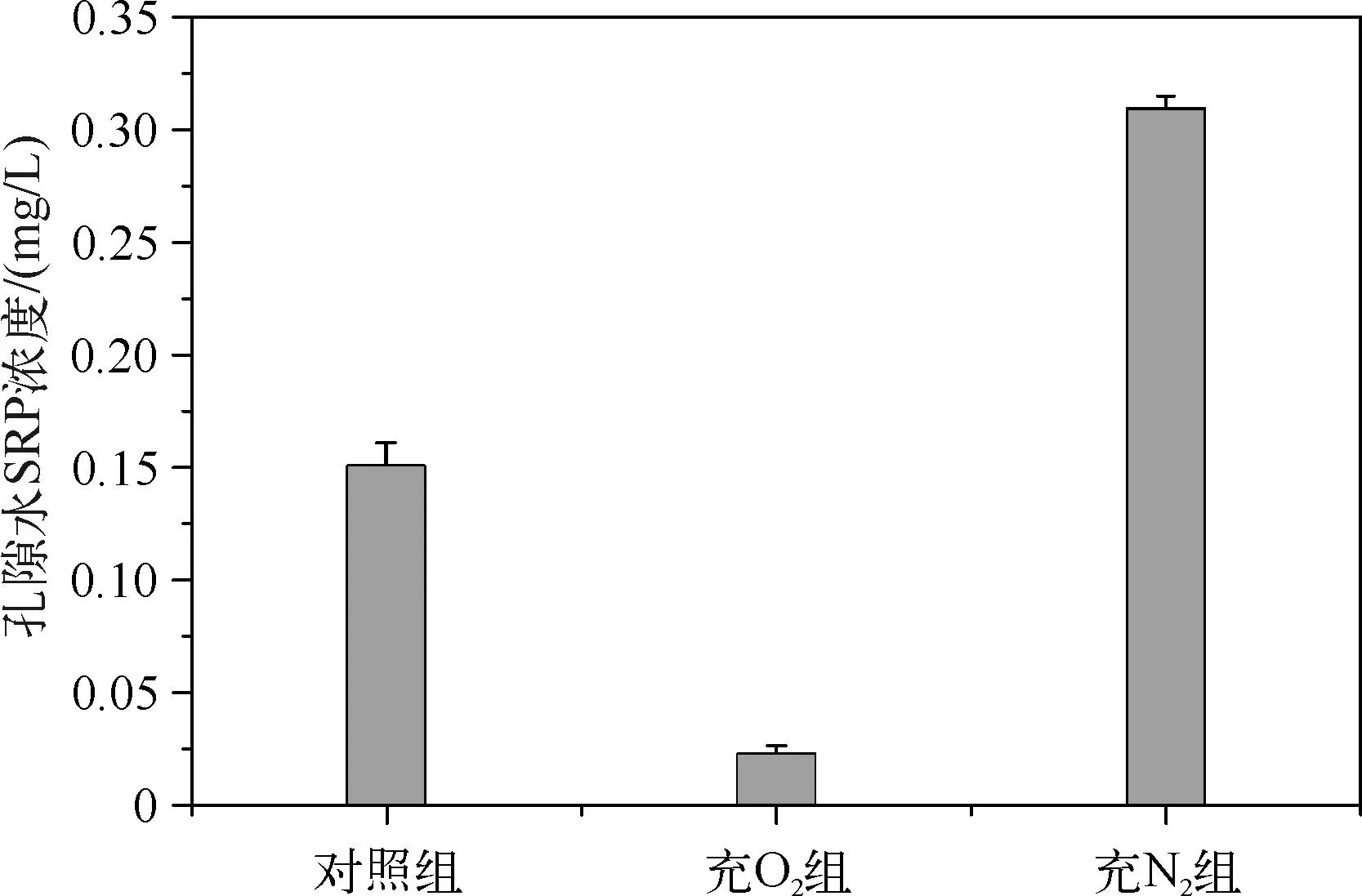
图2 不同培养条件下沉积物孔隙水中SRP浓度Fig.2 The sediment pore water SRP concentration under different cultivate conditions
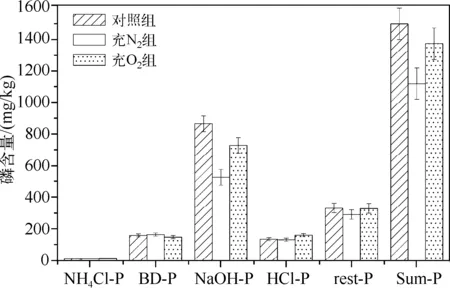
图3 不同培养条件下沉积物中各形态磷含量Fig.3 Each form of phosphorus in the sediment under different cultivate conditions
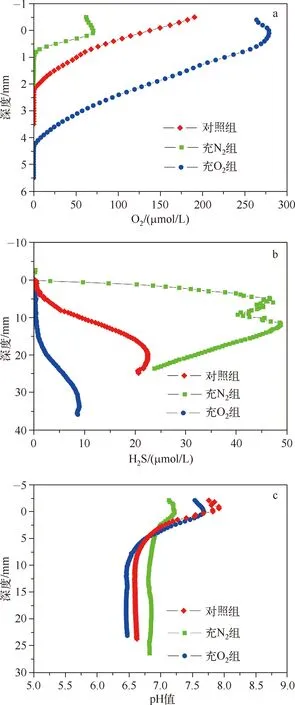
图4 不同培养条件下沉积物O2浓度、H2S浓度和pH值的剖面分布Fig.4 The profile distribution of O2 concentration,H2S concentration and pH value of sediment under different cultivate conditions
2.3 不同培养条件下沉积物O2、H2S浓度以及pH值的剖面变化
不同培养条件下O2的渗透深度与浓度均为:充O2组>对照组>充N2组.自然条件下,沉积物O2的渗透深度约为2.1mm左右,界面O2浓度为137μmol/L.充N2培养条件下,界面O2浓度为70μmol/L,O2的渗透深度降低至0.9mm左右.而充O2培养之后,O2的渗透深度变为4.2mm,约为自然状态的2倍(图4a)。
自然、充O2以及充N2条件下,沉积物内部产生的H2S浓度存在较大差别.自然条件下,H2S在沉积物约3mm处出现,随后浓度开始增加,到20.7mm处达到峰值(22.9μmol/L).充O2条件下,H2S的出现深度为15.9mm,在33.9mm处达到峰值(9.0μmol/L).充N2培养的沉积物中,H2S的变化范围最大:从沉积物表面便开始产生H2S,并且随着深度增加H2S快速增加,在6mm深度处H2S浓度达到峰值(47.3μmol/L),随后伴随深度的增加出现少许波动,至12mm处开始下降(图4b)。
不同氧化还原条件下沉积物pH值也存在明显差异.3种条件下沉积物pH值在4.2mm处发生交叉.4.2mm处的pH值为6.9;4.2mm以上沉积物pH值均大于6.9,且大小顺序为:充O2组>对照组>充N2组;而4.2mm以下pH值均小于6.9,且顺序为:充N2组>对照组>充O2组(图4c)。
3 讨论
3.1 溶解氧对沉积物NaOH-P释放的影响
已有研究表明,溶解氧主要通过影响NaOH-P而影响沉积物内源磷的释放[6].NaOH-P是受铁铝金属氧化物约束的磷,该形态磷的沉淀与溶解是决定沉积物内源磷释放与否的关键[23].韩伟明[24]在西湖沉积物磷释放实验中发现NaOH-P是沉积物释放的主要磷赋存形态.红枫湖沉积物中NaOH-P在总磷中所占比例最高,平均为57.8%.对沉积物孔隙水中SRP浓度、沉积物磷形态以及沉积物内部O2和H2S剖面分布特征的对比分析表明:经过充N2培养的沉积物与自然状态下的沉积物相比,沉积物内部O2浓度和渗透深度都有了大幅降低,与此同时,孔隙水中SRP浓度明显升高,而沉积物磷形态中NaOH-P和总磷含量明显降低,其他沉积物磷形态未发生显著变化.这反映在沉积物内部O2浓度降低的情况下,沉积物中的总磷含量降低的原因主要是NaOH-P的释放,并因此导致孔隙水中SRP浓度升高.此外,O2浓度的降低使得沉积物内部H2S浓度的剖面特征发生显著变化,从界面开始,硫酸根还原产生大量的H2S,H2S与二价铁离子产生硫化亚铁沉淀[25],铁离子的减少使得束缚NaOH-P的能力降低,NaOH-P更易被释放到孔隙水中。
充O2条件下沉积物NaOH-P含量略有降低,这可能是曝气过程对沉积物造成了一定扰动,导致沉积物磷的少量释放[26]。
3.2 溶解氧对沉积物rest-P释放的影响
从图3可知,沉积物总磷含量的降低除了主要受到NaOH-P含量降低影响之外,rest-P的降低也是部分原因.沉积物rest-P主要为有机磷[20].随着深度的增加,O2浓度逐渐降低,直至为0,深度继续增加,H2S开始出现(图4).当微生物的耗氧超过了O2在沉积物中的扩散速率时,微生物便开始利用其它氧化剂进行无氧呼吸,电子受体优先顺序依次为溶解氧、硝酸根离子、高价态铁锰、硫酸根离子[27].当电极监测到有H2S产生时,说明溶解氧、硝酸根离子以及高价态铁锰等已经被还原.在充O2条件下,好氧微生物占主导,微生物消耗大量的O2,同时pH值升高,而rest-P含量几乎没有变化,说明好氧微生物并不消耗有机磷.而在充N2条件下,厌氧微生物占主导,消耗硫酸根,产生了大量的H2S,使pH值降低,同时,rest-P含量降低,可能是厌氧微生物消耗了有机质,将有机磷转变为无机磷,进而释放到上覆水体[4].O2浓度决定好氧微生物与厌氧微生物的比例,因而影响有机磷的迁移转化。
3.3 不同条件下沉积物O2的扩散通量
沉积物与上覆水之间的相互作用已经引起广泛关注[28-29],了解不同条件下氧气的分布,可以估算出氧气的扩散通量,进而可以对扩散边界层中的微生物分布和营养物质的迁移转化进行定量研究.自然状态下红枫湖沉积物O2的扩散通量为235.6nmol/(m2·s)(20.4mmol/(m2·d)),这与汪嘉宁等在青岛会场湾所测得的O2的扩散通量(15.4~53.6mmol/(m2·d))接近[30],而充N2状态下,沉积物O2扩散通量仅为29.4nmol/(m2·s)(2.5mmol/(m2·d)),略低于王敬富等在红枫湖大坝自然缺氧状态下测出来的O2扩散通量(7.65mmol/(m2·d))[31],这可能是由于人工制造的厌氧程度本身就要高于自然界的厌氧程度.自然状态下沉积物O2的扩散通量为充N2条件下的近8倍,而充O2条件下沉积物O2扩散通量远远高于充N2条件.在沉积物-水界面处,充O2条件下微生物的耗氧活动和有机物的降解要比充N2条件下更加剧烈,但好氧环境下微生物活动对磷的吸收使得有机磷并未明显释放,而厌氧环境下微生物活动则显著促进了磷的释放[32].这表明好氧微生物和厌氧微生物对沉积物有机磷的影响存在重要差别。
红枫湖溶解氧的渗透深度为充O2组>对照组>充N2组.龚春生等[33]对不同溶解氧水平下的底泥研究发现,沉积物间隙水中的好氧层会随上覆水溶解氧浓度的增大而增厚,好氧层的增厚会加大沉积物与上覆水之间的物质传输阻力.充O2状态与充N2状态相比,其沉积物具有更厚的好氧层,因而抑制了内源磷的释放.Vopel等[34]发现即使没有光或者光很弱,沉积物表面的微生物垫也能产生氧气,因此在自然、充O2或者充N2状态下,氧气剖面均出现典型的界面放氧现象.虽然整个实验过程是在避光环境下开展的,但由于实验过程需要每天充气,因此实验室并不能保持始终黑暗,微生物垫表层应该也产生了一定量的O2.在自然、充O2或者充N2状态下,沉积物-水界面都存在上覆水复氧与微生物垫产氧,但三者溶解氧的走势存在明显差异:在自然状态下均匀下降,而充O2和充N2状态下,溶解氧在刚接触沉积物-水界面时呈升高的趋势,而后才逐渐降低。
4 结论
1) 厌氧条件下红枫湖沉积物TP含量显著降低,且主要是NaOH-P和rest-P含量降低所致,厌氧条件下沉积物孔隙水中磷酸盐浓度明显升高,而好氧条件下沉积物孔隙水磷酸盐浓度显著降低,表明厌氧条件显著促进了红枫湖沉积物磷释放。
2) 厌氧条件下沉积物含氧量下降、硫还原活动强烈是导致NaOH-P释放的主要原因.微电极分析结果表明,与对照组相比,厌氧条件下界面O2浓度降低至70μmol/L(对照组为137μmol/L),氧渗透深度降低为0.9mm(对照组为2.1mm),H2S浓度升高至47.3μmol/L(对照组为22.9μmol/L).O2浓度的降低加速了沉积物磷酸盐的还原作用并产生大量H2S,进而与二价铁离子形成硫化亚铁沉淀,最终导致NaOH-P(Fe-P)释放到孔隙水中。
3) 好氧向厌氧条件的转换可通过改变沉积物内部pH值分布和微生物活动,促使rest-P(有机磷)减少.微电极分析结果表明,好氧条件下,rest-P含量几乎没有变化,而厌氧条件下,厌氧微生物不仅可以消耗硫酸根产生H2S,导致pH值降低,还可消耗有机质,将有机磷转变为无机磷.O2浓度决定了好氧微生物与厌氧微生物的比例,因而影响了有机磷的迁移转化。
4) 沉积物-水界面氧化还原环境可影响沉积物氧渗透深度、pH值分布、微生物活动、硫循环以及有机质降解过程,进而控制沉积物磷的形态转化与释放。
5) 联合应用微电极技术和沉积物磷形态分析对湖泊沉积物-水界面开展微尺度观测研究是揭示沉积物内源磷释放机制与控制因素的有效途径,但前者分辨率为mm-μm级尺度,而后者分辨率为cm级尺度,如何进行更有效的衔接和对比研究值得今后继续探索。
参考文献5
[1]秦伯强, 高光, 朱广伟等. 湖泊富营养化及其生态系统响应. 科学通报, 2013, 58: 855-864。
[2]Rydin E. Potentially mobile phosphorus in Lake Erken sediment.WaterResearch, 2000, 34: 2037-2042。
[3]金相灿, 王圣瑞, 庞燕. 太湖沉积物磷形态及pH值对磷释放的影响. 中国环境科学, 2004, 24(6): 707-711。
[4]侯立军, 刘敏, 许世远. 环境因素对苏州河市区段底泥内源磷释放的影响. 上海环境科学, 2003, 22(4): 258-260。
[5] Røy H, Huettel M, Jørgensen BB. Transmission of oxygen concentration fluctuation through the diffusive boundary layer overlying aquatic sediments.LimnologyandOceanography, 2004, 49(3): 686-692。
[6]步青云. 浅水湖泊溶解氧变化对沉积物磷、氮的影响[学位论文]. 北京: 中国环境科学研究院, 2006。
[7]Kisand A, Noges P. Sediment phosphorus release in phytoplankton dominated versus macrophyte dominated shallow lakes: Importance of oxygen conditions.Hydrobiologia, 2003, 506/507/508/509(1/2/3): 129-133。
[8]Hupfer M, Lewandowski J. Oxygen controls the phosphorus release from lake sediments—a long lasting paradigm in limnology.InternationalReviewofHydrobiology, 2008, 93(4/5): 415-432。
[9]韩沙沙, 温琰茂. 富营养化水体沉积物中磷的释放及其影响因素. 生态学杂志, 2004, 23(2): 98-101。
[10]林艳, 刘亚丽, 段秀举. 双龙湖底泥磷释放强度影响因素正交试验研究. 资源环境与工程, 2006, 20(1): 78-88。
[11] Span D, Arbouille D, Howa Hetal. Variation of nutrient stocks in the superficial sediments of the Lake Geneva from 1978 to 1988.Hydrobiologia, 1990, 207: 161-166。
[12] Baudo R, Giesy JP, Muntau H. Sediments: Chemistry and toxicity of in-place pollutants. Michigna: Lewis Publishers, 1990: 131-144。
[13]刘素美, 张经. 沉积物间隙水的几种制备方法. 海洋环境科学, 1999, 18(2): 66-71。
[14]许昆明, 胡融刚. 微电极技术在沉积物化学原位测量中的应用. 地球科学进展, 2006, 21(8): 863-869。
[15] Beyenal H, Babauta J. Microsensors and microscale gradients in biofilms.AdvancesinBiochemicalEngineering/Biotechnology, 2013, 146: 235-256。
[16]王建军, 沈洁, 张路等. 湖泊沉积物-水界面氧气交换速率的测定及影响因素. 湖泊科学, 2009, 21(4): 474-482. DOI 10. 18307/2009. 0404。
[17]王敬富, 陈敬安, 曾艳等. 贵州红枫湖沉积物磷赋存形态的空间变化特征. 湖泊科学, 2012, 24(5): 789-796. DOI 10. 18307/2012. 0521。
[18]Chen JA, Zhang W, Zhang RYetal. Time and spatial distribution characteristics of nitrogen and phosphorus in the sediment of Lake Hongfeng. 13th World Lake Conference, 2009: 2226-2230。
[19]李键, 张维, 陈敬安等. 一种可实现不同水深条件下采样的湖泊沉积物柱芯采样装置. 地球与环境, 2011, 39(1): 121-124。
[20]Hupffer M, Gfichter R, Giovano Retal. Transformation of phosphorus species in settling seston and during early sediement diagenesis.AquaticSciences, 1995, 57(4): 305-324。
[21]Crank J. The mathematics of diffusion. Landon: Oxford University Press, 1975。
[22]Sandler SI. The 100most cited articles in AIChE Journal history.AIChEJournal, 2004, 50(1): 4-6。
[23]Ruban V, López-Sánchez JF, Pardo Petal. Selection and evaluation of sequential extraction procedures for the determination of phosphorus forms in lake sediment.JournalofEnvironmentalMonitoring, 1999, 1: 51-56。
[24]韩伟明. 底泥释磷及其对杭州西湖富营养化的影响. 湖泊科学, 1993, 5(1): 71-77. DOI 10. 18307/1993. 0110。
[25]万国江, 陈振楼, 万曦等. 湖泊沉积物-水界面铁-锰循环研究新进展. 地质地球化学, 1996, (2): 5-8。
[26]孙慧卿, 王平, 江和龙. 不同模拟条件下太湖沉积物-水界面磷行为的研究. 环境科学与技术, 2012, 35(5): 141-146。
[27]许昆明, 司靖宇. 适用于海洋沉积物间隙水中氧、锰Ⅱ、铁Ⅱ、硫分析的金汞齐微电极. 分析化学研究报告, 2007, 35(8): 1147-1150。
[28]吴丰昌, 万国江, 蔡玉蓉. 沉积物-水界面的生物地球化学作用. 地球科学进展, 1996, 11(2): 191-1971。
[29]Dade WB, Hogg AJ, Boudreau BP. Physics of flow above the sediment-water interface. In: Boudreau BP, Jorgensen BB eds. The benthic boundary layer: Transport processes and biogeochemistry. Oxford: Oxford University Press, 2001: 4-43。
[30]汪嘉宁, 赵亮, 魏皓. 潮滩动力过程影响下扩散边界层和沉积物-水界面扩散通量的变化. 科学通报, 2012, 57(8): 656-665。
[31]王敬富, 陈敬安, 曾艳等. 微电极测量系统在湖泊沉积物-水界面生物地球化学过程研究中的应用. 地球与环境, 2013, 41(1): 65-70。
[32]孙晓杭, 张昱, 张斌亮等. 微生物作用对太湖沉积物磷释放影响的模拟实验研究. 环境化学, 2006, 25(1): 24-27。
[33]龚春生, 范成新. 不同溶解氧水平下湖泊底泥-水界面磷交换影响因素分析. 湖泊科学, 2010, 22(3): 430-436. DOI 10. 18307/2010. 0317。
[34]Vopel K, Hawes I. Photosynthetic performance of benthic microbial mats in Lake Hoare, Antarctica.LimnologyandOceanography, 2006, 51(4): 1801-1812。
J.LakeSci.(湖泊科学), 2016, 28(1): 68-74
©2016 byJournalofLakeSciences
The micro-scale investigation on the effect of redox condition on the release of the sediment phosphorus in Lake Hongfeng
XU Yang1, CHEN Jing’an2**, WANG Jingfu2& LUO Jing1
(1:CollegeofResourcesandEnvironmentalEngineering,GuizhouUniversity,Guiyang550025,P.R.China)
(2:StateKeyLaboratoryofEnvironmentalGeochemistry,InstituteofGeochemistry,ChineseAcademyofSciences,Guiyang550002,P.R.China)
Abstract:In this paper, Lake Hongfeng, located in Guizhou Province, was chosen to study the release process of the sediment phosphorus under the natural, aerobic and anaerobic conditions. Microscale observation of the physical and chemical properties of sediment-water interface by microelectrode technology was used, together with traditional P-speciation analysis, to explore the P-releasing mechanisms. The results showed that under anaerobic conditions, the total content of phosphorus in the sediment in Lake Hongfeng decreased significantly, which was mainly caused by the reduction of NaOH-P and rest-P, indicating that the aerobic condition promoted the phosphorus release from sediments. The concentration of phosphate in the pore water of sediment increased greatly under anaerobic condition, and the trend was contrary to that under aerobic condition. Under the anaerobic condition, concentration of dissolved oxygen decreased and sulfate reduction was enhanced, which released NaOH-P from the sediment. Decrease of O2accelerated the sediment reducing processes and produced a large amount of H2S, which combined with ferrous icon to form the precipitation-ferrous sulfide, resulting in release of NaOH-P(Fe-P)into the pore water. The conversion of aerobic to anaerobic condition could promote the release of rest-P by changing the distribution of pH value in the sediment as well as microbial activities. Under the anaerobic condition, anaerobic microorganisms could not only contribute to the sulfate reduction and H2S production, leading to pH decrease, but also consume organic matter and convert organic phosphorus into inorganic phosphorus. The redox environment of sediment-water interface could affect the penetration depth of sediment-oxygen, pH distribution, microbial activity, sulfur cycle as well as organic matter degradation process, which controlled the speciation transformation and release of sediment phosphorus. Microelectrode technology, together with traditional P-speciation analysis, is an effective way to reveal the release mechanisms of sediment phosphorus as well as the control factors。
Keywords:Redox environment;microelectrode;microscale;sediment phosphorus;Lake Hongfeng
通信作者徐洋1,陈敬安2*; E-mail: chenjingan@vip.skleg.cn.,王敬富2,罗婧1
基金项目收修改稿.徐洋(1988~),男,硕士研究生;E-mail: 1061279190@qq.com。
DOI10.18307/2016.0108
