靶向PD-L1基因的CRISPR/Cas9基因敲除质粒的构建*
2016-02-23孙冉冉陈晓龙李晶晶阚全程余祖江
孙冉冉,陈晓龙,李 娟,申 申,李晶晶,阚全程,余祖江#
1)郑州大学第一附属医院感染科 郑州 450052 2)郑州大学第一附属医院药学部 郑州 450052
靶向PD-L1基因的CRISPR/Cas9基因敲除质粒的构建*
孙冉冉1),陈晓龙1),李娟1),申申1),李晶晶1),阚全程2),余祖江1)#
1)郑州大学第一附属医院感染科 郑州 4500522)郑州大学第一附属医院药学部 郑州 450052
关键词PD-L1;肿瘤免疫;CRISPR/Cas9;基因敲除
摘要目的:构建靶向PD-L1基因的CRISPR/Cas9基因敲除质粒。方法:根据CRISPR/Cas9靶点设计原则,设计并合成靶向PD-L1基因的5对sgRNA序列。为了进一步降低克隆背景和提高构建阳性率,在受体载体中引入毒性蛋白系统(Ccd)。构建pX459-CcdB重组载体,将pX459-CcdB载体进行BbsⅠ酶切,将sgRNA插入到pX459-CcdB骨架载体中,转化到不含CcdA基因的宿主菌Stbl3中。酶切不完全引起的背景载体将因毒性蛋白的作用杀死宿主菌。转化后挑取阳性克隆,进行PCR和测序验证。结果与结论:经PCR和测序验证,重组质粒pX459-PD-L1-sgRNA构建成功,为下一步体内外敲除PD-L1基因和深入研究其在肿瘤免疫逃逸中的功能奠定了基础。
AbstractAim: To construct CRISPR/Cas9 gene knock-out plasmid targeting PD-L1 gene.Methods: According to the principle of CRISPR/Cas9 sgRNA design,five sgRNA sequences targeting PD-L1 gene were selected. To reduce the undesirable cloning background and increase the positive rate,the control of cell division or death system(Ccd) was introduced to the receptor vector.Firstly the CcdB gene was cloned into the pX459 plasmid to obtain the pX459-CcdB recombinant vector,which was then digested by BbsⅠ.Afterwards,the sgRNA was inserted into the pX459-CcdB and transformed into Stbl3 without CcdA gene,then the undesirable cloning background caused by incomplete digestion would kill host bacteria via the action of toxic proteins.Finally,the single clone was picked up and identified with PCR and senquncing.Results and Conclusion: pX459-PD-L1-sgRNA has been successfully constructed and confirmed by PCR and sequencing.It will be helpful for knocking PD-L1 gene in vitro and vivo and further exploring the role of PD-L1 in tumor immune escape.
近年来研究[1]表明,介导协同刺激信号的协同刺激分子构成了肿瘤微环境的重要成分,已成为免疫学研究新的热点之一,其中的重要成员程序性死亡分子1配体-1(programmed death-1 ligand-1,PD-L1 )和其受体PD-1组成了重要的免疫检查点通路之一。研究[2-4]发现PD-L1在肿瘤的免疫逃逸过程中发挥了重要作用,几乎所有的实体肿瘤例如肝癌、乳腺癌、肾癌、膀胱癌、胃癌、卵巢癌、黑色素瘤等人类恶性肿瘤组织中均可以检测到PD-L1的表达,其可通过抑制肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)的活化并诱导其凋亡而抑制机体的抗肿瘤免疫,导致肿瘤免疫逃逸的发生。因此,阻断PD-1/PD-L1通路成为肿瘤免疫治疗的新途径。近年来靶向PD-1/PD-L1的单克隆抗体药物的研发已经成为各大药物研发公司的重点突破对象,并且在黑色素瘤和非小细胞肺癌患者的临床试验中已经取得了突破性的进展[5]。
CRISPR/Cas9技术是一种可以对人类基因组进行高效、精确地定点修饰的新基因工程技术。CRISPR/Cas9系统通过靶标序列对应的RNA序列与外源DNA互补,引导Cas9内切酶对互补的靶序列进行双链切割,从而对基因进行修饰;其具有技术简单、价格低廉、操作快捷的特点;同时Cas9结构功能域的功能改造使得CRISPR/Cas9技术在基因编辑领域的应用日渐广泛[6-7]。
因此,作者构建了靶向PD-L1基因的CRISPR/Cas9基因敲除质粒。在质粒构建过程中,为了进一步降低克隆背景和提高构建阳性率,在受体载体中引入毒性蛋白系统(control of cell division or death system,Ccd)进行筛选。该质粒可以在肿瘤细胞和动物模型中敲除PD-L1基因,为进一步研究PD-L1基因在肿瘤发生、发展中的作用奠定基础。
1材料与方法
1.1主要试剂和菌株感受态大肠杆菌Stbl3、感受态大肠杆菌DB3.1购自上海士锋生物技术公司;CRISPR/Cas9质粒骨架pX459购自美国Addgene公司;Gateway cloning system购自美国Invitrogen公司;T4 DNA连接酶、FastAP 去磷酸化酶购自美国Fermentas公司;限制性内切酶BbsⅠ、T4 PNK激酶购自美国NEB公司;DNA marker购自TaKaRa公司;质粒提取试剂盒、胶回收试剂盒、DNA纯化试剂盒购自美国Omega Bio-Tek公司;其余化学试剂购自上海生工生物工程有限公司。
1.2靶向PD-L1基因的gRNA的设计和选择根据CRISPR/Cas9靶点设计原则,利用gRNA在线设计工具(http://crispr.mit.edu)筛选并进行脱靶效应评估,从中挑选出特性强的gRNA。gRNA设计的主要原则如下:3’端有NGG碱基序列的20个连续的碱基序列,其中PAM序列不在20个连续的碱基序列范围之内;必须在外显子区域,尽量选择靠前的外显子,造成移码突变的概率较大;利用生物信息学软件进行全基因组比对,避免脱靶风险大的靶点序列,同时考虑到gRNA的效率和由于染色体和核小体的三维结构可能造成的空间位阻效应导致的Cas9无法结合的情况。同时选择以下5个序列作为构建靶向PD-L1基因的靶点序列(图1),通过体外实验,从中筛选出效率较高的gRNA,以增加成功率和增强敲除效率。
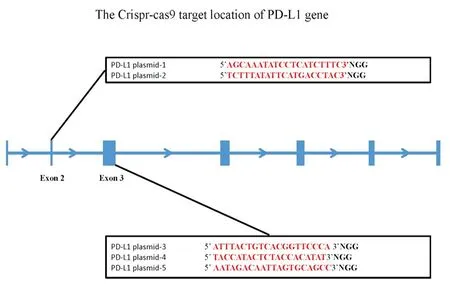
图1 靶向PD-L1基因靶点位置示意图
1.3引物合成根据实验要求设计用于构建pX459-CcdB和靶向PD-L1基因的sgRNA(PD-L1-sgRNA)引物 (表1),引物由上海生工生物工程有限公司合成。

表1 引物序列
1.4质粒pX459-CcdB的构建
1.4.1构建过程整个质粒构建过程见图2。
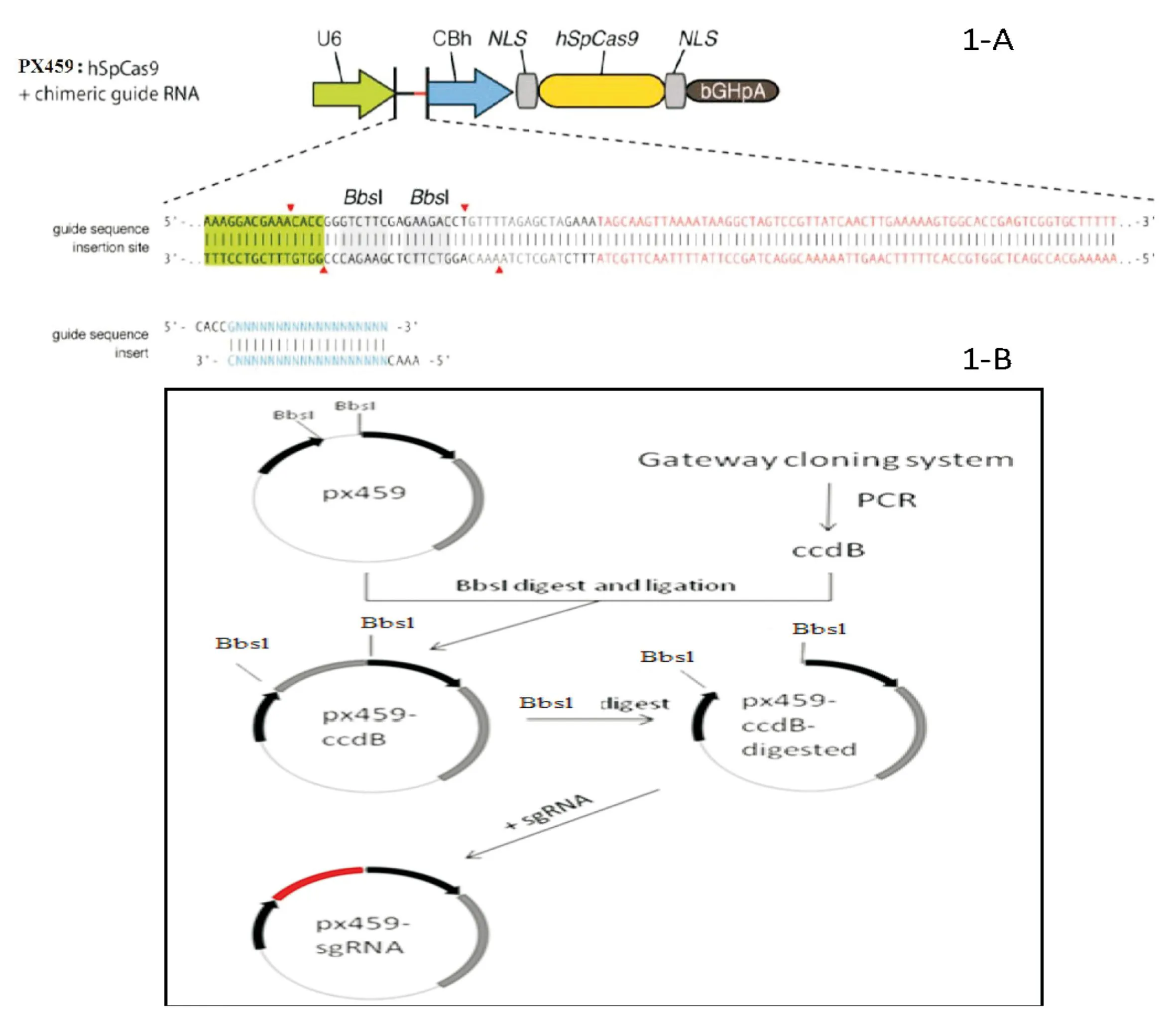
图2 载体pX459-CcdB构建过程示意图
1.4.2CcdB基因的扩增根据设计合成的引物,从gateway系统中扩增CcdB基因并引入BbsⅠ酶切位点。PCR体系包括PCR buffer 4 μL、dNTPs 2 μL、gateway vector 2 PCR 0.2 μL、5 u/μL的 Go Taq Polymerase 0.1 μL、CcdB上下游引物各2 μL,双蒸水定容至20 μL。反应条件为95 ℃30 s,55 ℃30 s,72 ℃120 s,30个循环。PCR产物经10 g/L琼脂糖凝胶电泳,按照胶回收试剂盒操作说明对目的片段进行胶回收。取1 μL回收产物、1 μLBbsⅠ酶、5 μL NEB3.1 buffer用ddH2O定容至50 μL,建立酶切体系,于37 ℃水浴锅中酶切1 h。酶切产物按DNA纯化试剂盒操作说明进行过柱回收。
1.4.3目的片段与载体片段的连接参照1.4.2中的酶切体系将pX459进行BbsⅠ酶切和胶回收,用T4 DNA连接酶将回收的载体片段与CcdB基因PCR产物进行连接。目的片段与载体片段物质的量之比为3~10。连接体系:CcdB 产物50 ng,pX459载体100 ng,T4 buffer 2 μL,T4 DNA连接酶1 μL,用ddH2O定容至20 μL。于16 ℃水浴连接过夜。
1.4.4pX459-CcdB的验证连接产物转化DB3.1感受态细胞,LB培养基37 ℃培养过夜。第2天,从LB平板上挑选出生长状况良好的单菌落置于5 mL含有所需抗性(Amp+Chl+)的LB培养液中,37 ℃ 250 r/min 培养过夜。第3天进行菌液PCR验证,若符合预期,则取100 μL菌液送上海生工生物工程有限公司测序。若测序正确,则按质粒提取试剂盒说明书操作,提取质粒pX459-CcdB。
1.5载体pX459-PD-L1-sgRNA的构建用内切酶BbsⅠ酶切pX459-CcdB,胶回收骨架大片段,去除CcdB片段,测定浓度待用。反应体系:5对sgRNA上下游引物(用双蒸水稀释)各2 μL,10×T4 buffer 5 μL,T4 PNK 1 μL,ddH2O定容至50 μL。首先37 ℃反应30 min进行激酶处理,随后置于沸水浴中3 min,待冷却至室温后,将sgRNA退火产物与骨架大片段用T4 DNA连接酶进行连接,连接体系参考1.4.3,于16 ℃水浴连接过夜。连接产物用Stbl3感受态细胞转化,LB培养基37 ℃培养过夜。第2天,从LB平板上挑选生长状况良好的单菌落置于5 mL含有所需抗性(Amp+)的LB培养液中,37 ℃ 250 r/min培养过夜。第3天用菌液PCR法筛选克隆,若利用U6启动子通用上游引物及sgRNA下游引物在筛选的阳性菌液中扩增到与目的基因片段大小一致的阳性条带,则为阳性。取阳性菌液送上海生工生物工程有限公司进行测序。
2结果
2.1pX459-CcdB的酶切鉴定PCR结果见图3。
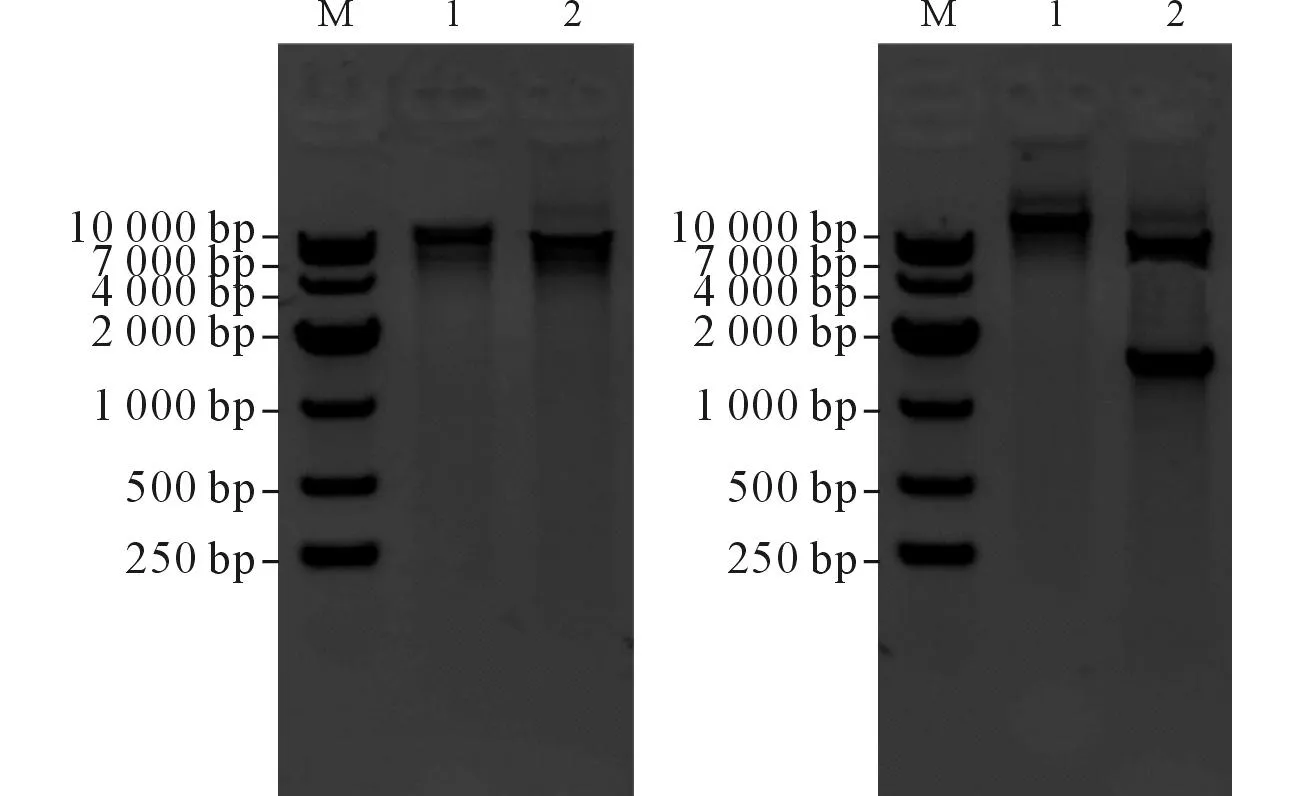
M:Marker;左1:pX459;左2:经BbsⅠ酶切的pX459;右1:pX459-CcdB;右2:经BbsⅠ酶切的pX459-CcdB。图3 pX459(左)及pX459-CcdB(右)酶切结果
2.2pX459-PD-L1-sgRNA的PCR鉴定经PCR扩增,10 g/L琼脂糖凝胶电泳鉴定正确,结果见图4。
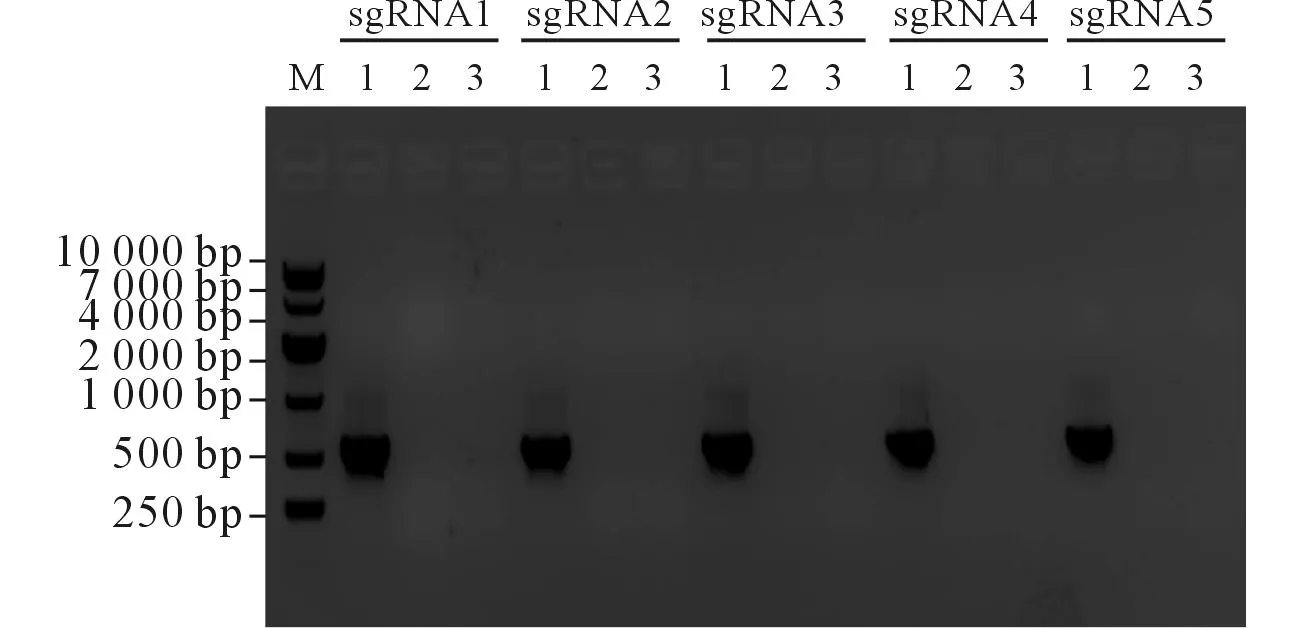
M:Marker;1:用U6和PD-L1-sgRNA下游引物扩增;2:只用U6引物扩增;3:只用PD-L1-sgRNA下游引物扩增。图4 pX459-PD-L1-sgRNA PCR鉴定结果
2.3pX459-PD-L1-sgRNA的测序测序比对结果见图5。图5说明,重组载体中插入的序列与sgRNA序列一致,载体构建成功。
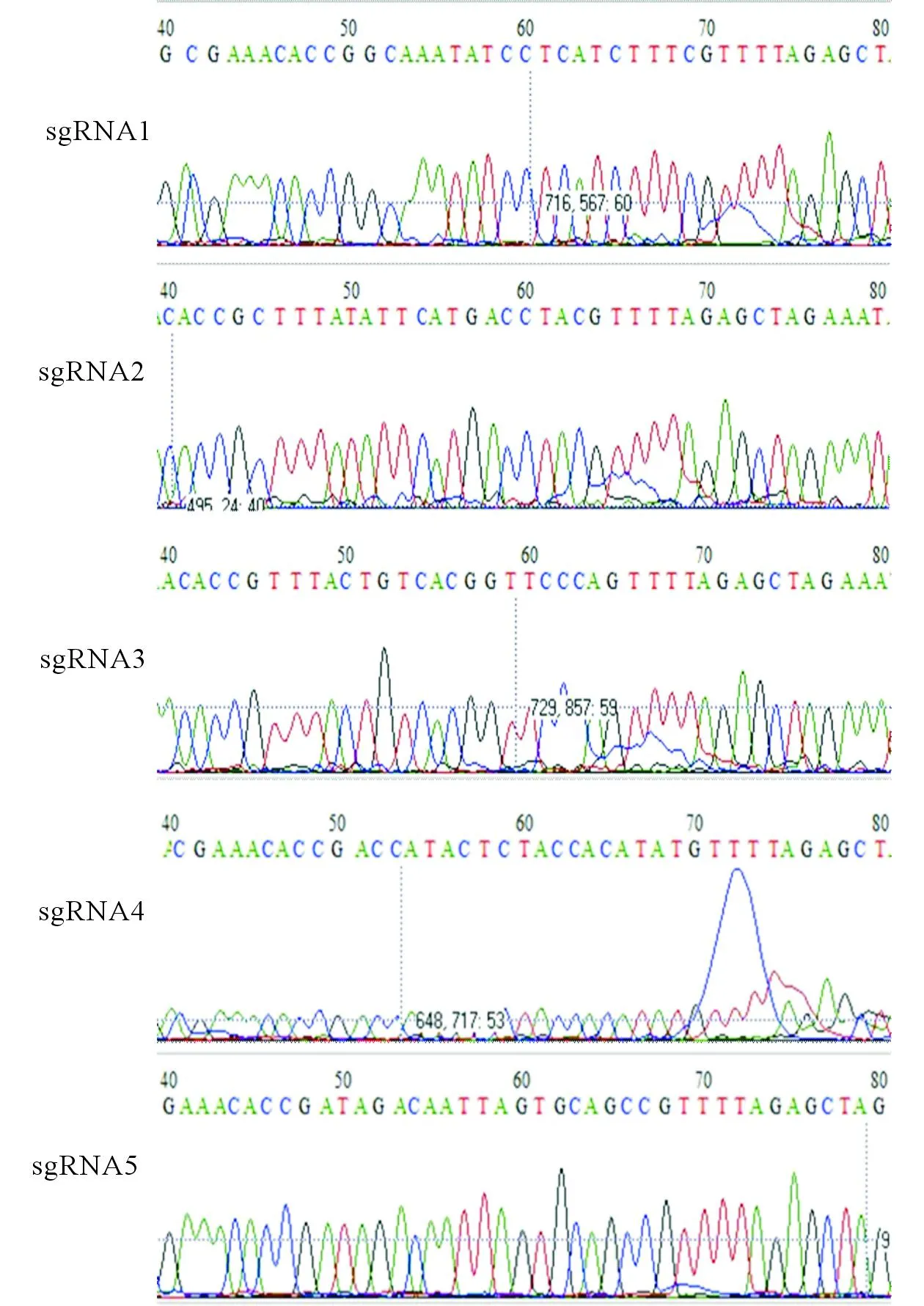
图5 pX459-PD-L1-sgRNA测序鉴定结果
3讨论
肿瘤的发生、发展不仅仅取决于肿瘤细胞本身的特性,而且还取决于肿瘤细胞赖以生存的土壤,即肿瘤微环境[8]。肿瘤细胞周围的免疫微环境(包括免疫细胞和免疫因子)参与了肿瘤的进展过程,与肿瘤的发生、发展和预后密切相关,其中介导协同刺激信号的协同刺激分子构成了肿瘤微环境的重要成分,而近年来研究[9]表明负性协同刺激分子的重要成员PD-L1/PD-1免疫检查点通路在肿瘤的发生、发展和免疫逃逸机制中发挥了重要作用,有望成为新的治疗靶点。
CRISPR系统最早发现于细菌和古生菌中,该系统由成簇间隔的短回文重复序列(clustered regularly interspaced short palindrome repeat sequences)和Cas基因(CRISPR-associated genes)组成,被认为是细菌的适应性免疫系统[10]。2013年研究者将CRISPR/Cas系统进行改造并成功应用到真核生物的基因编辑,利用人工合成的crRNA序列可以使Cas9 系统识别并结合到与该crRNA互补的DNA 序列上,介导Cas9 蛋白特异性切割该靶位点。Cas9 蛋白带有核定位信号(nuclear localization signal,NLS),使其能够与sgRNA结合并组装成sgRNA-Cas9 复合体,在目标基因PAM(proto spacer adjacent motif)元件的上游使DNA双链断裂;DNA发生双链断裂后,细胞利用自身的易错倾向的非同源末端连接(non-homologous end joining, NHEJ)修复,同源修复的过程中会在断裂位点发生插入或缺失,继而发生移码突变,最终实现对目标基因组的改造[7]。该系统可对任何靶位点后紧随的NGG(PAM)的17~20 bp序列进行定点编辑。由于人类基因组中存在丰富的NGG序列,因此利用该系统几乎可以对人类基因的任何位置进行编辑[11]。同现有的基因编辑工具锌指核酸酶(ZFNs)和TALE核酸酶(TALENs)相比,CRISPR/Cas 系统载体构建简单,只需设计并改造载体上目的基因的sgRNA序列即可[12]。传统的siRNA和shRNA基因沉默技术都是RNA干扰技术,其结构是与内源性mRNA编码区同源的双链RNA,其通过阻碍特定基因的翻译或转录来抑制基因表达,当细胞中导入siRNA或shRNA时,靶向mRNA发生降解,继而导致基因沉默[13]。siRNA只是对靶基因进行一过性的沉默,随着siRNA的降解,基因沉默作用也随之消失;而shRNA虽然能够通过整合到目标基因组中,从而对靶基因进行持续的抑制,但是其载体必须是病毒载体,构建费用较高,同时病毒整合对目标细胞会造成一定的影响[14]。而CRISPR/Cas9是从基因水平将靶基因彻底、永久地敲除,因此更具优势。这些明显的优势使该技术为人类医学、动物研究以及植物的改良育种等各方面的研究提供了高效武器,极有希望用于人体的基因治疗[15-16]。
该实验中,作者首先设计出可使目标DNA双链发生断裂的sgRNA-Cas9体系,利用Addgene公司提供的pX459质粒骨架系统,将设计好的、能够结合靶基因的sgRNA序列经过酶切后连入该载体中。在载体构建过程中,为了进一步降低克隆背景和提高构建阳性率,在受体载体中引入Ccd进行筛选。最后,作者成功构建了靶向PD-L1基因的CRISPR/Cas9基因敲除质粒,为下一步体内外水平敲除PD-L1基因、进一步研究其在肿瘤进展过程中的作用打下了良好的基础。
参考文献
[1]IWAI Y,ISHIDA M,TANAKA Y,et al.Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade[J].Proc Natl Acad Sci U S A,2002,99(19):12293
[2]DONG H,STROME SE,SALOMAO DR,et al.Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion[J].Nat Med,2002,8(8):793
[3]THOMPSON RH,KUNTZ SM,LEIBOVICH BC,et al.Tumor B7-H1 is associated with poor prognosis in renal cell carcinoma patients with long-term follow-up[J].Cancer Res,2006,66(7):3381
[4]GAO Q,WANG XY,QIU SJ,et al.Overexpression of PD-L1 significantly associates with tumor aggressiveness and postoperative recurrence in human hepatocellular carcinoma[J].Clin Cancer Res,2009,15(3):971
[5]OHAEGBULAM KC,ASSAL A,LAZAR-MOLNAR E,et al.Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway[J].Trends Mol Med,2015,21(1):24
[6]COX DB,PLATT RJ,ZHANG F.Therapeutic genome editing: prospects and challenges[J].Nat Med,2015,21(2):121
[7]CONG L,RAN FA,COX D,et al.Multiplex genome engineering using CRISPR/Cas systems[J].Science,2013,339(6121):819
[8]HANAHAN D,WEINBERG RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646
[9]RIBAS A,TUMEH PC.The future of cancer therapy:selecting patients likely to respond to PD1/L1 blockade[J].Clin Cancer Res,2014,20(19):4982
[10]BARRANGOU R,FREMAUX C,DEVEAU H,et al.CRISPR provides acquired resistance against viruses in prokaryotes[J].Science,2007,315(5819):1709
[11]WANG HY,YANG H,SHIVALILA CS,et al.One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering[J].Cell,2013,153(4):910
[12]GUIMOND S,CHATARD A,MARTINOT D,et al.Social comparison,self-stereotyping,and gender differences in self-construals[J].J Pers Soc Psychol,2006,90(2):221
[13]PENNISI E.The CRISPR craze[J].Science,2013,341(6148):833
[14]LU XJ,XUE HY,KE ZP,et al.CRISPR-Cas9:a new and promising player in gene therapy[J].J Med Genet,2015,52(5):289
[15]HAUSSECKER D,KAY MA.RNA interference:drugging RNAi[J].Science,2015,347(6226):1069
[16]RAO DD,VORHIES JS,SENZER N,et al.siRNA vs.shRNA:similarities and differences[J].Adv Drug Deliv Rev,2009,61(9):746
Construction of CRISPR/Cas9 gene knock-out plasmid targeting PD-L1 gene
SUNRanran1),CHENXiaolong1),LIJuan1),SHENShen1),LIJingjing1),KANQuancheng2),YUZujiang1)
1)DepartmentofInfectionDisease,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou4500522)DepartmentofPharmacology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
Key wordsPD-L1;tumor immunity;CRISPR/Cas9;gene knock-out
中图分类号Q781
通信作者#,男,1971年5月生,教授,研究方向:重症肝炎和肝癌的综合治疗,E-mail:johnyuem@zzu.edu.cn
基金项目*河南省科技厅创新人才124100510010;郑州大学第一附属医院青年 (2013年)
doi:10.13705/j.issn.1671-6825.2016.01.006
