调强放疗联合替莫唑胺治疗高级别脑胶质瘤的长期疗效分析*
2016-02-23吴伟莉龙金华李媛媛罗秀玲龚修云
唐 红, 吴伟莉,△, 金 风,, 龙金华,, 李媛媛,,罗秀玲,, 龚修云,周 亚, 张 芒
(1.贵州医科大学, 贵阳 550001; 2.贵州省肿瘤医院头颈肿瘤科, 贵阳 550001)
调强放疗联合替莫唑胺治疗高级别脑胶质瘤的长期疗效分析*
唐 红1, 吴伟莉1,2△, 金 风1,2, 龙金华1,2, 李媛媛1,2,罗秀玲1,2, 龚修云2,周 亚1, 张 芒1
(1.贵州医科大学, 贵阳 550001; 2.贵州省肿瘤医院头颈肿瘤科, 贵阳 550001)
目的: 观察调强放射治疗(IMRT)联合替莫唑胺(TMZ)治疗高级别脑胶质细胞瘤(HGG)患者的生存情况,探讨影响HGG患者预后的因素。方法: 选取2008年4月至2015年4月我院收治的初治Ⅲ~Ⅳ级脑胶质细胞瘤术后患者53例,所有患者行调强放疗联合同步及辅助TMZ化疗。放疗采用IMRT技术,剂量GTVp/GTVtb 64.2Gy/30f,PTV1 60Gy/30f,PTV2 54Gy/30f;放疗期间同步口服TMZ 75mg/(m2·d)。同步放化疗结束后4周行辅助化疗,TMZ 150~200mg/(m2·d),连用5天,21~28天/周期,共6周期。观察患者的总生存率(OS)、无进展生存率(PFS),并对患者性别、年龄、KPS评分、手术切除程度、病理分级、手术至放疗间隔时间、是否行辅助化疗等因素对患者的预后影响进行分析。结果: (1)全组患者中位随访时间为47个月(16~100个月)。(2)39例患者出现肿瘤进展或复发,其中死亡34例;因第二原发肿瘤(宫颈癌)死亡1例。(3)全组3、 5年OS分别为37.3%和26.7%,3、 5年PFS分别为28.5%和19.0%。(4)多因素分析显示手术切除程度(P=0.027,HR=0.383)、性别(P=0.011,HR=0.315)、是否完成6周期辅助化疗(P=0.028,HR=0.363)为影响患者OS的独立影响因素;年龄(P=0.006,HR=2.638)及手术切除程度(P=0.005,HR=0.318)是影响患者PFS的独立预后因素。结论: IMRT联合及辅助TMZ治疗HGG的疗效肯定,手术切除程度、性别、年龄及辅助化疗周期数是影响HGG患者预后的独立影响因素。
高级别脑胶质瘤; 调强放射治疗; 替莫唑胺; 生存; 预后
脑胶质瘤是中枢神经最常见的肿瘤,治疗方式为以手术为主的综合治疗。近年来,随着放射治疗技术的不断进步,其在胶质瘤治疗中的地位不断提高。调强放射治疗(intendensity modulated radiation therapy,IMRT)技术克服了常规外照射放疗技术的不足,实现了肿瘤靶区高剂量而临近器官低剂量的特点,从而在提高肿瘤控制率的同时减少重要器官的损伤。替莫唑胺(temozolomide,TMZ)具有易通过血脑屏障,生物利用度高等特点,解决了以往化疗药物颅内血药浓度不足的缺点,放疗联合及辅助TMZ化疗方案被证实能提高脑胶质瘤的生存[1-3]。目前关于采用调强放疗联合替莫唑胺治疗高级别胶质瘤(high-grade gliomas,HGG)的长期生存分析的研究少有报道,本研究回顾性分析了我院头颈肿瘤科53例应用IMRT联合同步及辅助TMZ化疗治疗的HGG患者的临床资料,对其长期生存进行分析。
1 资料与方法
1.1 一般资料
选取2008年4月至2015年4月期间我院收治的有较完整的治疗及随访资料的脑胶质瘤患者53例,术后病理确诊为Ⅲ~Ⅳ级,其中男性29例,女性24例,Ⅲ级20例,Ⅳ级33例,全组中位年龄45岁(10~73岁),女性平均年龄(41±15.134)岁,男性平均年龄(48±14.627)岁。Ⅲ级中位年龄44.5岁(15~73岁),Ⅳ级中位年龄45岁(10~70岁)。中位KPS评分90(60~90)。手术至放疗中位间隔时间42天(见表1)。
1.2 治疗方法
1.2.1 同步放化疗 同步放化疗在术后4~7周进行,放疗采用Philips CT Aura 模定位机,Elekta Precise医用直线加速器(瑞典医科达公司),能量为6MV-X射线,采用静态调强方式,扫描范围为头顶至胸骨平面,层距3mm,全部病例均作定位CT强化扫描,定位CT与术后MRI图像融合并结合术前MRI影像进行靶区勾画。(1)靶区定义及勾画细则:肿瘤残存灶GTVp,瘤床GTVtb,临床靶区1 CTV1=GTVp/GTVtb+1.5~2.0cm,临床靶区2 CTV2=GTVp/GTVtb+2.0~2.5cm,计划靶区PTV=GTV/CTV+0.3cm。(2)靶区剂量分别为:PGTVp/PGTVtb 64.2Gy/30f,PTV1 60Gy/30f,PTV2 54Gy/30f。(3)计划评估要求:100%等剂量曲线应包括95%~100%GTV,95%等剂量曲线包括95%以上的PTV1和PTV2,最大剂量点在GTV范围内。同步化疗:TMZ 75mg/(m2·d),整个放疗过程中服用。

表1 53例HGG患者的临床资料
1.2.2 辅助化疗 同步放疗结束4周后予辅助化疗,TMZ 150~200mg/(m2·d),连续服用5天,21~28天为一周期,连续服用6周期。
1.3 随访情况及疗效评价
自手术之日起,随访至患者疾病进展、死亡、失访或截止日期。评价指标以总生存率(overall survival,OS)及无进展生存率(progression-free survival,PFS)作为患者生存观察指标。OS定义为自手术之日起至患者死亡或最后一次随访时间间隔;PFS定义为自手术之日至患者出现颅内病灶进展或复发时间间隔。肿瘤进展或复发的诊断依据为手术、MRI影像、PET-CT、多学科会诊讨论并结合患者临床表现。
1.4 统计学方法
采用SPSS13.0软件进行统计分析,Kaplan-Meier法计算生存率,Log rank法对生存率进行显著性检验及单因素预后分析,Cox法进行多因素分析。P<0.05为差异有统计学意义。
2 结 果
2.1 随访情况
随访截止时间2016年7月。失访患者按最后一次随访时间计算生存时间。全组的中位随访时间为47个月(16~100个月),随访率为100%。Ⅲ级患者中位随访时间40个月(16~81个月),Ⅳ级中位随访时间为51个月(16~100个月)。
2.2 完成治疗情况
全组53例患者中22例患者行肿瘤全切术,Ⅲ级12例、Ⅳ级10例。98%患者完成同步放化疗(1例Ⅳ级患者仅完成20Gy/10f放疗),38例患者接受了TMZ辅助化疗,其中Ⅲ级14例、Ⅳ级24例,中位辅助周期数为2周期(0~11周期),Ⅲ级中位辅助周期数3周期(0~11周期),Ⅳ级中位辅助周期数为2周期(0~8周期)。
2.3 生存状况
全组出现肿瘤局部进展或复发40例,其中Ⅲ级12例、Ⅳ级28例,已死亡34例(其中Ⅲ级10例、Ⅳ级24例),1例Ⅳ级患者死于宫颈癌晚期。4例复发或进展的Ⅳ级胶质瘤仍生存患者中,1例患者仅完成同步放化疗,治疗后72个月出现复发,复发后接受了肿瘤次全切手术,术后完成了7个周期TMZ[150~200mg/(m2·d)]辅助化疗,化疗后10个月,患者再次出现疾病进展并再次行手术治疗,目前患者肢体不能活动,行积极对症治疗中;1例患者同步放化疗及6周期TMZ辅助化疗后32个月出现复发,复发后患者接受了1周期恩度(7.5mg/m2,d1-15)联合TMZ[150~200mg/(m2·d),d1-5]化疗,以及12周期单药TMZ[150~200mg/(m2·d),d1-5,21~28天/周期]化疗,患者因化疗后剧烈呕吐未继续化疗,治疗后2年患者出现疾病进展,颅内水肿明显,目前在院行对症支持治疗中;1例患者完成了同步放化疗及3周期辅助化疗后第18个月复查发现肿瘤复发,因一般情况差,患者未行肿瘤专科治疗,正在接受积极的对症处理;1例患者完成同步放化疗后行TMZ辅助治疗两周期后出现了进展(排除假性进展),进展后给予伊立替康联合TMZ化疗1周期,以及尼妥珠单抗治疗4周期,至随访时患者疾病稳定。2例现存活的复发Ⅲ级脑胶质瘤患者中1例患者完成同步放化疗及4周期TMZ辅助化疗后1年复发,复发后未行肿瘤专科治疗,目前积极对症支持治疗;1例术后残留患者完成同步放化疗后复查提示残留灶无明显改变,后继续完成6周期替莫唑胺单药化疗,化疗后2月复查见肿瘤进展,患者拒绝再次行手术治疗,现行对症治疗中。
2.4 总生存及无进展生存
全组中位生存时间为25个月(6~100个月),3、 5年OS为37.3%和26.7%,3、5年PFS为28.5%和19.0%,见图1~2。Ⅲ级脑胶质细胞瘤中位生存时间为28个月(9~81个月),3、5年OS为57.9%和43.4 %,3、5年PFS为49.5%和24.8%;Ⅳ级胶质细胞瘤中位生存时间为17个月(6~100个月),3年OS及PFS分别为24.8%及12.7%,5年OS及PFS分别为16.0%及6.3%。
2.5 单因素预后分析
对可能影响患者预后的因素,即性别、年龄、KPS评分、手术切除程度、病理分级、手术至放疗开始间隔时间及是否完成6周期辅助化疗等进行单因素分析,结果显示性别(χ2=16.647,P=0.001)、 年龄 (χ2=4.066,P=0.044)、病理分级(χ2=3.943,P=0.046)、是否全切(χ2=11.244,P=0.001)是影响患者3年OS的因素;性别(χ2=15.491,P<0.001)、年龄(χ2=4.561,P=0.033)、是否行全切(χ2=12.763,P<0.001)是患者3年PFS的影响因素。性别(χ2=13.900,P=0.001)、病理分级(χ2=4.040,P=0.044)、是否全切(χ2=11.523,P=0.001)、是否完成6周期辅助化疗(χ2=5.829,P=0.016 )是影响患者5年OS的因素,性别(χ2=10.031,P=0.002)、年龄(χ2=7.738,P=0.005)、是否行全切(χ2=12.882,P<0.001),是否完成6周期辅助化疗(χ2=3.995,P=0.046)是影响患者5年PFS的因素。详见表2、表3。
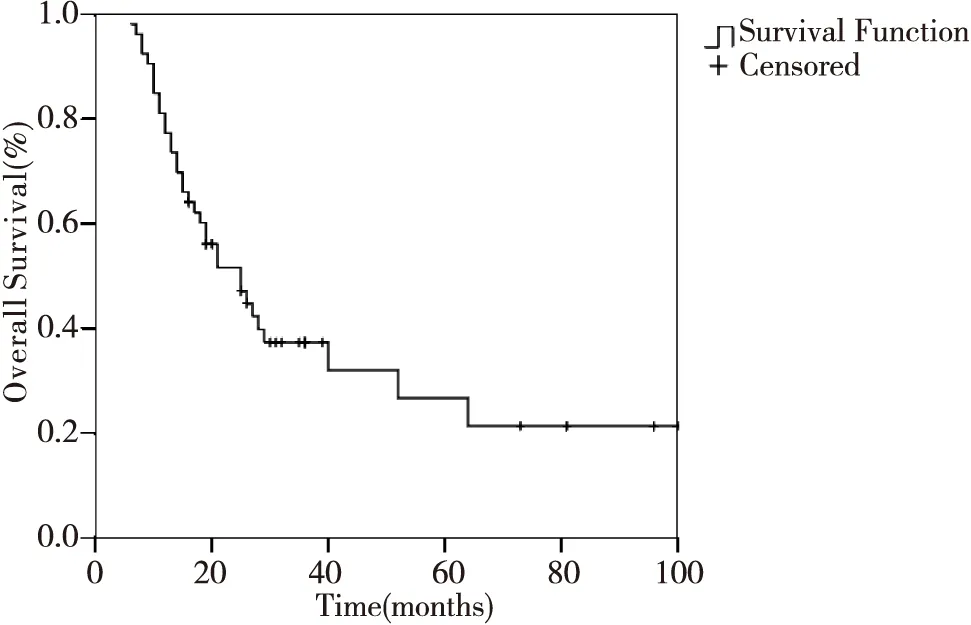
图1 患者总生存曲线
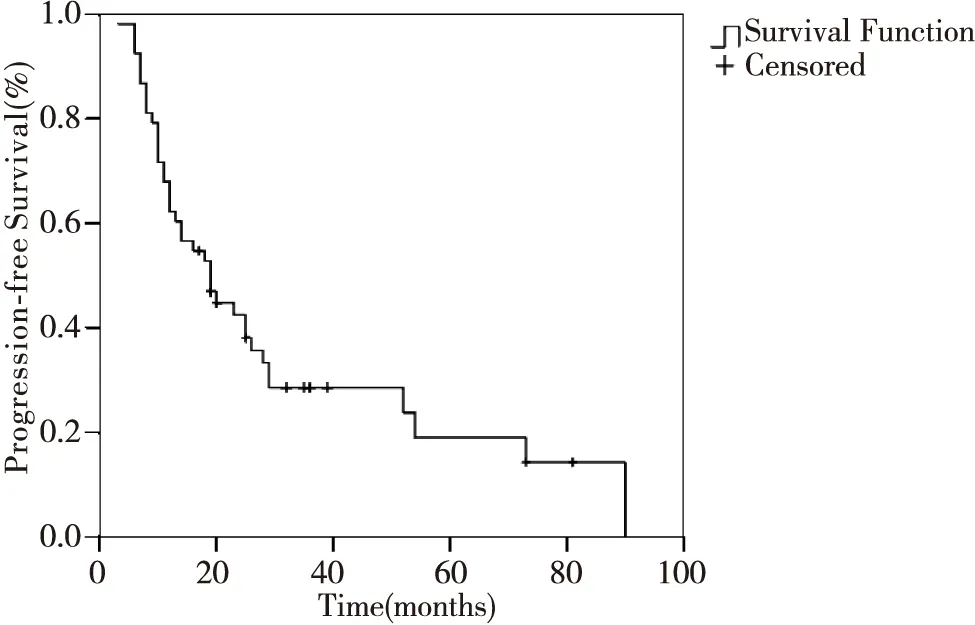
图2 患者无进展生存曲线
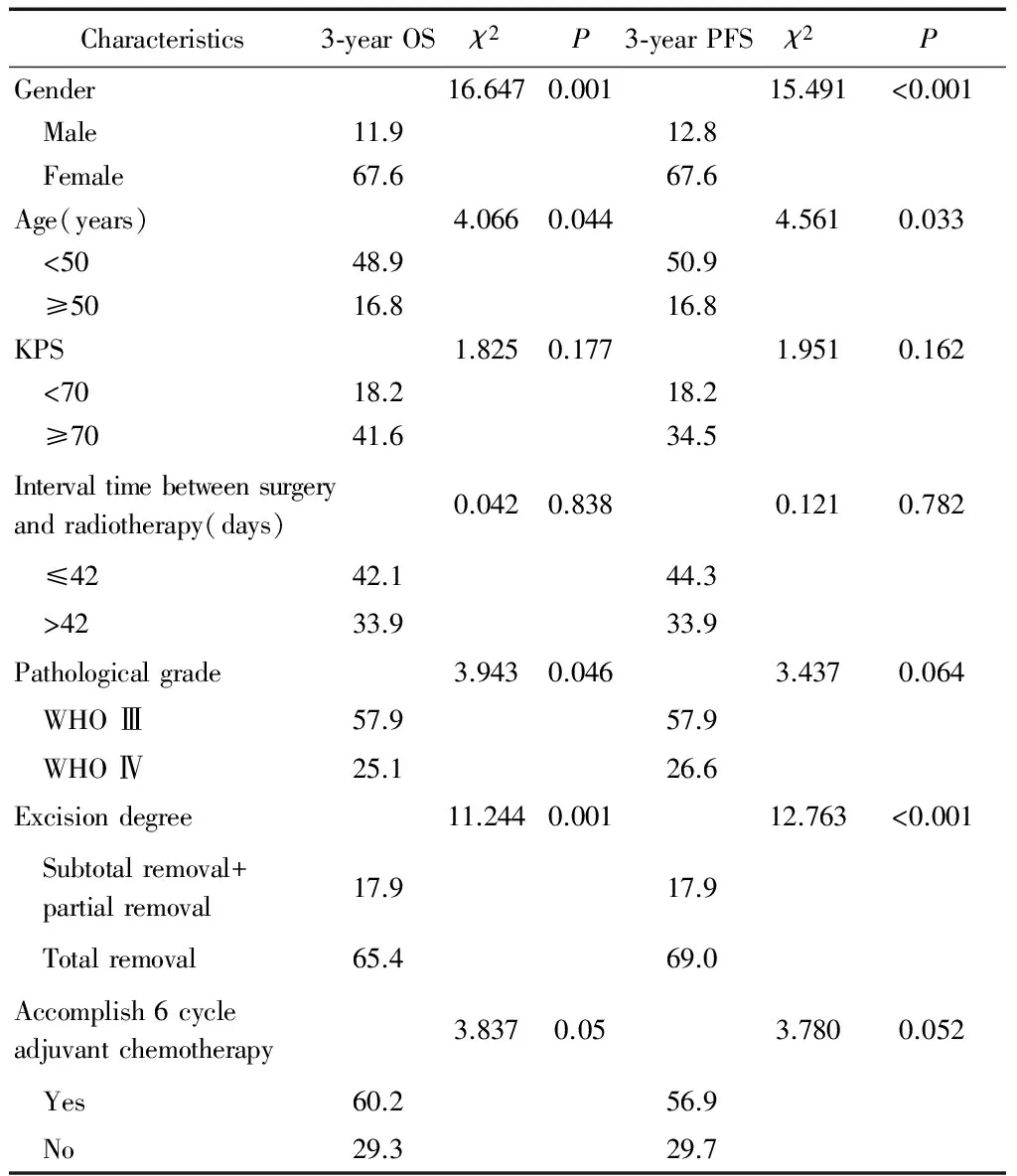
Characteristics3⁃yearOSχ2P3⁃yearPFSχ2PGender16.6470.00115.491<0.001 Male11.912.8 Female67.667.6Age(years)4.0660.0444.5610.033 <5048.950.9 ≥5016.816.8KPS1.8250.1771.9510.162 <7018.218.2 ≥7041.634.5Intervaltimebetweensurgeryandradiotherapy(days)0.0420.8380.1210.782 ≤4242.144.3 >4233.933.9Pathologicalgrade3.9430.0463.4370.064 WHOⅢ57.957.9 WHOⅣ25.126.6Excisiondegree11.2440.00112.763<0.001 Subtotalremoval+ partialremoval17.917.9 Totalremoval65.469.0Accomplish6cycleadjuvantchemotherapy3.8370.053.7800.052 Yes60.256.9 No29.329.7
表3 患者5年OS、PFS单因素分析结果
Table 3 Univariate analysis of 5-year OS, PFS of patients
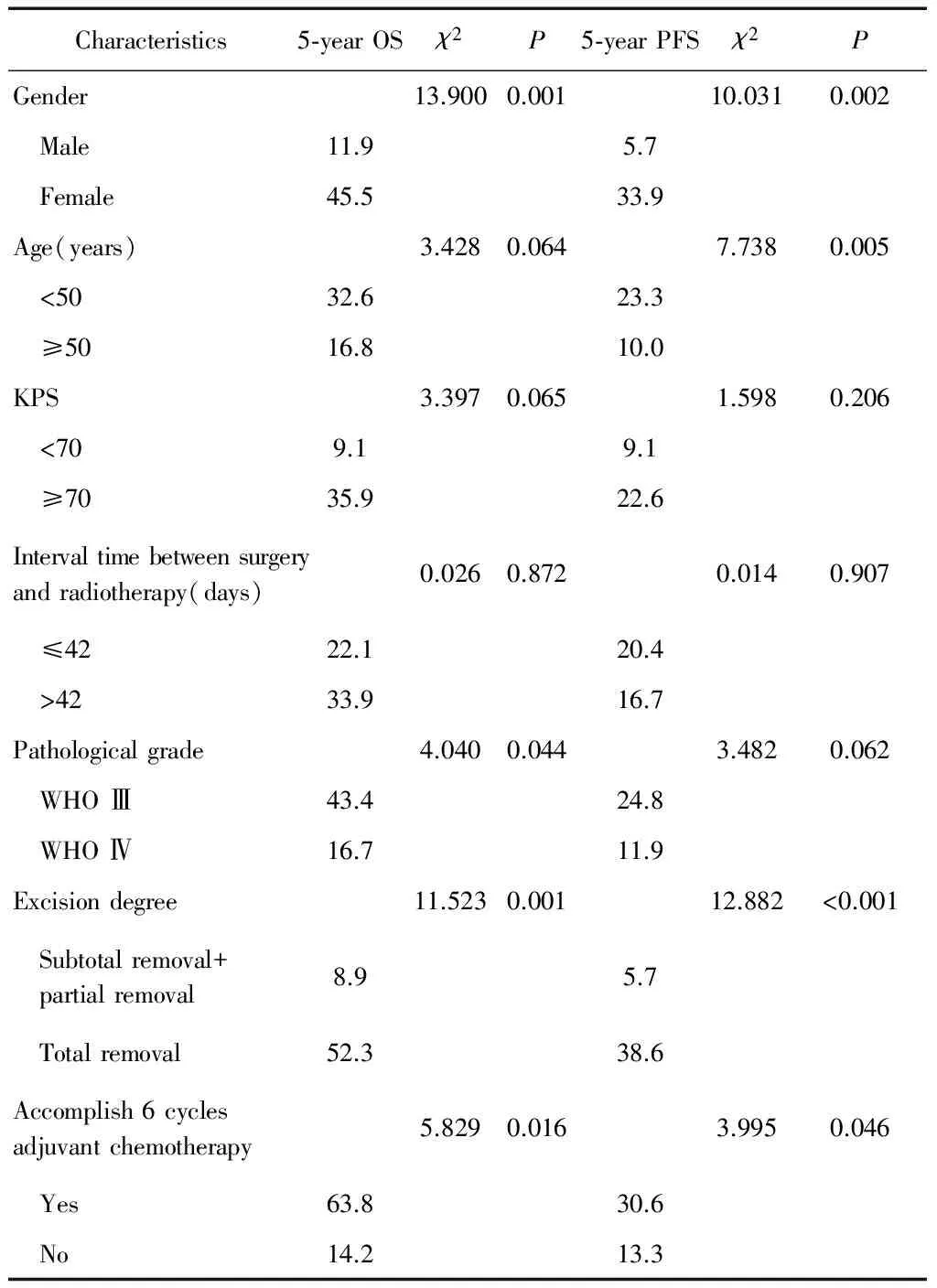
Characteristics5⁃yearOSχ2P5⁃yearPFSχ2PGender13.9000.00110.0310.002 Male11.95.7 Female45.533.9Age(years)3.4280.0647.7380.005 <5032.623.3 ≥5016.810.0KPS3.3970.0651.5980.206 <709.19.1 ≥7035.922.6Intervaltimebetweensurgeryandradiotherapy(days)0.0260.8720.0140.907 ≤4222.120.4 >4233.916.7Pathologicalgrade4.0400.0443.4820.062 WHOⅢ43.424.8 WHOⅣ16.711.9Excisiondegree11.5230.00112.882<0.001 Subtotalremoval+ partialremoval8.95.7 Totalremoval52.338.6Accomplish6cyclesadjuvantchemotherapy5.8290.0163.9950.046 Yes63.830.6 No14.213.3
2.6 多因素预后分析
将单因素分析中P<0.1的因素纳入多因素分析,手术切除程度(P=0.027)、性别(P=0.011)、是否完成6周期辅助化疗(P=0.028)为患者OS的独立影响因素;年龄(P=0.006)及手术切除程度(P=0.005)是患者PFS的独立影响因素(见表4)。
3 讨 论
HGG由于其解剖结构的特殊性,以及恶性肿瘤浸润性生长的特点,肉眼很难判断肿瘤组织与正常组织之间的界限,手术难以完整切除,单纯手术复发率高,5年生存率不足5%[4],术后综合治疗对生存显得十分重要。以往胶质瘤的常规放射治疗技术中,由于受正常组织和其他重要器官的限制,常常造成肿瘤靶区剂量的不足,从而导致肿瘤复发的几率增加,影响患者生存。研究表明[5~7],脑胶质瘤的IMRT计划可以使肿瘤区得到较高的剂量及较满意的肿瘤覆盖区,在正常组织保护中有明显优势。
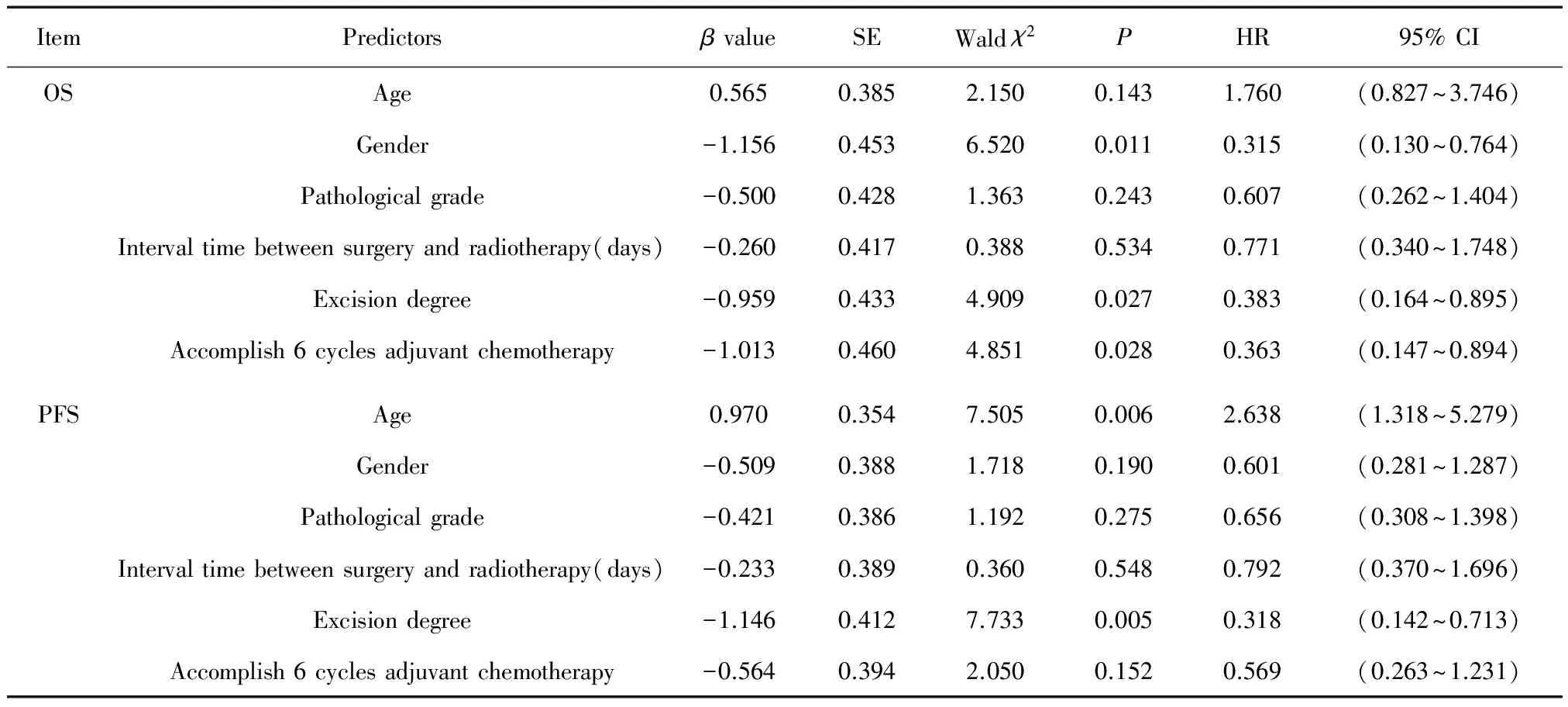
表4 影响患者5年OS和PFS的多因素分析结果
TMZ是第二代烷化口服抗肿瘤药,由于它能通过血脑屏障且在中枢神经系统的药物浓度约为血浆浓度的40%,生物利用度达100%。国内外一系列临床实验[1,2]已经证实TMZ在脑胶质瘤同步放化疗中不良反应轻,近期疗效及远期疗效均较单纯放疗好。它可与放疗相互增敏、减少肿瘤耐药发生和作用互补从而提高治疗效果[8-11]。Badiyan等[12]采用替莫唑胺同步放化疗的研究中将实验组平均放疗剂量提高至64Gy(61~76Gy),对照组给予60Gy常规剂量,结果提示正常组织剂量可耐受。本研究放疗方案仅在残留肿瘤/瘤床给予64Gy/30f,PTV1及PTV2仍采用的是国际、国内指南推荐剂量,分别为60Gy/30f和54Gy/30f,本组既往研究[13]结果显示该方案靶区适形度好;各重要器官的最大剂量和平均剂量也明显低于临床上可接受的各器官组织最小耐受剂量(TD5/5),并证实IMRT技术降低了靶区周围正常组织照射剂量,能较好地保护正常脑组织及周围器官,更好地提高生活质量。
本研究采用IMRT联合及辅助TMZ治疗HGG的中位生存时间为25个月(6~100个月),3、5年OS为37.3%和26.7%,3、5年PFS为28.5%和19.0%。Stupp等[1]证实TMZ同步放化疗序贯辅助化疗治疗Ⅳ级脑胶质母细胞瘤(glioblastoma,GBM)患者的中位生存为14.6个月,3年OS提高到16.0%[2],3年PFS为6%,5年OS及PFS分别为9.8%和4.1%。本研究采用NCCN指南推荐方案,给予TMZ同步放化疗序贯辅助化疗, Ⅳ级胶质瘤3、5年OS及PFS均高于以上Stupp的结果。本组研究Ⅳ级患者中位年龄为45岁,均完成不同程度的手术切除,放疗均采用IMRT技术,且97%(32/33)接受的照射剂量高于90%处方剂量,均行TMZ同步化疗;而Stupp研究中患者中位年龄56岁,行手术切除者仅83%,放疗采用3DCRT技术,接受大于90%处方剂量的患者为98%。本研究复发后的部分患者接受积极的综合治疗也可能是本组获得较好生存的原因,另外,本组病例数较Stupp研究少,也可能是上述结果出现差异的原因。Noel等[11]采用IMRT同步及辅助TMZ治疗Ⅳ级GBM的一项回顾性研究中,显示接受60Gy,2Gy/f,患者的中位生存时间为17.4个月,接受40.05Gy,2.67Gy/f的患者中位生存时间为7.3个月,两组OS及PFS差异均有统计学意义(P值分别为0.0006及0.0053)。本组研究中Ⅳ级胶质瘤的中位生存时间为17.0个月,与Noel的报道结果相似,两组患者均采用了IMRT技术,尽管Noel研究中患者的手术全切率(58.1%)大于本组Ⅳ级患者的全切率(33.3%,10/33),且患者均接受了60Gy放疗剂量,而本研究中有1例Ⅳ级患者(1/33)仅接受了20Gy/10f放疗,且该患者总生存仅14个月,降低了平均生存时间,但该组患者中位年龄63.9岁,明显高于本组研究(45岁),可能会抵消上述因素带来的生存获益。与Stupp组患者相对比,Noel及本组的生存率均较高,除患者年龄、接受放疗剂量及手术切除程度等原因外,可能与本组及Noel组患者采用IMRT放疗技术有关。
Young-Hoond等[14]研究中,同步及辅助TMZ化疗后Ⅲ级胶质瘤的3年PFS为50%(作者未提3年OS),本研究Ⅲ级胶质细胞瘤3年PFS分别为49.5%,疗效与Young-Hoond结果相当。Giuseppe等[3]的研究中,97例接受放疗联合同步及辅助TMZ治疗的Ⅲ级胶质瘤患者,中位生存时间为50.5个月,中位无进展生存时间为36个月,5年OS及PFS为38%及22%。本组Ⅲ级胶质细胞瘤中位生存时间为28个月(9~81月),5年OS为43.4 %,PFS为24.8%,中位生存时间低于Giuseppe的研究报道,5年OS稍高于Giuseppe的报道,PFS与其相当,可能与Giuseppe组患者的手术切除率较我组低(Giuseppe组为91%,我组为100%),也可能与本组病例数较少,随访时间较短(Giuseppe中位随访时间46个月,本组为40个月)有关。
Barker等[15]回顾性分析了年龄≥65岁GBM患者接受联合或不联合TMZ放疗患者的生存,结果提示年龄是患者长期生存的一个重要因素。本研究以50岁年龄为界进行分析,结果提示年龄是影响患者PFS的独立预后因素(P=0.006),而不是影响患者OS的独立预后因素。多因素分析结果提示手术切除程度是影响患者OS及PFS的独立预后因素,与大多数报道一致。本组研究发现性别是影响患者总生存的独立预后因素,女性患者的预后明显优于男性(P=0.011),与部分研究不符[1、16-17],可能与女性患者平均年龄较小有关,有待进一步的研究证实。Valduvieco等[16]对GBM全切术后至放疗开始的时间间隔对患者的生存影响进行研究,发现6周内开始放疗较超过6周开始放疗者预后好,而本组结果提示间隔时间42天(6周)并不是患者预后的独立影响因素,可能与本组患者中位间隔时间较短(42天),大部分患者均在6周内开始放疗有关。本组单因素分析结果提示,完成6周期辅助治疗是影响患者5年OS(P=0.016)及PFS(P=0.046)的重要因素,这与之前某些研究结果[1,16]不符。目前国内外大部分研究显示MGMT启动子甲基化程度、IDH突变等影响患者的预后[18],本研究因受条件限制未能行分子病理检测,患者对TMZ敏感性存在异质性。部分患者未进行辅助化疗及化疗周期数少,可能会影响整体辅助化疗疗效。辅助化疗周期数是否是影响患者预后的因素需要扩大病例数及更多的亚组分析研究。
总之,本研究显示手术切除是脑胶质瘤患者重要的治疗方式,术后IMRT联合及辅助TMZ治疗HGG疗效较好,但患者长期预后仍较差。手术切除程度、年龄、TMZ辅助周期数、性别可能与患者的预后密切相关,但受解剖及肿瘤组织学特异性以及其他因素的影响,手术方式改进受到局限,患者年龄及性别为患者个体性差异,故如何从改进放疗技术及化疗方式及其他治疗模式中探讨更好的生存获益值得研究,本研究结果提示IMRT放疗联合TMZ同步及辅助治疗HGG患者的生存较好,更准确的生存分析尚需要更多病例及长期随访观察及结合分子病理等分层分析进一步研究。
[1] Stupp R, Mason WP, van den Bent MJ, et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma [J]. N Engl J Med, 2005,352(10): 987-996.
[2] Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study: 5-year analysis of the EORTC-NCIC trial [J].Lancet Oncol,2009,10(5): 459-466.
[3] Giuseppe M, Claudia S, Antonella A, et al.IDH1 mutation and MGMT methylation status predict survival in patients with anaplastic astrocytoma treated with Temozolomide based chemoradiotherapy [J]. J Neuro Oncol,2014,118(2):377-383.
[4] 高 翔.颅内脑肿瘤的治疗趋势[J].现代实用医学,2012,24(10):1084-1087.
[5] 韩 非,卢泰祥.脑胶质瘤的调强放射治疗7例临床分析[J].中国神经肿瘤杂志,2004, 2(2):96-98.
[6] Biplab S,Jyotirup G,Ayan B,et al.Dosimetric comparison of three dimensional conformal radiotherapy and intensity modulated radiotherapy in high grade gliomas[J].Polish J Med Phys & Eng,2011,17(2): 75-84.
[7] De La TH,Salahuddin A,Maria TK,et al. Intensity modulated radiation therapy versus three dimensional conformal radiation therapy for treatment of high grade glioma:A radiobiological modeling study[J].J X-ray Sci Technol,2010,18(4):393-402.
[8] Van Rijn J,Heimans JJ,Van Den Berg J,et al. Survival of human glioma cells treated with various combination of temozolomide and x rays[J]. Int J Radiat Oncol Biol Phys, 2000,47(3):779-784.
[9] 伍 勇,刘国龙.放疗开放血脑屏障及其对化疗的意义[J].中国神经肿瘤杂志,2007, 5(1):63-65.
[10]陈丽昆,刘国贞,徐光川. 全脑放射促进顺铂通过血脑屏障的研究[J]. 癌症,2001,20(3),291-293.
[11]Noel JA,Linus CB,Patrick JH,et al.Improved outcomes with intensity modulated radiation therapy combined with temozolomide for Newly diagnosed glioblastoma multiforme[J/OL]. Neuro Res Inter,http:// dx.doi.org /10.1155 /2014/945620,2014-01-19.
[12]Badiyan SN,Markovina S,Simpson JR,et al.Radiation therapy dose escalation for glioblastoma multiform in the era of temozolomide[J].Inter J Radio Oncol,2014,90(4):877-885.
[13]印海林,吴伟莉,金 风,等.调强放射治疗联合同步及辅助替莫唑胺化疗治疗脑胶质瘤术后残余病灶的临床研究[J].肿瘤,2011,31(5):428-431.
[14]Young-Hoond K,Chul-kee P,Won HC,et al.Temozolomide during and after radiation therapy for WHO grade Ⅲ gliomas:preliminary report of a prospective multicenter study[J].J Neuro Oncol,2011,103(3):503-512.
[15]Barker CA, Chang M, Chou JF, et al. Radiotherapy and concomitant temozolomide may improve survival of elderly patients with glioblastoma[J]. J Neuro Oncol, 2012,109(2):391-397.
[16]Valduvieco I,Verger E,Bruna J,et al.Impact of radiotherapy delay on survival in glioblastoma[J].Clin Transl Oncol,2013,15(4):278-282.
[17]Li SW, Yan CX, Huang L,et al.Molucular prognostic factors of anaplastic oligodendroglial tumors and its relationship:a single instisutional review of 77 patients from China[J].Neuro Oncol,2012,14(1):109-116.
[18]Hegi ME,Diserens AC,Gorlia T,et al.MGMT gene silencing and benefit from temozolomide in glioblastoma[J].N Engl J Med,2005,352(10):997-1003.
Long-term Efficacy Analysis of Intensity Modulated Radiation Therapy Combined with Temozomide in the Treatment of High-grade Gliomas*
Tang Hong1, Wu Weili1,2△, Jin Feng1,2, et al
(1.GuizhouMedicalUniversity,Guiyang550001,Guizhou,China; 2.DepartmentofHeadandNeckOncology,GuizhouCancerHospital,Guiyang550001,Guizhou,China)
Objective: To observe the prognosis of patients with high-grade gliomas (HGG) treated with intensity modulated radiation therapy (IMRT) combined with temozomide (TMZ), and to explore the related influential factors. Methods: Fifty-three postoperative patients diagnosed as Ⅲ~Ⅳ grade glioma during April 2008 and April 2015 were enrolled. All patients were treated by IMRT combined with concurrent and adjuvant TMZ chemotherapy. The dose of GTVp/GTVtb, PTV1, PTV2 was 64.2Gy/30f, 60Gy/30f, and 54Gy/30f, respectively. TMZ [75mg/(m2·d)] was given concurrently. TMZ [150~200mg/(m2·d)] was administered for consecutive 5 days, 21 to 28 days as a cycle, 6 cycles in total 4 weeks after the concurrent chemoradiotherapy. The overall survive (OS) and progress free survive (PFS) were observed. The influence of gender, age, KPS score, surgical resection degree, pathological grading, interval time between surgery to radiotherapy, receiving adjuvant chemotherapy or not on the prognosis of patients were analyzed. Results: (1)The median follow-up time was 47 months (16 to 100 months).(2)Tumor progression or recurrence occurred in 39 patients, among which 34 died, and 1 case died from second primary tumors (cervical cancer).(3)The 3 and 5-year OS was 37.3% and 26.7%, respectively; the 3 and 5-year PFS was 28.5% and 19.0 %,respectively.(4)Multivariate analysis showed that the extent of surgical resection (P=0.027, HR=0.383), gender (P=0.011, HR=0.315), completing 6 cycles of adjuvant chemotherapy (P=0.028, HR=0.363) were independent influencing factors for OS; age (P=0.006, HR=2.638) and the degree of resection (P=0.005, HR=0.318) were independent influencing factors for PFS. Conclusion: The efficacy of IMRT combined with TMZ in the treatment of HGG is positive. It suggests that the degree of surgical resection, gender, age, and the number of adjuvant chemotherapy cycles are independent prognostic factors for patients with HGG.
High-grade gliomas; IMRT; TMZ; Survival; Prognosis
2016- 07- 25
2016- 09- 11
*贵州省优秀科技教育人才省长专项资金[编号:黔省专合字(2008)89号]
[作者简介] 唐 红(1991-),女,四川内江人,医师,硕士,主要从事头颈部肿瘤基础与临床研究。
△吴伟莉,主任医师,教授,硕士生导师,E-mail:wwlmhy@163.com
R739.41;R730.55;R730.53
A
10.3969/j.issn.1674- 0904.2016.05.004
