siRNA沉默HIF- 2α对缺氧培养的BGC- 823胃癌细胞中VEGF表达的影响*
2016-02-23刘翠云曲颜丽
刘翠云, 曲颜丽, 唐 勇, 周 宁, 舍 玲
(新疆医科大学附属肿瘤医院消化内科, 乌鲁木齐 830011)
•应用基础研究•
siRNA沉默HIF- 2α对缺氧培养的BGC- 823胃癌细胞中VEGF表达的影响*
刘翠云, 曲颜丽, 唐 勇△, 周 宁, 舍 玲
(新疆医科大学附属肿瘤医院消化内科, 乌鲁木齐 830011)
目的:观察乏氧培养条件下胃腺癌细胞系BGC- 823中HIF- 2α和VEGF的表达,探讨HIF- 2α在低氧条件下对胃癌血管生成的调控作用。方法: 采用实时定量聚合酶链反应(Real-time PCR)和Western blot法分别检测低氧状态下HIF- 2α和VEGF在mRNA和蛋白水平的表达。进一步采用化学合成小干扰RNA(siRNA)介导的RNA干扰技术(RNA interference, RNAi)转染BGC- 823细胞。观察转染后HIF- 2α沉默效果。结果: 与常氧时比较,缺氧后BGC- 823细胞HIF- 2α、VEGF的mRNA水平稳定,而蛋白的表达水平均明显升高(P<0.05),siRNA转染BGC- 823后能够显著下调HIF- 2α的基因表达,同时VEGF基因的表达也受到明显抑制。结论: 缺氧可促使BGC- 823细胞HIF- 2α在蛋白水平表达升高,并通过激活VEGF的机制调控胃癌血管生成,切断HIF- 2α途径可能会有效阻止胃癌血管生成。
胃癌; 乏氧诱导因子- 2α; 血管内皮生长因子; 小干扰RNA。
胃癌作为典型的实体肿瘤之一,具有恶性实体瘤的共同特征,即短期内快速增长时,瘤组织内部往往处于缺血、缺氧的状态,进而导致瘤细胞内线粒体的耗氧率下降、ATP生成减少,为了满足增长的需求,肿瘤就必须具备一定能量代谢和血管生成的补偿机制,才能适应其相对缺氧的微环境[1]。研究发现HIF-α在胃癌适应缺氧的补偿机制中起主导作用,其中作用最显著的是HIF-1α和HIF-2α,二者由于结构上的微小差异,功能也不尽相同[2]。从大量报道可得[3],HIF-1α在胃癌血管生成、能力代谢、侵袭及转移等方面的机制研究均已很成熟。而HIF-2α在小细胞肺癌、结肠癌、宫颈癌、肝癌、食管癌中的研究报道较多[4]。本研究针对人BGC-823胃癌细胞系,利用RNAi技术沉默细胞HIF-2α的表达,通过观察其下游靶基因VEGF的基因表达,初步探讨HIF-2α在缺氧条件下对胃癌血管生成的调控作用。
1 材料与方法
1.1 材料
BGC-823胃腺癌细胞系、羊抗兔二抗lgG均购自武汉博士德生物公司;HIF-2α抗体、VEGF抗体、GAPDH购自美国Cell Signaling Technology公司;RPMI 1640培养基购自美国Invitrogen公司;HIF-2α-siRNA(h):SC-353316、Control siRNA-A及siRNA转染试剂盒均购自Santa Cruz公司。全蛋白提取试剂盒、BCA蛋白含量检测盒购自江苏凯基生物技术有限公司。RNA提取试剂盒购自上海玉博生物科技有限公司;PCR试剂盒购自北京中杉生物技术公司;HIF-2α及VEGF引物试剂盒购自上海生工生物工程有限公司;SDS-PAGE凝胶制备试剂盒购自北京索莱宝科技有限公司。
1.2 方法
1.2.1 细胞培养 BGC-823胃癌细胞采用含10%胎牛血清的RPMI 1640培养基培养于37°C、5%CO2、饱和湿度的培养箱中培养,每隔一天更换培养液,待细胞生长至80%~90%融合后传代,取3~6代处于指数生长期的细胞进行试验。
1.2.2 缺氧处理 取3~6代处于指数生长期的细胞,以4×105个细胞/孔接种到6孔板中,分为常氧组和缺氧组。种板24h后,在完全培养基中加入浓度为200μmol/L的化学缺氧诱导剂CoCl2来模拟缺氧组细胞内部缺氧微环境,再将两组细胞共同置于37°C、5%CO2的培养箱中培养24h。
1.2.3 Real-time PCR法检测缺氧前后HIF-2α与VEGF mRNA的表达 将常氧组A、单纯缺氧组B,共同置于培养箱中培养24h后,用Trizol法分别提取总RNA,根据逆转录试剂盒说明,逆转录反应体系(20μL)组成为:RNA :3.2μL +RT Master Mix:4μL+H2O:12.8μL,各引物的设计分别为:HIF-2α:上游5′-TGGTAGCCCTCTCCAACAAG-3′,下游5′-CTTCATCCGTTTCCACATCA-3′;VEGF:上游5′-CCAACTTCTGGGCTGTTCTC-3′,下游5′-CCCCT-CTCCTCTTCCTTCTC-3′;GAPDH:上游5′-CAGGAGGCATTGCTGATGAT-3′,下游5′-GAAGGCTGGGGCTCATTT-3′。振荡、离心后于逆转录条件:37℃15 min,85℃5sec,4℃10 min进行逆转录。荧光定量PCR反应按以下顺序进行40个循环:95℃2 min预变性,95℃变性15S,60 ℃退火15 S,72 ℃延伸1min。记录各样本反应的阈值(threshold cycle, TC),以GAPDH作为内参照,以公式计算HIF-2α、VEGF表达的相对定量值并进行统计学分析。
1.2.4 Western-blot法检测缺氧前后HIF-2α与VEGF蛋白的表达 将常氧组A、单纯缺氧组B于培养箱中培养24h后按照全蛋白提取试剂盒操作进行提取、定量,取50μg行SDS-PAGE电泳,转膜,脱脂牛奶封闭90分钟,剪出目的基因范围合适的膜,分别加入各自稀释过的抗体(GAPDH 1 ∶1000;HIF-2α一抗1 ∶100;VEGF一抗1 ∶1000)孵育过夜,PBS洗膜3遍,每次5分钟,再加入羊抗兔二抗lgG,于常温下摇床慢孵1h,后PBS洗膜3遍,每次10分钟。提前预热曝光仪5分钟,ECL法曝光显色,保存相应电泳条带并作记录,照相,行图像分析。从色带有无及强弱来判断蛋白表达程度,用目的蛋白HIF-2α、VEGF值分别与内参GAPDH的比值进行统计学分析。
1.2.5 siRNA转染BGC-823胃癌细胞 将BGC-823胃癌细胞以4×105/ml密度接种于6孔板,设四组:常氧组A、单纯缺氧组B、阳性转染实验组C、阴性转染对照组D。待细胞生长至70%~80%融合时按照转染试剂盒对C、D两组细胞进行转染。当C组、D组细胞转染至48h时,再给B、C、D组细胞更换含200μmol/L CoCl2的培养基诱导缺氧,最后将四组细胞共同置于37°C培养箱中继续培养24 h。
1.2.6 测定HIF-2α的沉默效果 继续缺氧培养24 h后收集各组细胞的RNA和蛋白,对基因mRNA及蛋白的检测方法及实验同1.2.3、1.2.4。
1.2.7 HIF-2α基因沉默后对VEGF表达的影响 同样方法对VEGF mRNA及蛋白水平的表达进行检测,记录及分析。
1.3 统计学分析
2 结果
2.1 缺氧处理后HIF-2α、VEGFmRNA表达的变化
HIF-2α及VEGF在缺氧24h后mRNA表达水平分别为:0.72±0.15,1.11±0.10;而常氧组二者的表达水平分别为0.73±0.03,1.16±0.40。相比于常氧组,差异无统计学意义(t=0.113,P=0.914;t=0.208,P=0.843)(图1)。
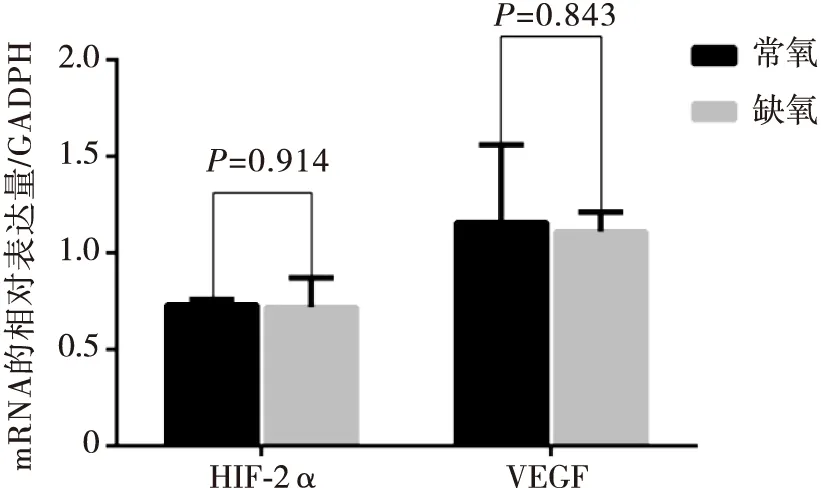
图1 Real-time PCR法检测缺氧前后BGC-823细胞中HIF-2α、VEGF的mRNA表达
2.2 缺氧处理后HIF-2α、VEGF蛋白表达变化
HIF-2α及VEGF在缺氧24h后蛋白表达水平分别为:0.48±0.09,2.35±0.10;而常氧组二者的表达水平分别为0.22±0.06,1.8±0.11。两者蛋白的表达与常氧组的差异均有统计学意义(t=4.163,P=0.009;t=13.637,P<0.001)(图2)。

图2 Western-blot法检测缺氧前后BGC-823细胞中HIF-2α、VEGF的蛋白表达
2.3 转染后HIF-2α的沉默效果及对VEGFmRNA表达水平的影响
常氧组A、单纯缺氧组B、阳性转染实验组C、阴性转染对照组D四组实验结果显示:HIF-2α的mRNA表达水平分别为:0.73±0.03,0.72±0.15,0.28±0.12,0.72±0.11;VEGF的mRNA表达水平分别为:1.16±0.04,1.11±0.10,0.39±0.10,1.18±0.10。与B组比较,C组HIF-2α和VEGF的mRNA表达水平下降(t=3.967,P=0.011;t=8.818,P<0.001)。B组、D组表达无差异(t=0.017,P=0.990;t=0.857,P=0.430)。(图3)。

图3 Real-time PCR法检测siRNA沉默HIF-2α对BGC-823细胞HIF-2α及VEGF mRNA的表达影响
2.4 转染后HIF-2α的沉默效果及对VEGF蛋白表达水平的影响
常氧组A、单纯缺氧组B、阳性转染实验组C、阴性转染对照组D四组实验结果显示:HIF-2α的蛋白表达水平分别为:0.22±0.06,0.48±0.09,0.19±0.12,0.56±0.08;VEGF的蛋白表达水平分别为:1.18±0.11,2.35±0.10,1.06±0.07,2.23±0.12。与B组比较,C组HIF-2α和VEGF的蛋白表达水平显著下降(t=3.348,P=0.002;t=18.304,P<0.001)。B组、D组表达无差异(t=1.151,P=0.302;t=1.331,P=0.241)。(图4)。
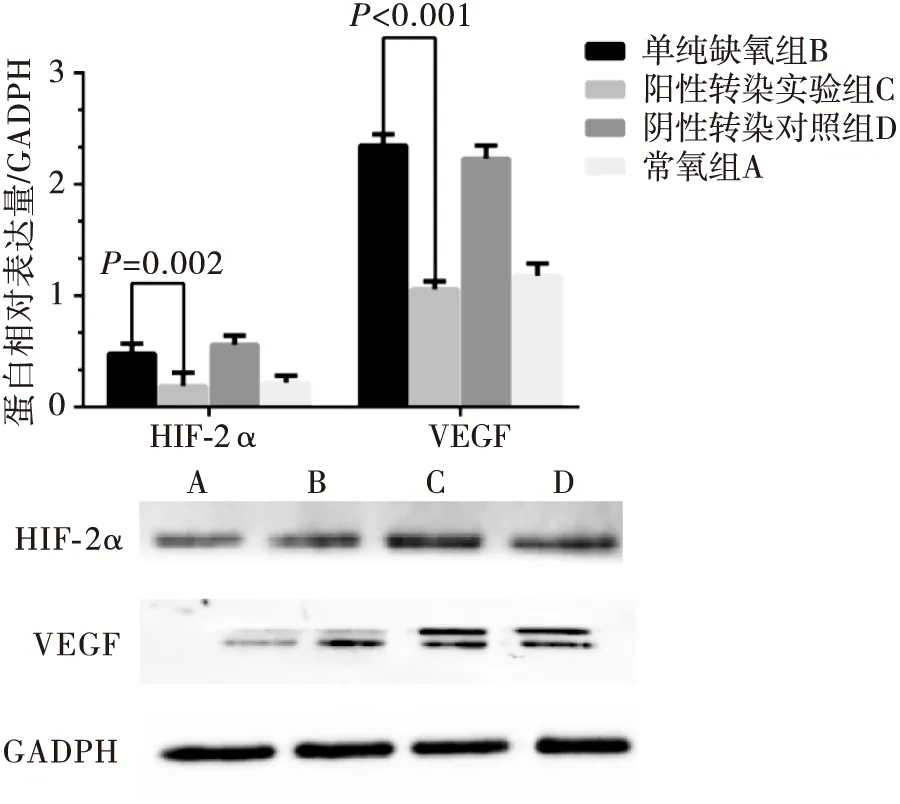
图4 Western-blot法检测沉默HIF-2α对BGC-823胃癌细胞HIF-2α和VEGF蛋白表达的影响
3 讨 论
恶性肿瘤生长的一个重要步骤就是对缺氧微环境的适应,其中生成大量的HIFs是适应缺氧的表现之一[8]。HIFs家族是一类具有多基因调控能力的转录因子,其对靶基因调控始于瘤细胞内低氧状态的刺激。VEGF就是其通过这种方式被调控的重要靶基因之一。VEGF是目前公认的刺激血管内皮细胞增殖、进而促进血管生成的最强、最直接的因子[9],其与血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)结合后传导信号,引起肿瘤内皮细胞增殖、迁移,诱导新生血管生成,因此,目前“VEGF-VEGFR”轴是抗血管生成治疗主要作用靶点之一[10]。HIFs根据α亚基的不同,分为3种亚型,分别是HIF-1α、HIF-2α和HIF-3α。其中对HIF-1α和HIF-2α研究较深入[11]。HIF-2α是HIFs家族的新成员,含有两个基本的螺旋-环-螺旋PAS区域蛋白,由诱导表达的α亚单位和结构性的β亚单位组成。其中β亚单位不受氧浓度控制而相对稳定表达。α亚单位则在常氧下迅速水解,乏氧时降解受阻而不断累积来调控下游靶基因VEGF的表达,进而对肿瘤生长过程中的血管生成产生作用[12]。有文献报道[13],HIF-2α对肿瘤血管生成的调控主要是抑制内皮细胞的迁移、抑制新生血管出芽形成新的血管腔,主要在新生血管的塑形中起关键作用,使肿瘤内血管化明显、微血管密度(microvessel density,MVD)增加。另外,Adam等[14]研究发现,不论缺氧的程度如何,对比HIF-1α,HIF-2α对VEGF mRNA都有更强、更特异的激活能力,提示下调HIF-2α的表达有利于抑制胃癌血管生成。但是关于HIF-2α的研究仍集中于肾恶性肿瘤中[15]。本研究通过分析HIF-2α与胃癌细胞中VEGF表达的关系,为临床有效抑制胃癌发生发展提供一条新的思路。
RNA干扰(RNA interference,RNAi)是近年来发展起来的新技术,由双链RNA引起的mRNA特异性降解致基因沉默。其具有抑制作用强、稳定性高、细胞摄取相对容易等优点[16]。本研究中应用RNAi技术,通过COCl2模拟缺氧微环境,观察HIF-2α基因沉默对BGC-823胃癌细胞中VEGF在mRNA和蛋白表达水平的改变,从分子水平上阐明HIF-2α对VEGF的调控。研究结果表明,在体外低氧条件下,HIF-2α和VEGF mRNA稳定表达,而蛋白表达水平较常氧时明显升高,且随着缺氧时间的延长缓慢升高并持续稳定表达,进一步证实了HIF-2α是一类介导细胞适应慢性缺氧的诱导因子。而且在低氧处理后,VEGF蛋白水平的表达也显著升高,提示乏氧主要在蛋白水平上影响HIF-2α,进而对VEGF调控的可能性更大,是促进胃癌VEGF生成,肿瘤新生血管形成的重要因素。当运用RNAi技术将特异性基因沉默片段导入细胞后,HIF-2α的mRNA和蛋白表达水平均能有效被抑制。同时检测下游靶基因VEGF在mRNA及蛋白质水平上的表达变化。结果显示,VEGFmRNA和蛋白随HIF-2α的表达下调而下降。阴性转染对照组与未转染组无差异。据此认为在低氧条件下,HIF-2α途径在胃癌血管生成的过程中具有显著作用。
目前,针对抑制胃癌血管生成的方法报道甚少,加之胃癌血管生成是由一系列而非单一血管生成因子来调控的,即使这些治疗方法在不同程度上取得了抑制胃癌血管形成、抑制胃癌生长和转移的效果,但均欠理想。因此,探索阻断多种血管生长因子作用靶点的方法更有实际意义。本研究通过沉默抑制HIF-2α,对低氧条件下培养的BGC-823胃癌细胞中VEGF的调控研究可得,切断HIF-2α途径可能会有效阻止胃癌血管生成。这将为胃癌的治疗提供一个新的靶点。
[1] 李能莲,李光明,骆亚莉,等. HIF-1α和HIF-2α在胃癌中的表达及意义[J].基础医学与临床,2010,30(6):619-620.
[2] Loboda A, Jozkowicz A, Dulak J.HIF-1 and HIF-2 transcription factors-similar but not identical[J]. Mol Cells,2010, 29(5):435-442.
[3] 梁 赅,杜 伟,李 爽,等.抑制 HIF-1α表达对低氧培养SGC-7901胃癌细胞CD44表达的影响[J]. 实用癌症杂志,2015,30(9): 1269-1272.
[4] 李国元,赵久达,王 成,等.HIF-1α和VEGF在胃癌中的表达及临床意义[J].中国癌症杂志, 2010,20(8):602-606.
[5] Yoshihiko, Kitajima,Kohji Miyazaki,et al.The critical impact of HIF-1αon gastric cancer biology[J].Cancer,2013,5(1):15-26.
[6] NRohwer, S Lobitz K, Daskalowetal. HIF-1α determines the metastatic potential of gastric cancer cells[J]. British Journal of Cancer, 2009,100(5):772-781.
[7] Löfstedt T, Fredlund E, Pietras A, et al. Hypoxia inducible factor-2α in Cancer[J]. Cell Cycle,2007,6(8):919-926.
[8] 韩婵婵,李积德,赵君慧,等.HIF-2α、HER-2α与胃癌关系的研究进展[J].中国医学创新,2012,9(36):158-159.
[9] 韩文峰,魏素菊.VEGF-A在肿瘤中的研究进展[J].河北医药,2010,32(6):214-216.
[10]罗翠莲,文庆莲.肿瘤抗血管生成治疗耐药分子机制研究进展[J].肿瘤预防与治疗,2014,27(1):33-34.
[11]Loboda A, Jozkowicz A,Dulak J. HIF-1α and HIF-2α transcription factors-similar but not identical[J]. Mol Cell,2010,29(5):435-442.
[12]Park S, Dadak AM, Volker H, et al. Hypoxia-induced gene expression occurs solely through the action of hypoxia-inducibke factor 1α(HIF-1α): role of cytoplasmic trapping of HIF-2α [J].Mole Cellu Biol,2003,23(14):4959-4971.
[13]Kimw Y, Perera S, Zhou B, et a1.HIF-2 alpha cooperates with RAS to promote lung tumorigenesis in mice [J].J Clin Invest,2009,119 (8):2160-2170.
[14]Adam J, Krieg Cullen M,Taniguchi,et al.Cross-talk between hypoxia and insulin signaling through Phd3 regulates hepatic glucose and lipidetbolism and ameliorates diabetes[J].Nat Med,2013,10(10):1325-1330.
[15]Cristina, Branco-Price, Na Zhang, et al. Endothelial cell HIF-1α and HIF-2α differentially regulate metastatic success[J]. Cancer Cell, 2012, 21(1): 52-65.
[16]吴欣爱,孙 燕,樊青霞,等. siRNA沉默HIF-2α在缺氧状态下对食管鳞癌细胞VEGF表达的影响[J].肿瘤防治研究,2007, 34(10):743-746.
Effect of Silencing HIF- 2α by siRNA on Expression of Vascular Endothelial Growth Factor in BGC- 823 Gastric Adenocarcinoma Cell under Hypoxia*
Liu Cuiyun, Qu Yanli, Tang Yong△, et al
(DigestivesystemdepartmentofAffiliatedTumorHospitalofXinjiangMedicalUniversity,Urumqi830011,Xinjiang,China)
Objective: To investigate the effect of specific silencing hypoxia inducible factor- 2 alpha (HIF- 2α) by small interference RNA(siRNA) on the expression of vascular endothelial growth factor in BGC- 823 gastric cancer cells under hypoxia. To observe the effect of HIF- 2α on hypoxia-activated angiogenesis regulation pathway in gastric carcinoma.Methods: BGC- 823 gastric adenocarcinoma cell line acts as the research subject by purchasing. We used chemical hypoxia inducer cobalt chloride (CoCl2) as a chemical hypoxia-inducible reagent to stimulate tumor hypoxic micro-environment. mRNA and protein levels of HIF- 2α and VEGF were detected by Quantitative Real-time PCR and immunohistochemistry. RNA interference (RNAi) technology was performed to transfect BGC- 823 cells with HIF- 2α siRNA. Results: Under hypoxia, protein levels of HIF- 2α and VEGF were increased obviously. The siRNA targeting HIF- 2α gene down-regulated HIF- 2α gene in cells efficiently, and VEGF gene was down-regulated as well. Conclusion: Hypoxia can increase the expression level of HIF- 2α gene in BGC- 823 cell. HIF- 2α can activate the downstream target gene—VEGF which promotes angiogenesis in gastric cancer under hypoxic microenvironment.
Gastriccancer; Hypoxia Inducible Factor- 2 Alpha; Vascular Endothelial Growth Factor; RNA Interference
2016- 06- 26
2016- 09- 18
*新疆维吾尔自治区自然科学基金(2015211C124)
刘翠云(1991-),女,在读硕士研究生,主要从事消化道肿瘤的临床基础研究。
△唐勇,副教授,E-mail:ae717ty@163.com
R735.2; R730.4
A
10.3969/j.issn.1674- 0904.2016.05.001
