沉默c-met基因表达对胃癌肝高转移潜能细胞生物学行为的影响
2016-02-20呼圣娟师红利姜荣兴贺婵婵
沈 皓,呼圣娟,师红利,姜荣兴,贺婵婵,张 蓉
·论著·
沉默c-met基因表达对胃癌肝高转移潜能细胞生物学行为的影响
沈 皓,呼圣娟,师红利,姜荣兴,贺婵婵,张 蓉
【摘要】背景胃癌肝高转移潜能细胞(XGC9811-L)是本实验组在前期工作中建立的一株具有肝脏高转移潜能的胃癌细胞系,c-met基因在其中高表达。c-met是肝细胞生长因子(HGF)的受体。目的研究沉默c-met基因表达对XGC9811-L的增殖、侵袭和转移等生物学行为的影响。方法2014年1—6月,采用细胞转染法将重组质粒pSuppressorRetro-c-met-siRNA导入XGC9811-L,建立稳定转染细胞系,按有无转染和转染目的基因的不同分为未转染组、空载体组、随机序列组和siRNA组。采用荧光定量反转录-聚合酶链式反应(RT-PCR)法检测XGC9811-L中c-met mRNA相对表达水平,Western blotting法检测c-met相对表达水平,通过细胞增殖实验检测各组细胞增殖能力并绘制细胞生长曲线,通过侵袭实验和运动实验计算各组穿膜细胞数。结果siRNA组c-met mRNA、c-met相对表达水平低于未转染组、空载体组、随机序列组(P<0.05)。siRNA组第3天、第5天、第6天、第7天细胞增殖能力低于未转染组、空载体组、随机序列组(P<0.05)。在侵袭实验中,siRNA组穿膜细胞数少于未转染组、空载体组、随机序列组(P<0.05)。在运动实验中,siRNA组穿膜细胞数少于未转染组、空载体组、随机序列组(P<0.05)。结论沉默c-met基因的表达可以抑制XGC9811-L的增殖、侵袭和转移能力,c-met在胃癌肝转移的发生、发展过程中可能起重要作用,抑制c-met基因表达可能会抑制胃癌细胞向肝脏转移。
胃癌肝高转移潜能细胞(XGC9811-L)是本实验组在前期工作中建立的一株具有肝脏高转移潜能的胃癌细胞系,c-met基因在其中高表达[1]。c-met是肝细胞生长因子(HGF)的受体。为验证c-met基因在XGC9811-L中的作用,本研究运用小干扰RNA(siRNA)技术下调XGC9811-L中c-met水平,阻断HGF/c-met传导通路,研究沉默c-met基因表达对XGC9811-L的增殖、侵袭、转移和运动能力的影响。
1材料与方法
1.1一般材料
1.1.1细胞来源XGC9811-L由第四军医大学肿瘤生物国家重点实验室建立并保存[1]。
1.1.2主要试剂RPMI 1640细胞培养液购于美国Gibco公司;胎牛血清购于杭州四季青生物工程材料有限公司;兔抗人c-met单克隆抗体购于Santa公司,山羊抗兔IgG二抗、β-actin抗体购于北京中杉金桥生物技术有限公司;OMEGA总RNA提取试剂盒购于西安润徳生物技术有限公司,反转录试剂盒购于宝生物工程(大连)有限公司;重组质粒pSuppressorRetro-c-met-siRNA(反转录病毒载体质粒和目的片段siRNA-Met连接的重组质粒,位点为537的靶序列)和兼嗜性反转录病毒包装细胞系(PhoenixA细胞)购于威斯腾生物医药科技有限责任公司;Trizol试剂盒购于Invitrogen公司。
1.2研究方法
1.2.1细胞转染法2014年1—6月,采用细胞转染法将重组质粒pSuppressorRetro-c-met-siRNA导入PhoenixA细胞。PhoenixA细胞按l×105/孔接种于6孔板,培养至细胞80%融合备用。DNA/脂质体复合物的制备方法:1~2 μg重组质粒pSuppressorRetro-c-met-siRNA稀释在1 ml 无血清RPMI 1640细胞培养液中,震荡1 s,加人5~10 μl脂质体悬液,再次震荡混匀,室温下温育5~10 min。转染步骤:吸去PhoenixA细胞培养上清液,用无血清RPMI 1640细胞培养液清洗2次,弃培养液,每孔加人1 ml DNA/脂质体复合物,于CO2恒温培养箱内温育3~5 h;每孔加入1 ml 含20% 胎牛血清的RPMI 1640细胞培养液,于CO2恒温培养箱内温育48 h,收集含病毒的上清液(由PhoenixA细胞短暂表达),立即用于感染靶细胞或于-70 ℃冻存。
1.2.2稳定转染细胞系的建立与分组将目的基因(pSuppressorRetro-c-met-siRNA)、空载体(pSuppressorRetro)、随机序列(pSuppressorRetro-random)分别转染入XGC9811-L,方法如下:将生长良好的1×105/ml的XGC9811-L接种于60 mm2平皿中,1 d后换新鲜的RPMI 1640细胞培养液并加入1 ml含病毒的上清液,加慢病毒感染增强剂Polybrene至终浓度为8 μg/ml,摇匀后继续培养,24 h后用新鲜含病毒的上清液重复感染XGC9811-L,共重复感染3次,每次间隔24 h,最后1次培养24 h后弃培养液,换含G418的选择培养基培养,2~3 d更换选择培养基1次,7~10 d形成细胞克隆,将细胞克隆扩增、冻存。按有无转染和转染目的基因的不同分为未转染组、空载体组、随机序列组和siRNA组。
1.2.3荧光定量反转录-聚合酶链式反应(RT-PCR)法检测XGC9811-L中c-met mRNA相对表达水平转染72 h后收集细胞,按Trizol试剂盒操作说明书提取总RNA。按反转录试剂盒说明将RNA反转录为cDNA,产物进行荧光定量RT-PCR,以GAPDH为内源性对照,c-met上游引物为5′-AATACGTGACGTAGAAAGTA-3′,下游引物为5′-CATGGCTCTAGTTGTCGAC-3′,扩增片段200 bp。GAPDH上游引物为5′-TGACTTCAACAGCGACACCCA-3′,下游引物为5′-CACCCTGTTGCTGTAGCCAAA-3′,扩增片段121 bp。PCR条件:94 ℃预变性1 min,95 ℃变性30 s,58 ℃退火延伸30 s,72 ℃延伸1 min,共进行30个循环。扩增产物进行琼脂糖凝胶电泳,并对凝胶成像进行分析,采用Photoshop16.0软件分析c-met mRNA相对表达水平,实验重复5次,取其均值。
1.2.4Western blotting法检测c-met相对表达水平培养各组细胞至对数期,分别取其蛋白样品20 μl,采用Western blotting法检测c-met相对表达水平:以12%聚丙烯酰胺为分离胶,浓缩胶水平为5%,电泳完毕后经蛋白转至聚乙烯二氟(PVDF)膜上,用10%脱脂牛奶在室温下封闭1 h;以β-actin抗体为内参,分别滴加一抗(兔抗人c-met单克隆抗体,1∶1 000稀释)4 ℃过夜,TBST缓冲液洗5次,5 min/次,滴加二抗(山羊抗兔IgG二抗),室温孵育2 h;最后用化学发光试剂显色5 min,用成像仪拍照记录。采用Photoshop16.0软件分析c-met相对表达水平,实验重复5次,取其平均值。
1.2.5细胞增殖实验取各组XGC9811-L,按照3×103/孔接种于96孔板,每组做3个复孔,置于细胞培养箱中常规培养至细胞贴壁;在第1~7天,每天每种细胞各取出3孔进行计数;每孔加入20 μl 噻唑蓝贮存液〔四甲基唑蓝(MTT) 5 mg/ml〕,继续培养4 h;将培养上清液置换成200 μl二甲基亚砜(Demso),溶解蓝紫色结晶甲瓒(Formazan)产物;设置仅含培养液的孔作为空白对照,用于调零;在酶联免疫检测仪吸光度(OD)为 490 nm处读取OD值;以时间为横坐标,3复孔的平均OD值为纵坐标,绘制细胞生长曲线;各组细胞培养第7天,比较各组细胞增殖能力。实验重复3次,取其平均值。
1.2.6侵袭实验和运动实验用人工基底膜胶Matrigel包被Transwell小室底部,4 ℃风干(运动实验不需此步骤)。将Transwell小室放入24孔培养板中,在小室外加入400 μl按1∶1混合的不含血清的RPMI 1640细胞培养液和含有10%胎牛血清的RPMI 1640细胞培养液;培养各组细胞至对数期,消化各组细胞,1 000 r/min离心5 min(离心半径为3 cm),弃上清液,用磷酸盐缓冲液(PBS)洗涤3次,用含1%胎牛血清的RPMI 1640细胞培养液悬浮细胞,调整细胞密度为2.5×105/ml,每组重复4个样本。侵袭实验常规培养48 h,运动实验培养24 h。取出Transwell小室,PBS冲洗,用棉签擦去微孔膜上层的细胞,95%甲醇溶液固定15 min,Gimsa溶液染色。在显微镜(×100)下随机挑取10个视野计数穿膜细胞数。实验重复5次,取其平均值。
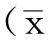
2结果
2.1各组c-met mRNA相对表达水平比较各组c-met mRNA相对表达水平比较,差异有统计学意义(P<0.05)。siRNA组c-met mRNA相对表达水平低于未转染组、空载体组、随机序列组,差异有统计学意义(P<0.05,见表1、图1)。
2.2各组c-met相对表达水平比较各组c-met相对表达水平比较,差异有统计学意义(P<0.05)。siRNA组c-met相对表达水平低于未转染组、空载体组、随机序列组,差异有统计学意义(P<0.05,见表1、图2)。
2.3各组细胞增殖能力比较各组第1天、第2天、第4天细胞增殖能力比较,差异无统计学意义(P>0.05);各组第3天、第5天、第6天、第7天细胞增殖能力比较,差异有统计学意义(P<0.05)。siRNA组第3天、第5天、第6天、第7天细胞增殖能力低于未转染组、空载体组、随机序列组,差异有统计学意义(P<0.05,见表2、图3)。
2.4各组穿膜细胞数比较在侵袭实验中,各组穿膜细胞数比较,差异有统计学意义(P<0.05);siRNA组穿膜细胞数少于未转染组、空载体组、随机序列组,差异有统计学意义(P<0.05)。在运动实验中,各组穿膜细胞数比较,差异有统计学意义(P<0.05);siRNA组穿膜细胞数少于未转染组、空载体组、随机序列组,差异有统计学意义(P<0.05,见表3)。
3讨论
本研究利用siRNA技术沉默了XGC9811-L中c-met基因的表达,并进一步通过细胞增殖实验和转移相关的体外实验证实,缺少了c-met基因的XGC9811-L在细胞增殖、侵袭和转移能力方面明显受到抑制。
本研究选择针对c-met基因537靶序列的siRNA进行实验,将c-met-siRNA转染入XGC9811-L中,建立稳定转染细胞系,荧光定量RT-PCR法、Western blotting法结果显示,siRNA组c-met mRNA、c-met相对表达水平均低于未转染组、空载体组、随机序列组,证实所建立的XGC9811-L /c-met-siRNA细胞系成功地沉默了c-met基因的表达。
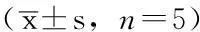
Table 1Comparison of the relative expression levels of c-met mRNA and c-met among the four groups

组别c-metmRNA/GAPDHβ-actin/c-met未转染组0.71±0.07a1.18±0.09a空载体组0.67±0.08a1.36±0.08a随机序列组0.71±0.05a1.24±0.16asiRNA组0.32±0.022.38±0.16F值46.424112.376P值<0.001<0.001
注:与siRNA组比较,aP<0.05;siRNA=小干扰RNA
注:siRNA=小干扰RNA
图14组c-met mRNA荧光定量RT-PCR结果
Figure 1Results of fluorescent quantitation RT-PCR of the four groups

图2 4组c-met Western blotting法结果
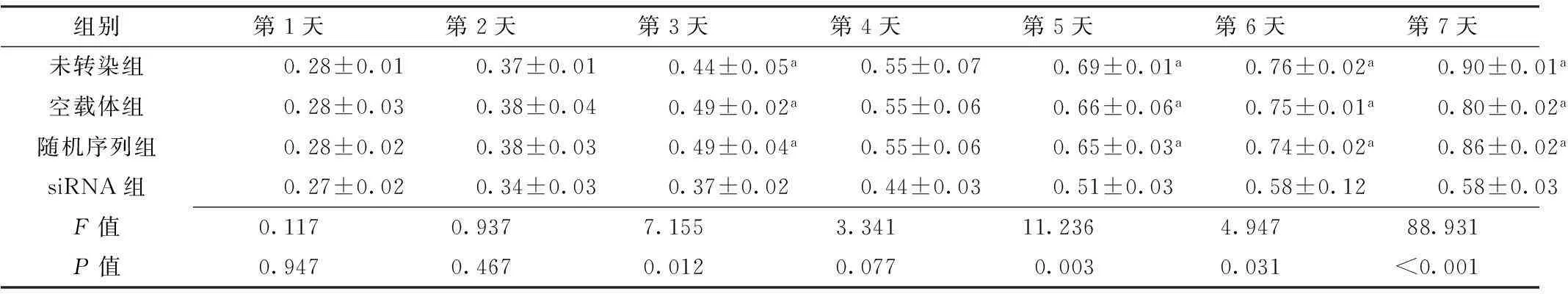
组别第1天第2天第3天第4天第5天第6天第7天未转染组0.28±0.010.37±0.010.44±0.05a0.55±0.070.69±0.01a0.76±0.02a0.90±0.01a空载体组0.28±0.030.38±0.040.49±0.02a0.55±0.060.66±0.06a0.75±0.01a0.80±0.02a随机序列组0.28±0.020.38±0.030.49±0.04a0.55±0.060.65±0.03a0.74±0.02a0.86±0.02asiRNA组0.27±0.020.34±0.030.37±0.020.44±0.030.51±0.030.58±0.120.58±0.03F值0.1170.9377.1553.34111.2364.94788.931P值0.9470.4670.0120.0770.0030.031<0.001
注:与siRNA组比较,aP<0.05
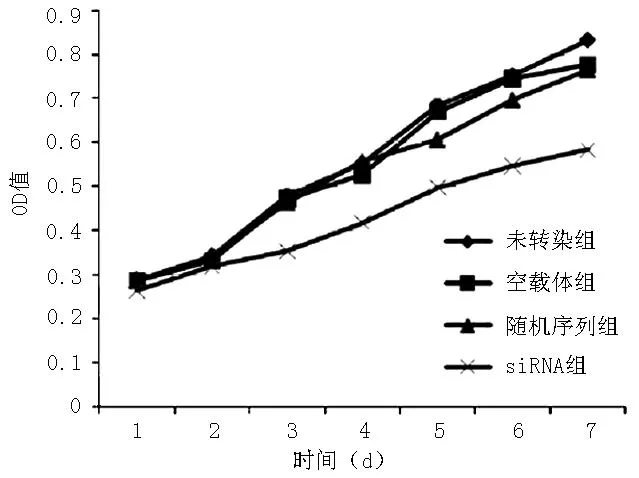
注:OD=吸光度
图34组细胞生长曲线
Figure 3Cell growth curves of the four groups

Table 3Comparison of the number of transmembrane cells among the four groups

组别侵袭实验穿膜细胞数运动实验穿膜细胞数未转染组31.2±6.3a44.6±5.7a空载体组29.8±2.4a42.4±3.2a随机序列组30.3±1.7a39.5±2.6asiRNA组16.4±3.924.2±4.4F值13.25415.596P值<0.001<0.001
注:与siRNA组比较,aP<0.05
HGF/c-met通路广泛存在于多种细胞中,参与调节组织器官的正常生长发育[2]。近年在恶性肿瘤细胞中发现HGF、c-met表达水平增加,HGF与c-met结合并持续激活HGF/c-met通路,促进肿瘤细胞的增殖、侵袭和转移,导致预后不良[3]。Gardner等[4]研究发现,HGF受体c-met在黑色素细胞中的表达能够增强黑色素瘤细胞的肝脏转移能力。Krause等[5]研究表明,c-met通路与结肠癌肝转移相关,并且c-met水平越高,在部分肝切除术后的复发率越高。在胃癌肝转移的相关研究中,Lee等[6]利用免疫组化法检测到c-met在胃癌肝转移组织中的表达水平高于胃癌组织。本研究发现,siRNA组第3天、第5天、第6天、第7天细胞增殖能力低于未转染组、空载体组、随机序列组;siRNA组穿膜细胞数均少于未转染组、空载体组、随机序列组,提示siRNA组XGC9811-L在细胞增殖、侵袭和转移能力方面均受到抑制,且c-met基因在胃癌肝转移过程中可能起重要作用。
本研究只是在细胞水平进行了转移相关的体外实验,不能有效证实c-met基因是否与胃癌肝脏转移相关,需要进一步的体内实验来验证。
综上所述,缺少c-met基因的XGC9811-L在增殖、侵袭和转移能力方面均受到抑制,提示c-met基因在胃癌肝转移的发生、发展过程中可能起重要作用,抑制c-met基因表达可能会抑制胃癌细胞向肝脏转移。
作者贡献:呼圣娟负责实验设计、评估、审校并对文章负责;沈皓、师红利、贺婵婵、张蓉负责实验具体实施,沈皓、姜荣兴负责收集资料和整理,并撰写论文。
本文无利益冲突。
参考文献
[1]Hu SJ,Jiang RX,Xie HH,et al.Purification of a Pd20-TNFα fusion protein that prevents liver metastasis of gastric cancer[J].Tumour Biol,2014,35(8):7523-7529.
[2] Skead G,Govender D.Gene of the month:MET[J].J Clin Pathol,2015,68(6):405-409.
[3]Goyal L,Muzumdar MD,Zhu AX.Targeting the HGF/c-MET pathway in hepatocellular carcinoma[J].Clin Cancer Res,2013,19(9):2310-2318.
[4]Gardner FP,Serie DJ,Salomao DR,et al.c-MET expression in primary and liver metastases in uveal melanoma[J].Melanoma Res,2014,24(6):617-620.
[5]Krause P,Flikweert H,Monin M,et al.Increased growth of colorectal liver metastasis following partial hepatectomy[J].Clin Exp Metastasis,2013,30(5):681-693.
[6]Lee HE,Kim MA,Lee HS,et al.MET in gastric carcinomas:comparision between protein expression and gene copy number and impact on clinical outcome[J].Br J Cancer,2012,107(2):325-333.
(本文编辑:崔丽红)
【关键词】RNA,小分子干扰;基因沉默;原癌基因蛋白质c-met;XGC9811-L
沈皓,呼圣娟,师红利,等 .沉默c-met基因表达对胃癌肝高转移潜能细胞生物学行为的影响[J].中国全科医学,2016,19(3):296-299.[www.chinagp.net]
Shen H,Hu SJ,Shi HL,et al.Effects of silencing of c-met gene expression on biological behavior of gastric cancer cells with high liver-metastatic potential[J].Chinese General Practice,2016,19(3):296-299.
Effects of Silencing of c-met Gene Expression on Biological Behavior of Gastric Cancer Cells With High Liver-metastatic PotentialSHENHao,HUSheng-juan,SHIHong-li,etal.DepartmentofGastroenterology,theFirstPeople′sHospitalofYinchuan,Yinchuan750001,China
【Abstract】BackgroundXGC9811-L,which is a gastric cancer cell line with high liver-metastatic potential,was established in the preliminary work of the study.The expression of c-met is higher in XGC9811-L than in other gastric cancer cell lines,and c-met is the receptor of hepatocyte growth factor.ObjectiveTo research the effects of silencing of c-met gene expression on biological behaviors of XGC9811-L,such as proliferation,invasion and metastasis.MethodsFrom January to June 2014,using cell transfection method,we imported recombinant plasmid pSuppressorRetro-c-met-siRNA into XGC9811-L cells and built stable transfection cell lines.Based on whether transfection was made and the difference in the target genes of transfection,the stable transfection cell lines were divided into four groups:non-transfection group,empty carrier group,random sequence group and siRNA group.Fluorescent quantitation RT-PCR method was adopted to detect the relative expression level of c-met mRNA in XGC9811-L;c-met relative expression was measured by western blotting method.By cell proliferation assay,the cell proliferation ability of each group was detected,and cell growth curves were drawn.Invasion assay and movement experiment were conducted to calculate the number of transmembrane cells of each group.ResultssiRNA group was lower than the other three groups in the relative expression levels of c-met mRNA and c-met (P<0.05).siRNA group was lower than the other three groups in cell proliferation ability on day 3,day 5,day 6 and day 7 (P<0.05).In invasion assay,siRNA group was less than the other three groups in the number of transmembrane cells (P<0.05).In movement experiment,siRNA group was less than other three groups in the number of transmembrane cells (P<0.05).ConclusionSilencing of c-met gene expression can inhibit the proliferation,invasion and metastasis of XGC9811-L,and c-met may play an important part in the occurrence and development of gastric hepatic metasis.The inhibition of c-met expression can inhibit the metastasis of gastric cancer cell to liver.
【Key words】RNA,small interfering;Gene silencing;Proto-oncogene proteins c-met;XGC9811-L
(收稿日期:2015-06-27;修回日期:2015-11-06)
【中图分类号】R 735.2
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.03.011
通信作者:呼圣娟,750000 宁夏银川市,宁夏回族自治区人民医院消化内科;E-mail:hsj.judy@163.com
基金项目:国家自然科学基金资助项目(81060193);宁夏自然科学基金资助项目(NZ1283)
作者单位:750001宁夏银川市第一人民医院消化内科(沈皓),放射科(姜荣兴);宁夏回族自治区人民医院消化内科(呼圣娟,师红利,贺婵婵,张蓉)
