早产儿低血糖临床干预阈值的探讨
2016-02-20陈艳玲陈葵带王义烔洪玉玲李曼莎暨南大学医学院附属东莞医院新生儿科广东东莞523900
陈艳玲 李 薇 陈葵带 王义烔 洪玉玲 李曼莎暨南大学医学院附属东莞医院新生儿科,广东东莞 523900
早产儿低血糖临床干预阈值的探讨
陈艳玲 李 薇▲陈葵带 王义烔 洪玉玲 李曼莎暨南大学医学院附属东莞医院新生儿科,广东东莞 523900
目的探讨早产儿低血糖的临床干预阈值。方法早产儿共107例,入院后连续监测血清葡萄糖及振幅整合脑电图(aEEG)6h。根据血糖水平分为4组,正常对照组:血糖维持在3.30~6.10mmol/L;Ⅰ组:监测期间至少一次血糖处于2.60~3.29mmol/L;Ⅱ组:至少一次血糖处于2.20~2.59mmol/L;Ⅲ组:至少一次血糖<2.20mmol/L。利用aEEG评分系统进行评分,将相应胎龄及校正胎龄早产儿总分的平均值减去原始分得校正后总分(ATS),以消除不同胎龄及校正胎龄所致差异,该值越大提示脑损伤越重。结果(1)Ⅰ、Ⅱ、Ⅲ组间低血糖持续时间比较,差异无统计学意义;(2)与对照组[(0.03±0.85)分]比较,Ⅱ组[(0.58±0.90)分]和Ⅲ组[(1.08±1.31)分] ATS较大,差异有统计学意义(P<0.05),而Ⅰ组[(0.07±0.87)分]与对照组差异无统计学意义;(3)与Ⅰ组比较,Ⅱ组和Ⅲ组的ATS较大,差异有统计学意义(P<0.05);(4)Ⅲ组的ATS比Ⅱ组大,组间差异无统计学意义(P>0.05)。结论可能引起脑功能受损的血糖阈值,即应考虑采取临床干预的血糖阈值是<2.6mmol/L,无论是否伴有临床症状。
早产儿;低血糖;干预阈值;振幅整合脑电图;低血糖性脑损伤
低血糖症(hypoglycemia)是早产儿常见的代谢性疾病,如未及时发现和处理,有可能导致低血糖性脑损伤(hypoglycemic brian injury,HBI),遗留癫痫、视力障碍、精神运动发育迟缓等后遗症,应引起高度重视[1-2]。准确识别可能引起脑功能障碍的血糖水平,及时采取临床干预措施,对预防HBI至关重要。现多主张不论胎龄和日龄,<2.2mmol/L诊断为低血糖症,但该值并不能代表致大脑功能障碍的低血糖阈值。WHO目前推荐,不论是否伴有临床症状,血清葡萄糖2.6mmol/L为足月儿和早产儿的低血糖干预阈值,但该值仍需更多的临床研究证实或修正。
振 幅 整 合 脑 电 图(amplitude integrated electroencephalogram,aEEG)是脑电连续记录简化形式,具有简便、容易识别、可床旁动态监测等优点[3]。本研究对107例早产儿进行aEEG监测,参照Burdjalov等[4]创建的评分系统对aEEG图形评分,探讨较适宜的早产儿低血糖干预阈值。
1 资料与方法
1.1 一般资料
选择2014年9月~2016年1月暨南大学医学院附属东莞医院新生儿科收住的早产儿107例。入选标准:(1)日龄≤1d,外观无畸形;(2)排除明显围产期缺氧病史,颅内出血,颅内感染,脑发育异常,败血症,先天性代谢性疾病及内分泌疾病者。所有研究均获得本院医学伦理委员会审核通过及患儿家属的知情同意。
1.2 研究方法
1.2.1 血糖监测及处理 应用瑞士罗氏全自动生化分析仪检测血清血糖。血糖的正常参考值为3.30~6.10mmol/L。血清血糖<2.6mmol/L即采取干预措施,包括喂哺母乳或配方奶、持续静脉输注葡萄糖液等;如血清血糖<2.2mmol/L,10min内静脉缓慢推注10%葡萄糖液2mL/kg,然后按8mg/(kg·min)持续静脉输注。所有研究对象每h复测一次血糖至生后3h,如出现低血糖每0.5~1小时复测1次血糖,如血糖正常每2小时复测1次,共监测6h。
1.2.2 研究分组 根据入院后6h内监测的血清血糖分成4组。正常对照组(30例):监测期间血糖稳定在3.30~6.10mmol/L;Ⅰ组:监测期间至少一次血糖处于2.60~3.29mmol/L;Ⅱ组:监测期间至少一次血糖处于2.20~2.59mmol/L;Ⅲ组:监测期间至少一次血糖<2.20mmol/L。
1.2.3 aEEG的记录 采用美国Nicolet-one脑功能监护仪。电极放置于双侧顶骨(相当于10/20国际电极安放法电极位置的P3、P4处,参考电极在距头顶中央25mm额中线上),脑电信号以半对数形式记录。所有研究对象于入院后即行aEEG描记6h。
1.2.4 aEEG图形分析盲法判读 参照早产儿aEEG评分系统[2]对各参数进行评分,求出总分,将相应胎龄及校正胎龄早产儿总分的平均值减去原始分得校正后总分(ATS),以消除不同胎龄及校正胎龄所致差异。ATS越大,提示aEEG异常程度越明显。
1.3 统计学方法
应用SPSS 19.0软件进行分析。计量资料以(x±s)表示,经方差齐性分析后,组间比较采用t检验;计数资料以百分比表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组一般情况比较
4组早产儿在胎龄、性别、出生体重等方面比较,差异均无统计学意义(P>0.05),具有可比性。Ⅰ、Ⅱ、Ⅲ组间低血糖持续时间比较,差异无统计学意义(P>0.05)。见表1。
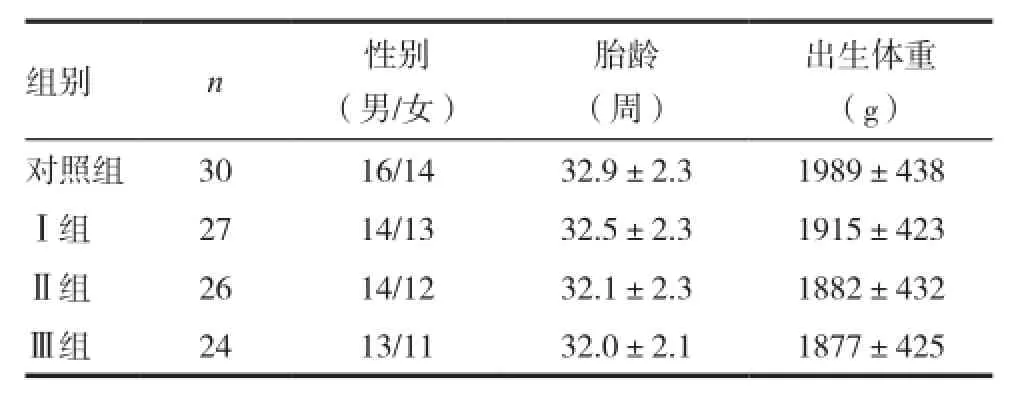
表1 4组新生儿的临床资料比较
2.2 各组aEEG图形的ATS比较
四组aEEG图形的ATS比较,F=6.322,P<0.05,具有统计学意义。对照组与Ⅰ组间差异无统计学意义(t=-0.178,P>0.05),而Ⅱ组、Ⅲ组的ATS均高于对照组,差异有统计学意义(t= -2.319,-3.384,P<0.05)。Ⅱ组、Ⅲ组的ATS均高于Ⅰ组,差异有统计学意义(t=-2.061,-3.185,P<0.05), Ⅲ组的ATS比Ⅱ组高,差异无统计学意义(t=-1.574,P>0.05)。见表2、3。
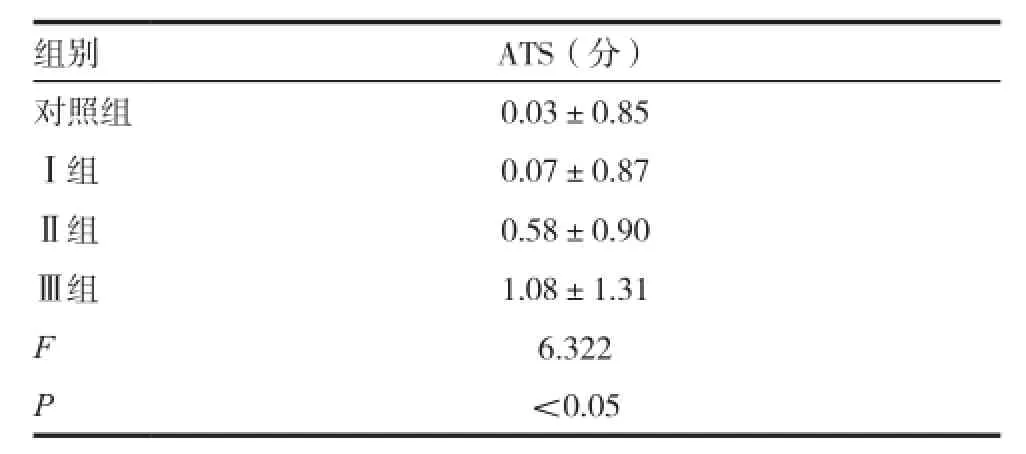
表2 4组新生儿ATS分值
3 讨论
低血糖的临床干预阈值(operational thresholds)[5],即临床工作者需考虑采取临床干预的血糖水平尚无统一定论。干预阈值应选取可能引起脑功能障碍的血糖值,无论是否伴有临床症状。常用研究途径主要包括检测脑血流[4]、内分泌激素[6]、感官诱发电位[7]、头颅影像学(MRI、DWI等)[8]、NBNA评分[9]等。综合以往研究,WHO推荐血浆血糖2.6mmol/L为足月儿和早产儿的低血糖干预阈值,无论是否伴有临床症状,该值仍需更多的临床研究以证实或更新。廖景文等[10]通过比较128例新生儿闪光视觉诱发电位主波潜伏期变化,提出引起脑功能障碍的血糖阈值是<2.6mmol/L。本研究采用aEEG检测脑功能改变,以探索引起脑功能障碍的血糖范围,用于指导临床工作。郭志梅等[11]报道,aEEG在诊断低血糖脑损伤与MRI一致,aEEG异常可出现在低血糖发生当天,较MRI能更早发现脑损伤并可动态监测。祝伟等[12]报道,低血糖脑损伤新生儿的脑电生理功能异常程度与临床预后密切相关,脑电生理功能测定能直观、准确地反映神经损伤状态,利于临床预后早期评估。
aEEG的主要参数包括背景活动的连续性(cuntinuity)、睡眠觉醒周期(sleep-wake cycling,SWC)、下边界振幅(amplitude of lower border)、波谱带宽度(bandwidth)及癫痫样电活动。SWC反映了较高级中枢神经系统的功能,它的出现和稳定是新生儿脑功能状态良好的重要表现;SWC的逐步恢复也提示受损脑功能的逐步恢复[13]。Burdjalov等[4]综合以往的研究资料创建了一个aEEG评分系统,综合各参数的变化,并对其进行量化。据报道,该评分系统客观反映新生儿不同的脑电活动,有助于对脑损伤患儿aEEG图形进行客观评价,便于不同患儿间aEEG图形的比较和同一患儿不同时间点的比较[14]。
本研究参照该评分系统,对不同血糖范围早产儿的aEEG图形进行分析。Ⅰ、Ⅱ、Ⅲ组间低血糖持续时间比较,差异无统计学意义,可排除低血糖持续时间不同对结果的干扰。研究结果提示,血糖<2.6mmol/L即可能出现aEEG异常,即血糖<2.6mmol/L可能引起脑细胞功能障碍,且血糖越低,对脑的损害越大。
对所有新生儿采取同一个干预阈值是不尽合理的,因为低血糖是否引起脑损伤及其严重程度还需考虑患儿本身是否同时合并早产、围产期缺氧缺血、感染等诸多病理因素[15-19]。综上,临床工作者应将血糖<2.6mmol/L作为临床干预的参考值,同时需结合实践灵活调整。
[1]龚华,孙玲.新生儿低血糖发生情况及其影响因素分析[J].中国妇幼保健,2014,29(20):3268-3269.
[2]Adamkin DH.Postnatal glucose homeostasis in late-preterm and term infants[J].Pediatrics,2011,l27(3):575-579.
[3]刘芳.振幅整合脑电图监测新生儿脑功能的评价[J].中国实用儿科杂志,2006,21(11):875-877.
[4]Burdjalov VF,Baumgart S,Spitzer AR.Cerebral function monitoring: A new scoring system for the evaluation of brain maturation in neonates[J].Pediatrics,2003,112(4):855-861.
[5]Cornblath M,Hawdon JM,Williams AF,et al.Controversies regarding definition of neonatal hypoglycemia: Suggested operational thresholds[J].Pediatrics,2000,105(5):1141-1145.
[6]Van De Ven KC,De Galan BE,Van Der Graaf M,et al.Effect of acute hypoglycemia on human cerebral glucose metabolism measured by 13C magnetic resonance spectroscopy[J].Diabetes,2011,60(5):1467-1473.
[7]Koh TH,Aynsley-Green A,Tarbit M,et al.Neural dysfunction during hypoglycaemia[J].Arch Dis Child,1988,63(11):1353-1358.
[8]关文华,孙新峰,史展,等.新生儿低血糖脑损伤早期DWI表现与临床相关因素分析[J].中国妇幼保健,2015,30(28):4882-4884.
[9]尤金英,梁志明,李建国,等.新生儿低血糖脑损伤的预后观察[J].中国妇幼保健,2014,29(30):4943-4945.
[10]廖景文.新生儿低血糖临床干预阈值探讨[J].中国小儿急救医学,2012,19(1):64-66.
[11]郭志梅,刘芳,周春风,等.新生儿低血糖脑损伤振幅整合脑电图特征研究[J].临床儿科杂志,2013(11):1019-1023.
[12]祝伟,张成云.新生儿低血糖脑损伤时脑电生理功能改变与临床预后的关系[J].中国妇幼保健,2014,29(8):1201-1203.
[13]刘晓燕,吴逊.临床脑电图学[M].北京:人民卫生出版社,2006:541-575.
[14]程国强,施亿赟,邵肖梅,等.振幅整合脑电图评分系统评价新生儿脑发育的临床价值[J].中华围产医学杂志,2012,15(4):234-237.
[15]周彩玲,林丹,郏丽娜,等.新生儿低血糖的临床表现及高危因素分析[J].中国现代医生,2016,54(8):53-56.
[16]赵惠琴.新生儿低血糖的病因分析与治疗体会[J].现代诊断与治疗,2015,26(12):2806-2807.
[17]黄笑群,翁志媛,宋敏.家长参与式技能训练对新生儿低血糖脑损伤预后的影响[J].现代医院,2015,15(5):155-156.
[18]田瑾 ,刘艳云.美国新生儿低血糖管理指南在基层医院临床应用的可行性和必要性[J]. 中外医学研究,2016,14(14):31-32.
[19]霍洁玲.妊娠期糖代谢异常孕妇产程中血糖水平管理与新生儿低血糖的关系研究[J].现代诊断与治疗,2015,26(7):1545-1546.
Clinical intervention threshold of premature hypoglycemia
CHEN Yanling LI Wei CHEN Kuidai WANG Yitong HONG Yuling LI Mansha Department of Neonatology, Ji'nan University Medical College Affiniated Dongguan Hospital, Dongguan 523900,China
ObjectiveTo search clinical intervention threshold of premature hypoglycemia.MethodsSerum glucose and continuous aEEG was monitored for 6h immediately after admission.107 premature infants in our hospital were divided into 4 groups: normal control group (serum glucose ranged 3.30~ 6.10mmol/L during monitoring),groupⅠ (serum glucose ranged 2.60~ 3.29mmol/L at least once during monitoring), groupⅡ (serum glucose ranged 2.2~ 2.59mmol/L at least once during monitoring), group Ⅲ (serum glucose <2.2mmol/L at least once during monitoring). aEEG recordings scoring system were used to record continuity, sleep-waking cycle, degree of voltage amplitude depression and bandwidth. All variables were summed to yield a total score. The total scores were correlated with gestational and postconceptional ages, called adjusted total score(ATS). Higher ATS suggests severer brain injury.ResultsThere were no significant differences in duration of hypoglycemia between group Ⅰ, group Ⅱand group Ⅲ(P>0.05). The ATS in group Ⅱ(0.58±0.90 points) and group Ⅲ (1.08±1.31points) were significantly higher than that in groupⅠ (0.07±0.87points) and the normal control group (0.03±0.85 points) respectively(P< 0.05), and there were no significant differences in group I as compared with the normal control group. The ATS in group Ⅲ were higher than that in group Ⅱ(P<0.05).ConclusionWhether the premature has any clinical manifestations or not, it appears that the threshold of serum glucose for clinical intervention of neonatal hypoglycemia is less than 2.6mmol/L.
Hypoglycemia; Premature; Intervention threshold; Amplitude integrated electroencephalogram;Hypogly cemic brian injury
R722
B
2095-0616(2016)22-45-03
2016-09-05)
广东省东莞市医疗卫生科技计划(2014105101249 )。
▲通讯作者
