CCR9及其配体CCL25在肿瘤中的作用及其作用机制研究进展
2016-02-17王志维牛玉旭
王志维 牛玉旭 林 辉
(1 武汉大学人民医院胸心外科,武汉市 430060,E-mail:wangzhiwp@sina.com;2 广西壮族自治区人民医院胸心外科,南宁市 530021)
综 述
CCR9及其配体CCL25在肿瘤中的作用及其作用机制研究进展
王志维1牛玉旭1林 辉2
(1 武汉大学人民医院胸心外科,武汉市 430060,E-mail:wangzhiwp@sina.com;2 广西壮族自治区人民医院胸心外科,南宁市 530021)
癌症严重威胁人类的生命健康,放射治疗、化学治疗和手术治疗是目前主流的治疗方式,但其弊端也是不可忽视的。近年来,趋化因子与肿瘤的相关研究越来越深入。趋化因子受体9(CCR9)在多种恶性肿瘤中过度表达,而CC族趋化因子配体25(CCL25)是CCR9的唯一配体,CCL25/CCR9与肿瘤的发生及进展关系密切。本文围绕CCL25/CCR9的现阶段研究成果进行综述。
肿瘤;趋化因子受体9;CC族趋化因子配体25;分子机制;综述
随着我国经济的快速发展,人口老龄化不断加剧,社会的工业化、城市化以及生活方式的改变,我国慢性非传染性疾病的负担日益加重,其所致死亡比例已占所有疾病死亡的82.45%,其中恶性肿瘤占全死因的22.32%[1]。最新版的《全球癌症报告2014》指出,2012年全球癌症患者和死亡病例均大幅度增加,有1 400万人被诊断患癌,预测至2035年将增至2 400万[2]。2012年全球罹患人数最多的3大癌症依次为肺癌(180万)、乳腺癌(170万)、大肠癌(140万);近一半的新增癌症病例出现在亚洲,其中大部分在中国,中国新增癌症病例在全球位居第一;中国新增307万癌症患者,其中约220万人死亡,分别占全球总量的21.9%和26.8%。男性发病率最高的前3位癌症分别是肺癌、前列腺癌、大肠癌,女性则是乳腺癌、大肠癌、宫颈癌[3]。
目前,对于大多数癌症,手术疗法、放射疗法及化学疗法是主要的治疗手段,三者都能不同程度地延长患者生命、提高患者生存质量,但均存在巨大弊端,其中手术给患者带来巨大创伤,术后恢复期长,而放、化疗过程也让患者痛苦不堪。近年来,随着分子生物学的发展,靶向治疗为癌症患者带来了福音,提供了一条新的治疗途径,其可对肿瘤细胞发生、发展、转移、侵袭等过程进行针对性治疗,比如靶向基因-病毒治疗[4-7]、抗体治疗、RNA干扰技术、小分子靶向药物和纳米技术等。同时越来越多的研究表明,CC族趋化因子配体25(C-C motif chemokine ligand 25,CCL25)/趋化因子受体(C-C motif chemokine receptor,CCR)9与肺癌[8-10]、前列腺癌[11]、乳腺癌[12]、卵巢癌[13]、胰腺癌[14-15]以及黑色素瘤[16]等多种肿瘤关系密切,寻求CCL25/CCR9方面的突破,或许会给肿瘤防治带来曙光。本文主要对近年来CCL25/CCR9的研究进展作一综述,并探讨其发展前景。
1 CCL25/CCR9的生物学特征
趋化因子是一系列结构类似、有20%~70%氨基酸同源性的小分子细胞因子超家族,以结合特异性的7次跨膜G蛋白偶联受体的方式定位在细胞表面发挥作用[17]。趋化因子目前分为四大家族,包括α趋化因子(CXC亚族)、β趋化因子(CC亚族)、γ-趋化因子(C亚族)和δ-趋化因子(CX3C亚族)[17-18]。CCL25 又称为胸腺表达趋化因子,由Vicari等[19]在人和小鼠的胸腺中发现的,主要在胸腺和小肠上皮表达,对来自脾、肠淋巴组织和小肠自身分泌IgA的细胞具有趋化活性,是CCR9的唯一配体。CCR9既往被称为孤儿G蛋白偶联受体-9-6(G protein-coupled receptor-9-6,GPR-9-6),在1996年由Bonner等发现,后经Zaballos等证明是CCL25的特异性受体[20]。其可以调节CCR9阳性CD4+T淋巴细胞的趋化运动,参与多种生理和病理过程,在炎症反应、免疫细胞发育和分化、过敏性疾病、白细胞运输的调节、免疫系统的自身稳定等过程中发挥重要作用[21],被认为是归巢淋巴细胞的表面标志。
2 CCL25/CCR9在相关肿瘤方面的研究进展
研究表明, CCR9与肿瘤的器官特异性转移有关[22],在多种恶性肿瘤中过度表达,与肿瘤的发生及进展关系密切[23]。趋化因子作为关键的调节介质,不仅介导癌细胞归巢到转移灶,还会募集多种类型细胞到肿瘤微环境,其中包括肿瘤相关巨噬细胞、肿瘤相关白细胞、癌相关成纤维细胞、肿瘤相关嗜中性粒细胞、间充质细胞以及内皮细胞等[24]。
2.1 CCL25/CCR9与黑色素瘤、结肠癌等肿瘤 Letsch等[25]曾发现CCR9会在黑色素瘤小肠转移灶表达。而CCL25/CCR9生物轴很有可能会募集CCR9阳性表达的T细胞到小肠,而这些细胞在溃疡性结肠炎和克罗恩病等肠道病变中也发挥着重要的调节作用[26]。CCR9表达于黑色素瘤细胞,增强细胞的运动性,很可能是黑色素瘤转移到小肠过程中的“归巢受体”[27]。Amersi等[16]对198例已发生转移黑色素瘤患者的肿瘤组织CCR9表达情况进行研究后发现,96例肝、肾脏、肺、膀胱、胰腺、胃、肾上腺及结肠等部位的转移性黑色素瘤CCR9全部阴性,而102例小肠部位的转移性黑色素瘤,其中有88例表达CCR9;此外,23例原发黑色素瘤的石蜡标本中11例为CCR9阳性,其中CCL25在CCR9阳性标本的表达要高于CCR9阴性标本;体外迁移侵袭实验结果显示CCR9阳性的黑色素瘤细胞能在CCL25作用下发生迁移,通过给予抗CCR9抗体拮抗或RNA干扰能阻断该迁移侵袭过程。Kuhnelt-Leddihn等[28]使用免疫组织化学法对38例原发性黑色素瘤组织CXC族趋化因子受体(chemokine CXC-motif receptor,CXCR)4、CCR7、CCR9和CCR10的蛋白质进行了测定,发现CXCR4和CCR9过度表达与患者生存以及预后无明显相关性,而CCR7和CCR10的过度表达则会预示着患者生存率降低以及预后不良。以上研究结果表明CCL25/CCR9参与黑色素瘤的发展、侵袭及转移,但能否作为黑色素瘤患者预后的评价指标,还有待进一步深入研究。
CCR9及其配体CCL25组成的信号轴对于小肠和结肠非常重要。小肠和结肠上皮细胞可以产生CCL25[29-31],而后者能吸引CCR9阳性T淋巴细胞进入肠道。 Chen等[32]发现,相对于正常结肠黏膜,CCR9在腺癌和侵袭前结直肠癌细胞中的表达上调,同时发现原发性结直肠癌细胞株及从早期肿瘤中分离的结肠癌细胞株全部为CCR9阳性。这表明CCR9可能在结肠癌的发生、发展过程中发挥重要作用。同时,Chen等[32]通过体内实验分析,注入小鼠体内的CCR9阳性的早期结肠癌起始细胞(colon-cancer-initiating cell,CCIC),全部可以形成正常的结肠、小肠异种移植物;而通常使用的结直肠癌细胞株、CCR9阴性的CCIC仅能形成胃肠外肿瘤,从而认为通过阻断CCL25/CCR9生物轴可以抑制CCIC形成结肠或者小肠肿瘤,但却会增加肠外肿瘤的多样性,并且该阻断过程与促进CCR9蛋白酶降解及抑制CCL25介导的蛋白激酶(Akt)信号通路密切相关。该研究证明了结肠癌与CCL25/CCR9生物轴之间紧密的联系,但目前CCL25/CCR9在结肠癌领域的研究偏少,尚需进一步系统性的研究。
2.2 CCL25/CCR9与前列腺癌 Sharma等[23]在比较正常前列腺上皮细胞和多种前列腺癌细胞系中的CCR9和CCL25的表达水平时发现,CCR9在前列腺淋巴结癌细胞系(lymph node carcinoma of prostate cell line,LNCaP)中高度表达,在前列腺癌细胞系(prostate cancer cell line-3,PC3)中为中度表达但强于前列腺上皮细胞,这提示前列腺癌细胞系比前列腺上皮细胞有更高的CCR9表达量;而阻断CCL25/CCR9相互作用可以降低PC3和LNCaP细胞的迁移侵袭能力。曾有学者发现,CCL25/CCR9在特定生物环境下具有抗凋亡作用,因此前列腺癌细胞系中CCR9及转移部位的CCL25表达均增高,不仅能吸引循环中的癌细胞还能在保护癌细胞方面起积极作用[23]。这表明CCL25的靶向阻断药物配合化疗药物或许会为前列腺癌临床治疗提供一种新选择。
2.3 CCL25/CCR9与胰腺癌 李杰等[14]发现在胰腺癌引流淋巴结中,CCR9及CCL25的表达均高于胰腺癌组织,而胰腺癌组织中CCR9、CCL25的表达高于良性病变组织;并且CCR9和CCL25与淋巴结转移显著相关,随着癌细胞分化程度的降低和临床病理分期的增加,表达呈增长趋势。这提示CCL25/CCR9可能在胰腺癌发生淋巴结以及远处转移过程中起促进作用。Heinrich等[33]的研究也得到了相似的结果,其发现CCR9、CCL25在正常的胰腺组织中不表达,而CCR9在胰腺癌组织中高表达,CCL25在癌细胞和肿瘤旁基质细胞中高表达。其在随后的迁移侵袭实验中,也证实了CCL25能增强胰腺癌-1(pancreatic cancer-1,PNAC-1)细胞的侵袭性,同时发现给予抗CCR9抗体则能减少侵袭细胞的数量,减弱PNAC-1细胞的侵袭性,抑制PNAC-1细胞侵袭的发生发展。同时期,Shen等[34]发现CCR9在人和鼠的胰腺内皮肿瘤样病变组织均有表达,而在后续的实验中进一步证实,CCR9在人和鼠细胞株(如PanIN、5143PDA、5143LM、PANC-1和HPDE)上都有表达,并且在细胞株5143PDA、PANC-1中的表达率更高,CCL25/CCR9对胰腺内皮肿瘤样细胞及胰腺癌细胞株PANC-1的增殖具有促进作用,提示CCL25/CCR9在胰腺内皮肿瘤样病变的恶变过程中发挥作用。因此CCL25/CCR9在胰腺癌的发生、发展过程中作用不可忽视。
2.4 CCL25/CCR9与非小细胞肺癌 王志维等[10]发现在非小细胞肺癌组织中的CCR9蛋白阳性率明显高于癌旁正常肺组织,CCR9表达与非小细胞肺癌病理组织类型、淋巴结转移、p-TNM分期有关,CCR9蛋白表达与患者术后总生存率呈负相关,且CCR9是非小细胞肺癌NSCLC患者术后总生存率的独立预测因素。钟永泷等[35]也得到了相似的实验结论,并且还发现癌组织中的CCR9阳性表达率(61.25%)远高于癌旁正常组织(3.75%),并且CCR9在肺腺癌组织中的阳性表达率为73.53%,高于肺鳞癌组织的50.00%。Gupta等[9]进一步发现非小细胞肺癌患者血清中的CCL25明显上升,且与病理组织类型相关,同时还发现CCL25可对基质金属蛋白酶(matrix metalloproteinase,MMP)和基质金属蛋白酶组织抑制剂(tissue inhibitor of matrix metalloproteinases,TIMPs)进行调节从而发挥作用。因此,CCR9与非小细胞肺癌之间关系密切,但目前CCR9对肺癌发生、发展及转移的具体分子机制尚不明确,还需进一步探索。
2.5 CCL25/CCR9与卵巢癌 Singh等[13]通过体外迁移侵袭实验发现CCL25可以诱导卵巢癌细胞迁移,而CCR9抗体可阻断该迁移侵袭过程;并发现在癌细胞中CCR9呈过度表达;此外CCL25对OVCAR-3、CAVO-3细胞系的MMP具体调节作用不同,其中OVCAR-3细胞系中MMP-2、MMP-3、MMP-8、MMP-9、MMP-10、MMP-11、MMP-13的m-RNA和蛋白表达较对照组会明显升高,CAVO-3细胞系在CCL25作用下MMP-1、MMP-8、MMP-3、MMP-10、MMP-2的蛋白以及MMP-2的m-RNA的表达会提高。而MMP在卵巢癌的侵袭转移中有重要中作用。另外一项研究表明,CCL25/CCR9能提高卵巢癌细胞内抗凋亡信号的级联反应,避免顺铂诱导的细胞死亡[36]。上述研究提示,CCL25/CCR9能减少顺铂诱导的卵巢癌细胞凋亡,在卵巢癌的发生、发展以及治疗方面有着重要的意义,值得继续深入研究。
2.6 CCL25/CCR9与乳腺癌 Johnson-Holiday等[12]发现CCR9在乳腺癌细胞中呈高表达,并且随着细胞侵袭性增强其表达量也会逐渐增加;而CCL25可促进MMP-2、MMP-9、MMP-11、MMP-13的m-RNA、蛋白以及MMP-1蛋白的表达,该过程能在抗CCR9抗体参与的情况下被抑制。该研究结果与Johnson等[37]的实验结果相吻合,进一步提示该过程是CCL25/CCR9共同参与完成的。而Johnson等[37]还发现,CCL25/CCR9能增强乳腺癌细胞的存活,且能诱导磷脂酰基醇3-激酶(phosphoinositide 3-kinase,PI3K)/Akt途径的激活及下游调节因子糖原合成酶激酶(glycogen synthase kinase,GSK)-3β和叉头转录因子(forkhead-type transcription factors,FKHR)的磷酸化,PI3K抑制剂渥曼青霉素可阻断该过程。MMP是一组金属锌离子依赖性内肽酶,是人体内降解细胞外基质的主要酶类,其中MMP-2,MMP-9 能够特异的降解细胞外基质和基底膜的主要成分 IV 型胶原,被认为是肿瘤侵袭转移过程中重要的MMP[38]。TIMPs是一种内源性的 MMP天然抑制剂,在正常组织中的MMPs与TIMPs之间保持相对平衡状态,共同维持着ECM的降解或聚集。因此,CCL25/CCR9生物轴在乳腺癌细胞侵袭、存活及顺铂耐药性上有着重要作用,而其分子机制与FAK无关,主要涉及PI3K/Akt途径。
3 CCL25/CCR9 调控肿瘤发生、发展等过程的可能分子机制
3.1 PI3K/AKT信号通路在肿瘤细胞侵袭、转移中的作用 PI3K/Akt信号通路是机体内非常重要的信号通路之一,参与多种生长因子的信号传导,与细胞的生理功能和某些疾病的发生、发展密切相关。 Akt是信号转导途径中重要蛋白激酶,为 PI3K 下游的靶蛋白,是PI3K/Akt信号通路的核心。活化的Akt通过磷酸化作用激活或抑制其下游靶蛋白,如哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)、B淋巴细胞瘤-2蛋白(B-cell lymphoma-2,BCL-2)家族、转录因子E2F-1、GSK3和S6蛋白激酶等,与肿瘤的发生、发展密切相关。Li等[39]发现在恶性肿瘤中,活化的PI3K/Akt/mTOR途径可上调MMP-2表达。而水通道蛋白3(aquaporin-3)通过激活PI3K/Akt信号通路,正反馈调节胃癌细胞的 MMP表达,从而促进癌细胞侵袭、迁移[40]。 Lee等[41]的研究结果提示,活化的Akt能够增加核转录因子κB的转录活性,使MMP-2、MMP-9表达增加,有助于癌细胞侵袭。淋巴管生成是肿瘤淋巴结转移的早期事件,也是其中的必要环节。同时,VEGF(vascular endothelial growth factor, VEGF)是一种重要的血管生成因子,VEGF-C、VEGF-D是VEGF家族中的新成员,又称为淋巴管生成因子,两者的受体均为血管内皮生长因子受体3(vascular endothelial growth factor receptor-3,VEGFR-3),特异地表达于淋巴管内皮细胞上。研究发现,VEGF-C、VEGF-D及其受体VEGFR-3是调控淋巴管生成最重要的信号通路,与恶性肿瘤淋巴结转移密切相关。研究表明,VEGF-C、VEGF-D与VEGF的受体VEGFR-3结合后,通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和PI3K信号通路促进淋巴管内皮细胞的增殖和迁移,增加新生淋巴管的数目[39,42]。Yu等[43]在非小细胞肺癌的研究中发现,细胞色素P450ω-羟化酶通过激活PI3K与胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)信号通路,上调 MMP-9表达,从而促进肿瘤侵袭。总之,某些特定因子通过活化以PI3K/Akt信号通路为中心的、复杂的网络,调控VEGF、MMP及TIMPs的表达,从而在肿瘤细胞的侵袭、转移过程中发挥作用。具体机制见图1。
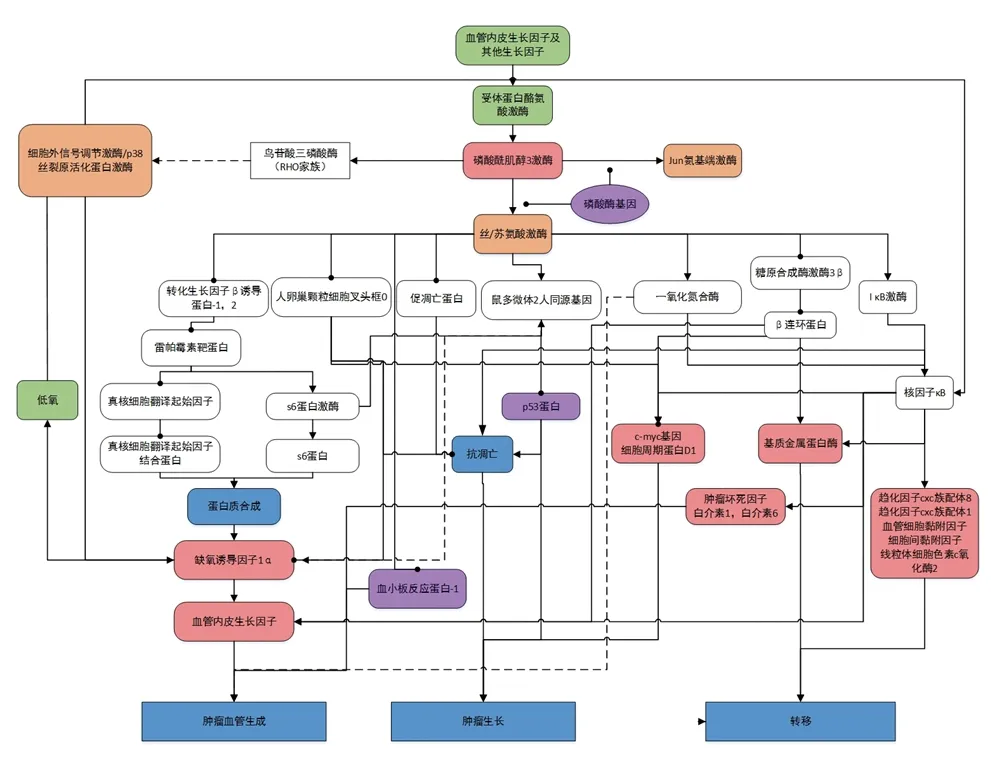
图1 PI3K/Akt 信号通路在肿瘤生物学方面的作用机制
3.2 CCL25/CCR9生物轴活化PI3K/Akt信号通路对肿瘤细胞生物学活性的影响 Sharma等[23]发现,CCL25/CCR9 生物轴通过活化PI3K/Akt信号通路,抑制化疗药物诱导的前列腺癌细胞的凋亡。其他学者在关于乳腺癌和卵巢癌的研究中发现CCR9及其配体CCL25相互作用,能增强PI3KP85/AktSer473/GSK-3βSer9/FKHRThr24的磷酸化水平,抑制化疗药物诱导的乳腺癌细胞的凋亡[36,45]。以上4个因子在肿瘤细胞的凋亡、侵袭、转移过程中有着重要的作用。另有研究表明,CCL25/CCR9生物轴的相互作用抑制非小细胞肺癌的凋亡,而这一作用是通过PI3K/Akt信号通路的活化并以PI3K/Akt依赖的方式实现的[46]。此外,CCR9与配体CCL25相互作用,能激活CD4+T淋巴细胞相关酶MAPK、PI3K、GSK-3β以及核转录因子κB,从而逃避Fas的细胞凋亡[29]。Sharma等[23]在前列腺癌的研究中也得到了相同的结论。Johnson等[36]也发现,CCL25/CCR9生物轴相互作用通过PI3K/Akt信号通路的活化及其下游调节因子GSK-3β和FKHR的磷酸化,抑制化疗药物诱导的乳腺癌细胞的凋亡。
4 展 望
随着科学技术的发展,靶向治疗从理想走进现实,而其也以痛苦小、疗效好的优势开始被越来越多的患者所接受。CCR9作为一个重要的靶点,为多种癌症的诊治提供了一种崭新的治疗方向。但肿瘤疾病的发病机制较复杂,CCR9、CXCR4[47-53]、CXCR6[54-55]等多种因子都参与肿瘤细胞的侵袭转移等过程,目前其完整的分子机制尚未阐述清楚。但随着对CCR9更深入的研究,明确CCR9在多种疾病中具体的发病机制,对其他因子的探索会有相当重要的参考价值,对肿瘤的治疗也必会有突破性进展,势必也会给患者带来更多的福音。因此,早发现、早诊断、尽早靶向治疗从而达到最理想的治疗效果将成为肿瘤治疗的一种策略。探寻CCL25/CCR9在相关肿瘤中的确切分子机制,研制开发相关的靶向药物,延长患者寿命,提高患者生存质量,最终彻底消灭肿瘤,是医务工作者未来共同努力的方向之一。
[1] 陈 竺.全国第三次死因回顾抽样调查报告[M].北京:中国协和医科大学出版社,2008:14.
[2] 杨柯君.全球癌症状况最新数据更新[J].上海医药,2014,35(2):5.
[3] Jacobs M,Verdeja JC,Goldstein HS.Minimally invasive colon resection(laparoscopic colectomy)[J].Surg Laparosc Endosc,1991,1(3):144-150.
[4] Zou W,Luo C,Zhang Z,et al.A novel oncolytic adenovirus targeting to telomerase activity in tumor cells with potent[J].Oncogene,2004,23(2):457-464.
[5] 刘新垣.癌症靶向治疗的最新进展[J].中华肿瘤防治杂志,2006,13(18):1 361-1 364
[6] Liu XY,Gu JF,Shi WF.Targeting gene-virotherapy for cancer[J].Acta Biochim Biophys Sin(Shanghai),2005,37(9):581-587
[7] Liu XY,Gu JF.Targeting gene-virotherapy of cancer[J].Cell Res,2006,16(1):25-30.
[8] 郭明高,姜明红,杨 琴,等.腺病毒介导的全抗体基因治疗卵巢癌的实验研究[J].中华医学杂志,2004,84(14):1 147-1 151.
[9] Gupta P,Sharma PK,Mir H,et al.CCR9/CCL25 expression in non-small cell lung cancer correlates with aggressive disease and mediates key steps of metastasis[J].Oncotarget,2014,5(20):10 170-10 179.
[10]王志维,雷珍牛,林 辉,等.119例非小细胞肺癌中CCR9的表达及其预后分析[J].临床与实验病理学杂志,2015,31(7):764-768.
[11]Singh S,Singh UP,Stiles JK,et al.Expression and functional role of CCR9 in prostate cancer cell migration and invasion[J].Clin Cancer Res,2004,10(24):8 743-8 750.
[12]Johnson-Holiday C,Singh R,Johnson E,et al.CCL25 mediates migration,invasion and matrix metalloproteinase expression by breast cancer cells in a CCR9-dependent fashion[J].Int J Oncol,2011,38(5):1 279-1 285.
[13]Singh R,Stockard CR,Grizzle WE,et al.Expression and histopathological correlation of CCR9 and CCL25 in ovarian cancer[J].Int J Oncol,2011,39(2):373-381.
[14]李 杰,李 强.趋化因子CCL25/CCR9在胰腺癌患者的表达研究[J].中华肝胆外科杂志,2011,17(6):475-478.
[15]徐 锋.SDF-1/CXCR4和TECK/CCR9与胰腺癌预后不良相关性研究[D].天津:天津医科大学,2013.
[16]Amersi FF,Terando AM,Goto Y,et al.Activation of CCR9/CCL25 in cutaneous melanoma mediates preferential metastasis to the small intestine[J].Clin Cancer Res,2008,14(3):638-645.
[17]Stein JV,Nombela-Arrieta C.Chemokine control of lymphocyte trafficking:a general overview[J].Immunology,2005,116(1):1-12.
[18]Olson TS,Ley K.Chemokines and chemokine receptors in leukocyte trafficking[J].Am J Physiol Regul Integr Comp Physiol,2002,283(1):R7-28.
[19]Vicari AP,Figueroa DJ,Hedrick JA,et al.TECK:a novel CC chemokine specifically expressed by thymic dendritic cells and potentially involved in T cell development[J].Immunity,1997,7(2):291-301.
[20]Ling V,Wu PW,Finnerty HF,et al.Cutting edge:identification of GL50,a novel B7-like protein that functionally binds to ICOS receptor[J].J Immunol,2000,164(4):1 653-1 657
[21]Costa MF,Bornstein VU,Candéa AL,et al.CCL25 induces α4β7integrin-dependent migration of IL-17+γδ T lymphocytes during an allergic reaction[J].Eur J Immunol,2012,42(5):1 250-1 260.
[22]Ben-Baruch A.Organ selectivity in metastasis:regulation by chemokines and their receptors[J].Clin Exp Metastasis,2008,25(4):345-356.
[23]Sharma PK,Singh R,Novakovic KR,et al.CCR9 mediates PI3K/AKT-dependent antiapoptotic signals in prostate cancer cells and inhibition of CCR9-CCL25 interaction enhances the cytotoxic effects of etoposide[J].Int J Cancer,2010,127(9):2 020-2 030.
[24]Lazennec G,Richmond A.Chemokines and chemokine receptors:new insights into cancer-related inflammation[J].Trends Mol Med,2010,16(3):133-144
[25]Letsch A,Keilholz U,Schadendorf D,et al.Functional CCR9 expression is associated with small intestinal metastasis[J].J Invest Dermatol,2004,122(3):685-690
[26]Koenecke C,Förster R.CCR9 and inflammatory bowel disease[J].Expert Opin Ther Targets,2009,13(3):297-306.
[27]Richmond A.CCR9 homes metastatic melanoma cells to the small bowel[J].Clin Cancer Res,2008,14(3):621-623.
[28]Kühnelt-Leddihn L,Müller H,Eisendle K,et al.Overexpression of the chemokine receptors CXCR4,CCR7,CCR9,and CCR10 in human primary cutaneous melanoma:a potential prognostic value for CCR7 and CCR10?[J].Arch Dermatol Res,2012,304(3):185-193.
[29]Youn BS,Kim YJ,Mantel C,et al.Blocking of c-FLIP(L)--independent cycloheximide-induced apoptosis or Fas-mediated apoptosis by the CC chemokine receptor 9/TECK interaction[J].Blood,2001,98(4):925-933.
[30]Wurbel MA,Mclntire MG,Dwyer P,et al.CCL25/CCR9 interactions regulate large intestinal inflammation in a murine model of acute colitis[J].PLoS One,2011,6(1):e16 442.
[31]Li X,Madison BB,Zacharias W,et al.Deconvoluting the intestine:molecular evidence for a major role of the mesenchyme in the modulation of signaling cross talk[J].Physiol Genomics,2007,29(3):290-301.
[32]Chen HJ,Edwards R,Tucci S,et al.Chemokine 25-induced signaling suppresses colon cancer invasion and metastasis[J].J Clin Invest,2012,122(9):3 184-3 196.
[33]Heinrich EL,Arrington AK,Ko ME,et al.Paracrine activation of chemokine receptor CCR9 enhances the invasiveness of pancreatic cancer cells[J].Cancer Microenviron,2013,6(3):241-245.
[34]Shen X,Mailey B,Ellenhorn JD,et al.CC chemokine receptor 9 enhances proliferation in pancreatic intraepithelial neoplasia and pancreatic cancer cells[J].J Gastrointest Surg,2009,13(11):1 955-1 962.
[35]钟永泷,林 辉,李柏钧,等.非小细胞肺癌组织CCR9和Survivin及Bcl-2表达相关性研究[J].中华肿瘤防治杂志,2013,20(16):1 232-1 235.
[36]Johnson EL,Singh R,Johnson-Holiday CM,et al.CCR9 interactions support ovarian cancer cell survival and resistance to cisplatin-induced apoptosis in a PI3K-dependent and FAK-independent fashion[J].J Ovarian Res,2010,3:15.
[37]Johnson EL,Singh R,Singh S,et al.CCL25-CCR9 interaction modulates ovarian cancer cell migration,metalloproteinase expression,and invasion[J].World J Surg Oncol,2010,8:62.
[38]唐小军,周清华.基质金属蛋白酶与肺癌侵袭转移的关系[J].中国肺癌杂志,2001,4(2):116-120.
[39]Li H,Zhang B,Liu Y,et al.EBP50 inhibits the migration and invasion of human breast cancer cells via LIMK/cofilin and the PI3K/Akt/mTOR/MMP signaling pathway[J].Med Oncol,2014,31(9):162.
[40]Xu H,Xu Y,Zhang W,et al.Aquaporin-3 positively regulates matrix metalloproteinases via PI3K/AKT signal pathway in human gastric carcinoma SGC7901 cells[J].J Exp Clin Cancer Res,2011,30:86.
[41]Lee WT,Lee TH,Cheng CH,et al.Antroquinonol from Antrodia Camphorata suppresses breast tumor migration/invasion through inhibiting ERK-AP-1- and AKT-NF-κB-dependent MMP-9 and epithelial-mesenchymal transition expressions[J].Food Chem Toxicol,2015,78:33-41.
[42]Mäkinen T,Veikkola T,Mustjoki S,et al.Isolated lymphatic endothelial cells transduce growth,survival and migratory signals via the VEGF-C/D receptor VEGFR-3[J].EMBO J,2001,20(17):4 762-4 773.
[43]Yu W,Chen L,Yang YQ,et al.Cytochrome P450 ω-hydroxylase promotes angiogenesis and metastasis by upregulation of VEGF and MMP-9 in non-small cell lung cancer[J].Cancer Chemother Pharmacol,2011,68(3):619-629.
[44]Jiang BH,Liu LZ.PI3K/PTEN signaling in angiogenesis and tumorigenesis[J].Adv Cancer Res,2009,102:19-65
[45]Johnson-Holiday C,Singh R,Johnson EL,et al.CCR9-CCL25 interactions promote cisplatin resistance in breast cancer cell through Akt activation in a PI3K-dependent and FAK-independent fashion[J].World J Surg Oncol,2011,9:46
[46]Li B,Wang Z,Zhong Y,et al.CCR9-CCL25 interaction suppresses apoptosis of lung cancer cells by activating the PI3K/Akt pathway[J].Med Oncol,2015,32(3):66.
[47]Li L,Li S,Cai T,et al.The targeted inhibitory effects of human amniotic fluid stem cells carrying CXCR4 promoter and DAL-1 on non-small cell lung carcinoma growth[J].Gene Ther,2016,23(2):214-222.
[48]Liu K,Bao C,Yao N,et al.Expression of CXCR4 and non-small cell lung cancer prognosis:a meta-analysis[J].Int J Clin Exp Med,2015,8(5):7 435-7 445.
[49]Singla AK,Downey CM,Bebb GD,et al.Characterization of a murine model of metastatic human non-small cell lung cancer and effect of CXCR4 inhibition on the growth of metastases[J].Oncoscience,2015,2(3):263-271.
[50]Zhang C,Li J,Han Y,et al.A meta-analysis for CXCR4 as a prognostic marker and potential drug target in non-small cell lung cancer[J].Drug Des Devel Ther,2015,9:3 267-3 278
[51]Choi YH,Burdick MD,Strieter BA,et al.CXCR4,but not CXCR7,discriminates metastatic behavior in non-small cell lung cancer cells[J].Mol Cancer Res,2014,12(1):38-47
[52]Su L,Zhang J,Xu H,et al.Differential expression of CXCR4 is associated with the metastatic potential of human non-small cell lung cancer cells[J].Clin Cancer Res,2005,11(23):8 273-8 280.
[53]Wang L,Wang Z,Liu X,et al.High-level C-X-C chemokine receptor type 4 expression correlates with brain-specific metastasis following complete resection of non-small cell lung cancer[J].Oncol Lett,2014,7(6):1 871-1 876
[54]Hald SM,Kiselev Y,Al-Saad S,et al.Prognostic impact of CXCL16 and CXCR6 in non-small cell lung cancer:combined high CXCL16 expression in tumor stroma and cancer cells yields improved survival [J].BMC Cancer,2015,15:441
[55]Mir H,Singh R,Kloecker GH,et al.CXCR6 expression in non-small cell lung carcinoma supports metastatic process via modulating metalloproteinases[J].Oncotarget,2015,6(12):9 985-9 998.
王志维(1962~),男,博士,教授,主任医师,研究方向:心脏大血管疾病的防治。
林辉(1957~),男,博士,教授,主任医师,研究方向:胸心疾病临床诊断的研究,E-mail: linhui33622@126.com。
R 73-37
A
0253-4304(2016)06-0833-06
10.11675/j.issn.0253-4304.2016.06.22
2015-12-21
2016-03-10)
