蛋白质泛素化发现者
——罗斯
2016-02-10郭晓强
郭晓强
深圳市第二人民医院,广东 深圳 518035
蛋白质泛素化发现者
——罗斯
郭晓强†
深圳市第二人民医院,广东 深圳 518035
罗斯;蛋白质泛素化;酶学;诺贝尔化学奖
蛋白质既是生命的物质基础(静态功能),又是生命活动的体现者(动态功能),因此蛋白质的正常功能是生命得以维持的基本保证。细胞内蛋白质含量有一个动态变化的过程以适应不同环境的需求。过多造成浪费,过少则影响生理功能,因此蛋白质含量的精确调控对生命而言具有重要意义。蛋白质含量由合成速度与降解速度间的平衡决定。蛋白质合成由mRNA负责翻译,而蛋白质降解过程长期以来认为由溶酶体负责,直到1980年泛素介导的蛋白质降解系统的发现才改观了人们的认识。三位做出卓越贡献的科学家也因此分享了2004年诺贝尔化学奖,其中之一是美国生物化学家罗斯(Irwin Allan Rose)(图1)[1]。
热爱科学
1926年7月16日,罗斯出生于纽约布鲁克林的一个犹太家庭。父亲哈利(Harry Royze Rose)经营一家装饰公司。13岁时,由于弟弟患有风湿热,母亲带着罗斯和弟弟搬到相对干燥的华盛顿州斯波坎(Spokane)的亲戚家居住,而父亲继续在纽约打理生意。罗斯曾在斯波坎当地一家医院的精神科病房担任助理,并因此对大脑产生痴迷,进而对医学充满极大兴趣。尽管罗斯父母和亲戚都很少从事研究工作,但罗斯还是将科学作为自己的未来职业。进入华盛顿州立大学后,罗斯失望地发现学校并没有神经生物学课程,无奈之下只好选择动物学作为专业。
由于第二次世界大战,罗斯在入学一年后开始到海军服役,担任无线电技术人员。退役后,罗斯进入芝加哥大学学习,并于1948年获得学士学位,随后继续进行博士研究。罗斯的博士研究课题是试图测量维生素B12对大鼠组织DNA含量的影响。这项计划注定是失败的,因为DNA遗传信息载体的功能已经阐述,每个组织中DNA含量都相对恒定,不依赖于饮食情况而发生明显变化。在这个项目不顺的情况下,罗斯匆忙找到一个替代课题——研究胞苷和核糖在脱氧胞苷合成中的作用。罗斯承认对这个项目缺乏兴趣,而只是为了毕业的权宜之计,但在研究过程中,罗斯逐渐对酶产生了浓厚兴趣。1952年,罗斯从芝加哥大学获得博士学位,并选择进一步研究酶的催化机制[2]。
酶学专家
20世纪50年代,正是生命科学变革的一个重要节点。1953年,DNA双螺旋模型的提出使许多科学家加入分子生物学这一新兴领域,核酸研究也迅速成为生命科学领域的主流,但经典酶学仍是一个重要方向。当时,代谢通路大多已经阐明,罗斯选择深入探索酶催化的详细分子机制作为研究方向。在经历西储大学(Case Western Reserve University)卡特(Charles Carter)教授和纽约大学著名酶学大师奥乔亚(Severo Ochoa,1959年诺贝尔生理学或医学奖获得者)教授的博士后训练后,罗斯于1954年成为耶鲁大学药学院的一位生物化学讲师,并开始独立的科研生涯。1963年,罗斯离开耶鲁大学加入位于宾夕法尼亚州费城的法克斯蔡司癌症研究中心(Fox Chase Cancer Center)。这个研究中心的目的是在更宽广的层面上理解癌症发生的原因。罗斯被这种自由和多学科交叉的研究氛围所吸引而加入该研究所,并一直工作到退休。
从耶鲁大学开始,罗斯的研究重点就在酶的催化机制,这也是他一生的主要研究内容。罗斯先驱性地将同位素示踪、立体化学、有机化学和同位素捕获等理论和技术有机结合起来用于研究酶催化反应的详细过程,从而可以在前人难以企及的精细水平上探索质子转移。通过体外测量酶促反应过程中质子与溶剂、底物或产物间的交换/转移过程,罗斯可在不知酶结构的前提下详细描述酶的具体机制。他还进一步与晶体学家、光谱学家和化学家等合作,从而对化学反应的细节了解得更为清晰。罗斯和同事先后清晰阐明糖酵解和三羧酸循环过程中多种酶的催化机制,包括醛缩酶、丙糖/戊糖异构酶、丙酮酸激酶、己糖激酶、磷酸果糖激酶等。凭借这一系列成就,罗斯成为领域内著名的酶学大师,并于1978年当选为美国科学院院士[3]。罗斯不仅在代谢酶领域取得巨大成功,而且对蛋白质降解机制亦情有独钟。
蛋白质降解
早在1953年,辛普森(Melvin Simpson)就开始研究蛋白质降解的机制。他以肝脏切片为材料研究同位素标记的蛋氨酸从蛋白质中释放的情况(速度快慢反映蛋白质分解)。当在低氧环境或用氰化物/2,4-二硝基苯酚处理后发现蛋白质降解速度显著降低。由于这些处理都可造成ATP生成的减少,因此推测ATP对蛋白质降解发挥着重要作用。1954年罗斯进入耶鲁大学生物系后,成为了辛普森的同事,并且两人的实验室相隔不远,因此他有机会了解辛普森的研究内容。尽管辛普森不久转向蛋白质体外合成系统而放弃进一步研究蛋白质降解,罗斯却对蛋白质降解的问题特别痴迷,并一直念念不忘,想解开这个谜题。
在耶鲁期间,罗斯并未进行蛋白质降解的研究。来到费城后,他开始逐渐做一些相关的实验以寻找蛋白质分解相关因子,但由于一直未获得理想的实验体系而进展缓慢,罗斯也一直未发表任何一篇与蛋白质分解相关的论文。20世纪70年代初,ATP依赖的蛋白质降解一直未取得真正意义上的突破。详细过程是一个无人知晓的黑箱子,而转机来自于一次学术会议。
1975年,在美国贝塞斯达举办的福格蒂表达调控会议(Fogerty Conference on Regulation)上,罗斯结识了来自以色列的科学家赫什科(Avram Hershko),从而开启一段科研合作的佳话。赫什科曾在美国加州大学旧金山分校进行博士后研究,对ATP依赖的蛋白质降解过程也充满极大兴趣,并打算在美国寻找一家实验室合作研究。遗憾的是,他的博士后指导老师意外去世,从而使赫什科不得不寻找新的合作伙伴。与罗斯的交流使赫什科感到很适合开展学术合作,并因此达成协议,每年的学术休假和夏季来到罗斯实验室进行实验。
1977年,赫什科和他的博士切哈诺沃(Aaron Ciechanover)等人来到费城,全面启动蛋白质降解研究计划,并且形成一个老中青三代配置的核心团体。当时罗斯51岁,赫什科40岁,而切哈诺沃30岁,因此,这个团队中罗斯主要发挥顾问作用(凭借自己在酶学研究方面的深厚基础为课题的实施提出指导性意见),赫什科更多是项目负责人角色(主要负责实验设计方面的工作),而切哈诺沃则是课题的主要实施者(核心实验基本由他完成)。此外还有多名研究人员参与,罗斯的三位博士后威尔金森(Keith Wilkinson)、哈斯(Arthur Haas)和皮卡特(Cecile Pickart)等亦发挥了关键性作用。
成功合作
当时已知的细胞内降解途径是在溶酶体完成,并由相应蛋白酶催化。1977年,哈佛大学医学院的戈德堡(Alfred L. Goldberg)和同事选择缺乏溶酶体的网状红细胞成功制备出细胞裂解液,并研究发现这个系统仍可降解蛋白质,同时需要ATP参与,而且蛋白质降解过程最适pH值偏碱性(7.8),从而进一步否定溶酶体蛋白酶释放的可能(酸性催化)[4]。这个结果进一步说明,细胞内确实存在一个不依赖溶酶体,但依赖ATP的蛋白降解体系。这个突破立刻引起赫什科注意,并决定利用这个理想研究体系进一步解析蛋白质降解的详细机制。
为避免内源蛋白对外加蛋白的干扰,赫什科和切哈诺沃决定先去除红细胞裂解液含量极为丰富的血红蛋白。为实现这一目标,他们利用离子交换树脂对裂解液进行分离,从而将裂解液分成两部分:不被树脂吸附的部分和被树脂吸附后又被高盐洗脱的部分。随后的实验发现,两部分单独情况下均无蛋白质降解活性,但二者混合后具有这种活性。考虑到不被树脂吸附的部分成分较少,因此他们决定先从中分离活性成分,并最终发现一种小分子热稳定性蛋白,命名为APF-1 (active principle in fraction 1)[5]。
至此,所有研究都在按部就班进行。按照赫什科推测,细胞内应存在一类独立于溶酶体之外且依赖ATP的蛋白酶,这类蛋白酶应有两部分组成——酶蛋白(大分子)和辅酶(小分子),因此推测APF-1可能发挥辅酶的功能。为更好研究蛋白酶作用机制,赫什科团队联合罗斯团队深入探索两种组分的详细作用。
罗斯再一次发挥了自己在酶学研究方面的雄厚知识背景和熟练操作能力。他指导研究生先将APF-1和待降解蛋白质(如溶菌酶和乳白蛋白)分别标记同位素I-125,然后将它们分别与红细胞裂解液混合,完毕后借助电泳和放射自显影方法检测标记同位素蛋白质的变化情况。结果取得意想不到的发现。首先,检测标记同位素APF-1时,发现分子量显著增加,意味着它应与其他蛋白质实现了结合,而且蛋白质变性后二者还可紧密结合,说明APF-1与蛋白质间形成共价键[6];其次,检测待降解蛋白质放射性时,发现有多个条带,暗示同一种蛋白质可结合多个APF-1分子[7];最后,实验还发现在一定情况下APF-1与蛋白质可以分开,因此二者的结合是一个可逆过程。在简单生化分析的基础上,罗斯提出一个蛋白质被APF-1修饰的机制模型(图1),而后续研究证实这个模型给出的解释与预测惊人地吻合[8]。
与此同时,罗斯团队取得另一重大突破。博士后威尔金森和哈斯与隔壁实验室研究人员较为熟悉。在一次谈话中,威尔金森提及是否存在两种蛋白质之间的共价结合,而隔壁实验室的一名博士后突然想起最近才发表的一项工作,就是组蛋白H2A可与泛素之间形成共价键。这一消息激发了两位博士后的灵感。他们立刻启动试验,并不久证实APF-1和泛素就是同一物质[9]。至此,蛋白质泛素化修饰被正式发现。这个进展一方面阐明了一种细胞内全新的蛋白质降解机制,另一方面还有效地解释了一个科学难题。因为肽键水解在热力学上是一个放热反应,没有ATP辅助的必要,而罗斯他们的结果表明ATP消耗在泛素修饰阶段,因此并不违背热力学。
这一突破性的发现一方面奠定了罗斯等在蛋白质泛素化研究领域的地位,也成为将来授予诺贝尔奖的主要依据;另一方面也完全改变了研究小组的科研方向,从当初试图寻找一类ATP依赖的蛋白酶转向研究蛋白质的泛素修饰过程。1981年到1983年,他们全面阐明了蛋白质泛素化修饰的三个阶段。切哈诺沃和赫什科充分发挥酶分离方面的优势,鉴定出泛素化过程的三类酶,即泛素激活酶(E1)、泛素结合酶(E2)和泛素连接酶(E3),其中E3种类最为丰富,它决定靶蛋白泛素修饰特异性;而罗斯凭借在酶研究方面娴熟的理论和实验技术,在皮卡特协助下全面开展了对泛素修饰相关酶作用机制的探索[10],包括ATP/ PPi交换实验、E1酶共价层析纯化、巯基中间产物的阐明和去泛素化酶的鉴定等。后来,其他科学家鉴定出26S蛋白酶体,从而扩展了蛋白质泛素化-蛋白酶体降解体系:蛋白质可在三类泛素修饰酶催化下发生多泛素化;而多泛素化是启动蛋白质降解的死亡标记,因此泛素被称为死亡标签;多泛素化修饰蛋白质进入蛋白酶体被降解,释放出的泛素可进一步被重复利用(图2)。至此,表明在溶酶体外还存在蛋白酶体这一重要蛋白降解细胞器。
随着蛋白质泛素化在多个生理过程(如细胞分裂、DNA修复和免疫防御等)中重要性的发现,三位科学家罗斯、切哈诺沃和赫什科凭借“泛素介导蛋白质降解的发现”而分享2004年诺贝尔化学奖[11]。蛋白质泛素化异常还被发现与多种疾病包括癌症和囊性纤维化变性等相关,从而为疾病治疗提供新方向。科学家通过研发药物干扰蛋白降解或促进致病蛋白降解而实现疾病治疗的目的。用于多发性骨髓瘤治疗的药物万珂(Velcade)就是一种蛋白酶体抑制剂。
蛋白质泛素化修饰发现背后的驱动力仅仅在于想回答一个基本的科学问题,研究人员也完全出于一种科学激情。当时极少人能理解这项工作的重要性,因此也无法预见将来可获得诺贝尔奖。这也充分体现科学研究本身的不可预见性。另外,这项发现还阐明一个科学研究的普遍规律:任何生命现象的第一次被阐明都是极其困难的,我们更喜欢依赖已有经验和知识提出合乎常规的假说,但真正具有独特性和新颖性的概念往往被忽视许多年。
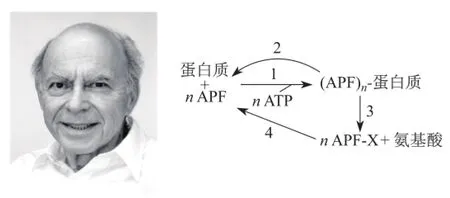
图1 罗斯和他提出的蛋白质泛素化模型
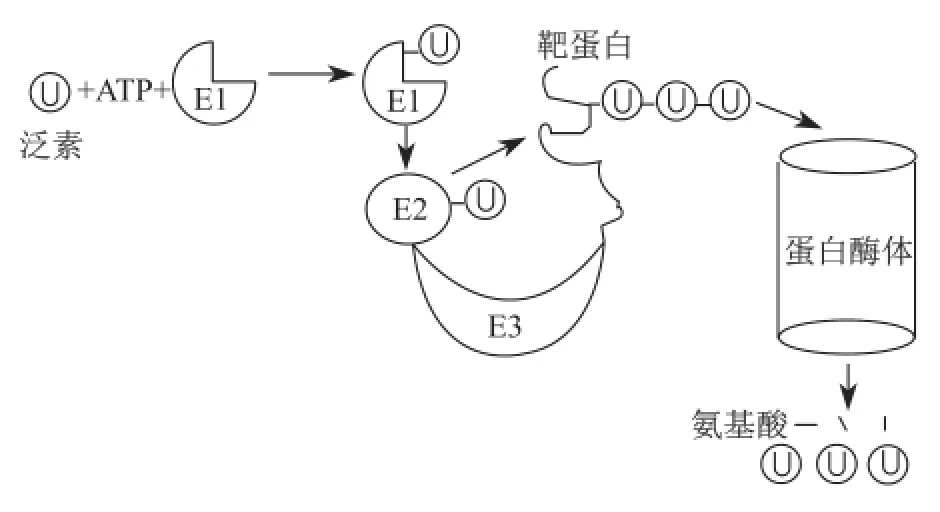
图2 蛋白质泛素化-蛋白酶体降解示意图
晚年科研
1995年,罗斯退休回到加州的拉古纳伍茨(Laguna Woods),但对科学的挚爱使他不愿在家颐养天年,而是继续工作。他又加入加州大学欧文分校生理学与生物物理学系研究三羧酸循环过程中一个重要酶——延胡索酸酶的作用机制。罗斯在加州的工作很有规律,一周3~4天在学校实验室,一年发表一篇研究论文。
在同事的眼中,罗斯是一个纯粹的、近乎完美的科学家。面对科学,罗斯表现出谦逊和无休止的好奇心;面对同事和后辈,罗斯表现更多的是慷慨和无私。罗斯关注更多的是科学本身,而非因发现本身带来的荣誉。诺贝尔化学奖宣布当晚,罗斯还正在口袋中夹着两支试管,悄悄来到另一位诺贝尔奖获得者莱因斯的实验室,利用大学公用的质谱仪器分析实验样品。化学教授诺瓦克(James Nowick)对罗斯的评价是:永不满足于自己已经取得的成就,总是渴望取得新的发现。罗斯非常喜欢为那些陷于困境的年轻学子或博士后提供援手,还非常乐意与年轻人一起探索自然奥秘,鼓励他们选择“瓶颈”问题作为研究方向。在赫什科看来,罗斯的科学贡献远非仅仅通过文章可以体现的,因为许多情况下,罗斯不愿署名,而愿把更多机会给予年轻人[12]。罗斯在蛋白质泛素化发现过程中具有不可替代的作用。以两篇《美国科学院院刊》(PNAS)经典论文为例。由于罗斯已是美国科学院院士,因此具有发表文章的“特权”。尽管赫什科那篇论文未署罗斯的姓名,但也由罗斯推荐(罗斯强烈要求不署自己的姓名)。另外,发现APF-1和泛素为同一分子的文章,罗斯也未曾署名,而是只有博士后的名字。
2015年6月2日,罗斯在马萨诸塞州迪尔菲尔德(Deerfield)于睡眠中离世,享年88岁。多个著名杂志都刊发讣告[3,12-13],以纪念这位伟大而低调的化学家。本文一方面缅怀这位科学大师,另一方面也展示蛋白质泛素化发现背后的科学故事。
(2015年10月26日收稿)■
[1] 郭晓强. 泛素介导的蛋白质降解—2004年诺贝尔化学奖[J]. 生物学通报, 2004, 39(11): 22-23.
[2] ROSE I A. Isotopic strategies for the study of enzymes [J]. Protein Sci, 1995, 4(7): 1430-1433.
[3] HAAS A L, WILKINSON K. Irwin (Ernie) Allen Rose (1926—2015) [J]. Cell, 2015, 162(2): 235-236.
[4] GOLDBERG A L. Nobel committee tags ubiquitin for distinction [J]. Neuron, 2005, 45(3): 339-344.
[5] KRESGE N, SIMONI R D, HILL R L. The discovery of ubiquitin-mediated proteolysis by Aaron Ciechanover, Avram Hershko, and Irwin Rose [J]. J Biol Chem, 2006, 40(281): e32.
[6] CIECHANOVER A, HELLER H, ELIAS S, et al. ATP-dependent conjugation of reticulocyte proteins with the polypeptide required for protein degradation [J]. Proc Natl Acad Sci USA, 1980, 77(3): 1365-1368.
[7] HERSHKO A, CIECHANOVER A, HELLER H, et al. Proposed role of ATP in protein breakdown: Conjugation of proteins with multiple chains of the polypeptide of ATP-dependent proteolysis [J]. Proc Natl Acad Sci USA, 1980, 77(4): 1783-1786.
[8] ROSE I A. Ubiquitin at Fox Chase [J]. Proc Natl Acad Sci USA, 2005, 102(33): 11575-11577.
[9] WILKINSON K D. The discovery of ubiquitin-dependent proteolysis [J]. Proc Natl Acad Sci USA, 2005, 102(43): 15280-15282.
[10] IRWIN R. Early work on the ubiquitin proteasome system, an interview with Irwin Rose. Interview by CDD [J]. Cell Death Differ, 2005, 12(9): 1162-1166.
[11] WILKINSON K D. Ubiquitin: a Nobel protein [J]. Cell, 2004, 119(6): 741-775.
[12] WILKINSON K, HERSHKO A. Irwin Allan Rose (1926—2015) [J]. Nature, 2015, 523(7562): 532.
[13] KLINMAN J P. Irwin Rose (1926—2015) [J]. Proc Natl Acad Sci USA, 2015, 112(34): 10568-10569.
(编辑:沈美芳)
The discoverer of protein ubiquitination: Irwin Allan Rose
GUO Xiaoqiang
Shenzhen Second People's Hospital, Shenzhen 518035, Guangdong Province, China
Irwin Allan Rose, protein ubiquitination, enzyme, Nobel Prize in Chemistry
10.3969/j.issn.0253-9608.2016.03.010
†通信作者,E-mail: xiaoqiangguo123@163.com
