改良Frey氏液体培养基质控菌株菌种代次与生长曲线研究
2016-02-07朱真万建青杨挺英康凯
朱真,万建青,杨挺英,康凯
(中国兽医药品监察所,北京 100081)
改良Frey氏液体培养基质控菌株菌种代次与生长曲线研究
朱真,万建青*,杨挺英,康凯
(中国兽医药品监察所,北京 100081)
为探究改良Frey氏液体培养基质控菌CVCC2960滑液支原体(以下简称MS)生长规律,本试验首次同时采用CFU计数、CCU测定和pH值测定的方法,比较不同接种浓度、接种体积和不同代次MS生长情况。结果显示:5%与10%接种量的CCU测定结果峰值差异不明显,但5%接种的CFU计数峰值更高,pH下降更慢;1~5代菌在生长曲线各阶段的测定结果均无明显差别;3种不同接种方式的测定结果显示,用0.5 mL菌液接种9.5 mL培养基的方式更利于MS生长。本试验为改良Frey氏液体培养基的质控标准化提供依据。
滑液支原体;培养基质控;菌种代次;传代
支原体污染是生物制品常见的污染源,给科研、疫苗生产及生物制品产业带来许多麻烦,《美国药典》、《欧洲药典》及《中国兽药典》二〇一〇年版三部中均有使用培养法进行生物制品支原体检查的专题论述[1-3],《中国兽药典》二〇一〇年版三部规定滑液支原体、猪鼻支原体分别为支原体检验用培养基支原体改良Frey氏培养基、支原体培养基质控菌株[3]。通过测定不同培养时段的CCU,绘制出的MS生长曲线表明:其迟缓期为培养后6 h内,对数期为6~36 h,稳定期为 36~54 h,衰老期为54 h之后[4]。而通过测定不同培养时段的CCU可以发现,MS培养过程中活菌浓度上升伴随着pH值的降低,且pH值为6.9时浓度达到最高[5],但同时用以上三种方法对滑液支原体进行生长曲线研究国内尚未见报道。本试验结合CFU计数法、CCU测定法和pH值测定法,以活菌浓度、生长滴度和菌液pH值为指标,比较不同接种浓度、体积和不同代次MS生长情况,对该MS生长特性进行了系统研究,以期为改良Frey氏液体培养基质控工作的标准化提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株 滑液支原体(CVCC2960),由中国兽医药品监察所提供。
1.1.2 培养基 改良Frey氏液体培养基、改良Frey氏固体培养基,均由北京中海生物科技有限公司提供。
1.1.3 仪器 生物安全柜,NUAIRE公司;CO2培养箱,SANYO公司;恒温培养箱,SANYO公司;pH计,METTLER TOLEDO公司;涡旋震荡器,北京金紫光科技发展有限公司;冰箱,海尔公司。
1.2 方法
1.2.1 不同接种浓度和收获时间差异比较1.2.1.1 菌液制备 将MS冻干菌株启开,用改良Frey氏液体培养基恢复原体积,再以10%比例接种至改良Frey氏液体培养基中,35~37 ℃培养24 h后,再按5%比例传1代,然后分别按5%(将1 mL菌液加至19 mL改良Frey氏液体培养基中)和10%(将2 mL菌液加至18 mL改良Frey氏液体培养基中)两种比例进行连续传代,选择2代菌作为工作菌液。
1.2.2 不同菌种代次差异比较
1.2.2.1 菌液制备 将MS冻干菌株启开,用改良Frey氏液体培养基恢复原体积,按5%比例接种至改良Frey氏液体培养基中,35 ~37 ℃培养24 h后,再按5%比例,将1 mL菌液加至19 mL支原体液体培养基中,以同样方式,连续传至5代,分别选择1~5代菌作为工作菌液。
1.2.2.2 活菌计数 分别选择1~5代菌菌液,用“1.2.1.2”中所提及的方法,分别对各代次培养的0、6、18、24、30、34、40 h进行CCU测定,分别从每代的各时间节点选取2个样本,同时对1~5代MS生长滴度变化进行比较。
1.2.3 不同传代体积差异 比较取2代MS工作菌株,5%比例接种至改良Frey氏液体培养基中,35~37 ℃培养24 h后,再按5%比例,分别选择3种不同培养体积传代,一种方式是使用小试管将0.1 mL菌液加至1.9 mL支原体液体培养基中,一种是使用小试管将0.2 mL菌液加至3.8 mL培养基,另一种则是使用细胞培养瓶将0.5 mL菌液加至9.5 mL培养基,35~37 ℃培养24 h后,用“1.2.1.2”中所提及的方法进行活菌计数(CFU计数法),对数据进行统计学分析。
2 结果与分析
2.1 不同接种浓度和收获时间差异比较2.1.1 不同接种浓度活菌浓度和pH值的比较 两种浓度接种的MS各时间点的活菌浓度、生长滴度和pH值如表1、表2所示。从表1可以看出,5%浓度接种的MS接种后24 h 活菌浓度达到峰值;生长滴度18 h达到峰值;菌液pH则持续下降,18~24 h降至7.0以下。从表2可以看出,10%浓度接种的MS活菌浓度24 h达到峰值;生长滴度18 h达到峰值;菌液pH持续下降,18~24 h降至7.0以下。
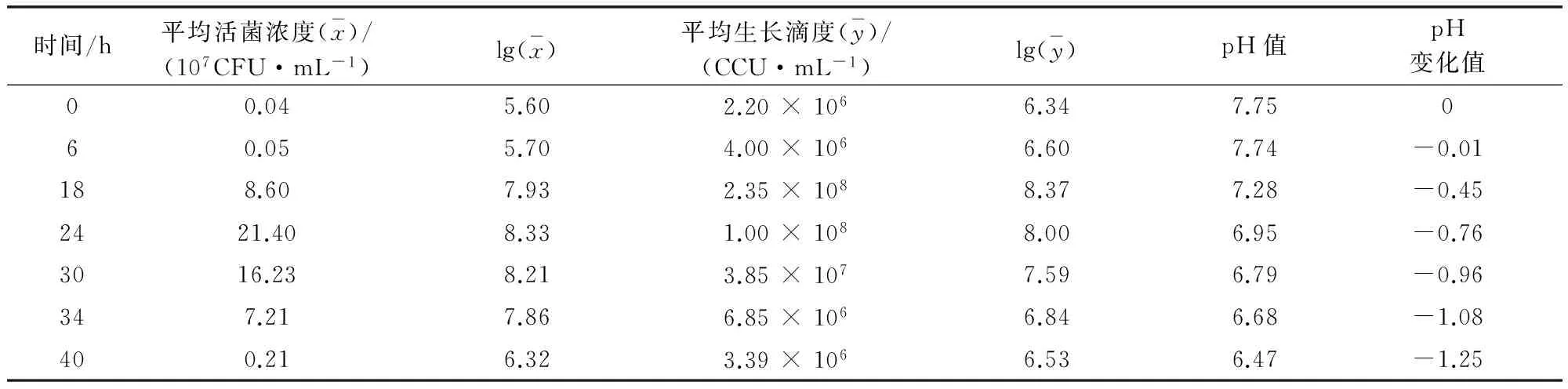
表1 5%浓度接种滑液支原体各时刻生长情况表
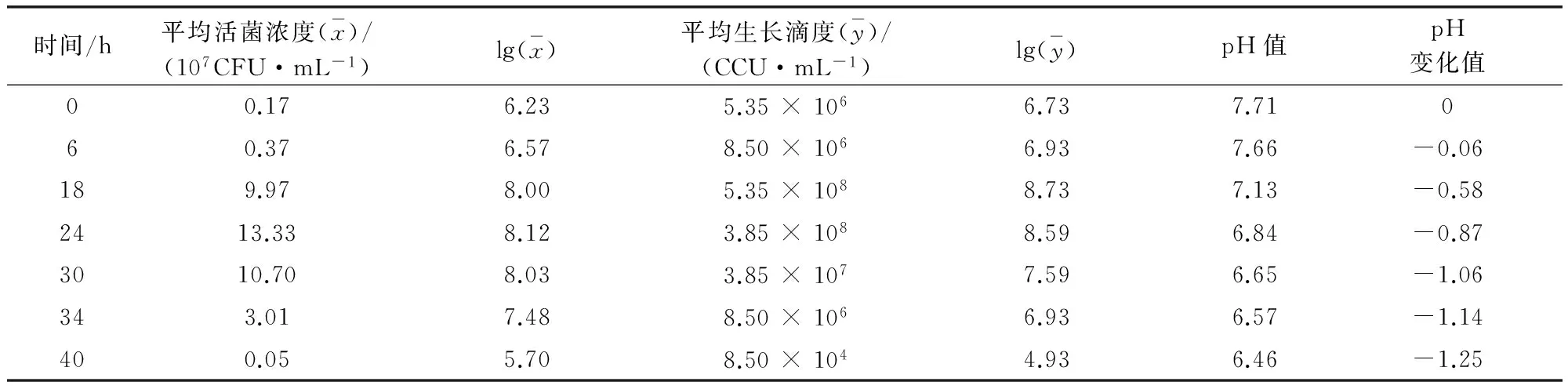
表2 10%浓度接种滑液支原体各时刻生长情况表
2.1.2 不同接种浓度生长曲线和pH值变化比较 两种接种浓度MS生长曲线和pH值变化情况见图1~图3。从图1可以看出,接种浓度5%的MS 6~18 h活菌浓度增长更快,18~30 h活菌浓度更高;从图2可以看出,接种浓度10%的MS 18~24 h生长滴度更高,24~40 h生长滴度下降更快;从图3可以看出,同为pH持续下降的情况下,10%下降更快。
2.2 滑液支原体1~5代菌生长滴度比较 1~5代菌0~40 h各时间生长滴度见表3,F1~F5分别表示1~5代菌,其生长滴度变化范围从低代至高代依次为(105~108)、(106~5.5×108)、(106~109)、(106~5.5×108)、(106~109)CCU/mL、通过比较1~5代MS生长滴度差异(表4、图4),可以看出1~5代菌峰值均不小于1.00 × 108CCU/mL,其中,F3、F5峰值达1.00 × 109CCU/mL,1~5代菌生长滴度不小于1.00 × 108CCU/mL的生长时间区段重叠部分为24~30 h。
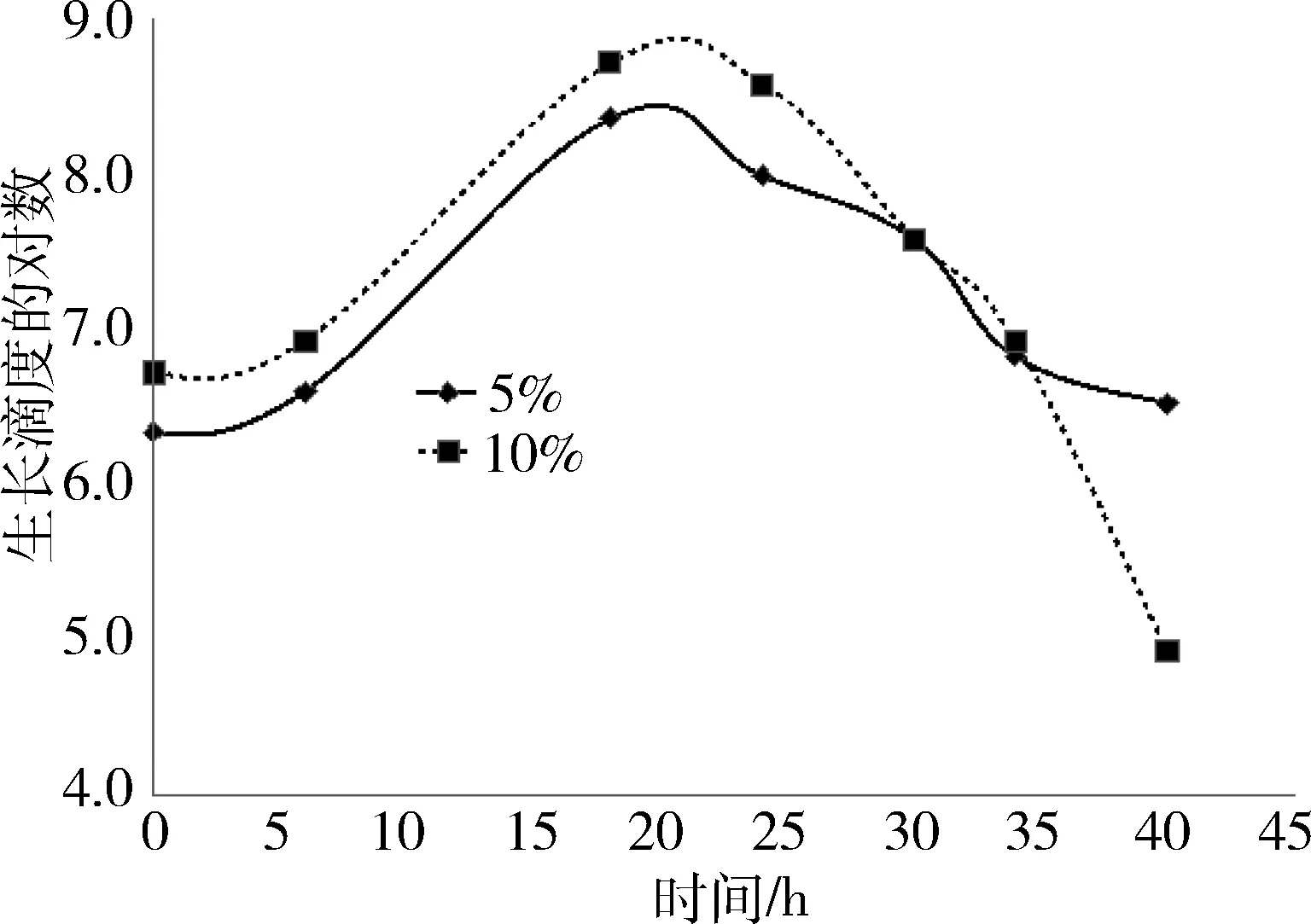
图2 不同接种浓度滑液支原体生长曲线图(生长滴度CCU测定法)

图3 不同接种浓度滑液支原体pH值变化图

图4 1~5代菌生长滴度的对数图
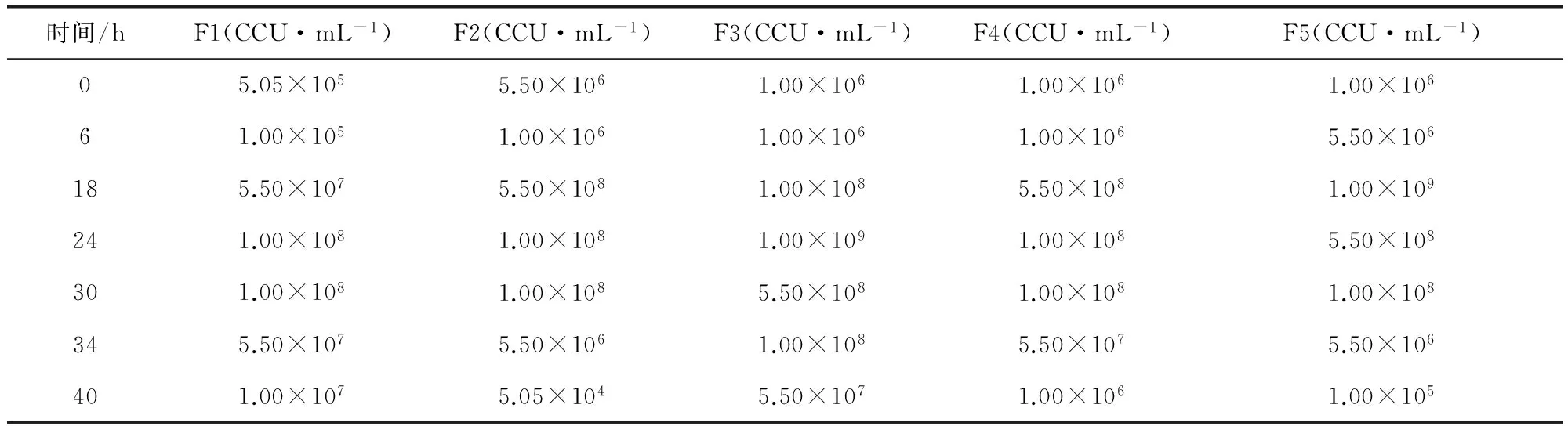
时间/hF1(CCU·mL-1)F2(CCU·mL-1)F3(CCU·mL-1)F4(CCU·mL-1)F5(CCU·mL-1)05.05×1055.50×1061.00×1061.00×1061.00×10661.00×1051.00×1061.00×1061.00×1065.50×106185.50×1075.50×1081.00×1085.50×1081.00×109241.00×1081.00×1081.00×1091.00×1085.50×108301.00×1081.00×1085.50×1081.00×1081.00×108345.50×1075.50×1061.00×1085.50×1075.50×106401.00×1075.05×1045.50×1071.00×1061.00×105

表4 1~5代菌生长滴度差异比较表
2.3 不同传代体积差异比较 从表5可以看出两种传代体积MS不同生长情况,在菌液浓度样本重复次数相同(n=4)的情况下,3组传代方式的MS平均活菌浓度依次为(6.6±2.1)×107、(5.6±0.4)×107、(13.3±2.5)×107CFU/mL。对3组实验数据进行单因素方差分析,利用最小显著差数法(LSD法)对3组平均值进行多重比较,结果显示:组1和组2无显著差异,组3分别和组1、组2之间存在极显著差异(P<0.01),就MS活菌浓度而言,组3传代方式优于组1、组2,即用0.5 mL菌液接种9.5 mL培养基的方式更利于MS生长。
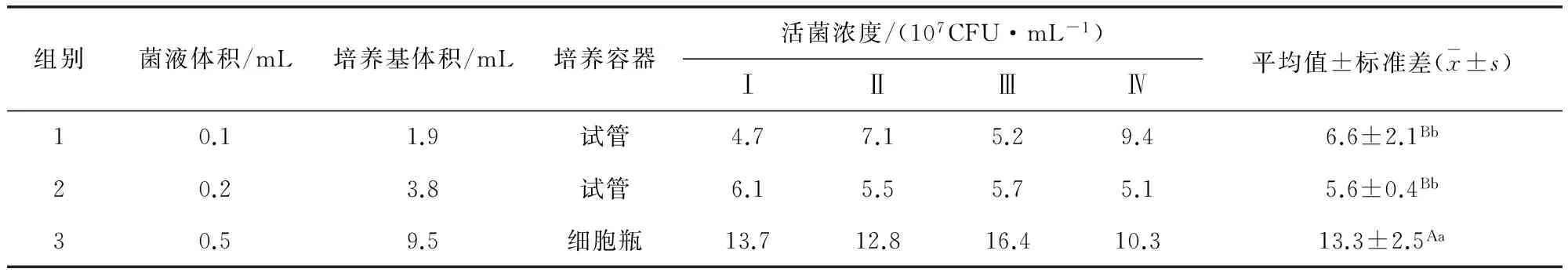
表5 不同传代体积滑液支原体活菌浓度表
注:用LSD法进行多重比较,同列标有不同大写字母A、B者表示组间差异极显著(P<0.01),即组3与组1、组2组间差异极显著;标有不同小写字母a、b者表示组间差异显著(P<0.05),即组3与组1、组2组间差异显著,标有相同小写字母b者表示组间差异不显著(P>0.05),即组1、组2组间差异不显著
3 讨论与小结
3.1 传代比例菌种传代是常用的微生物试验技术之一,细菌及支原体常用的传代比例通常为10%,魏顺在MS培养时,先将菌株复苏,再以1∶9比例接种,通过肉眼判断,当培养基由红色变为橙色或泛黄色时收获[6],刘轶秋等则是将-20 ℃冻存的MS恢复原体积后,再按5%比例接种[4]。本试验比较了5%与10%传代比例的生长曲线,从结果来看,5%与10%两种比例接种的MS,活菌浓度与生长滴度均呈先升高后降低的趋势,二者活菌浓度峰值均出现在24 h,而生长滴度的峰值是18 h,二者生长滴度不小于108CCU/mL时间区段均为18~24 h,生长滴度峰值均差异不明显,但传代浓度5%与10%相比有两点优势,一是传代比例下峰值活菌浓度高,前者近乎于后者2倍,差异明显;二是5%传代比10%传代pH值下降慢,即比较同时间点pH值,5%传代比例比10%传代比例高,MS是一类对pH值较敏感的微生物,pH值低于6.8时极易死亡[7],基于活菌浓度和pH值综合考虑,建议在改良Frey氏培养基日常检验中,MS复苏后,将5%作为传代比例。
3.2 收获时间《中国兽药典》规定,改良Frey氏培养基灵敏度试验最小变色单位不小于108[3],在日常检验中,为保证检验结果真实、客观、有效,所使用工作菌液生长活性不能过高或过低,过高导致培养基检验敏感性低,过低则使敏感性高。选择接种浓度为5%,培养18~24 h,生长滴度维持在108CFU/mL与109CFU/mL之间,理论上,可以在18~24 h内收获菌液。每次试验的菌种、环境、操作不尽相同,具体的收获时机需要依赖pH值测定,周锦龙等发现,当pH值为6.9的时候,活菌浓度达到最高[5],从本次试验来看,pH值为6.95时为菌液发生变色的转折点。基于以上综合分析,建议菌液培养18~24 h内,菌液即将发生变色之时收获。3.3 菌种代次为保证检验过程中菌种均一、一致,《中国兽药典》规定改良Frey氏液体培养基质控菌MS传代不可超过5代[3],鉴于此,本次试验只针对1~5代菌进行比较。从结果来看, 1~5代菌生长滴度不小于108CFU/mL,收获时间段基本重叠于18~30 h(1代略显迟滞),但峰值会随着代次增加而略有抬升,因为随着传代次数增加,支原体对培养基适应性更强,生长更好。通过分析,1~5代菌均可用作培养基质控菌工作菌液,但在实际工作中,可综合考虑冻存菌种代次、保存时间等影响种子菌液活性的客观因素,再科学确定工作菌液代次。
3.4 传代体积传代体积是培养基检验、生物制品生产等过程中一项重要技术参数,杜德艳等通过测定猪肺炎支原体在不同容积培养瓶中CCU值和pH变化值得出,菌种在小容量瓶培养与在万瓶培养相比,生长更快,CCU值亦更高[8],由于在改良Frey氏培养基日常检验中,所需要菌液量较少,故本试验选取了3组菌液与培养基体积搭配。通过比较分析, “0.5 mL菌液+9.5 mL培养基”的传代方式优于“0.1 mL菌液+1.9 mL培养基”和“0.2 mL菌液+3.8 mL培养基”,具有极显著差异,而后两者间无显著差异,故在改良Frey氏培养基日常检验中,建议使用“0.5 mL菌液+9.5 mL培养基”的传代方式。
本试验首次结合CFU计数法、CCU测定法以及pH值测定法,通过活菌计数和pH值测定,确定了MS体适宜传代比例、收获时间、菌种代次以及传代体积,为改良Frey氏液体培养基的质控标准化提供依据。
[1] The United States Phamacopeial Convention, Inc. USP36NF31, General Chapter 63, Mycoplasma Tests[S].
[2] European Directorate for the Quality of Medicines & Healthcare, Councile of Europe. European Phamacopoeia 5.0, 2.6.7Mycoplasmas[S].
[3] 中国兽药典委员会. 中国人民共和国兽药典二〇一〇年版三部[S].
[4] 刘轶秋, 丁家波, 李蓓蓓, 等. 支原体检验用培养基质控菌株的生长曲线与世代时间测定[J]. 中国兽药杂志, 2012, 46(12): 13-15.
[5] 周锦龙, 封柯宇, 吴波良, 等. 禽滑液支原体液体培养中pH与活菌浓度关系研究[A]. 动物微生态学分会第四届第十一次全国学术研讨会论文集[C].2014.
[6] 魏顺. 衣阿华支原体与滑液支原体的全基因组测序及分析[D]. 武汉: 华中农业大学, 2012.
[7] 吴移谋, 叶元康. 支原体学[M]. 北京: 人民卫生出版社, 2008.
[8] 杜德燕, 张洪, 姜来生, 等. 不同容积的培养瓶对猪肺炎支原体培养滴度的影响[J]. 四川畜牧兽医, 2013,(6): 29-31.
(编辑:侯向辉)
Study on the Generation and Growth Curve of Modified Frey Liquid Culture Medium Quality Control Strains
ZHU Zhen,WAN Jian-qing*,YANG Ting-ying,KANG Kai
(ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
To explore the growth law of a quality control strain for modified Frey liquid medium, CVCC2960MycoplasmaSynoviae(MS), the colony counting method, CCU assay and pH determination were combined to compare MS growth in different inoculation concentrations, inoculation volumes and generations. The results indicated that there was no significant difference in growing titer peak, while 5% strains had a higher living cell concentration peak and a slower decrease pH value. The generation and growth value of 1~5 generations didn’t have significant difference. That mix 0.5 mL bacteria suspension with 9.5 mL medium was proved to be more suitable than other two for MS. This study provided a basis evidence of standardization for modified Frey liquid medium.
MycoplasmaSynoviae(MS); medium quality control; strains generation; passage cultured
朱真,研究实习员,从事培养基等原材料的质控工作。
2015-11-13
A
1002-1280 (2016) 01-0014-05
S852.61
