EZp对胃癌细胞核因子 κB靶基因的调节作用
2016-01-31吴雪雷蔡耀武庄志忠陈园静郭仁杰郑茂松
吴雪雷, 蔡耀武, 庄志忠, 陈园静, 郭仁杰, 郑茂松
(莆田学院附属莆田市第一医院 1肿瘤外科, 2病理科,福建 莆田 351100)
EZp对胃癌细胞核因子 κB靶基因的调节作用
吴雪雷1△,蔡耀武1,庄志忠1,陈园静1,郭仁杰2,郑茂松1
(莆田学院附属莆田市第一医院1肿瘤外科,2病理科,福建 莆田 351100)
[摘要]目的: 探讨zeste同源物增强子2 (EZp) 蛋白的表达对胃癌细胞的影响以及可能的作用机制。方法: 用real-time PCR 和Western blot实验检测正常胃黏膜上皮细胞和不同胃癌细胞系中EZp的mRNA和蛋白表达;采用细胞生长、细胞迁移以及软琼脂增殖实验测定EZp对胃癌细胞系致癌能力的影响;利用萤光素酶报告基因和real-time PCR检测EZp对核因子κB靶基因的调节作用;用免疫共沉淀法检测EZp和p65的相互作用。结果: 与正常胃上皮细胞相比,胃癌细胞系中的EZp过量表达(P<0.05)。EZp特异性抑制剂腺苷类似物DZNep处理或shEZp抑制了AGS和SNU-16细胞系的细胞活力。此外,DZNep和shEZp 抑制了AGS细胞迁移及软琼脂细胞形成的克隆数目(P<0.05)。shEZp 下调了核因子κB报告基因或白细胞介素8报告基因的活性以及核因子κB靶基因白细胞介素8、趋化因子配体5及趋化因子配体20的表达(P<0.05)。此外,EZp可以特异性与p65蛋白相互作用。结论: EZp 通过调节核因子κB靶基因介导胃癌细胞的生长。
[关键词]胃癌; Zeste同源物增强子2; 核因子κB
流行病学研究显示,幽门螺旋杆菌(Helicobacterpylori)感染引起的慢性炎症与胃癌的发生有着紧密的关联[1-2]。幽门螺旋杆菌可分泌多种毒力因子,比如细胞毒素相关基因A蛋白 (cytotoxin-associated gene A, CagA)、空泡细胞毒素(vacuolating cytotoxin A, VacA)等。而之前的数据显示核因子κB(nuclear factor kappa B, NF-κB)介导慢性炎症的发生。有研究表明CagA可激活核因子κB信号通路上调其下游的靶基因,包括细胞白介素(interleukin, IL)-1β、IL-6、IL-8以及肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)。而这些细胞因子可诱导炎症的发生,从而促进肿瘤的生成[3-4]。
越来越多的研究认为表观遗传对于肿瘤的发生发展具有重要的调节作用。Zeste同源物增强子2(enhancer of zeste homolog 2, EZp)蛋白是多梳蛋白抑制复合体2(polycomb repressive complex 2, PRC2)中的组分之一,可特异性催化组蛋白p第27个赖氨酸三甲基化(pK27me3)。TCGA数据库显示EZp在胃癌组织中高表达与相关研究的结果一致[5-7]。本研究基于前人已有的信息探讨胃癌细胞系中核因子κB通路与EZp的关联,以及潜在的分子机制。
材料和方法
1材料与试剂
人胚肾细胞293T、人胃上皮细胞GES-1和人胃癌细胞AGS、 MKN-45、SNU-16、NCI-N87购自上海生博生物医药;DZNep是Selleck产品;EZp抗体是BD产品;T345磷酸化EZp 抗体购自Active Motif;V5和β-actin抗体、V5和HA抗体偶联珠子、pLKO-shLuc 和shEZp(5’-ATTCTTGGTTTAAGATTTCCG-3’) 购自Sigma;HA抗体购自Santa Cruz;脂质体Lipofectamine 2000、Superscript III反转录酶、TRIzol、SYBR Green 购自Invitrogen;MTS试剂盒、Dual-Luciferase Reporter为Promega产品; Difco Noble 琼脂为BD产品;TNF-α购自R&D;pCMV-HA-EZp购自Addgene;pcDNA-V5-p65 cDNA克隆自293T细胞。
2方法
2.1慢病毒包装与感染使用磷酸钙沉淀法转染293T细胞。将细胞接种于100 mm培养皿中, 24 h后转染10 μg pLKO-shLuc或者pLKO-shEZp, 8 μg pCMV-ΔR8.2和2 μg pCMV-VSV-G。转染16 h后换成新鲜培养液。48 h后收集病毒上清并用0.45 μm 过滤器过滤并分装冷冻于-80 ℃。AGS和SNU-16细胞培养于60 mm, 24 h后去掉培养液,加入2 mL含有5 mg/L 聚凝胺(polybrene)的慢病毒。感染12 h后,换成新鲜培养液,再过36 h后用2 mg/L的嘌呤霉素(puromycin)筛选细胞。
2.2MTS实验检测细胞活力将AGS和SNU-16细胞以每孔5×103个细胞接种于96孔板中,每孔加入100 μL RPMI-1640培养液。 培养24 h后换成分别含有0.25 μmol/L、 0.5 μmol/L、 1 μmol/L和 2 μmol/L DZNep的新鲜培养液,溶剂对照组加入相同体积的二甲基亚砜(dimethyl sulfoxide, DMSO)。72 h后向每孔加入20 μL MTS试剂,于培养箱中孵育2 h。然后用酶标仪测定各样品在490 nm波长下的吸光度(A) 值,并计算相对细胞生长率。 生长率(%) =加药孔A值/对照孔A值×100%。
2.3细胞迁移实验AGS shLuc对照细胞和shEZp细胞以每孔5×105接种于6孔板中, 每孔加入2 mL培养液。24 h后(约有95%融合率)用20 μL tip头用力均匀地在孔中划痕。PBS洗涤2次,加入RPMI-1640培养液。在不同的时点测量细胞迁移的距离。细胞迁移率 (%) =不同时点划痕距离/0 h划痕距离×100%。
2.4软琼脂集落形成实验于6孔板中加入0.6% Noble 琼脂,于室温冷却40 min后,加入含0.3% Noble琼脂的5 000个AGS shLuc对照细胞和shEZp细胞。每种细胞接种3个孔。室温冷却30 min后,6孔板于培养箱中培养4周后倒置显微镜下计数含16个细胞以上的克隆。
2.5萤光素酶报告基因活性的检测AGS细胞以1×108/L 铺于24孔板中。24 h后转染每孔20 pmol的对照小干扰RNA和EZp小干扰RNA(5’-ATTCTTGGTTTAAGATTTCCG-3’)。培养24 h后换成新鲜培养液,再转染 0.4 μg的NF-κB报告基因或IL-8报告基因,以及0.1 μg阳性对照Renilla萤光素酶报告基因。 24 h后加入含有50 μg/L TNF-α培养液孵育5 h。之后去除培养液加入50 μL PLB裂解液裂解细胞与室温孵育20 min。每个样品取5 μL于白色不透明96孔板中以双荧光报告基因检测试剂盒检测荧光活性。各组相对荧光活性=核因子κB或IL-8报告基因荧光强度/Renilla荧光强度。
2.6实时荧光定量PCR人正常胃黏膜细胞以及胃癌细胞系以 2×108/L培养于 60 mm 培养皿中。24 h后去掉培养基,加入1 mL TRIzol裂解提取总RNA。 1 μg总RNA用SuperScript III反转录酶合成cDNA。20 μL的反应体系含10 μL 2×SYBR Green, 2 μL 引物,1 μL cDNA以及7 μL 去离子水。PCR反应条件为95 ℃ 20 s; 95 ℃ 3 s, 60 ℃ 30 s,扩增40个循环。所有PCR反应均在ABI 7500 Fast Real-Time PCR System上进行。或者,AGS细胞铺板24 h后,加入50 μg/L TNF-α,分别于不同的时点收集细胞。TRIzol裂解提取总RNA。1 μg总RNA用SuperScript III反转录酶合成cDNA。EZp的上游引物序列为5’-AATCAGAGTACATGCGACTGAGA-3’, 下游引物序列为5’-GCTGTATCCTTCGCTGTTTCC-3’;IL-8的上游引物序列为5’-GACCACACTGCGCCAACAC-3’, 下游引物序列为5’-CTTCTCCACAACCCTCTGCAC-3’; CXCL5的上游引物序列为5’-AGCTGCGTTGCGTTTGTTTAC-3’,下游引物序列为5’-TGGCGAACACTTGCAGATTAC-3’;CCL20的上游引物序列为5’-CTGGCTGCTTTGATGTCAGT-3’, 下游引物序列为5’-CGTGTGAAGCCCACAATAAA-3’;GAPDH的上游引物序列为5’-CTGGGCTACACTGAGCACC-3’, 下游引物序列为5’-AAGTGGTCGTTGAGGGCAATG-3’。
2.7免疫共沉淀和Western blot实验293T细胞铺板于6 cm培养皿24 h后,共转染4 μg pCMV-HA-EZp和/(或) 4 μg pcDNA3-V5-p65,用空载体pc-DNA3平衡总DNA量。36 h后,收集细胞并用RIPA裂解液裂解。收集上清,加入10 μL V5或者HA抗体偶联的珠子于4 ℃孵育2 h。1 000 r/min离心 1 min, 用RIPA裂解液洗3次,去上清并加入50 μL 2×样品液于95 ℃煮5 min。收集上清用10%聚丙烯酰胺凝胶电泳 (SDS-PAGE)分离。接着电转至硝酸纤维素膜,室温用5%脱脂牛奶封闭1 h,加入I抗4 ℃孵育过夜,用含0.1% 吐温 20 的TBS缓冲液漂洗3次,每次5 min。加入相应辣根过氧化物酶(horseradish peroxidase,HRP)标记的 II 抗室温孵育1 h后,化学发光试剂孵育 5 min,暗室曝光显影。β-actin作为内参照。
3统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示。显著性差异检验采用单因素方差分析及Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结果
1胃癌细胞系中EZp mRNA和蛋白的表达
我们首先比较了4种不同的人胃癌细胞系与正常胃黏膜上皮细胞中EZp的mRNA表达水平,4种胃癌细胞EZp的mRNA表达水平均比正常细胞高(P<0.01)。同样通过Western blot检测EZp总蛋白水平,胃癌细胞中的表达高于正常细胞(P<0.05),同时检测EZp T345磷酸化发现其表达水平与总蛋白呈正相关,且正常胃上皮细胞的磷酸化EZp表达较弱(P<0.05),见图1。以上结果说明EZp可能对胃癌细胞的生长以及致癌能力有调节作用。由于AGS和SNU-16中的表达水平相对较高,后续的实验均用其作为研究对象。
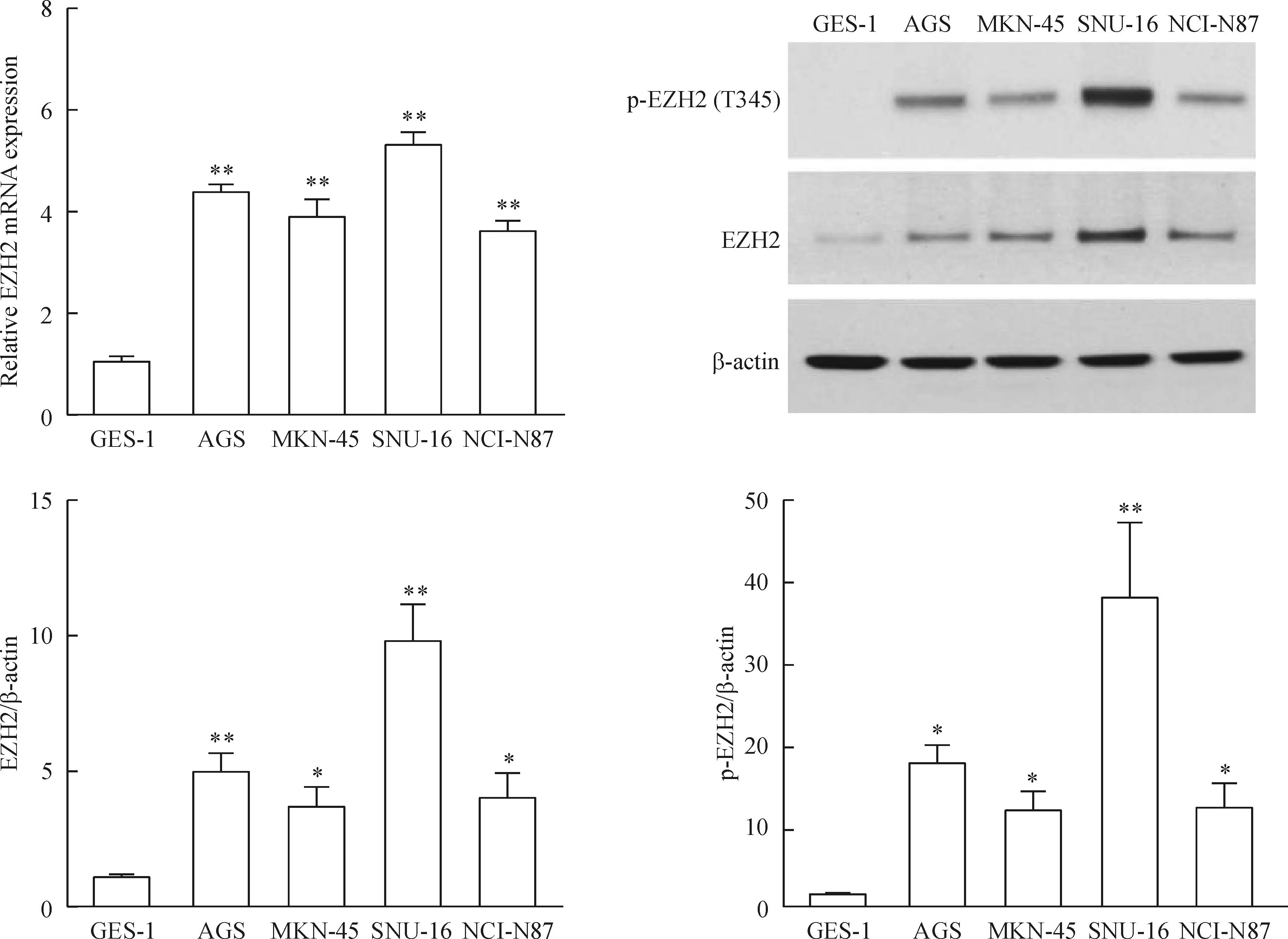
Figure 1.The expression of EZp in normal gastric epithelial cells and different gastric cancer cell lines. Mean±SD.n=3.*P<0.05,**P<0.01vsGES-1.
图1正常人胃上皮细胞与不同胃癌细胞EZp mRNA和蛋白的表达水平
2抑制EZp或沉默EZH2对胃癌细胞生长的抑制作用
胃癌细胞AGS和SNU-16接种于96孔板后,以不同浓度DZNep处理72 h, MTS实验检测EZp抑制剂对细胞活力的影响。结果显示,DZNep抑制细胞的生长呈剂量效应关系。当剂量达到2 μmol/L时,对AGS和SNU-16细胞的抑制率分别为(46.62±3.47)%和(43.78±2.58)%(P<0.01)。Western blot证明了DZNep对 EZp蛋白表达的抑制呈浓度依赖性关系。类似地, 利用慢病毒将EZH2 shRNA导入2种胃癌细胞,puromycin筛选,获得稳定表达shEZp的细胞株,Western blot检测到EZp表达水平降低。shRNA介导的EZp沉默抑制了胃癌细胞的增殖,见图2。

Figure2.TheeffectsofEZH2inhibitororEZpsilencingoncellactivity.A:inhibitoryeffectofDZNeponAGSandSNU-16cellactivity;B:DZNepdown-regulatedEZH2proteinexpressioninadose-dependentmanner;C:knockdownofEZpinAGSandSNU-16cells;D:knockdownofEZpdecreasedtheactivityofAGSandSNU-16cells.Mean±SD. n=3.*P<0.05,**P<0.01vs0 μmol/L;#P<0.05 vsshLuc.
图2EZH2抑制剂或EZp沉默对胃癌细胞增殖的影响
3抑制EZH2或沉默EZp对细胞迁移和集落形成的影响
以稳定表达对照shRNA和EZpshRNA的AGS细胞为对象做细胞划痕实验。划痕后18h,对照组细胞的迁移率为(79.21±3.26)%, 而EZpshRNA细胞的迁移率为(47.85±4.89)%,二者之间差异有统计学意义(P<0.01)。36h后,对照组细胞划痕完全消失即达到100%的迁移率,但是EZp 沉默细胞为81.54%,差异有统计学意义(P<0.01)。在软琼脂集落形成实验中,对照组细胞形成较多的细胞克隆,克隆体积较大,而EZpshRNA细胞形成的细胞克隆显著减少且没有较大的克隆体积(P<0.05)。同样,以EZH2抑制剂DZNep处理的细胞形成的细胞集落不管是数量还是体积均比DMSO处理细胞要少而小(P<0.05),见图3。这说明EZH2增强AGS细胞的集落形成能力,使癌细胞的恶性度降低。

Figure3.SilencingofEZporinhibitionofEZH2reducedcellmigrationandcolonyformation(×40).A:shEZH2inhibitedAGScellmigrationinscratchassay;B:shEZH2AGScellsshowedlessandsmallercoloniesinanchorage-independentassay;C:DZNepreducedcolonynumberandsize.Mean±SD. n=3.*P<0.05,**P<0.01vsshLuc or DMSO.
图3 EZp 沉默或EZH2 抑制剂对细胞迁移和集落形成的影响
4EZH2对NF-κB靶基因的影响
分别利用不同的萤光素酶报告基因NF-κB-Luc和IL-8-Luc,我们发现 EZp 沉默抑制了TNF-α介导的启动子激活作用(P<0.01)。另外,通过实时萤光定量PCR法检测NF-κB靶基因IL-8、CXCL5和CCL20的mRNA表达,发现在TNF-α处理4h后,与对照组相比,EZpshRNA下调了上述3个基因的mRNA表达(P<0.05)。以上结果显示EZH2对TNF-α诱导的胃癌细胞中核因子κB靶基因具有正调节作用,见图4。
5EZH2与NF-κBp65的相互作用
利用免疫共沉淀验证EZH2与p65在哺乳动物细胞中是否相互作用。结果显示,在V5-p65的沉淀产物中可以检测到HA-EZH2,而在对照组中则检测不到。同样,在HA-EZH2的沉淀产物中可以检测到V5-p65,但是对照组没有检测到蛋白,见图5。这表明V5-p65与HA-EZH2在细胞中具有特异性的蛋白相互作用。
讨论
越来越多的研究证实了幽门螺旋杆菌对于胃癌的发生起到诱因作用。幽门螺旋杆菌通过其自身分泌的毒力因子诱使慢性炎症的形成。已有的证据认为核因子κB对胃癌具有促进作用[4]。然而,核因子κB是如何参与调节炎症及恶性肿瘤发生的分子机制仍然不清楚。有报道表明核因子κB通过调节其下游的靶基因促进炎症发生和肿瘤的生成[8-10]。
近年来表观遗传学在肿瘤的发生和发展中的调节作用受到了越来越多的关注。EZH2是PRC2复合体中的甲基转移酶催化活性成分,在许多不同类型的肿瘤中过表达[11]。在胃癌中,EZH2通过抑制抑癌微小RNAs(microRNAs),比如miR-1246、miR-302a、miR-4448、miR-200和miR-429,或者下调RUNX3转录因子的表达,增强致癌能力[12-14]。此外,EZH2的翻译后修饰也参与调解其活性[15]。
基于前人的研究,本文主要探讨EZH2与核因子κB转录因子之间潜在的关系。我们在一系列的胃癌细胞中证实了EZH2总蛋白和蛋白磷酸化的过表达, 而正常胃上皮细胞的表达水平较弱。不同的研究说明EZH2苏氨酸345和487磷酸化对肿瘤细胞的增殖和迁移具有促进作用[15]。EZpshRNA沉默抑制了癌细胞的生长、迁移和致癌力。同样,小分子抑制剂DZNep处理胃癌细胞24h, 诱导浓度依赖性的EZH2降解。DZNep抑制细胞增殖和集落形成。TNF-α可诱导与炎症相关的基因包括细胞因子和趋化因子的表达,而核因子κB是关联TNF-α信号通路与下游基因的媒介物。有研究表明核因子κB的靶基因IL-8、CXCL5以及 CCL20可促进局部炎症发生,细胞异常增殖,最终导致肿瘤的形成、迁移和侵袭。这些细胞因子一方面可招募炎症细胞到上皮细胞周围,而炎症细胞分泌的其它细胞因子可促进上皮细胞的生长,另一方面可直接激活上皮细胞内促生存的相关信号通路[4,16-17]。本研究显示,抑制EZp的表达显著下调了核因子κB的转录活性以及上述细胞因子和趋化因子的表达水平。之前的报道声称在三阴性乳腺癌细胞中EZH2特异性地与p65相互作用并促进p65结合到靶基因启动子比如IL-6、IL-8以及TNF-α,增强细胞因子的表达从而促进乳腺癌细胞的增殖[18]。本研究发现IL-8、CXCL5和CCL20同样能被EZH2调控。通过蛋白质-蛋白质相互作用的研究,我们发现过表达的EZH2和核因子κB组分p65相互作用。EZH2可能是通过相似的机制达到调节作用。EZH2是组蛋白甲基转移酶,具有催化活性。Lee等[18]的数据显示在特定乳腺癌细胞中EZH2对核因子κB靶基因的调节不依赖于其酶活性。在胃癌细胞中,我们不能排除EZH2可能通过其酶活性调节核因子κB下游基因的表达。将来需要进一步的研究以证实这种可能性。本研究结果即EZH2介导的胃癌中核因子κB靶基因调控为阐明慢性炎症促进胃癌发生以及潜在的靶向治疗提供了实验依据。

Figure4.SilencingofEZpinhibitedTNF-α-mediatedNF-κBtranscriptionalactivityanddownstreamtargetgeneexpression.A: EZpsilencingdecreasedTNF-α-inducedNF-κB-LucandIL-8-Lucactivity;B: EZpsilencingsuppressedNF-κBtargetgeneexpressioninducedbyTNF-α.Mean±SD. n=3.*P<0.05,**P<0.01vsscrambled ;##P<0.01vsscrambled + TNF-α.
图4EZp沉默对TNF-α诱导的核因子κB的转录活性及其靶基因的抑制作用

Figure5.Over-expressedEZH2physicallyintereactedwithNF-κBp65inHEK293Tcells.A:interactionbetweenHA-EZH2andV5-p65detectedbyimmunoprecipitionwithV5antibody;B:bindingofV5-p65toHA-EZH2byimmunoprecipitionwithHAantibody.
图5过表达的EZH2与NF-κBp65的相互作用
[参考文献]
[1]WarrenJR.GastricpathologyassociatedwithHelicobacter pylori[J].GastroenterolClinNorthAm, 2000, 29(3):705-751.
[2]ChibaT,MarusawaH,UshijimaT.Inflammation-associatedcancerdevelopmentindigestiveorgans:mechanismsandrolesforgeneticandepigeneticmodulation[J].Gastroenterology, 2012, 143(3):550-563.
[3]EL-OmarEM,CarringtonM,ChowWH,etal.Interleukin-1polymorphismsassociatedwithincreasedriskofgastriccancer[J].Nature, 2000, 404(6776):398-402.
[4]Ben-NeriahY,KarinM.Inflammationmeetscancer,withNF-κBasthematchmaker[J].NatImmunol, 2011, 12(8):715-723.
[5]MatsukawaY,SembaS,KatoH,etal.Expressionoftheenhancerofzestehomolog2iscorrelatedwithpoorprognosisinhumangastriccancer[J].CancerSci, 2006, 97(6):484-491.
[6]ChoiJH,SongYS,YoonJS,etal.Enhancerofzestehomolog2expressionisassociatedwithtumorcellproliferationandmetastasisingastriccancer[J].APMIS, 2010, 118(3):196-202.
[7]CaiGH,WangK,MiaoQ,etal.ExpressionofpolycombproteinEZH2inmulti-stagetissuesofgastriccarcinogenesis[J].JDigDis, 2010, 11(2):88-93.
[8]MatsumotoY,MarsawaH,KnoshitaK,etal. Helicobac-ter pyloriinfectiontriggersaberrantexpressionofactivation-inducedcytidinedeaminaseingastricepithelium[J].Nat-Med,2007, 13(4):470-476.
[9]LambA,ChenLF.RoleoftheHelicobacter pylori-inducedinflammatoryresponseinthedevelopmentofgastriccancer[J].JCellBiochem, 2013, 114(3):491-497.
[10]HorYT,VoonDC,KooJK,etal.AroleofRUNX3ininflammation-inducedexpressionofIL23Aingastricepithelialcells[J].CellRep, 2014, 8(1):50-58.
[11]ChaseA,CrossNC.AberrationsofEZpincancer[J].ClinCancerRes, 2011, 17(9): 2613-2618.
[12]HibinoS,SaitoY,MuramatsuT,etal.Inhibitorsofenhancerofzestehomolog2 (EZH2)activatetumor-suppressormicroRNAsinhumancancercells[J].Oncogenesis, 2014, 3:e104.
[13]FujiiS,ItoK,ItoY,etal.Enhancerofzestehomologue2 (EZH2)down-regulatesRUNX3byincreasinghistoneH3methylaiton[J].JBiolChem, 2008, 283(25):17324-17332.
[14]NingX,ShiZ,LiuX,etal.DNMT1andEZH2mediatedmethylationsilencesthemicroRNA-200b/a/429geneandpromotestumorprogression[J].CancerLett, 2015, 359(2): 198-205.
[15]YamaguchiH,HungMC.RegulationandroleofEZH2incancer[J].CancerResTreat, 2014,46(3):209-222.
[16]SouttoM,BelkhiriA,PiazueloMB,etal.LossofTFF1isassociatedwithactivationofNF-κB-mediatedinflammationandgastricneoplasiainmiceandhumans[J].JClinInvest, 2011, 121(5): 1753-1767.
[17]HarantH,EldershawSA,LindleyIJ.Humanmacrophageinflammatoryprotein-3α/CCL20/LARC/Exodus/SCYA20istranscriptionallyupregulatedbytumornecrosisfactor-αviaanon-standardNF-kBsites[J].FEBSLett, 2001, 509(3):439-445.
[18]LeeST,LiZ,WuZ,etal.Context-specificregulationofNF-κBtargetgeneexpressionbyEZH2inbreastcancers[J].MolCell, 2011, 43(5):798-810.
(责任编辑: 林白霜, 罗森)

*[基金项目]国家自然科学基金资助项目(No. 81370706;No. 81372758);重庆市自然科学基金资助项目(No.cstc2013jcyjA10058);重庆市人力资源与社会保障局课题资助项目(渝留助2013011号);重庆市卫生局课题资助项目(No. 2012-2-001)
EZp-mediated regulation of NF-κB target gene expression in gastric cancerWU Xue-lei1, CAI Yao-wu1, ZHUANG Zhi-zhong1, CHEN Yuan-jing1, GUO Ren-jie2, ZHENG Mao-song1
(1DepartmentofOncology,2DepartmentofPathology,TheFirstAffiliatedHospitalofPutianCity,PutianUniversity,Putian351100,China.E-mail:xuelei_wu@163.com)
[ABSTRACT]AIM: To explore the mechanism by which over-expression of enhancer of zeste homolog 2 (EZp) in a panel of gastric cancer cell lines is involved in tumorigenesis of gastric cancer. METHODS: Real-time PCR and Western blot were employed to examine the mRNA and protein levels of EZp, respectively. MTS assay, cell migration and soft agar assay were performed to investigate the role of EZp in the regulation of stomach cancer behaviors. The effect of EZp on NF-κB target gene expression was determined by Luciferase reporter and real-time PCR. Co-immunoprecipitation was used to analyze the interaction of EZp and p65 in HEK293T cells. RESULTS: The expression levels of EZp were significantly increased in the gastric cancer cells compared with normal gastric epithelial cells. Pharmacological inhibition by DZNep or knockdown of EZH2 significantly compromised AGS and SNU-16 cell activity, cell migration and anchorage-independent cell growth. Moreover, siRNA knockdown of EZH2 impaired NF-κB downstream targets, such as IL-8, CXCL5 and CCL20. In addition, the interaction of EZp and p65 was detected. CONCLUSION: EZp mediates the growth of gastric cancer cells through the regulation of NF-κB downstream gene expression.
[KEY WORDS]Gastric cancer; Enhancer of zeste homolog 2; Nuclear factor-κB
通讯作者△Tel: 023-89012559; E-mail: gouxincq@163.com
[收稿日期]2015- 05- 07[修回日期] 2015- 09- 21
[文章编号]1000- 4718(2015)12- 2176- 07
doi:10.3969/j.issn.1000- 4718.2015.12.010
[中图分类号]R730.23.12
[文献标志码]A
