血清型A肉毒杆菌神经毒素重链对Neuro-2a细胞的促神经突起再生作用*
2016-01-31高美玲张彩云李夏青
高美玲, 王 红, 张彩云, 兰 婧, 李夏青△
(1山西医科大学病理生理教研室,山西 太原 030001; 2兰州大学第一医院,甘肃 兰州 730000)
血清型A肉毒杆菌神经毒素重链对Neuro-2a细胞的促神经突起再生作用*
高美玲1,王红1,张彩云2,兰婧1,李夏青1△
(1山西医科大学病理生理教研室,山西 太原 030001;2兰州大学第一医院,甘肃 兰州 730000)
[摘要]目的: 观察血清型A肉毒杆菌神经毒素重链(botulinum neurotoxin serotype A heavy chain,BoNT/A HC)对Neuro-2a细胞的促神经突起再生作用并探讨与其相关的细胞内信号机制。方法: 采用体外细胞培养技术,在培养液中加入不同浓度的BoNT/A HC(0.01 nmol/L、0.1 nmol/L、1 nmol/L和10 nmol/L)进行干预,于24 h、48 h和72 h时收集细胞进行免疫荧光染色,再计算细胞突起长度及有突起细胞的百分比;在此基础上,选择最有效的BoNT/A HC浓度作为处理剂量加入细胞培养液,于BoNT/A HC作用后不同时点收集全细胞蛋白,采用Western blot检测p-ERK1/2及p-Akt的蛋白水平。 结果: 当BoNT/A HC 浓度为0.1 nmol/L、1 nmol/L和10 nmol/L时,细胞突起的长度及有突起细胞的百分比与对照组相比皆明显增加,差异显著(P<0.05),其中1 nmol/L效果最显著。在细胞培养液内加入1 nmol/L BoNT/A HC 后,p-ERK1/2的蛋白水平呈增加趋势,其中BoNT/A HC作用60 min后,p-ERK1/2的增加与对照组相比差异显著(P<0.05);与p-ERK1/2变化趋势类似,细胞培养液内加入1 nmol/L的BoNT/A HC后, p-Akt的蛋白水平也呈增加趋势,其中BoNT/A HC作用15 min和60 min 时,p-Akt增加显著(P<0.05)。结论: 一定剂量的BoNT/A HC可以促进神经细胞突起再生和生长; BoNT/A HC对Neuro-2a细胞的促神经突起再生作用机制可能通过激活与神经再生相关的信号蛋白ERK1/2和Akt的磷酸化而实现。
[关键词]血清型A肉毒杆菌神经毒素重链; Neuro-2a细胞株; 神经突起再生; 细胞外信号调节激酶; 蛋白激酶B
肉毒杆菌神经毒素(botulinum neurotoxin,BoNT)是一种由肉毒杆菌产生并释放的细菌外毒素,是一种致病力极强的神经肌肉毒素,可导致致命肉毒症。BoNT也是迄今为止所发现的致死率极强的生物毒素之一[1]。目前BoNT已经广泛用于临床治疗与肌肉反应性过强相关的一些疾病,如斜视、眨眼症、斜颈、面肌痉挛及脑瘫引起的外周肌肉强直等[2]。根据血清型将BoNT分为A型、B型、C型、D型、E型、F型和G型7种类型,其中A型BoNT(BoNT/A)毒力最强,也是目前主要的市售BoNT[3]。BoNT/A为蛋白多肽,其分子由一条包含结合域的重链(heavy chain,HC)和一条包含酶域的轻链(light chain,LC)所组成,二者借二硫键相互连接[4]。HC有氨基端和羧基端两个功能区域,氨基端称为穿膜域,主要形成离子通道;羧基端称为结合域,主要介导毒素的内吞。LC具有锌金属蛋白酶活性,是毒素的催化单位[5]。
关于BoNT/A 在中毒的神经末梢可以诱导轴突出芽的现象早已有一些研究报道[6]。近些年发现,BoNT/A除了抑制乙酰胆碱等神经递质释放外,在体外还可以直接刺激运动神经元突起增长、分枝增多[6]。基于BoNT/A LC的主要作用是裂解突触相关蛋白,是BoNT引起中毒的主要活性单位,而BoNT/A HC为BoNT的主要膜结合蛋白,当其与宿主膜蛋白结合后不仅介导轻链入胞,同时还有可能通过受体-配体结合而激活细胞内多种信号通路,因此提出设想:BoNT/A HC与宿主细胞膜受体结合所引发的细胞内信号通路有可能与毒素所引发的神经末梢出芽、运动神经元突起生长及分枝增多现象有关。因此本研究采用小鼠脑神经母细胞瘤Neuro-2a细胞验证BoNT/A HC对神经细胞的促神经突起增生作用,并探讨其作用机制。
材料和方法
1细胞系及主要试剂
Neuro-2a细胞购自中国科学院细胞库;DMEM高糖培养基(HyClone);胎牛血清(ExCell Bio);青链霉素(索来宝);多聚赖氨酸(Sigma);0.25%胰蛋白酶含0.02% EDTA和酚红(全式金);人工重组BoNT/A HC(List Biological Labotories Inc.)
2细胞培养
Neuro-2a细胞用DMEM 高糖培养液(含10%胎牛血清和1%青链霉素),于37 ℃、5% CO2恒温培养箱(Thermo)中培养。每隔2 d 按50%换液1次,并在倒置光学显微镜下连续观察细胞生长情况,当细胞密度达到培养瓶80%时进行传代。
3方法
3.1细胞接种及处理取10代以内细胞以每孔1×104接种到预先用多聚赖氨酸铺被的96孔培养板中,每孔50 μL培养液。并轻摇培养板使细胞均匀分布,然后放置在37 ℃、5% CO2培养箱中维持4 h,使细胞充分贴壁后加入BoNT/A HC干预,浓度分别为0 nmol/L、0.01 nmol/L、0.1 nmol/L、1 nmol/L及10 nmol/L。
3.2免疫荧光法分别加入BoNT/A HC于培养液24 h、48 h和72 h后按下列方法收集细胞进行β-tubulin免疫荧光染色。弃掉培养液,用0.1 mol/L、pH 7.4的PBS洗去残存的培养液,用4%多聚甲醛固定30 min,0.1 mol/L 的PBS洗涤(5 min×3次),10%正常血清封闭30 min,加入鼠抗β-tubulin单克隆抗体(1∶1 000;Invitrogen),4 ℃冰箱孵育过夜。弃去 I 抗,PBS充分冲洗(5 min×3次),加入Alexa Fluor® 594结合的羊抗鼠IgG II 抗(1∶500; Invitrogen),室温避光孵育1 h,PBS充分冲洗后加入含有DAPI荧光封片剂(Invitrogen),置于倒置荧光显微镜(Olympus)下进行观察并采集图片。
3.3神经突起长度及有突起细胞的百分比的测量应用ImageJ软件对所摄取的β-tubulin免疫荧光染色图片上的细胞进行突起长度测定及有突起细胞占图片所有细胞百分比的测定。凡长度大于细胞胞体最大直径的突起被认定为生长突起。每个浓度为一组,每组包含6孔,每组平均摄取图像20张图片,每张图片上测定符合标准的8个细胞的突起,实验重复3次,在Photoshop下分别计数有突起细胞数量及图片上细胞总数。
3.4Western blot检测p-ERK1/2及p-Akt的蛋白水平Neuro-2a细胞长至70%~ 80%时加入1 nmol/L的BoNT/A HC,于加入BoNT/A HC后不同时点用0.25%胰蛋白酶含0.02% EDTA消化收集各时点细胞,2 000 r/min离心5 min后,用RIPA 裂解液[含1%蛋白酶抑制剂和1%磷酸酶抑制剂(Sigma)]冰上裂解蛋白60 min,4 ℃,Bradford法蛋白浓度测定试剂盒(上海生工)蛋白定量。取30 μg 蛋白,煮沸10 min,10% SDS-PAGE分离蛋白,将蛋白转移至PVDF 膜上,5%脱脂奶粉室温封闭1 h,加入抗p-ERK1/2 (1∶2 000;CST)、抗p-Akt(1∶1 000;CST)、抗ERK1/2 (1∶1 000;CST)及抗Akt抗体(1∶1 000;CST),4 ℃摇床孵育过夜充分洗涤后加入HRP 标记的羊抗兔IgG(1∶5 000;上海生工)室温孵育1 h,EasySee Western blot kit发光液(全式金) 测定反应条带灰度值,以GAPDH 作为内参照。
4统计学处理
计量数据以均数±标准差(mean±SD)表示。所有数据采用SPSS 16.0软件进行统计分析,应用单因素方差分析(One-way ANOVA)分析数据差异的显著性,以P<0.05为差异有统计学意义。
结果
1BoNT/A HC对Neuro-2a细胞轴突生长的影响
免疫荧光观察3个时点的细胞均收集于同一代细胞,且培养条件一致。加入不同浓度BoNT/A HC后24 h、48 h和72 h时其神经轴突长度均较对照组细胞明显增长,而且尤以BoNT/A HC 浓度为1 nmol/L时最为明显(P<0.01)。具体来讲,BoNT/A HC 作用24 h时,0.01 nmol/L与对照组相比细胞轴突长度虽有所增加,但差异不显著。而其它各浓度组与对照组比较, 细胞突起明显增长, 差异有统计学意义(P<0.05),当BoNT/A HC作用48 h和72 h时,0.1 nmol/L、1 nmol/L及10 nmol/L组的细胞突起长度与对照组相比其差异也具有统计学意义(P< 0.05)。归纳起来,3个时点不同浓度BoNT/A HC均对Neuro-2a细胞突起的生长具有刺激作用,尤以浓度为1 nmol/L最为明显,见图1。
2BoNT/A HC刺激细胞突起数量增多
分别计数每张图片中有轴突细胞数占细胞总数的百分比发现,随着BoNT/A HC浓度的增加,有突起细胞所占百分比也随之增加。BoNT/A HC 作用24 h后,0.01 nmol/L、0.1 nmol/L及1 nmol/L组具有突起的细胞百分比均较对照组有所增加。与促进细胞突起增长一样,BoNT/A HC 浓度为1 nmol/L时,有突起细胞的百分比增多最为明显。然而,实验中观察到,当BoNT/A浓度为10 nmol/L时,具有突起的细胞百分比并未继续增加,反而稍有降低。BoNT/A HC 作用48 h及72 h后有突起细胞所占百分比与24 h类似,仍以1 nmol/L作用最为显著。与此同时,0.01 nmol/L在各个时点与对照组相比虽有增加趋势,但差异皆不显著。总之,BoNT/A HC单一浓度作用的不同时点,有轴突细胞的百分比随着作用时间的延长呈增加的趋势,见图2。
3BoNT/A HC促进Neuro-2a细胞中信号蛋白ERK1/2和Akt的磷酸化
基于前述实验,采用1 nmol/L BoNT/A HC作为干预剂量,对BoNT/AHC作用于Neuor-2a细胞后不同时点信号蛋白ERK1/2和Akt的蛋白表达及磷酸化激活状态进行检测。
加入1 nmol/L 的BoNT/A HC后,ERK1/2的总量各组间无明显差异,但是p-ERK1/2的水平则呈增加趋势,BoNT/A HC作用时间≥60 min时, p-ERK1/2 的水平明显增加,与对照组相比差异显著(P<0.05),同时,p-ERK1/2的免疫荧光染色也呈现相同的趋势。实验中观察到的另一个现象是:尽管在BoNT/A HC后,Neuro-2a细胞ERK1/2的磷酸化水平整体呈增加趋势,但呈现60 min和4 h 2个时间峰值,见图3。
加入1 nmol/L BoNT/A HC后,Western blot显示Akt的总体水平无明显变化,但p-Akt的水平呈现增加趋势,尤以15 min和60 min明显,与对照组比较差异显著(P<0.05)。更有意思的是,Akt的磷酸化程度在加入BoNT/A HC后也呈现2个时间峰值, 分别是15 min 和60 min,见图4。
上述结果均表明,BoNT/A HC可促进Neuro-2a细胞中ERK1/2和Akt信号蛋白磷酸化。加入BoNT/A HC后,p-ERK1/2和p-Akt的增强皆呈现时间上的双峰值,且p-Akt激活峰值的出现早于p-ERK1/2。
讨论
本研究表明BoNT/AHC具有促进神经突起再生的效应,其表现为BoNT/A HC作用于培养的Neuro-2a细胞不同时间后可刺激细胞突起增长,同时具有神经突起的Neuro-2a细胞的百分比明显增加。BoNT/A HC的这种促神经突起再生效应在一定范围内具有浓度依赖性。随着BoNT/A HC浓度增加,其促神经突起增长的作用增强,这与前人有关肉毒素中毒后期神经末梢的出芽现象及体外肉毒素刺激运动神经突起再生有关的报道是一致的。研究中还观察到,如果BoNT/A HC的剂量过高,譬如达到10 nmol/L时,其刺激神经突起再生的作用并不会进一步增加,反而有所降低。很少有研究调查这种发芽的细胞及分子机制,然而,关于肉毒素中毒后期的神经末梢出芽或体外促进神经突起再生的机制目前并不清楚,大多数人仅仅认为这种出芽很大程度上只是一种非特异性的化学去神经反应[6]。

Figure 1. Concentration-dependent effect of BoNT/A HC on the neurite outgrowth of Neuro-2a cells. The neurons were labeled with mouse anti-β-tubulin (red). Mean±SD.n=3.*P<0.05,**P<0.01vs0 nmol/L.
图1BoNT/A HC对Neuro-2a细胞神经轴突长度的浓度依赖性影响
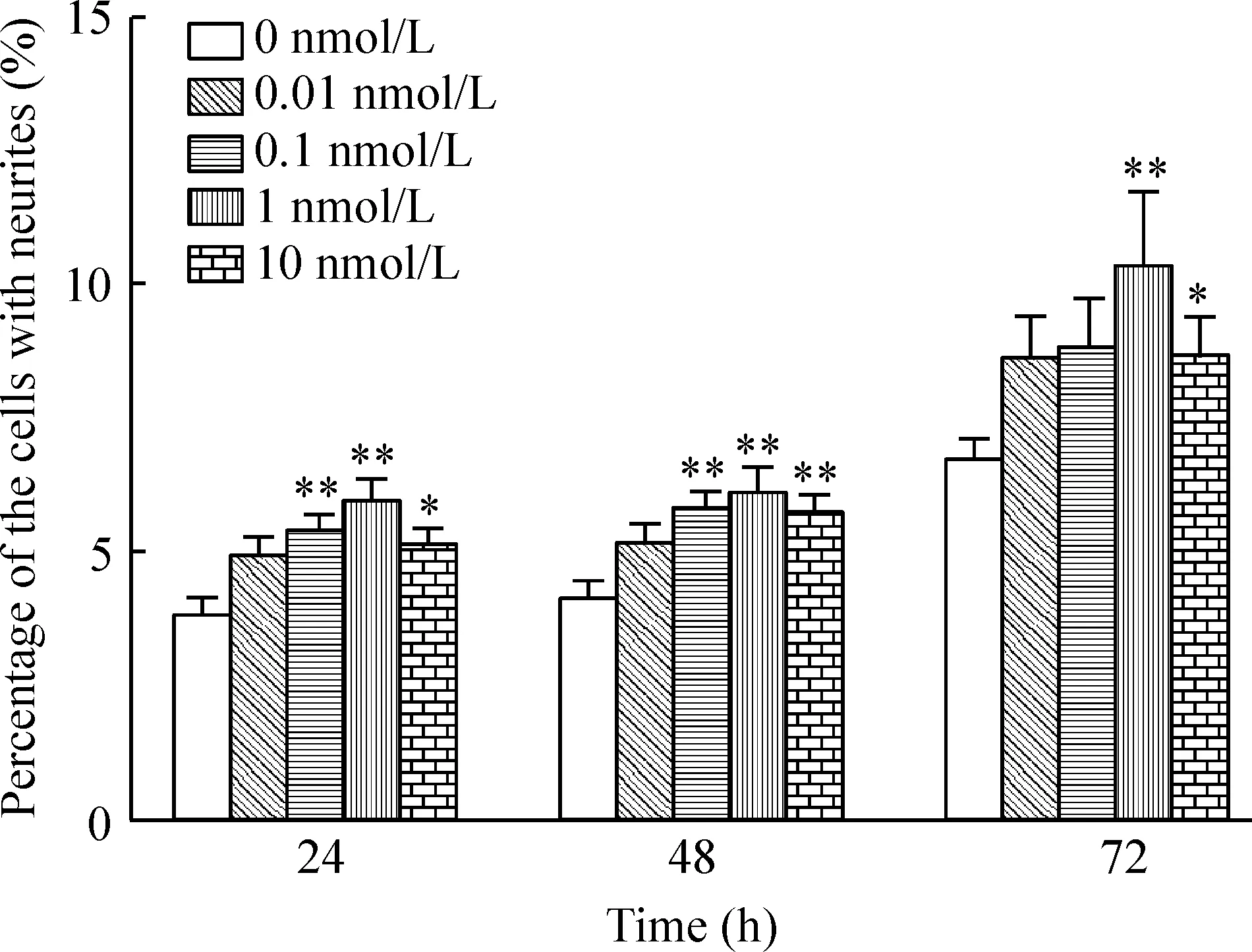
Figure 2.The neurite positive percentage of the Neuro-2a cells treated with different concentrations of BoNT/A HC at 24 h, 48 h and 72 h. Mean±SD.n=3.*P<0.05,**P<0.01vs0 nmol/L.
图2不同浓度的BoNT/A HC在不同时点有轴突细胞占总细胞数的百分比
ERK1/2和Akt是目前公认的与细胞存活、再生相关的重要细胞内信号蛋白,二者通过上游信号分子激活后被磷酸化,以磷酸化的活性形式参与对下游信号通路的干预。ERK1/2是MAPK家族的主要成员之一,又称p44/p42丝裂原活化蛋白激酶,为信号转导的重要分子[7]。已经有报道一些神经生长因子如IGF-1、NGF和BDNF会促进MAPK/ERK再生信号通路而导致神经再生[8],而以前的研究也表明ERK1/2能够参与细胞的增殖、分化、细胞形态的维持及骨架的构建[9]。Akt是一种丝氨酸/苏氨酸激酶,PI3K/Akt信号通路的激活主要参与抑制细胞凋亡、促进细胞存活机制。PI3K可诱导无活性的 Akt 转移至浆膜内表面,使其Ser473和Thr308位点磷酸化,从而使 Akt 活化(磷酸化)[10]。在上述基础上,本研究的结果发现BoNT/A HC作用于Neuro-2a细胞后可引起细胞内ERK1/2和Akt信号蛋白磷酸化过程增强,且二者磷酸化增强皆表现出时间上的双峰现象,其中p-ERK1/2的2个峰值为加入BoNT/A HC 后60 min和4 h;而p-Akt的增强则分别是15 min和60 min,比p-ERK1/2的激活呈现较早。由此,本实验结果证实p-ERK1/2和p-Akt磷酸化的改变有可能是BoNT/A HC促进神经突起再生的重要信号蛋白和分子机制。目前已经证实,在神经系统里ERK1/2和Akt通常被神经营养因子(NGF和BDNF)激活,表现为磷酸化过程增强,从而参与促进神经元存活或神经突起再生[11]。文献报道激活的Akt信号通路在神经细胞的生长发育、增殖、髓鞘形成、轴突再生和细胞凋亡方面起着重要的作用[12];抑制 Akt 降解和促进 Akt 活化均可以促进轴突的形成和生长[13]。近年的研究也表明,PI3K/Akt 信号通路在微管组装和动力学方面具有非常重要的作用[14]。微管系统和肌动蛋白丝是组成轴突细胞骨架的主要部分,它们之间的相互影响,对轴突的生长和延伸至关重要[15]。Markus等[16]的研究证实ERK1/2及Akt的磷酸化可以被同一种刺激所激活,在同一时点,Akt激活的倍数明显高于ERK1/2。
小鼠神经母细胞瘤Neuro-2a细胞是由Klebe和Ruddle经A株白鼠的自生肿瘤建立[17]。Neuro-2a细胞株的主要组织来源是脑神经母细胞瘤和神经母细胞,形态似神经和阿米巴样干细胞,具有神经干细胞的特征,培养时呈单层贴壁细胞生长状态,普通培养条件下部分细胞可形成神经突起。另外,Neuro-2a细胞含有与BoNT/A HC结合的膜蛋白成分,因此培养液内加入BoNT/A HC可以引起Neuro-2a细胞膜上出现受体-配体复合物形成并激活相应细胞内再生相关信号蛋白。
除上述之外,本实验中还观察到BoNT/A HC作用于Neuro-2a细胞后ERK1/2和Akt的磷酸化增强呈现2个时间高峰。从时间的延续性看,Akt高峰值的出现早于ERK1/2,结果提示,当BoNT/A HC与细胞表面相应受体结合而激活细胞内信号蛋白时,Akt的激活要早于ERK1/2。但是这种时间延续上的信号蛋白磷酸化双峰值的跳跃性增加的机制还不是十分清楚。Steinmetz等[18]采用卵巢癌原代细胞培养发现ERK1/2的磷酸化在癌细胞增殖过程中也呈时间上的双峰表达现象, 并认为这种时间延续上的ERK1/2磷酸化的变化可能与MEK依赖性和非依赖性2种机制有关。有文献报道,Akt和ERK1/2皆参与应激反应[19]。因此本研究中外源性给予BoNT/A HC时,Neuro-2a细胞是否也表现有早期应激反应尚待进一步证实,但是,ERK1/2及Akt磷酸化时间序列上的第一个峰值与应激反应有关的可能性是存在的。如果有这样的可能,2种信号蛋白第一个磷酸化的高峰可能属于应激反应,而随后的长时程磷酸化增强高峰则可能才是受体-配体激活引起的细胞内信号蛋白的激活。
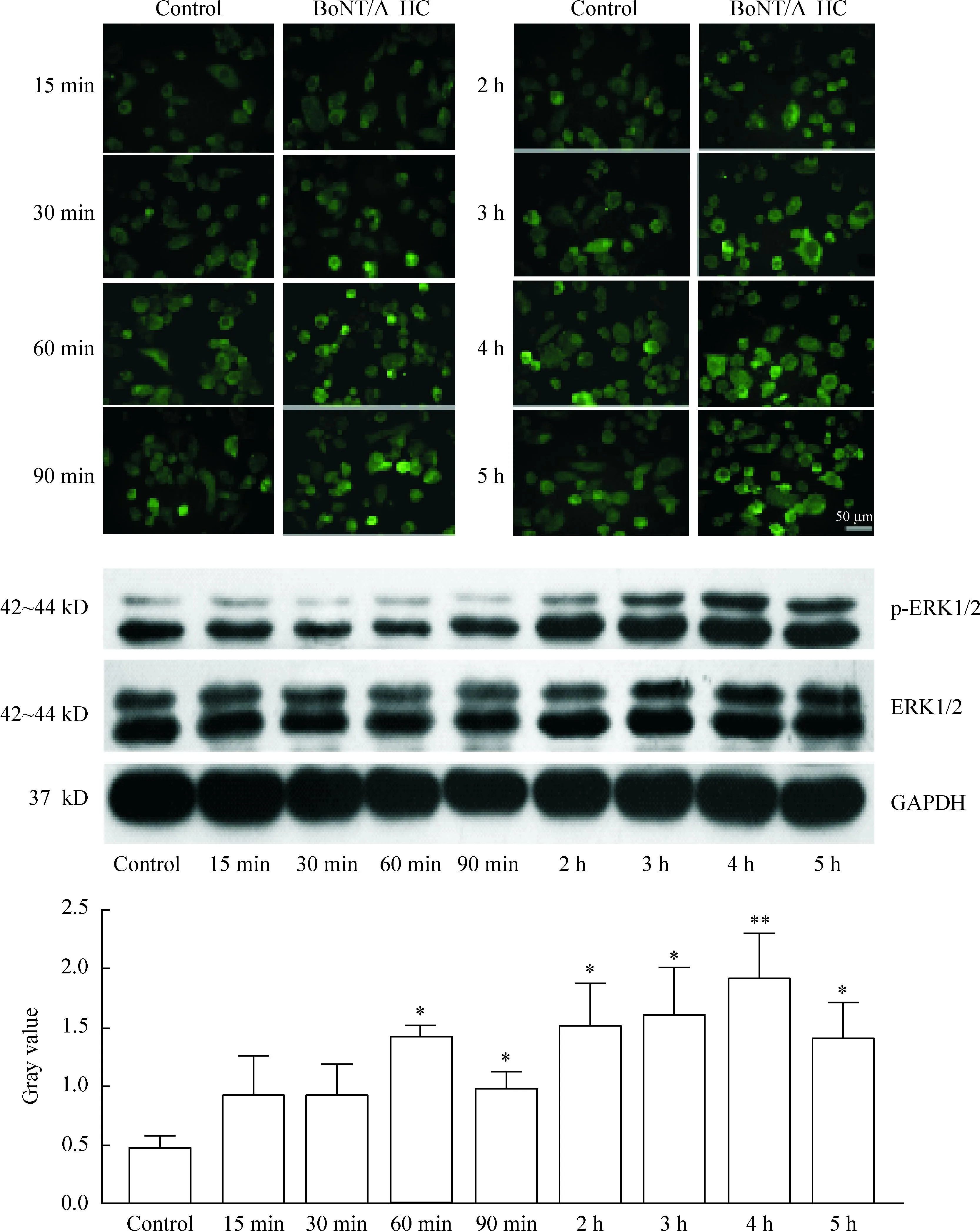
Figure 3.Phosphorylation of ERK1/2 affected by 1 nmol/L of BoNT/A HC treatment for different incubation time in Neuro-2a cells. Mean±SD.n=4.*P<0.05,**P<0.01vscontrol.
图3BoNT/A HC(1 nmol/L)作用不同时间对Neuro-2a细胞ERK1/2磷酸化的影响
综上所述,BoNT/A或BoNT/A HC具有促神经再生的作用,其作用机制可能与其相关膜受体激活细胞内某些信号通路相关,BoNT/A HC与相应膜受体结合所激活的与ERK1/2及Akt相关的细胞内信号通路可能是BoNT/A HC促进神经突起增长的主要机制。然而,鉴于细胞各种信号蛋白质之间相互作用的复杂情况,BoNT/A HC与膜受体结合后所激活的细胞内信号通路尚未完全明了,因此,有关BoNT/A HC促进神经突起再生/增长的机制还需进一步深入研究。

Figure 4.Phosphorylation of Akt affected by 1 nmol/L of BoNT/A HC treatment for different incubation periods in cultured Neuro-2 cells. Mean±SD.n=4.*P<0.05vscontrol.
图4BoNT/A HC(1 nmol/L)作用不同时间对Neuro-2a细胞Akt磷酸化的影响
[参考文献]
[1]Arnon SS, Schechter R, Inglesby TV, et al. Botulinum toxin as a biological weapon: medical and public health management[J]. JAMA, 2001, 285(8):1059-1070.
[2]Barnes M. Botulinum toxin: mechanisms of action and cli-nical use in spasticity[J]. J Rehabil Med, 2003, 41(Suppl):56-59.
[3]Mahant N, Clouston PD, Lorentz IT. The current use of botulinum toxin[J]. J Clin Neurosci, 2000, 7(5):389-394.
[4]Montal M. Botulinum neurotoxin: a marvel of protein design[J]. Annu Rev Biochem, 2010, 79:591-617.
[5]李夏青. 肉毒杆菌毒素的临床应用及其前景[M]. 第1版.北京:知识产权出版社, 2012: 13.
[6]Coffield JA, Yan XZ. Neuritogenic actions of Botulinum neurotoxin A on cultured motor neurons[J]. J Pharmcol Exp Ther, 2009, 330(1):352-358.
[7]Kwon DS, Kwon CH, Kim JH, et al. Signal transduction of MEK/ERK and PI3K/Akt activation by hypoxia/reoxygenation in renal epithelial cells[J]. Eur J Cell Biol, 2006, 85(11):1189-1199.
[8]Jiang P, Zhu T, Xia Z, et al. Inhibition of MAPK/ERK signaling blocks hippocampal neurogenesis and impairs cognitive performance in prenatally infected neonatal rats[J]. Eur Arch Psychiatry Clin Neurosci, 2015, 265(6):497-509.
[9]Johnson-Farley NN, Patel K, Kim D, et al. Interaction of FGF-2 with IGF-1 and BDNF in stimulating Akt, ERK, and neuronal survival in hippocampal cultures[J]. Brain Res, 2007, 1154:40-49.
[10]Solit DB, Basso AD, Olshen AB, et al. Inhibition of heat shock protein 90 function down-regulates Akt kinase and sensitizes tumors to Taxol[J]. Cancer Res, 2003, 63(9):2139-2144.
[11]Okada K, Tanaqka H, Temporin K, et al. Methylcobalamin increases Erk1/2 and Akt activities through the methylation cycle and promotes nerve regeneration in a rat sciatic nerve injury model[J] . Exp Neurol, 2010, 222(2):191-203.
[12]Pal I, Mandal M. PI3K and Akt as molecular targets for cancer therapy: current clinical outcomes[J]. Acta Pharmacol Sin, 2012, 33(12):1441-1458.
[13]Jiang H, Guo W, Liang X, et al. Both the establishment and the maintenance of neuronal polarity require active mechanisms: critical roles of GSK-3β and its upstream regulators[J]. Cell, 2005, 120(1):123-135.
[14]Buttrick GJ, Wakefield JG. PI3-K and GSK-3: Akt-ing together with microtubules[J]. Cell Cycle, 2008, 7(17):2621-2625.
[15]邹佳,李长清. RhoA 信号通路调控与中枢神经系统损伤和修复[J]. 神经损伤与功能重建,2008, 3(4):278-280.
[16]Markus A, Zhong J, Snider WD. Raf and Akt mediate distinct aspects of sensory axon growth[J]. Neuron, 2002, 35(1):65-76.
[17]马志奎,赵炜疆. Neuro-2a细胞替代神经元原代培养进行神经轴突测量实验研究[J]. 中国实用神经疾病杂志, 2012, 15(10):4-6.
[18]Steinmetz R, Wagoner HA, Zeng P, et al. Mechanisms regulating the constitutive activation of the extracellular signal-regulated kinase (ERK) signaling pathway in ovarian cancer and the effect of ribonucleic acid interference for ERK1/2 on cancer cell proliferation[J]. Mol Endocrinol, 2004, 18(10):2570-2582.
(责任编辑: 卢萍, 罗森)

*[基金项目]浙江省自然科学基金青年基金资助项目(No.LQ15H150002);国家自然科学基金资助项目(No.81571923)
Promoting effect of botulinum neurotoxin serotype A heavy chain on neuritogenesis in cultured Neuro-2a cellsGAO Mei-ling1, WANG Hong1, ZHANG Cai-yun2, LAN Jing1, LI Xia-qing1
(1DepartmentofPathophysiology,ShanxiMedicalUniversity,Taiyuan030001,China;2TheFirstHospitalofLanzhouUniversity,Lanzhou730000,China.E-mail:xqli2013@126.com)
[ABSTRACT]AIM: To observe the neuritogenic actions of botulinum neurotoxin serotype A heavy chain (BoNT/A HC) on cultured Neuro-2a cells and to investigate the related signaling mechanisms for the effect of BoNT/A HC. METHODS: Neuro-2a cells were treated with different doses of BoNT/A HC (0.01, 0.1, 1 and 10 nmol/L), and then the cells were harvested at 24 h, 48 h and 72 h of BoNT/A HC exposure for detecting the neurite length and the percen-tage of the cells with neuronal processes by immunofluorescence staining. The most efficient dose of BoNT/A HC was chosen for exposure to Neuro-2a cells as the above. Whole cell protein was harvested at different time points for detecting the protein levels of phosphorylated ERK1/2 (p-ERK1/2) and phosphorylated Akt (p-Akt) by Western blot. RESULTS: Low doses of BoNT/A HC stimulated the neurite outgrowth, and increased the percentage of the cells with neurites compared with the negative controls (P<0.05), especially in the group with 1 nmol/L of BoNT/A HC treatment. Meanwhile, the phosphorylation of ERK1/2 and Akt was increased after treated with BoNT/A HC. There was an increasing tendency for the phosphorylation of ERK1/2 after the exposure of the cells to BoNT/A HC. The obvious increase in p-ERK1/2 was seen from 60 min to 5 h with 1 nmol/L of BoNT/A HC treatment (P< 0.05), and the increased protein level of p-Akt was mainly observed at 15 min and 60 min (P<0.05). CONCLUSION: BoNT/A HC stimulates the neuritogenesis. The neuritogenic mechanism of BoNT/A HC on Neuro-2a cells might be realized by activation of the phosphorylation of ERK1/2 and Akt.
[KEY WORDS]Botulinum neurotoxin serotype A heavy chain; Neuro-2a cell line; Neuritogenesis; Extracellular signal-regulated kinases; Protein kinase B
通讯作者△Tel: 0577-88069280; E-mail: zhangdan6250@yeah.net
[收稿日期]2015- 08- 07[修回日期] 2015- 09- 30
[文章编号]1000- 4718(2015)12- 2228- 05
doi:10.3969/j.issn.1000- 4718.2015.12.018
[中图分类号]R392.12
[文献标志码]A
