eEF1A2在原发性肝细胞癌的表达*
2016-01-31邱福南陈敦雁伍严安黄肖利吴文冰
黄 毅, 邱福南, 陈敦雁, 伍严安, 李 峰, 黄肖利, 吴文冰
(福建医科大学省立临床医学院 1检验科, 2肝胆外科, 3病理科,福建 福州 350001)
eEF1A2在原发性肝细胞癌的表达*
黄毅1△,邱福南2,陈敦雁1,伍严安1,李峰3,黄肖利1,吴文冰1
(福建医科大学省立临床医学院1检验科,2肝胆外科,3病理科,福建 福州 350001)
[摘要]目的: 研究真核翻译延长因子1A2(eEF1A2)在原发性肝细胞癌(HCC)组织的表达,以及eEF1A2过表达对HCC细胞生物学行为的影响。方法: 应用real-time PCR法和免疫组化法分别检测62例HCC癌组织与配对癌旁组织、20例正常肝脏组织eEF1A2的mRNA和蛋白表达,应用real-time PCR法与Western blot法分别检测几种HCC细胞株eEF1A2的mRNA与蛋白表达。构建GV287-eEF1A2表达慢病毒感染低表达eEF1A2的HCC细胞,应用real-time PCR法和Western blot法分别检测细胞eEF1A2 的mRNA和蛋白表达;应用MTT法、DNA倍体法和real-time PCR法分别检测细胞活力、细胞周期和白蛋白mRNA的表达。结果: HCC癌组织eEF1A2的mRNA表达水平和蛋白表达阳性率明显高于配对癌旁组织与正常肝脏组织(P<0.01);eEF1A2的mRNA和蛋白在HCC细胞株SMMC-7721和BEL-7402高表达,在SK-HEP-1低表达。构建的GV287-eEF1A2表达慢病毒可感染SK-HEP-1细胞使eEF1A2过表达;与阴性对照组相比,GV287-eEF1A2组SK-HEP-1细胞的活力升高,白蛋白的mRNA表达水平降低,G0/G1期的细胞比例显著减少,而S期和G2/M期的细胞比例显著升高。结论: eEF1A2在HCC癌组织存在异位高表达;eEF1A2可能是HCC的一种潜在癌蛋白,其过表达可增强HCC细胞的增殖能力,降低HCC细胞的分化程度,并促使细胞周期通过G0/G1期,进入S期和G2/M期。
[关键词]真核翻译延长因子1A2; 肝细胞癌; 细胞增殖; 细胞周期
原发性肝细胞癌(hepatocellular carcinoma,HCC)是我国常见的恶性肿瘤,全世界每年发生50万例HCC中一半以上在中国,其相关致癌机制一直是国内外研究的难点。长期以来,对肿瘤的研究多集中在癌基因突变、活化、抑癌基因失活及转录因子异常等方面,而相对忽略与蛋白质合成进程相关蛋白的致癌作用[1]。人类真核翻译延长因子1A2(eukaryotic elongation factor 1A2,eEF1A2)参与蛋白质翻译过程肽链的延长,传统观念被认为是一种管家蛋白。相比其异构体eEF1A1,eEF1A2表达具有组织特异性,只局限于心脏、脑和骨骼肌。但近年来的研究发现,eEF1A2在多种其它组织来源的肿瘤中存在着异位高表达[2-7],与肿瘤的发生发展密切相关。本研究旨在观察eEF1A2在HCC组织与细胞株的表达情况,并构建有效表达eEF1A2的慢病毒,探讨eEF1A2过表达对HCC细胞增殖的影响。
材料和方法
1研究对象
收集2012年10月~2013年12月期间在福建省立医院接受手术切除并经术后病理证实的HCC患者62例,其中男性52例,女性10例,年龄(54.3±12.2)岁(18~73岁)。所有患者术前均未行放、化治疗。分别取每位患者手术切除的肝癌组织及配对癌旁组织标本,标本切除后部分置4%甲醛固定,备用免疫组化法检测;部分置RNA保存液浸泡过夜,然后置于-80 ℃低温冰箱保存,备用real-time PCR法检测。正常肝脏组织对照来自2012年10月~2013年12月期间在福建省立医院接受手术切除的20例肝脏血管瘤患者,其中男性12例,女性8例,年龄(40.8±10.4)岁(25~66岁)。所有患者均排除肝炎与肝硬化。取患者手术切除的肝脏血管瘤周边组织标本,处理方式同肝癌组织及配对癌旁组织标本。
2细胞培养
人HCC细胞株SMMC-7721、BEL-7402和SK-HEP-1购自中科院细胞所,用含10%胎牛血清的DMEM培养液(Gibco),置37 ℃、5% CO2、饱和湿度的培养箱中培养,2~3 d换液传代1次;实验用细胞为状态良好的对数生长期细胞。
3实验方法
3.1Real-time PCR法检测HCC肝脏癌组织标本与细胞株eEF1A2的 mRNA表达用TRIzol试剂(Invitrogen)提取经充分研磨的62例HCC肝脏癌组织和配对癌旁组织、20例正常肝脏组织标本以及处于对数生长期HCC细胞株SMMC-7721、BEL-7402和SK-HEP-1的总RNA,并对其进行DNase 处理后,分别取2 μg反转录成cDNA,以SYBR GreenⅠ(ABI)为荧光染料,在real-time PCR仪(ABI 7300)上分别行eEF1A2和磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)基因的扩增。eEF1A2的上游引物为5’-GTCAAGGAAGTCAGCGCCTAC-3’,下游引物为5’-TGAACCACGGCATGTTGGG-3’,扩增产物为124 bp;GAPDH的上游引物为5’-TGACTTCAACAGCGACACCCA-3’,下游引物为5’-CACCCTGTTGCTGTAGCCAAA-3’,扩增产物为121 bp。Real-time PCR反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环。PCR反应结束后,扩增产物均经熔解曲线分析验证特异性,熔解曲线分析条件为95 ℃ 1 min,20 ℃/s;55 ℃ 1 min,20 ℃/s;55~95 ℃,0.5 ℃/s。以GAPDH为内参照,采用 2-ΔΔCt法比较各组eEF1A2 的mRNA相对表达量。
3.2免疫组化法检测HCC肝脏癌组织标本eEF1A2 蛋白的表达62例HCC肝脏癌组织和配对癌旁组织、20例正常肝脏组织标本经4%甲醛固定后,制作成石蜡切片,采用免疫组化SP法染色(试剂盒购于福州迈新生物技术有限公司),用1∶50稀释的兔抗人eEF1A2多克隆抗体(Novusbio)进行检测,严格按照说明书操作,阳性判断标准:细胞浆中出现棕黄色颗粒为阳性细胞,高倍镜下计数500个细胞,染色细胞≥10%为阳性,<10%为阴性。
3.3Western blot法检测HCC细胞株eEF1A2蛋白的表达按1×105∶1的比例加入细胞裂解液提取处于对数生长期HCC细胞株SK-HEP-1的总蛋白,经紫外分光光度计(Beckman DU640)测定含量后,分别取等量总蛋白99 ℃变性5 min,进行12% SDS-聚丙烯酰胺凝胶垂直电泳,电转移至NC膜上;封闭NC膜1 h,加入相应抗体4 ℃孵育过夜,其中GAPDH兔抗购自CST,eEF1A2兔抗购自Novusbio;TBS洗涤后,加辣根过氧化物酶标记的羊抗兔IgG(KPL),室温孵育1 h;TBS洗涤后加LumiGLO Chemiluminescent Substrate(KPL)室温下孵育1 min,曝光,洗片,然后在GelDoc凝胶图像分析仪(Bio-Rad)上扫描条带的灰度,并以GAPDH为内参照,计算eEF1A2蛋白的相对表达量。
3.4构建eEF1A2表达慢病毒(1)eEF1A2表达慢病毒载体的构建:根据GenBank数据库提供的eEF1A2基因(NM_001958)编码序列,设计出含交换配对碱基和酶切位点,并含有目的基因5’端部分序列用于PCR钓取目的基因的一对引物,正向引物为 5’-GAGGATCCCCGGGTACCGGTCGCCACCATGGGC-AAGGAGAAGACCCAC-3’,反向引物为5’-TCCTTGTAGTCCATACCCTTGCCCGCCTTCTGCGCCTT CTGC-GCCGACTTG-3’。经PCR扩增后,将得到的PCR产物(1.43 kb)交换入线性化表达载体GV287(AgeI/AgeI酶切,购自上海吉凯基因化学技术有限公司)中,构建重组的GV287-eEF1A2慢病毒表达载体,预期表达产物为50 kD的eEF1A2蛋白,然后以线性环化的空载体作为阴性对照,转化感受态大肠杆菌Dpα,挑取重组阳性菌落行PCR 及测序鉴定。(2)慢病毒包装:通过Lipofectamine 2000(Invitrogen)将构建的重组慢病毒表达载体和相对应的包装质粒pHelper 1.0载体、pHelper 2.0载体共转染293T细胞进行慢病毒包装,48 h后收集上清液,浓缩,测定慢病毒的滴度,分装,-80oC保存备用。(3)细胞感染及实验分组:根据预先摸索的MOI值,将获得的慢病毒感染对数生长期的SK-HEP-1细胞,12 h后吸去含病毒和聚凝胺(polybrene)的上清液,加入新鲜含10%胎牛血清的DMEM培养液,继续培养,感染3 d后在荧光显微镜下观察慢病毒上报告基因GFP 的表达情况,感染效率大于80%者继续后续实验。每次实验设3组,分别为:过表达组(over-expression,OE)组,感染GV287-eEF1A2表达慢病毒;阴性对照(negative control,NC)组,感染GV287空载体;空白对照(control,CON)组,未感染慢病毒。(4)GV287-eEF1A2表达慢病毒功能鉴定:慢病毒感染5 d后,收集各组细胞分别提取RNA和总蛋白,采用real-time PCR法检测eEF1A2的 mRNA,Western blot法检测eEF1A2的蛋白,观察GV287-eEF1A2表达慢病毒在SK-HEP-1细胞内表达eEF1A2的效果。
3.5MTT法绘制细胞活力曲线收集感染效率大于80% 的SK-HEP-1细胞并接种于96孔板,每孔100 μL,每孔接种细胞数为2×103,实验设OE组、NC组和CON组,每组3个复孔,连续培养5 d;实验结束前4 h加入5 g/L的MTT(Sigma)10 μL,37 ℃孵育4 h后小心吸去上清,加入100 μL二甲基亚砜(DMSO),置酶标仪(Stat Fax-2100)上振荡溶解结晶后用490 nm波长比色,以吸光度A值为纵轴,作用时间为横轴绘制SK-HEP-1细胞活力变化曲线。
3.6白蛋白(albumin)mRNA表达的检测慢病毒感染5 d后,分别收集OE组、NC组和CON组SK-HEP-1细胞,采用real-time PCR法检测白蛋白的mRNA。白蛋白的上游引物为5’-TGCAACTCTTCGTGAAACCTATG-3’,下游引物为5’-ACATCAACCTCTGGTCTCACC-3’,扩增产物为135 bp。Real-time PCR的反应条件及扩增产物相对表达量的计算方法见3.1。
3.7 细胞周期的检测慢病毒感染5 d后,分别收集OE组、NC组和CON组SK-HEP-1细胞,PBS洗涤;加入4 ℃预冷的70% 乙醇固定细胞至少1 h,1 500 r/min 离心5 min去除固定液,PBS洗涤细胞沉淀1次;按DNA倍体检测试剂盒(Sigma)说明加入碘化丙碇溶液,避光作用15 min,FACSCalibur流式细胞分析仪(BD)上检测细胞周期情况,每次至少计数10 000个细胞。
4统计学处理
所有实验均重复3次,对符合正态分布的定量数据,多组间均值的比较采用单因素方差分析(one-way ANOVA)检验,两组间均值的比较采用SNK-q检验;对不符合正态分布的定量数据,组间的比较采用Nonparametric Tests的Mann-WhitneyU检验。阳性率的比较采用χ2检验。所有统计学处理均在SPSS 13.0统计软件包上进行,以P<0.05为差异有统计学意义。
结果
1HCC肝脏癌组织eEF1A2的表达
以real-time PCR法检测62例HCC肝脏癌组织与配对癌旁组织、20例正常肝脏组织的eEF1A2的mRNA表达,结果显示癌组织eEF1A2的mRNA表达量的中位数为35.27,明显高于配对癌旁组织和正常肝脏组织(P<0.01),见图1。免疫组化染色结果显示eEF1A2的阳性表达主要位于胞质(图2)。62例HCC癌组织有47例呈eEF1A2阳性表达,阳性率达75.8%;62例配对癌旁组织仅5例呈eEF1A2弱阳性表达,阳性率为8.1%,20例正常肝脏组织无一例eEF1A2阳性。HCC癌组织的eEF1A2蛋白表达阳性率明显高于配对癌旁组织与正常肝脏组织(P<0.01)。

Figure 1.The mRNA expression of eEF1A2 in the HCC tissues and cells detected by real-time PCR. The mRNA of GAPDH was used as an internal control. The expression data was plotted as 2-ΔΔCtrelative to normal liver tissues. A: the relative mRNA expression level of eEF1A2 in the HCC tissues; B: the relative mRNA expression level of eEF1A2 in the HCC cells. Mean±SD.**P<0.01vsHCC;##P<0.01vsnormal liver tissues and SK-HEP-1.
图1HCC肝脏癌组织与细胞eEF1A2 mRNA的表达

Figure 2.The protein expression of eEF1A2 in the HCC tissue and matched liver tissue from an HCC patient, and normal liver tissue analyzed by immunohistochemical staining (SP,×200).
图2HCC患者癌组织、配对肝脏组织及正常肝脏组织eEF1A2蛋白的表达
2HCC细胞株eEF1A2的表达
Real-time PCR法与Western blot法检测结果显示eEF1A2的mRNA和蛋白在HCC细胞株SMMC-7721和BEL-7402中存在明显高表达,且以BEL-7402细胞的表达量最高;在HCC细胞株SK-HEP-1中则呈低表达,见图1、3。
3GV287-eEF1A2表达慢病毒在SK-HEP-1细胞内表达eEF1A2的效果
构建GV287-eEF1A2表达慢病毒感染SK-HEP-1细胞,使eEF1A2过表达,与NC组相比较,OE组细胞eEF1A2的mRNA和蛋白表达水平分别升高了88.3%和69.2%,两组之间差异有统计学意义(P<0.01),见图4。
4eEF1A2过表达对SK-HEP-1细胞活力的影响
MTT检测结果显示,OE组、NC组和CON组SK-HEP-1细胞的细胞活力在培养的第2天开始增加,第3天进入对数生长期,生长曲线良好;相比NC组,OE组细胞活力增加趋势更为明显,在培养第5天的细胞活力明显升高(P<0.05),见图5。

Figure 3.The protein expression of eEF1A2 in the HCC cells. GAPDH protein was used as an internal control. Mean±SD.n=3.**P<0.01vsBEL-7402 and SMMC-7721.
图3HCC细胞eEF1A2蛋白的表达

Figure 4.The effect of GV287-eEF1A2 on the expression of eEF1A2 in SK-HEP-1 cells. GAPDH was used as an internal control. Mean±SD.n=3.**P<0.01vsNC and CON.
图4GV287-eEF1A2对SK-HEP-1细胞eEF1A2表达的影响

Figure 5.The effect of GV287-eEF1A2 on the activity of SK-HEP-1 cells. Mean±SD.n=3.*P<0.05vsNC and CON.
图5GV287-eEF1A2对SK-HEP-1细胞活力的影响
5eEF1A2过表达对SK-HEP-1细胞白蛋白mRNA表达的影响
Real-time PCR法检测结果显示,OE组细胞的白蛋白mRNA呈低表达,与NC组相比较其表达水平减低了53.5%,两组间差异有统计学意义(P<0.01),见图6。

Figure 6.The effect of GV287-eEF1A2 on the mRNA expression of albumin in the SK-HEP-1 cells. Mean±SD.n=3.**P<0.01vsNC and CON.
图6GV287-eEF1A2对SK-HEP-1细胞白蛋白mRNA表达的影响
6eEF1A2过表达对SK-HEP-1细胞周期的影响
DNA倍体法检测结果显示慢病毒感染后,OE组处于G0/G1期的SK-HEP-1细胞比例为(38.17±1.49)%,明显低于NC组的(62.37±2.06)%(P<0.01);而处于S期和G2/M期的细胞比例升高,与NC组相比较差异有统计学意义(P<0.01),见图7。
讨论
eEF1A能与GTP、氨基酰-tRNA形成3聚体,再与核糖体结合,传送氨基酸-tRNA入A位,使肽链延长,保证蛋白质合成的准确性和速度。eEF1A有2个异构体,分别为eEF1A1与eEF1A2,两者序列同源性大于90%,而且功能相同;但在哺乳动物中,两者的表达模式存在明显差异:eEF1A1在体内组织中广泛表达,而eEF1A2的表达只限于心脏、脑和骨骼肌。研究表明除了翻译延长因子的基本功能外,eEF1A2在细胞中还发挥着其它多种作用,如促进细胞骨架重排、细胞增殖、核内转录活动,抑制衰老,并可通过与一些信号分子如磷脂酰肌醇-4-激酶、磷脂酶Cγ、钙调蛋白的相互作用参与磷脂酰肌醇、钙等信号转导途径的调节[8]。这种多功能蛋白的特性使eEF1A2具有潜在的致癌作用,并在多种肿瘤中存在着异位高表达[2-7]。Anand等[2]最早提出eEF1A2可能在卵巢癌的发展过程中起重要作用。研究显示eEF1A2在正常卵巢上皮细胞不表达,但1/3的卵巢肿瘤组织及细胞株中存在eEF1A2 mRNA的异位高表达。同时eEF1A2还具有诱导正常细胞恶性转化的作用,将外源性eEF1A2转染入小鼠成纤维细胞NIpT3,表达eEF1A2的NIpT3细胞可在软琼脂糖中呈集落样生长,且生长速率明显大于对照组;另外,将高表达eEF1A2的NIpT3细胞植入裸鼠体内,可引起移植瘤的形成。除卵巢癌外,eEF1A2的异常高表达被发现也见于乳腺癌、前列腺癌、肺癌、消化道肿瘤中[3-7]。
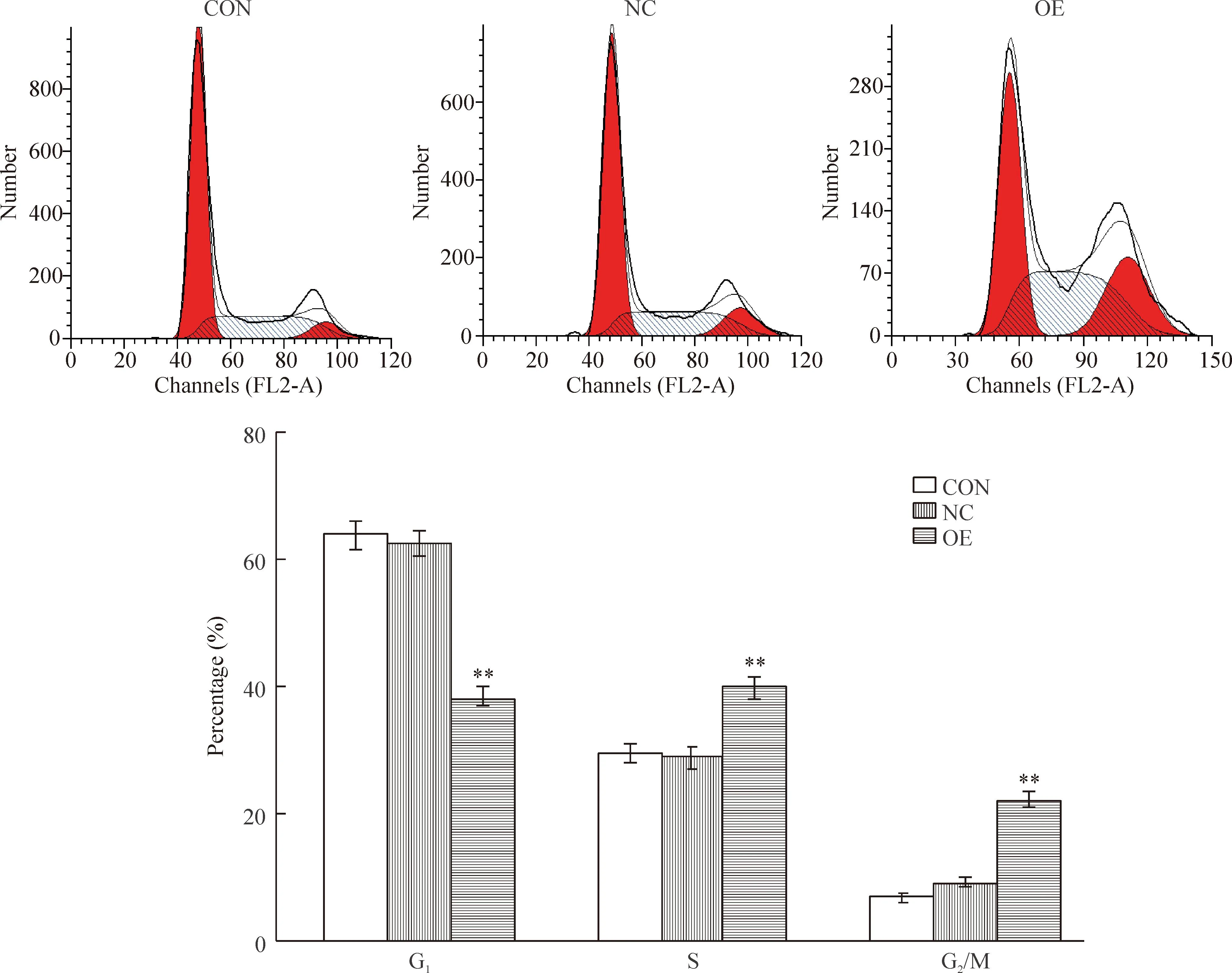
Figure 7.The effect of GV287-eEF1A2 on the cell cycle of SK-HEP-1 cells. Mean±SD.n=3.**P<0.01vsNC and CON.
图7GV287-eEF1A2对SK-HEP-1细胞周期的影响
我们的研究结果显示,eEF1A2的mRNA在HCC癌组织的表达量明显高于配对癌旁组织与正常肝脏组织;其蛋白的免疫组化阳性率高达75.8%,而配对的癌旁组织仅5例呈弱阳性表达,正常肝脏组织无一例阳性,提示eEF1A2在HCC组织存在着异位高表达。文献报道eEF1A2能与锌指蛋白1结合,再通过与一组具有酪氨酸激酶活性的受体结合,将信号从胞浆传到胞核,有效促进细胞的增殖[9]。此外,eEF1A2还可有效结合蛋白激酶B(Akt),通过提高人乳腺癌BT-549细胞[10]与小鼠浆细胞瘤ABPC4细胞[11]内Akt的磷酸化水平,促进这些肿瘤细胞的增殖、侵袭性与迁移能力,增强细胞的恶性度。因此,eEF1A2在HCC的异位高表达是否参与HCC的发展值得探讨。为筛选用于eEF1A2过表达研究的HCC工具细胞,本研究检测了eEF1A2的mRNA和蛋白在几种HCC细胞株的表达,发现相比SMMC-7721和BEL-7402细胞的高表达,SK-HEP-1细胞的eEF1A2表达量低,可作为一种理想的工具细胞。在此工作基础上,我们以GV287为载体,构建了GV287-eEF1A2重组表达慢病毒,通过real-time PCR及Western blot方法检测显示GV287-eEF1A2慢病毒在SK-HEP-1细胞内可有效表达eEF1A2,表现为与NC组相比较,OE组细胞eEF1A2 mRNA和蛋白的表达水平分别明显升高了88.3%和69.2%。将该慢病毒感染SK-HEP-1细胞,MTT结果显示SK-HEP-1细胞的活力增强,在培养第5天的细胞活力明显高于NC组,结合细胞周期分析可认为eEF1A2过表达能促进HCC细胞的增殖。Real-time PCR检测结果发现eEF1A2的过表达还可明显抑制HCC细胞合成白蛋白的能力,使其mRNA表达水平的减少高达53.5%,而合成白蛋白能力被认为与肝脏细胞分化程度密切相关[12],提示eEF1A2的过表达可能降低HCC细胞的分化程度,从而增加其恶性表型;对增殖能力增强以及白蛋白合成能力减低的HCC细胞行细胞周期分析,结果显示GV287-eEF1A2的感染使G0/G1期的细胞比例显著减少,而S期、G2/M期的细胞比例显著升高。以上结果说明eEF1A2的过表达可增强HCC细胞的增殖能力,降低HCC细胞的分化程度,并促使细胞周期通过G0/G1期、进入S期和G2/M期,提示eEF1A2可能参与了HCC疾病的发生发展进程。细胞的增殖、分化及周期调控异常是肿瘤形成的重要生物学基础,我们认为在HCC异位高表达的eEF1A2可能是HCC的一种潜在癌蛋白,其致癌作用与机制可能是多方面的,除了本身对蛋白质翻译的调节外,eEF1A2在HCC细胞是否还参与Akt等信号通路的调节,以及eEF1A2表达对凋亡、迁移、侵袭等其它肿瘤细胞生物学行为的影响,有待本研究后续探讨。
[参考文献]
[1]Caraglia M, Budillon A, Vitale G, et al. Modulation of molecular mechanisms involved in protein synthesis machinery as a new tool for the control of cell proliferation[J]. Eur J Biochem, 2000, 267(13):3919-3936.
[2]Anand N, Murthy S, Amann G, et al. Protein elongation factor eEF1A2 is a putative oncogene in ovarian cancer[J]. Nat Genet, 2002, 31(3):301-305.
[3]Kulkarni G, Turbin DA, Amiri A, et al. Expression of protein elongation factor eEF1A2 predicts favorable outcome in breastcancer[J]. Breast Cancer Res Treat, 2007, 102(1): 31-41.
[4]Scaggiante B, Dapas B, Bonin S, et al. Dissecting the expression ofEEF1A1/2 genes in human prostate cancer cells: the potential of EEF1A2 as a hallmark for prostate transformation and progression[J]. Br J Cancer, 2012, 106(1):166-173.
[5]Zhu H, Lam DC, Han KC, et al. High resolution analysis of genomic aberrations by metaphase and array comparative genomic hybridization identifies candidate tumour genes in lung cancer cell lines[J]. Cancer Lett, 2007, 245(1-2):303-314.
[6]Duanmin H, Chao X, Qi Z. eEF1A2 protein expression correlates with lymph node metastasis and decreased survival in pancreatic ductal adenocarcinoma[J]. Hepatogastroenterology,2013, 60(124): 870-875.
[7]Grassi G, Scaggiante B, Farra R, et al. The expression levels of the translational factors eEF1A 1/2 correlate with cell growth but not apoptosis in hepatocellular carcinoma cell lines with different differentiation grade[J]. Biochi-mie, 2007, 89 (12):1544-1552.
[8]Ejiri S. Moonlighting function of polypeptide elongation factor 1: from actin bundling to zinc finger protein R1-associated nuclear localization[J]. Biosci Biotechnol Biochem, 2002, 66(1):1-21.
[9]Panasyuk G, Nemazanyy I, Filonenko V, et al. A2 isoform of mammalian translation factor eEF1A displays increased tyrosine phosphorylation and ability to interact with different signalling molecules[J]. Int J Biochem Cell Biol, 2008, 40(1):63-71.
[10]Amiri A, Noei F, Jeganathan S,et al. eEF1A2 activates Akt and stimulates Akt-dependent actin remodeling, invasion and migration[J]. Oncogene, 2007, 26(27):3027-3040.
[11]Li Z, Qi CF, Shin DM, et al.Eef1a2 promotes cell growth, inhibits apoptosis and activates JAK/STAT and AKT signaling in mouse plasmacytomas[J]. PLoS One, 2010, 5(5): e10755.
[12]Rothschild MA, Oratz M, Schreiber SS. Albumin synthesis[J]. Int Rev Physiol, 1980,21: 249-274.
(责任编辑: 卢萍, 罗森)

*[基金项目] 重庆市卫生局重点项目(No. 2013-1-013)
Expression of eEF1A2 in hepatocellular carcinomaHUANG Yi1, QIU Fu-nan2, CHEN Dun-yan1, WU Yan-an1, LI Feng3, HUANG Xiao-li1, WU Wen-bing1
(1DepartmentofClinicalLaboratory,2DepartmentofHepatobiliarySurgery,3DepartmentofPathology,ProvincialClinicalCollege,FujianMedicalUniversity,Fuzhou350001,China.E-mail:hyi8070@126.com)
[ABSTRACT]AIM: To study the expression of eukaryotic elongation factor 1A2 (eEF1A2) in the hepatocellular carcinoma (HCC) tissues and the effects of eEF1A2 over-expression on the biological behaviors of the HCC cells. ME-THODS: The expression of eEF1A2 at mRNA and protein levels in the HCC tissues and matched liver tissues from 62 HCC patients, and 20 normal liver tissues were detected by the methods of real-time PCR and immunohistochemical staining, respectively. The mRNA and protein expression of eEF1A2 in the HCC cells was also determined by real-time PCR and Western blot, respectively. The lentivirus containing eEF1A2 gene was constructed, and was used to infect the HCC cells with low eEF1A2 expression. The expression of eEF1A2 at mRNA and protein levels in the infected cells was detected by real-time PCR and Western blot, respectively. The cell activity, cell cycle and mRNA expression of albumin were measured by MTT assay, DNA ploid analysis and real-time PCR, respectively.RESULTS: The mRNA expression levels and protein expression positive rates of eEF1A2 in the 62 cases of HCC tissues, were significantly higher than those of 62 matched liver tissues and 20 normal liver tissues (P<0.01). eEF1A2 mRNA and protein were highly expressed in SMMC-7721 cells and BEL-7402 cells, and expressed in SK-HEP-1 cells at low level. The expression of eEF1A2 at mRNA and protein levels in the SK-HEP-1 cells was significantly enhanced by infection of GV287-eEF1A2 expression lentivirus.Compared with negative control group (transfected with negative control lentivirus), the cell activity in eEF1A2 over-expression group (transfected with GV287-eEF1A2 expression lentivirus) was significantly enhanced, the mRNA expression of albumin was remarkably reduced, and the cells in G0/G1phase were significantly decreased with increased percentage of the cells in S and G2/M phases.CONCLUSION: eEF1A2 is selectively over-expressed in human HCC cancer tissues. eEF1A2 might be a putative oncoprotein in HCC. eEF1A2 over-expression has noticeable effects on the HCC cell proliferation enhancement, differentiation inhibition, and cell cycle acceleration through the G0/G1phase to S phase and G2/M phases.
[KEY WORDS]Eukaryotic elongation factor 1A2; Hepatocellular carcinoma; Cell proliferation; Cell cycle
通讯作者△Tel: 023-89011536; E-mail: 13220327680@163.com
[收稿日期]2015- 06- 16[修回日期] 2015- 08- 30
[文章编号]1000- 4718(2015)12- 2151- 07
doi:10.3969/j.issn.1000- 4718.2015.12.006
[中图分类号]R730.23
[文献标志码]A
