cGKⅠ对胃癌细胞的抑制作用及其机制
2016-01-29赵凯
赵 凯
(江苏大学附属金坛医院消化内科,江苏 金坛 213200)
cGKⅠ对胃癌细胞的抑制作用及其机制
赵凯
(江苏大学附属金坛医院消化内科,江苏金坛213200)
〔摘要〕目的探讨cGMP依赖性蛋白激酶(cGK)Ⅰ对胃癌细胞的抑制作用及其机制。方法构建过表达cGK Ⅰ慢病毒,感染胃癌细胞株(AGS)获得过表达cGK Ⅰ细胞系,通过四甲基偶氮唑蓝比色法(MTT)测定过表达cGK对AGS细胞活力的影响,Western印迹检测原癌基因p53,抑癌基因C-myc,细胞凋亡相关基因半胱氨酸蛋白酶(caspas)3以及迁袭转移相关基质金属蛋白酶(MMP)2、MMP-9蛋白的表达变化。结果cGKⅠ腺病毒载体感染的AGS细胞,细胞活性显著下降。p53抑癌基因和C-myc原癌基因并没有显著变化,细胞迁移相关蛋白MMP-2、7、9均显著下降,凋亡蛋白caspase3显著上升。结论cGKⅠ对AGS细胞增殖有抑制作用。cGKⅠ诱导的细胞迁移能力的下降和凋亡的上升与抑癌基因和原癌基因无关,或者在AGS细胞中存在p53和C-myc原癌基因突变。
〔关键词〕cGKⅠ;胃癌细胞
第一作者:赵凯(1974-),男,副主任医师,主要从事消化内镜及消化道肿瘤的诊治研究。
最近研究发现cGMP依赖性蛋白激酶(cGK)具有抗肿瘤作用,但其抗肿瘤的机制尚未完全阐明〔1〕。可能的机制主要有抑制营养性激素及生长因子的分泌、诱导凋亡、调节免疫应答抑制肿瘤血管形成等〔2〕。但也有研究发现cGKⅠ在某些肿瘤组织中低表达〔3〕。本研究旨在初步阐明cGKⅠ在胃癌发生发展中的作用及其可能的机制。
1材料与方法
1.1实验材料AGS细胞由上海生物研究所提供(cellbank)。兔抗人蛋白激酶cGKⅠ多克隆抗体购于SANTA CRUZ,批号为SC-25429;多克隆抗体基质金属蛋白酶(MMP)2(H-76)、MMP-7(FL-267)、MMP-9 (H-129)、p53(FL-393)、C-myc、半胱氨酸蛋白酶(caspase)3均购于SANTA CRUZ公司,批号分别为sc-10736、sc-30071、 sc-10737、sc-6243、sc-789、sc-98785;腺病毒包装试剂盒购于invitrogen公司,pAd/CMV/V5-DESTTMGateway®Vector Kit,批号为V493-20。
1.2实验方法
1.2.1人cGKⅠ腺病毒表达载体的构建上游引物:5'-CGCGGATCCAGTCGGCTACTATGGCGC-3',酶切位点BamH1,下游引物:5'-ATCAGGCCGCGAAAGTCCTGTTATC-3',酶切位点Ecor1。
从人肺动脉组织中提取总RNA,行RT-PCR。产物进行定量后,取20 μg行PCR扩增,1%琼脂糖凝胶电泳证实PCR产物后,酶切胶回收目的基因片段,多聚腺苷加尾(A-Tailing)反应后与载体pGEM-T连接,对重组质粒pGEM-T-cGKⅠ进行PCR及酶切鉴定,并测序分析。纯化酶切产物,用T4 DNA连接酶连接cGKⅠ及线性化的pAd-Track-CMV,转化Dpα感受态细菌,筛选转化的菌落行酶切鉴定。酶切重组腺病毒质粒pAd-CMV-cGKⅠ,暴露其反转末端重复序列(ITR),用Lipofectamine TM 2000将线性化的pAd-CMV-cGKⅠ转染至Ad293A细胞中,当90%以上细胞出现病理征时收集细胞,反复快速冻融4次(-20℃和37℃、震荡15 s)使细胞破裂释放出病毒,然后将含有大量扩增的重组腺病毒载体的上清液转移至新Eppendorf管中。
1.2.2四甲基偶氮唑蓝比色法(MTT)分析将AGS细胞接种于96孔板中,每孔加细胞悬液30 μl(4.8×104个细胞),待细胞生长至90%汇合时候,换10%胎牛血清(FBS)的DMEM培养液培养24 h。按实验分组处理好细胞后,吸弃各孔培养液,每孔加入100 μl的MTT溶液(5 mg/ml),37℃,5%CO2培养箱孵育3~4 h,加120 μl二甲基亚砜(DMSO)震荡混合15 min。用酶联免疫检测仪检测波长570 nm处的吸光度值(OD值)。
1.2.3Western印迹将细胞密度为80%的cGKⅠ腺病毒载体转染的AGS细胞,磷酸盐缓冲液(PBS)洗1次,裂解液裂解细胞并提取细胞总蛋白,行电泳分离,转膜过夜后,室温封闭3 h。加入Tris盐酸缓冲液(TBST)洗3次,10 min/次。用TBST按1∶100稀释多克隆抗体MMP-2、MMP-7、MMP-9、C-myc、p53,室温孵育。TBST洗膜3次,10 min/次。加入辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗(1∶10 000),室温孵育。蛋白检测采用增强化学发光法(ECL),进行化学发光扫描。
2结果
2.1成功构建了cGKⅠ腺病毒表达载体扩增实验显示cGKⅠ蛋白表达稳定、高效。BamH1和EcoR1双酶切重组质粒pAdTrack-CMV-cGKⅠ,得到约9.2 kb和2.2 kb的2个片段,分别代表穿梭载体pAd-Track-CMV和cGKⅠ基因片段,证明穿梭质粒构建成功。见图1。

图1 pAd-Track-CMV和cGKⅠ鉴定
同源重组获得重组腺病毒质粒pAd-CMV- cGKⅠ,线性化重组腺病毒质粒pAd-CMV- cGKⅠ使用Lipofectamine TM 2000转染293A细胞3 d后,在荧光显微镜下同一视野的荧光和可见光照片(CPE)上可见空斑形成,细胞变圆、肿胀、脱壁、胞核变大等病变出现。转染效率为(90±5)%。pAd-CMV- cGKⅠ病毒的滴度为2×106pfu/ml。不同组梯度浓度MOI值的重组腺病毒转染胃癌AGS细胞,免疫荧光均可测到75 kD的cGKⅠ蛋白,而空载腺病毒、阴性对照组无cGKⅠ蛋白表达,说明重组腺病毒能在胃癌AGS细胞中高效表达cGKⅠ。见图2~图4。
2.2Western印迹见图5。细胞迁移相关蛋白MMP-2、7、9均显著下降,凋亡蛋白caspase3显著上升。但是,p53抑癌基因和C-myc原癌基因并没有显著变化,显示cGK Ⅰ诱导的细胞迁移能力的下降和凋亡的上升与抑癌基因和原癌基因无关,或者在AGS细胞中存在p53和C-myc原癌基因突变。
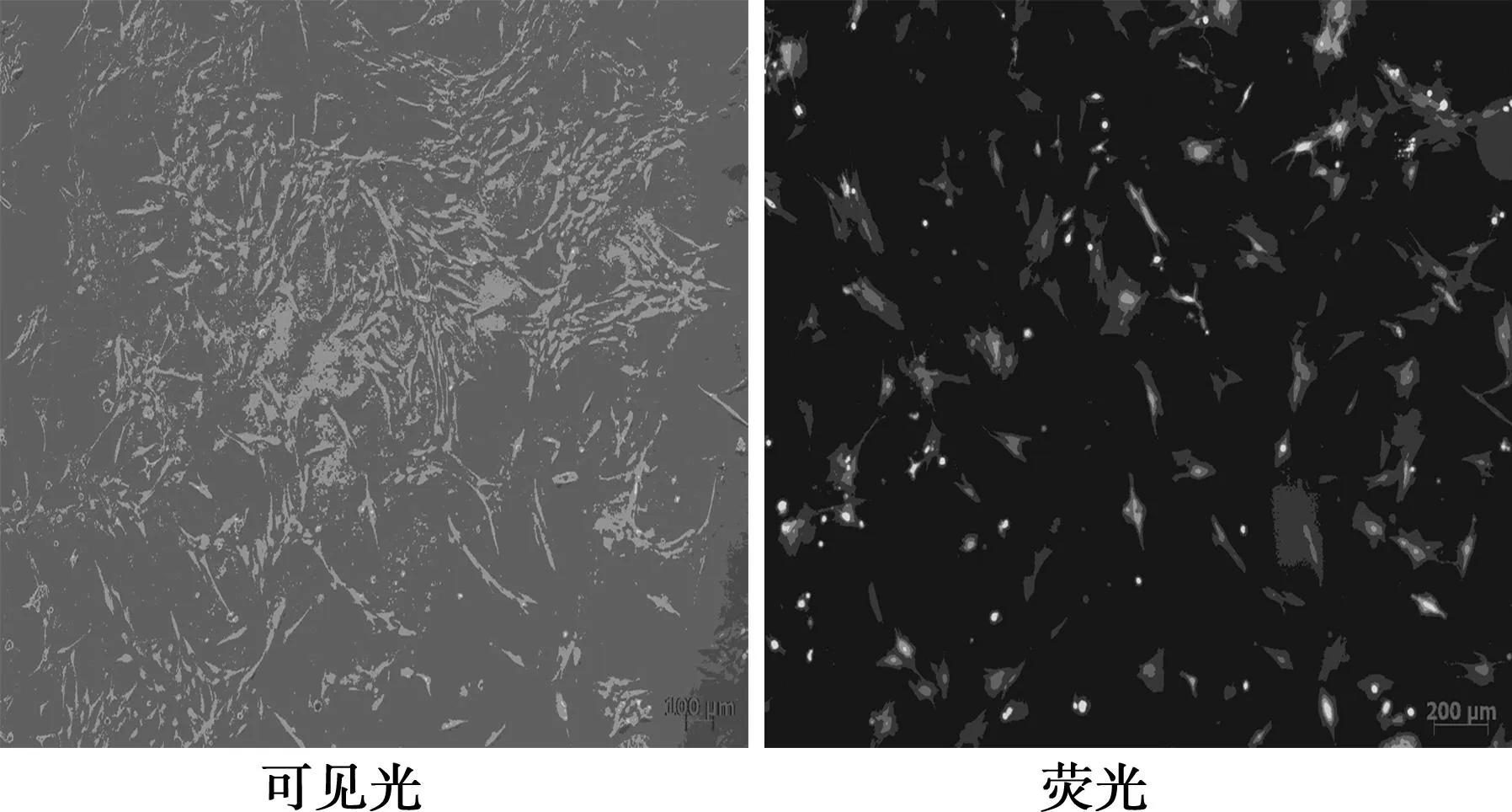
图2 荧光显微镜下同一视野的荧光和可见光照片
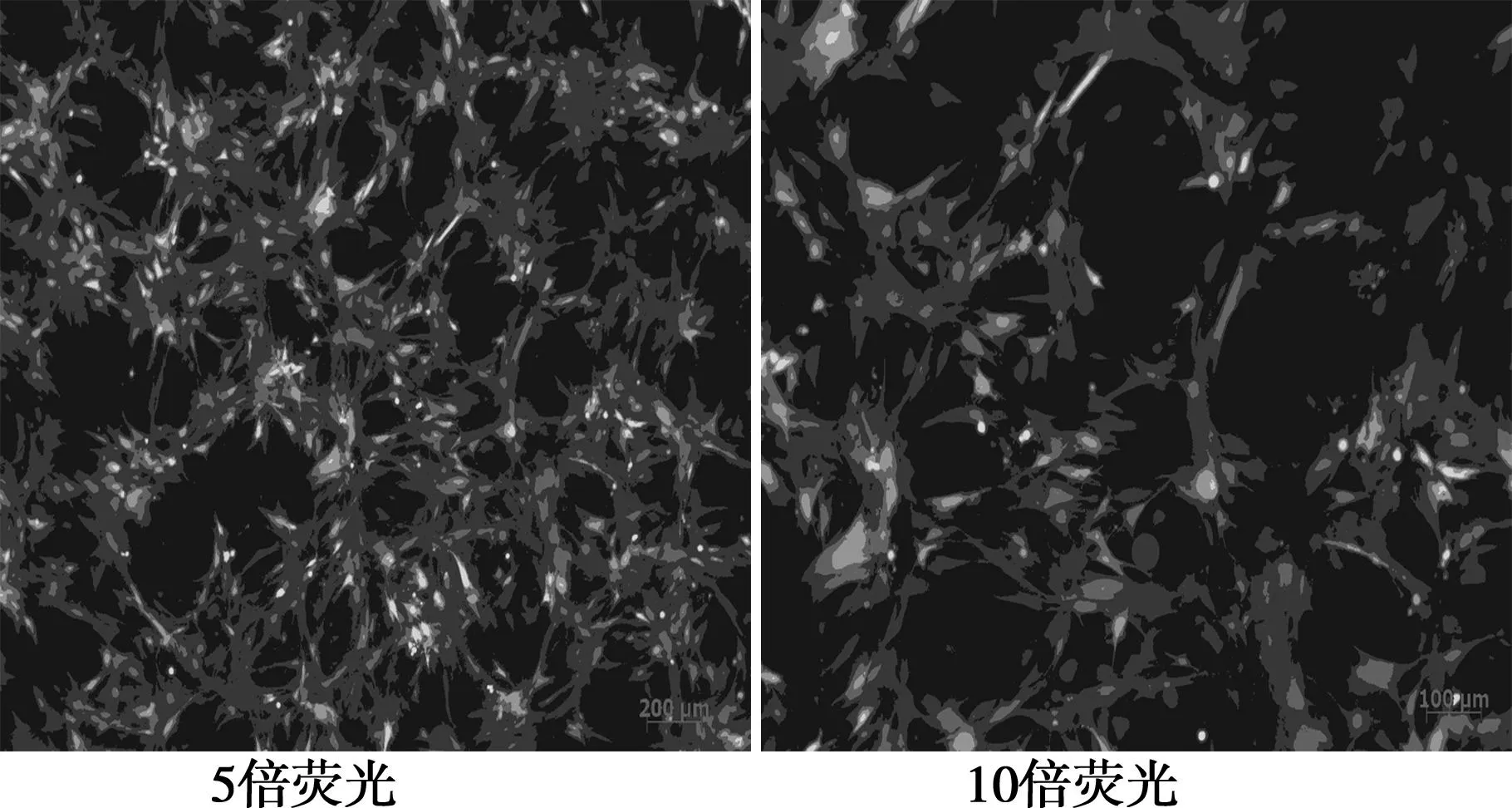
图3 pAd-CMV- cGKⅠ滴度测定
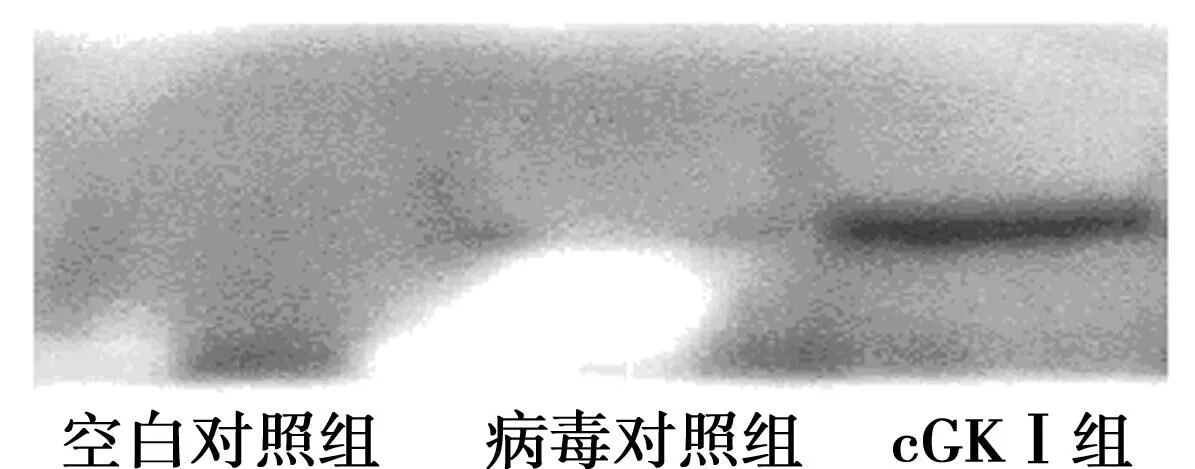
图4 胃癌AGS细胞中高效表达cGKⅠ

图5 Western印迹分析
2.3MTT结果cGKⅠ编码的腺病毒载体感染AGS细胞经培养基培养后,吸光度值显著降低,细胞活性显著下降,细胞出现明显抑制现象。
3讨论
恶性肿瘤是危害人类健康的杀手,其中胃癌是中国常见的癌症死亡原因之一,根据GLOBOCAN 2008的统计,2008年全球胃癌新发病例98.9万,中国为46.3万;同期全球死于胃癌的病例共73.7万,中国为35.2万〔4〕。肿瘤的发生与细胞内信号通路的激活密切相关。随着对肿瘤分子水平认识的不断深入,针对肿瘤细胞生长、凋亡、细胞周期、侵袭浸润以及血管生成等分子靶点提出的分子靶向治疗逐渐成为抗肿瘤药物治疗的重点和热点。
关于cGKⅠ与肿瘤的关系,没有明确的报道。最近已有越来越多的证据表明,cGKⅠ可能与细胞增殖和凋亡等活动以及肿瘤的发生发展有着密切关系。Fallahian等〔5〕的研究显示在胸腺癌细胞MCF-7和MDA-MB-468中使用cGKⅠ的特异激活剂和抑制剂控制它们的表达,发现cGKⅠβ能够促进细胞的凋亡。Kwon等〔6〕发现cGK能够在肿瘤细胞中抑制β-catenin蛋白的表达。这些实验都显示,cGKⅠ在肿瘤的发生发展中可能发挥着重要的调节作用。尽管有些文献也指出cGKⅠ可能促进卵巢癌细胞的SRC活性提高其抗凋亡能力〔7〕。但这也从另一方面说明了cGKⅠ的研究价值。
caspase- 3作为调控细胞增殖和凋亡调控的重要基因,参与多种因素诱导的生理及病理性细胞凋亡过程〔8〕。C-myc基因在细胞的增殖与分化过程中具有重要的调节作用,C-myc基因表达的失调是多种细胞凋亡的主要诱因,与多种肿瘤发生发展有关〔9,10〕。抑癌基因p53在胃癌的发生、发展过程中起重要作用,其中p53基因突变和p53蛋白过表达已被大量实验所证实,被认为可能成为指导胃癌综合治疗、判断预后的有效指标〔11〕。MMP具有强烈恶性组织特性及独特的分解各种细胞外基质能力,在肿瘤侵袭及转移中起着重要的作用〔12〕。
本文认为cGK Ⅰ抑制胃癌细胞株AGS细胞活力,而cGK Ⅰ诱导的细胞迁移能力下降和凋亡上升与抑癌基因和原癌基因无关,或者在AGS细胞中存在p53和C-myc原癌基因突变。
4参考文献
1Brochet M,Collins MO,Smith TK,etal.Phosphoinositide metabolism links cGMP-dependent protein kinase G to essential Ca2+signals at key decision points in the life cycle of malaria parasites〔J〕.PLoS Biol,2014;12(3):e1001806.
2Browning DD.Protein kinase G as a therapeutic target for the treatment of metastatic colorectal cancer〔J〕.Expert Opin Ther Targets,2008;12(3):367-76.
3Hou Y,Gupta N,Schoenlein P,etal.An anti-tumor role for cGMP-dependent protein kinase〔J〕.Cancer Lett,2006;240(1):60-8.
4邹小农,孙喜斌,陈万青,等.2003~2007年中国胃癌发病与死亡情况分析〔J〕.肿瘤,2012;32(2):109-14.
5Fallahian F,Karami-Tehrani F,Salami S.Induction of apoptosis by type Ⅰ beta protein kinase G in the human breast cancer cell lines MCF-7 and MDA-MB-468〔J〕.Cell Biochem Funct,2012;30(3):183-90.
6Kwon IK,Wang R,Thangaraju M,etal.PKG inhibits TCF signaling in colon cancer cells by blocking beta-catenin expression and activating FOXO4〔J〕.Oncogene,2010;29(23):3423-34.
7Leung EL,Wong JC,Johlfs MG,etal.Protein kinase G type Ⅰ alpha activity in human ovarian cancer cells significantly contributes to enhanced Src activation and DNA synthesis/cell proliferation〔J〕.Mol Cancer Res,2010;8(4):578-91.
8凌康,王颢.胃癌细胞株SGC-7901的Wnt/β-Catenin信号途径与Caspase-8、Caspase-3及Bcl-2 的关系〔J〕.重庆医科大学学报,2009;34(6):690-3.
9张俊文,王丕龙.三氧化二砷诱导胃癌细胞凋亡及其对C-myc和TGF-β1表达的影响〔J〕.胃肠病学和肝病学杂志,2006;15(1):7-9.
10陈洁平,林晨,徐采朴,等.腺病毒介导反义c-myc RNA对人胃癌细胞系作用的分子机制研究〔J〕.中华消化杂志,2001;21(1):46-7.
11周亚东,甘润良.抑癌基因p53与胃癌的研究进展〔J〕.医学综述,2010;16(9):1326-30.
12汪丽燕,乔镇,关景明.基质金属蛋白酶与其抑制剂在消化道肿瘤中的研究进展〔J〕.世界华人消化杂志,2004;12(11):2674-8.
〔2015-03-25修回〕
(编辑袁左鸣/滕欣航)
基金项目:江苏大学医学临床科技发展基金项目(No.JLY20120080)
〔中图分类号〕R73
〔文献标识码〕A
〔文章编号〕1005-9202(2015)22-6456-03;
doi:10.3969/j.issn.1005-9202.2015.22.067
