自身启动子调控miR-7真核表达载体的构建及其意义
2016-01-29郭萌萌,廖珍媛,赵娟娟等
自身启动子调控miR-7真核表达载体的构建及其意义
郭萌萌,廖珍媛,赵娟娟,陶弋婧,胡燕,陈超,秦娜琳,郑静,徐林
(遵义医学院 免疫学教研室暨贵州省免疫学研究生教育创新基地,贵州 遵义563099)
[摘要]目的 构建带有miR-7自身启动子的miR-7重组真核表达载体,研究其对人肺癌细胞增殖、迁移和凋亡的影响。方法 预测miR-7启动子序列,设计含有该序列和miR-7前体序列目的片段的引物,PCR扩增后亚克隆入pGL3.0-Basic载体以构建miR-7自身启动子调控的真核表达载体pGL3.0-Basic-miR-7-promoter(命名为p-miR-7-pro);将所构建载体转染人肺癌95D细胞, Real-time PCR探针法检测95D细胞中miR-7的表达水平;MTT和克隆形成实验分别检测95D细胞的增殖和克隆形成能力;划痕法观察95D细胞体外迁移能力的变化;FACS检测95D细胞的凋亡情况。结果 酶切和测序结果证明成功构建p-miR-7-pro真核表达载体,转染95D细胞后可有效表达miR-7;与对照组相比,p-miR-7-pro转染组95D细胞的体外增殖能力受到明显的抑制(0.60±0.03 vs 0.19±0.05,P<0.05);同时其迁移能力也显著降低(473±7 vs 99±2,P<0.05);而细胞凋亡则显著增加(9.233±0.586 % vs 12.967±0.643%,P<0.05)。结论 成功构建由自身启动子调控的miR-7真核表达载体,为后续研究miR-7在肺癌基因治疗中的作用提供重要实验基础。
[关键词]miR-7;真核表达;肺癌;95D细胞;增殖;迁移;凋亡
启动子(Promoter)是一段位于结构基因5′端上游区的DNA序列,是RNA聚合酶特异性识别和结合的部位,控制基因表达的起始时间、转录方向、模板链以及转录效率。启动子的强弱、位点突变以及CpG岛的甲基化,都可能导致基因表达的调控障碍[1-2]。微小RNA(microRNAs,miRNAs)是长约为22个核苷酸的高度保守的单链非编码RNA,它从DNA转录,但不能翻译成蛋白,在转录后水平通过对多重靶基因的负调节参与调控细胞的发育、分化、增殖和凋亡等多种生物学进程[3-4]。miRNAs启动子的活性对于miRNAs的表达具有重要作用[5-6]。而近年来的研究显示,肿瘤的发生中多种miRNA表达异常与其启动子的活性密切相关[7-9]。如Baer C等研究报道,启动子DNA甲基化与miRNA(miR-21、miR-34a、miR-155等)成熟体的表达成反比,并且miR-21的启动子甲基化水平与慢性淋巴细胞白血病的发展密切相关[5,8]。类似的Lei等研究发现,启动子CpG岛的高甲基化使miR-129-2-3p表达下调,从而影响胃癌的发生发展[9]。因此,对miRNAs基因启动子(核心序列)的结构和功能的分析研究,有利于进一步探讨肿瘤的发生机制,同时对于开发肿瘤临床基因治疗的新靶标也将有非常积极的影响。
微小RNA-7(MicroRNA-7,miR-7)是近年来报道的miRNAs家族成员之一,研究发现[10-12]它在包括肺癌在内的多种恶性肿瘤中异常表达,并能够有效抑制肺癌细胞的生长和转移侵袭。然而miR-7启动子活性及调控机制等仍远未阐明,在肺癌中异常表达的调控因素也未明确。因此,本研究拟构建了带有miRNA-7基因自身启动子的真核表达载体,鉴定其表达活性,并初步探讨该载体对人肺癌95D细胞生长、迁移以及凋亡方面的影响,可为后续研究miRNA-7表达变化调控因素,明确其在肺癌发生中的表达调控机制及在临床肿瘤基因治疗中的开发应用奠定基础。
1材料与方法
1.1材料
1.1.1细胞株DH5α大肠杆菌菌株(本实验室保存);人源性肺巨细胞癌95D细胞株(中科院生物化学与细胞生物学研究所)。
1.1.2主要试剂与仪器pGL3-Basic、LipofectamineTM 2000转染试剂(invitrogen);限制性内切酶NheⅠ、BglⅡ(Takara);T4连接酶、RevertAidTMFirstStrand cDNA Synthesis Kit(Fermentas);PCR试剂、Premix Ex Taq Version2.0、RNAisoTMPlus(Takara);引入酶切位点包含miR-7启动子序列引物合成及测序(北京华大基因);质粒抽提试剂盒(天根生化科技有限公司);miR-7的Real-time PCR探针试剂盒(MBI);胎牛血清、细胞培养液RPMI 1640(Hyclone)。
IX-51倒置显微镜、IX-71倒置荧光显微镜(OLYMPUS);低温台式高速离心机、CO2培养箱(Thermo);PCR仪、Gel DocTM XR+凝胶成像系统、稳压DNA电泳仪、荧光定量PCR仪(Bio-Rad);SW-CJ-2FD型超净工作台(苏州净化设备厂)。
1.2方法
1.2.1miR-7启动子的预测及引物设计从Pubmed上调取含miR-7成熟体3’端70 bp基因组序列(基因序列号:AJ550392),通过GeneBank获得miR-7成熟体前段5’端-1 068位点到其3’端侧翼+124位点的序列,通过Primer5设计包含预测的启动子区域的1 302 bp大小的引物;根据pGL3.0-Basic的MCS区的酶切位点,筛选并在引物(上游和下游)引入酶切位点(NheⅠ和BglⅡ);引物序列:上游(引入NheⅠ位点)5’ CTAGCTAGCTAGAGCACCAATAGGGAAGGG-3’;下游引物(引入BglⅡ位点)5’ GAAGATCTTCGAGTCTGCCGATGGGTGT-3’。预期产物大小,1 302 bp。
1.2.2 pGL3.0-Basic-miR-7-promoter表达载体的构建及鉴定抽提人肺癌95D细胞基因组DNA并作为模板,用设计的引物PCR反应扩增包含miR-7启动子、miR-7和3’段侧翼序列在内的目的片段,扩增条件:95 ℃1 min,95 ℃30 s,58 ℃ 30 s,72 ℃ 90 s,36个循环,72 ℃8 min。产物凝胶电泳后回收目的片段(1 302 bp),送北京华大基因公司测序,用BLAST程序进行结果比对,结果显示启动子核心序列完整且不存在突变。扩增产物经NheⅠ和BglⅡ双酶切后回收并连入表达载体pGL3.0-Basic(T4DNA连接酶,22 ℃,1 h)。继而转化入感受态细菌E.coli DH5α,挑取其中的阳性克隆(Amp(+))培养后,菌液PCR和凝胶电泳鉴定;并进行质粒小量抽提,双酶切(NheI和BglII)来筛选阳性重组质粒,送北京华大基因测序,结果显示pGL3.0-Basic-miR-7-promoter表达载体构建成功,命名为p-miR-7-pro(对应的pGL3.0-Basic命名为p-Cont)。

图1 pGL3.0-Basic-miR-7-promoter真核表达载体的示意图
1.2.3细胞培养与转染培养95D细胞,条件:RPMI1640细胞完全培养液(10%胎牛血清、100 mg/mL链霉素、1 000μ/mL青霉素以及2 mmol/L谷氨酰胺),37 ℃、5%CO2。当单层细胞生长达到80%融合后,用胰蛋白酶(0.02%)消化收集细胞,PBS轻柔冲洗,将1×105/mL的细胞接种至6孔板(每孔2 mL),培养12 h ,按照LipofectamineTM2 000转染试剂说明书瞬时转染95D细胞。实验分为2组:pGL3.0-Basic-miR-7-promoter(p-miR-7-pro)和pGL3.0-Basic空载(p-Cont)转染组。所有细胞实验n=3,每个实验重复3次。
1.2.4p-miR-7-pro转染95D细胞表达水平的检测将1×105/mL的细胞接种于24孔板(每孔500μL),10 μg质粒p-miR-7-pro和对照质粒p-Cont体外分别瞬时转染95D细胞,5% CO2,37 ℃条件下培养48 h后,抽提各组细胞总RNA,利用Realtime PCR探针法检测miR-7的表达水平。
1.2.5p-miR-7-pro转染对95D细胞增殖的影响转染48 h后,分别收集2个转染组的细胞悬液,以1.5×104/mL个细胞接种于96孔板(每孔200 μL),培养72 h(37 ℃、5%CO2),每孔加入50 μL MTT液(2 μg/mL),孵育4 h,吸出培养基,每孔加入DMSO液150 μL,微孔板振荡器振荡培养板10 min,溶解结晶物,酶标仪检测各孔的吸光度(OD)值(波长570 nm)。
1.2.6p-miR-7-pro转染对95D细胞体外克隆形成的影响转染48 h后,分别收集2个转染组的细胞,将细胞悬液按每孔100、1 000个细胞接种于6孔板中并确保细胞均匀分散;培养10~15 d,期间根据情况更换新鲜培养基,当有肉眼可见的克隆后即可终止培养,吸掉培养基并用PBS轻柔洗涤2~3次,自然干燥后固定30 min(4%多聚甲醛),吸出甲醛待其干燥后,使用结晶紫染液(1%)染色30 min,PBS轻柔多次清洗直至洗去染液,自然干燥后拍照记录。
1.2.7p-miR-7-pro转染对95D细胞迁移的影响收集95D细胞,以7×104/mL接种于24孔板,待细胞充分贴壁后,分别将p-miR-7-pro和p-Cont载体瞬时转染入细胞,6h后用1 mL枪头于每孔中线处划出2 mm的刮痕,PBS洗涤2~3次直至刮痕内无细胞后加入新鲜培养基,继续培养72 h,显微镜下观察计算刮痕内的细胞数,并拍照。
1.2.8p-miR-7-pro转染对95D细胞凋亡的影响收集转染后48h的p-miR-7-pro和p-Cont转染组细胞,制成细胞悬液,PBS洗1次,过滤,离心,弃上清,每管加入Annexin V-APC荧光标记抗体2 μL,4 ℃避光孵育10~15 min,PBS洗涤2遍,每管分别加入PI 荧光标记抗体2 μL,冰上避光孵育10 min ,FACS检测。

2结果
2.1miR-7 启动子的预测如图2所示,通过GeneBank获得miR-7前段5’端-1068位点到其3’端侧翼+124位点的序列,利用Primer5设计对应引物;引物序列:上游,5’ CTAGCTAGCTAGAGCACCAATAGGGAAGGG-3’;下游引物:5’ GAAGATCTTCGAGTCTGCCGATGGGTGT-3’。预期产物大小1 302 bp。

图2 miR-7启动子区域示意图
2.2PCR扩增miR-7启动子区序列以肺癌95D细胞DNA为模板,PCR扩增含miR-7成熟体3’端70 bp碱基的启动子序列,如图3所示,电泳后可见1 302 bp大小的目的条带。

M:Marker。 图3 miR-7启动子PCR扩增产物琼脂糖凝胶电泳
2.3p-miR-7-pro载体阳性克隆PCR鉴定纯化的目的片段经双酶切后(NheⅠ和BglII)连入pGL3.0-Basic载体,转化入感受态细菌E.coli DH5α,Amp(+)培养12 h后随机挑取6个克隆,继续培养16 h,最后菌液PCR扩增后进行琼脂糖凝胶电泳,6个克隆培养扩增后均可见1302 bp大小的目的条带(见图4),提示其均为阳性克隆。

1~6:6个不同的克降培养后菌液PCR扩增结果;M:Marker。图4 菌液PCR产物琼脂糖凝胶电泳
2.4p-miR-7-pro载体的酶切和测序鉴定重组载体p GL3.0-Basic-miR-7-pro经双酶切后(NheI,Bgl Ⅱ),电泳结果可见约4.8 kb及1302 bp大小的2条片段 (见图5A);测序结果显示(见图5B),插入片段正确 ,结果表明pGL3.0-miR-7-promoter表达载体构建成功,命名为p-miR-7-pro(对应的pGL3.0-Basic命名为p-Cont)。

A:重组质粒双酶切结果 (M:Marker);B:重组质粒测序结果图5 重组质粒双酶切与测序鉴定
2.595D细胞转染p -miR-7 -pro载体后miR-7表达水平检测转染48h后,利用Real-time PCR探针法检测miR-7成熟体的表达水平。如图6所示,p-miR-7-pro转染组miR-7成熟体的表达水平较p-Cont组显著升高,提示该启动子可以有效启动miR-7的表达。
2.6p-miR-7-pro转染抑制95D细胞的增殖MTT实验结果(见图7)显示,与对照组相比,p -miR-7-pro转染组细胞的增殖能力明显降低。

*P<0.05,vs-p-Cont。 图6 Real-time PCR检测p-miR-7-pro转染95D细胞后miR-7的表达
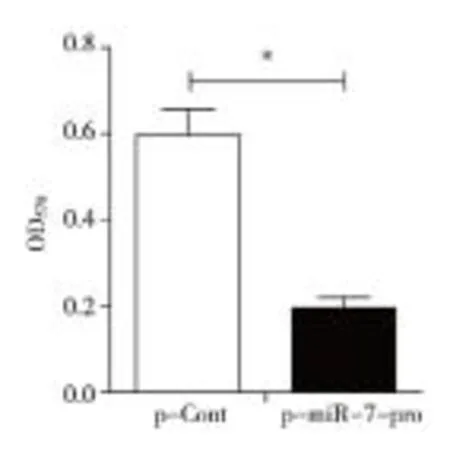
*P<0.05, vs p-Cont。 图7 p-miR-7-pro转染抑制95D细胞体外增殖
2.7p-miR-7-pro转染对95D细胞体外克隆形成的影响克隆形成实验结果(见图8)显示,每孔100和1000个细胞的接种条件下,p-miR-7-pro转染组95D细胞克隆形成数均较p-Cont组明显减少(14±4vs31±5个; 77±7vs122±6个,P<0.05)。结果表明,miR-7既可以抑制肺癌95D细胞的增殖,也可以影响其克隆形成的能力。
2.8p-miR-7-pro转染抑制95D细胞的迁移划痕法结果(见图9)显示,与p-Cont转染组细胞相比,p-miR-7-pro组95D细胞的体外迁移能力受到了明显的抑制,48h后p-miR-7-pro-95D转染组细胞的迁移数明显少于p-Cont组 :(99±2vs473±7,P<0.05),72h 后为 (399±6vs1339±20,P<0.05)。结果提示,miR-7过表达可以抑制95D细胞的体外迁移能力。
2.9p-miR-7-pro转染诱导95D细胞的凋亡采用流式细胞仪检测各组细胞凋亡的变化。结果(见图10)显示,与对照组相比,p-miR-7-pro转染组细胞的凋亡比例明显增加 (9.233±0.586%vs12.967±0.643%,P<0.05)。结果表明,过表达miR-7可诱导肺癌细胞95D细胞凋亡增加。

A:1000个细胞/孔;B:100个细胞/孔;*P<0.05,vs p-Cont。图8 p-miR-7-pro转染抑制95D细胞的克隆形成能力
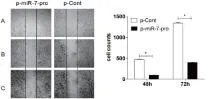
A:0 h (100×);B:48 h (100×);C:72 h(100×);*P<0.05,vs p-Cont。图9 p-miR-7-pro转染抑制95D细胞体外迁移

*P<0.05,vs p-Cot。图10 p-miR-7-pro转染后诱导95D细胞的凋亡
3讨论
MiRNA-7是新近报道的miRNA家族成员之一,定位于第15号染色体。研究发现,miR-7在正常肺组织中高表达,但在临床肺癌组织中呈现低表达;当过表达miR-7时,肺癌细胞的生长、转移以及侵袭能力都受到明显的抑制[13-14]。这与我们在前期研究中发现miR-7模拟物(mimics)和真核表达载体可过表达miR-7,并通过下调IGFIR、EGFR和p-Akt的表达水平,从而显著抑制肺癌细胞的体外增殖、转移和侵袭是一致的[15-18]。这些研究均提示miRNA-7是肺癌发生发展中的重要调控分子。因此进一步明确miR-7在肺癌发生中的表达调控机制,对于miR-7基因功能的研究,以及在临床肿瘤治疗中利用miR-7进行基因诊断、预防和治疗都具有十分重要的作用。
由于miRNAs分子在基因组上定位的复杂性,导致对其启动子鉴定和活性研究工作开展较为困难。本研究利用生物信息学分析发现[19],在miR-7成熟体前段至其5’端-1068位点间存在多个转录因子(如,Gfi-1,c-Myc等)的潜在结合位点,提示该段序列具有启动子活性。为了验证该段序列是否为miR-7启动子序列,本实验利用分子克隆技术,设计含miR-7启动子、miR-7和3’段侧翼序列在内的目的片段的引物,以人肺巨细胞癌细胞系95D基因组DNA为模板,扩展出1302bp大小的目的片段;经NheI和BglⅡ双酶切、纯化后亚克隆入无启动子、增强子的pGL3.0-Basic载体,从而构建miRNA-7自身启动子的miR-7真核表达载体;酶切和测序结果表明,成功构建载体pGL3.0-Basic-miR-7-promoter(命名为p-miR-7-pro)。更重要的是,将该载体瞬时转染人肺癌95 D细胞后发现,转染组miR-7成熟体的表达水平显著增加,这提示miR-7成熟体前段至其5’端-1068位点间存在miR-7自身启动子,其可有效启动miR-7成熟体的表达。进一步观察发现p-miR-7-pro过表达的miR-7可显著抑制人肺癌95D细胞的体外增殖和迁移能力,这与我们前期结果一致[16-18]。此外,本研究还发现95D细胞的凋亡也明显增加。类似地,Xiong[20]等报道过表达miR-7可以在体外诱导人肺癌 A549细胞的凋亡。新近,Li等还发现人抗原R (human antigen R, HuR)可以在mRNA水平调控miR-7成熟体的表达[21],这些研究提示了miR-7在肺癌中表达调控机制的复杂性。因此,深入探讨miR-7启动子活性变化机制对于最终阐明以miR-7为代表的miRNA分子在人肺癌发生中的作用具有重要意义。
总之,本研究成功构建带有miRNA-7自身启动子的真核表达载体,并观察其对肺癌95D细胞的影响,这对于进一步研究肺癌发生中miR-7表达的调控机制,以及针对肺癌临床基因治疗中基于miR-7治疗新方案的开发具有重要意义。
[参考文献]
[1] Laird P W.The power and the promise of DNA methylation markers[J].Nat Rev Cancer,2003,3(4):253-266.
[2] Bird A.The essentials of DNA methylation[J].Cell,1992,70(1):5-8.
[3] Lee R C,Feinbaum R L,Ambros V.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.
[4] Bartel D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[5] Baer C,Claus R,Frenzel L P,et al.Extensive promoter DNA hypermethylation and hypomethylation is associated with aberrant microRNA expression in chronic lymphocytic leukemia[J].Cancer Res,2012,72(15):3775-3785.
[6] Salmanidis M,Pillman K,Goodall G,et al.Direct transcriptional regulation by nuclear microRNAs[J].Int J Biochem Cell Biol,2014,54C:304-311.
[7] Weber B,Stresemann C,Brueckner B,et al.Methylation of human microRNA genes in normal and neoplastic cells[J].Cell Cycle,2007,6(9):1001-1005.
[8] Baer C,Claus R,Plass C.Genome-wide epigenetic regulation of miRNAs in cancer[J].Cancer Res,2013,73(2):473-477.
[9] Lei H,Zou D,Li Z,et al.MicroRNA-219-2-3p functions as a tumor suppressor in Gastric cancer and is regulated by DNA methylation[J].PLoS One,2013,8(4):e60369.
[10] Xu K,Chen Z,Qin C,et al.miR-7 inhibits colorectal cancer cell proliferation and induces apoptosis by targeting XRCC2[J].Onco Targets Ther,2014,7:325-332.
[11] LiY,Li Y,Liu Y,et al.PAX6, a Novel Target of microRNA-7,Promotes Cellular Proliferation and Invasion in Human Colorectal Cancer Cells[J].Dig Dis Sci,2014,59(3):598-606.
[12] Kefas B,Godlewski J,Comeau L,et al.microRNA-7 inhibits the epidermal growth factor receptor and the Akt pathway and is down-regulated in glioblastoma[J].Cancer Res,2008,68(10):3566-3572.
[13] 郑静,李颖,秦安东,等.miRNA-7 在小鼠不同组织器官中表达的检测及其意义[J].遵义医学院学报,2012,35(2):91-97.
[14] 朱顺飞,廖珍媛,胡燕,等.微小RNA-7过表达对人肺癌细胞体内外转移的影响[J].遵义医学院学报,2013,36(5):401-405.
[15] Xu L,Wen Z,Zhou Y,et al.MicroRNA-7-regulated TLR9 signaling-enhanced growth and metastatic potential of human lung cancer cells by altering the phosphoinositide-3-kinase, regulatory subunit 3/Akt pathway[J].Mol Biol Cell,2013,24(1):42-55.
[16] 徐林,任涛,秦安东,等.microRNA-7 对人肺癌 95D 细胞体外侵袭的作用[J].遵义医学院学报,2011,34(1):12-16.
[17] 宋永祥,李颖,秦安东,等.miRNA-7真核表达载体的构建与鉴定[J].西安交通大学学报,2013,34(9):454-459.
[18] 陈超,赵娟娟,胡艳,等. TTF-1启动子调控microRNA-7真和表达载体的构建[J].遵义医学院学报,2014,37(3):263-270.
[19] Chou Y T,Lin H H,Lien Y C,et al.EGFR promotes lung tumorigenesis by activating miR-7 through a Ras/ERK/Myc pathway that targets the Ets2 transcriptional repressor ERF[J]. Cancer Res,2010,70(21):8822-8831.
[20] Xiong S,Zheng Y,Jiang P,et al.MicroRNA-7 Inhibits the growth of human non-small cell lung cancer A549 Cells through Targeting BCL-2[J].Int J Biol Sci,2011,7(6):805-814.
[21] Li YJ,Wang C H,Zhou Y,et al.TLR9 signaling repressed tumor suppressor miR-7 expression through up-regulation of HuR in human lung cancer cells[J].Cancer Cell Int,2013,13(1):90.
[收稿2015-03-11;修回2015-04-26]
(编辑:谭秀荣)

·学术动态·
Construction of an eukaryotic expression vector encoding miRNA-7 with self promoter and its significance
GuoMengmeng,LiaoZhenyuan,ZhaoJuanjuan,TaoYijing,HuYan,ChenChao,QinNalin,ZhengJing,XuLin
(Department of Immunology,Immunology Graduate Education and Innovation Base of Guizhou Province,Zunyi Medical University,Zunyi Guizhou 563099,China)
[Abstract]Objective To construct an eukaryotic expression vector encoding miRNA-7 (miR-7) with its own promoter and explore its effects on the growth, migration and apoptosis of lung cancer cells.Methods The PCR primer was designed to amplify the promoter sequence and precursor sequence fragment of miR-7. The PCR products were subcloned into pGL3.0-Basic vector to construct the eukaryotic expression vector pGL3.0-Basic-miR-7-promoter (Named as p-miR-7-pro). Then, the recombinant plasmid p-miR-7-pro was transiently transfected into human lung cancer cell line 95D cells in vitro. The expression level of miR-7 in 95D cells was detected by real-time PCR. The proliferation and colony formation ability of cells were detected by MTT assay and colony formation assay, respectively. The migration of cells in vitro was determined by scratch assay. The apoptosis of cells was investigated by flow cytometry analysis.Results Enzyme digestion and DNA sequencing validated the successful construction of p-miR-7-pro eukaryotic expression vector. The expression level of miR-7 in p-miR-7-pro transfected group was higher than that in control group. Moreover, compared with control group (p-Cont), the proliferation and migration ability of cells in p-miR-7-pro-transfected group significantly decreased, respectively(0.60±0.03 vs 0.19±0.05,P<0.05)(473±7 vs 99±2,P<0.05). Conversely, the apoptosis of 95D cells significantly increased (9.233±0.586 % vs 12.967±0.643%, P<0.05).Conclusion The eukaryotic expression vector encoding miRNA-7 with self promoter is successfully constructed, which provides an important foundation for the study on the effects of miR-7 in gene therapy against lung cancer.
[Key words]miR-7; eukaryotic expression; lung cancer; 95D cell; proliferation; migration;apoptosis
[文献标志码][中图法分类号] R734.2 A
[文章编号]1000-2715(2015)03-0219-07
[基金项目]国家自然科学基金资助项目(NO:31370918);教育部新世纪优秀人才计划资助项目(NO:NCET-12-0661);贵州省国际合作项目(NO:10C315)。[通信作者]徐林,男,博士,教授,硕士生导师,研究方向:肿瘤免疫,E-mail:xulinzhouya@163.com。
