中华绒螯蟹幼蟹对苏氨酸需求量的研究
2016-01-19伟叶金云霞张易祥刘温州医科大学检验医学院生命科学学院温州35035浙江省水生生物资源养护与开发技术研究重点实验室中国水产科学研究院水生动物繁育与营养重点实验室湖州师范学院湖州33000大连海洋大学大连603
王 伟叶金云,∗杨 霞张易祥刘 沛,3(.温州医科大学检验医学院、生命科学学院,温州35035;.浙江省水生生物资源养护与开发技术研究重点实验室,中国水产科学研究院水生动物繁育与营养重点实验室,湖州师范学院,湖州33000;3.大连海洋大学,大连603)
中华绒螯蟹幼蟹对苏氨酸需求量的研究
王 伟1叶金云1,2∗杨 霞2张易祥2刘 沛2,3
(1.温州医科大学检验医学院、生命科学学院,温州325035;2.浙江省水生生物资源养护与开发技术研究重点实验室,中国水产科学研究院水生动物繁育与营养重点实验室,湖州师范学院,湖州313000;3.大连海洋大学,大连116023)
摘 要:通过56 d的生长试验确定中华绒螯蟹(Eriocheir sinensis)幼蟹对苏氨酸的需求量。试验设计了6种以酪蛋白、明胶和晶体氨基酸为蛋白质源的等氮等能纯化饲料,通过添加晶体L-苏氨酸,使得饲料中苏氨酸含量分别为饲料干物质的0.86%(对照,无外源苏氨酸)、1.24%、1.61%、2.04%、2.42%、2.81%。选取初始体重为(0.36±0.00)g的中华绒螯蟹幼蟹360只,随机分为6组,每组3个重复,每个重复20只幼蟹。结果表明:随饲料中苏氨酸含量的升高,幼蟹的增重率、特定生长率以及消化酶(胃蛋白酶、胰蛋白酶、脂肪酶和淀粉酶)活力均先升高后降低,在苏氨酸含量为饲料干物质的1.61%时,各项指标均达到最大值,且此时饲料系数最低,蛋白质效率最高,且该组增重率、特定生长率显著高于0.86%、1.24%、2.42%和2.81%组(P<0.05),消化酶活力显著高于其他各组(P<0.05)。饲料中苏氨酸含量对幼蟹的成活率及体成分无显著影响(P>0.05)。幼蟹肝胰腺超氧化物歧化酶、碱性磷酸酶和酸性磷酸酶活力均随饲料中苏氨酸含量的升高呈先升高后降低趋势,并分别在苏氨酸含量为饲料干物质的1.61%、1.61%和2.42%时达到最大值。以增重率为评价指标进行折线回归模型分析,得到中华绒螯蟹幼蟹对饲料中苏氨酸的需求量为饲料干物质的1.59%(饲料蛋白质的3.98%)。
关键词:中华绒螯蟹;苏氨酸;需求量;消化酶;非特异性免疫指标
苏氨酸(threonine,Thr)是鱼虾健康生长所必需的氨基酸之一,苏氨酸的缺乏可以导致水生动物生长减缓[1-3],饲料利用率降低[4-6]。苏氨酸还直接参与体蛋白质的合成,且具有一定的免疫作用。近年来,随着赖氨酸和蛋氨酸在配合饲料中的广泛使用,以及大量植物性蛋白质源如玉米蛋白、小麦面筋、豆粕、菜籽粕等在饲料中的使用,苏氨酸逐渐成为影响动物生产性能的限制性氨基酸[7-8],有关苏氨酸的研究已成为新的热点之一。目前,水产动物的苏氨酸需求量已见部分报道,如斑节对虾(Penaeus monodon)苏氨酸需求量为饲料蛋白质的3.5%[3]、凡纳滨对虾(Litopenaeus van⁃ namei)为3.53%[9]、低盐度下凡纳滨对虾(Litope⁃naeus vannamei)为3.78%[10]、日本对虾(Penaeus japonicus)为2.6%[11]。可见,不同种类的水生动物对苏氨酸的需求量不同,即使同一种类在不同条件下其氨基酸需求量也存在差异,而有关中华绒螯蟹(Eriocheir sinensis)苏氨酸需求量的研究尚未见报道。
中华绒螯蟹,俗称河蟹,是我国特有的淡水珍品。其营养价值丰富、肉味鲜美,备受国内外市场青睐。近几年,有关中华绒螯蟹对蛋白质、脂肪、蛋白质能量比、脂肪酸、钙、磷及其比例、维生素、肌醇和胆碱等需求量的研究均有报道[12]。但有关中华绒螯蟹对必需氨基酸需求量的研究仅限于赖氨酸、蛋氨酸和精氨酸[13],尚不能全面反映其对必需氨基酸的需求状况。本试验采用苏氨酸含量不同的纯化饲料饲喂中华绒螯蟹幼蟹,探讨苏氨酸对中华绒螯蟹幼蟹生长及相关理化指标的影响,确定其对饲料中苏氨酸的需求量,为配制营养均衡、廉价高效、低污染的中华绒螯蟹饲料提供理论依据。
1 材料与方法
1.1 试验用蟹及养殖系统
试验用中华绒螯蟹幼蟹购自上海崇明岛长江口中华绒螯蟹养殖基地,属于长江系中华绒螯蟹。选取体格健康、附肢完整、规格一致、初始体重为(0.36±0.00)g的幼蟹360只,随机分成6组,每组3个重复,每个重复20只幼蟹。养殖试验在室内养殖系统内进行,以重复为单位养殖于长方体白色硬质聚乙烯水族箱,每箱体积300 L,实际蓄水200 L,缸内放置塑料网片和圆形聚氯乙烯(PVC)管作为幼蟹的隐蔽物。试验用水为天然池塘水,不间断充气增氧,试验期间水温为28~ 30℃,pH为7.5~8.5,溶解氧浓度>5 mg/L,氨氮浓度<0.15 mg/L,亚硝酸盐浓度<0.01 mg/L。
1.2 试验饲料
以酪蛋白、明胶、晶体氨基酸为蛋白质源配制基础饲料,以王树英等[14]报道的蟹种肌肉必需氨基酸组成模式补充必需氨基酸,添加的晶体氨基酸利用率以100%计算[15]。分别在每千克基础饲料中添加0、4、8、12、16、10 g晶体L-苏氨酸(购至国药集团化学试剂有限公司,分析纯,纯度>98%),实测饲料中苏氨酸含量分别为饲料干物质的0.86%、1.24%、1.61%、2.04%、2.42%、2.81%,用谷氨酸平衡氨基酸混合物,配制成6种等氮等能的试验饲料。试验饲料组成及营养水平见表1,试验饲料氨基酸组成见表2。
试验饲料制作时,将所有原料粉碎并通过60目筛,采用逐级扩大法将预混料等微量成分按比例充分混匀,然后加入鱼油、大豆卵磷脂和水搅拌混匀,通过饲料机(型号SLX-80,上海亚励科技贸易有限公司)挤压制成直径为1.5 mm的长条,55℃烘干,自然冷却后破碎成粒径为1~2 mm的破碎料,置于-20℃冰箱内密封保存备用。
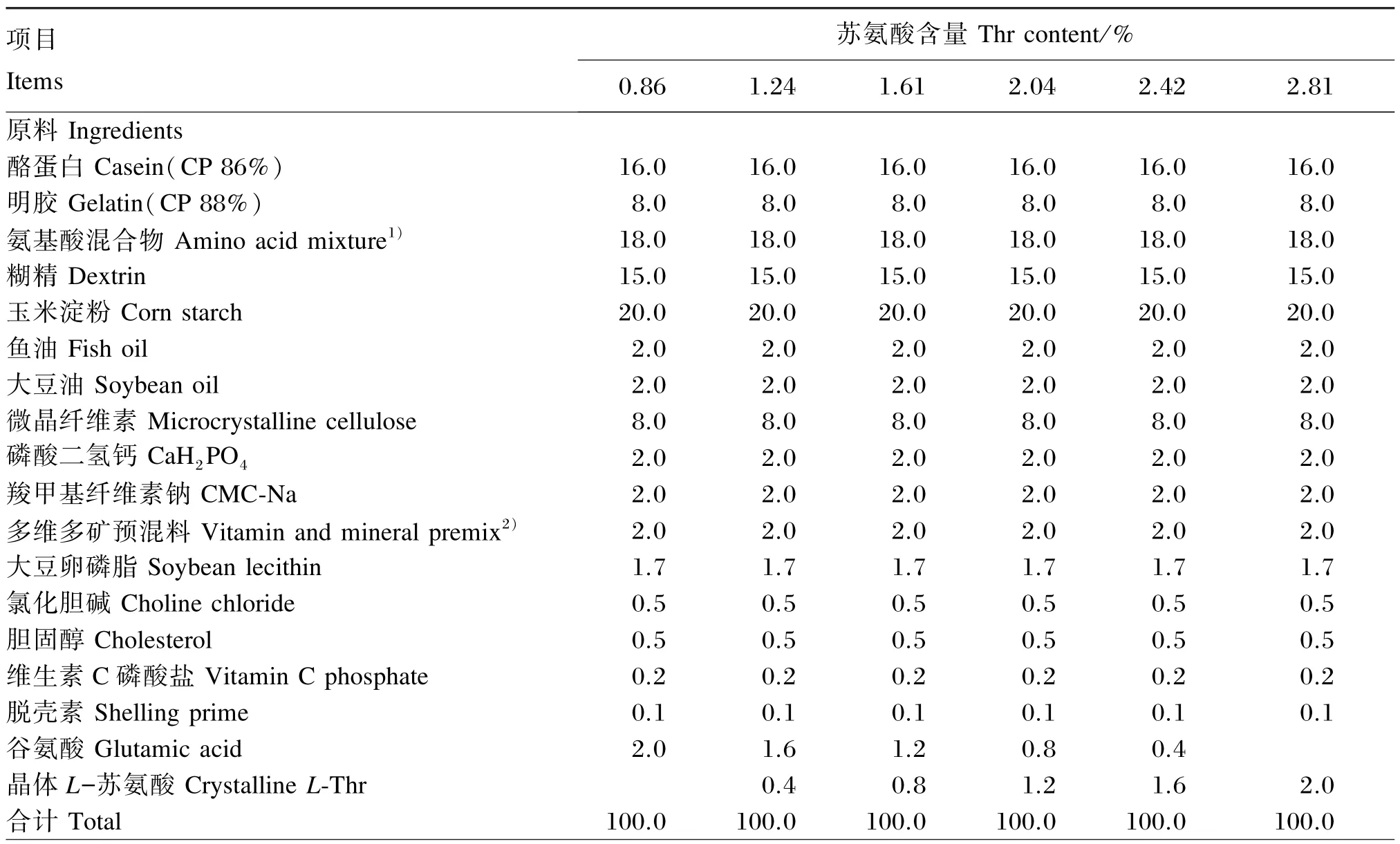
表1 试验饲料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(DM basis) %
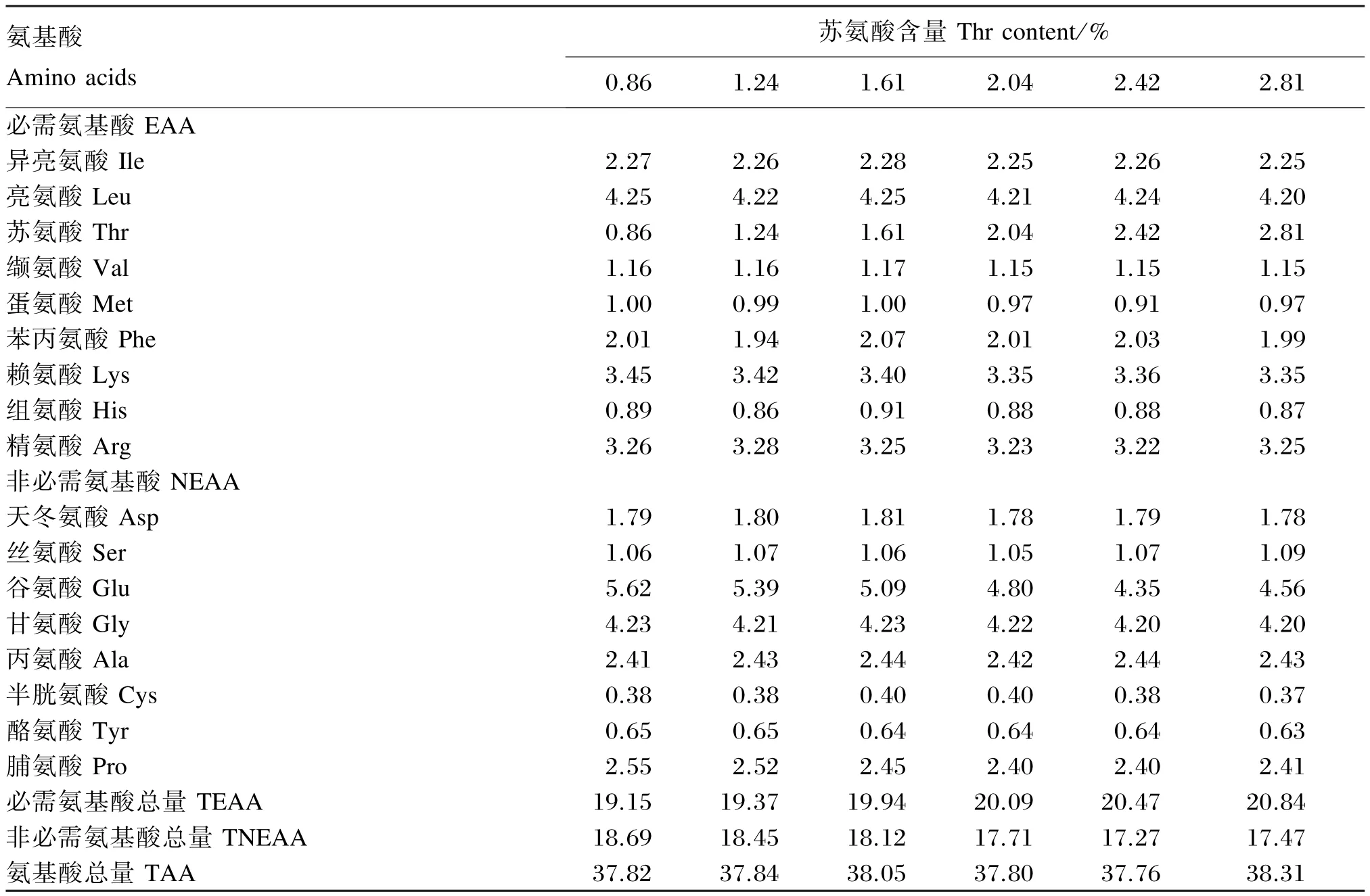
表2 试验饲料氨基酸组成(干物质基础)Table 2 Composition of amino acids in experimental diets(DM basis) %
1.3 试验管理
试验用幼蟹在驯化1周后开始正式试验。每天饱食投喂2次(08:30和16:30),日投喂量为体重的3%~5%,视摄食情况和幼蟹生长做适当调整,每天晨饲前1 h采用微流水进行换水,每天换水量为养殖水体的1/3,饲养周期为8周。
1.4 样品采集及分析
试验结束停食24 h后,以重复为单位称重并记录存活只数。每箱随机取5~7只幼蟹用于体成分分析,每箱另随机取3只幼蟹,取肝胰腺于-80℃冰箱保存,用于消化酶活力和非特异性免疫指标的测定。
试验饲料及全蟹水分、粗蛋白质、粗脂肪和粗灰分含量分别采用105℃恒重法、凯氏定氮法、索氏抽提法和550℃马福炉灼烧法进行测定,试验饲料氨基酸含量采用酸水解法利用日立L-8900氨基酸自动分析仪测定。
酶液蛋白质浓度的测定采用考马斯亮蓝法,定义为1 mg粗酶液的酶活力单位数为酶的比活力。本试验测定的酶活力指标均采用比活力。胃蛋白酶活力采用水解蛋白质法测定,定义为每毫克组织蛋白质37℃每分钟分解蛋白质生成1 μg氨基酸相当于1个酶活力单位。胰蛋白酶活力采用水解精氨酸乙酯法测定,定义为在pH 8.0、37℃条件下,每毫克蛋白质中含有的胰蛋白酶每分钟使吸光度变化0.003为1个酶活力单位。淀粉酶活力采用水解淀粉法测定,定义为每毫克组织中含有的淀粉酶在37℃与底物作用30 min,水解10 mg淀粉为1个酶活力单位。脂肪酶活力采用水解脂肪酸法测定,定义为在37℃条件下,每克组织蛋白质在反应体系中与底物反应1 min,每消耗1 μmol底物为1个酶活力单位。超氧化物歧化酶(superoxide dismutase,SOD)活力按照黄嘌呤氧化酶法测定,定义为每毫升反应液中SOD抑制率达50%时所对应的SOD量为1个酶活力单位。碱性磷酸酶(alkaline phosphatase,AKP)和酸性磷酸酶(acid phosphatase,ACP)活力按照磷酸苯二钠法测定,定义为100 mL组织匀浆在37℃下与底物作用15或60 min,产生1 mg酚为1个金氏单位或1个酶活力单位。以上指标均采用南京建成生物工程研究所生产的试剂盒测定,具体操作方法参考试剂盒说明书进行。
1.5 生长性能指标计算公式
增重率(weight gain ratio,WGR,%)=100×(终末均重-初始均重)/初始均重;特定生长率(specific growth rate,SGR,%/d)=100×(ln终末均重-ln初始均重)/试验天数;
成活率(survival rate,SR,%)=100×试验结束时蟹尾数/试验开始时蟹尾数;饲料系数(feed conversion ratio,FCR)=摄食量/(总终末蟹重+死亡蟹重-总初始蟹重);
蛋白质效率(protein efficiency ratio,PER,%)=100×蟹体净增重/(饲料摄入量×饲料蛋白质含量)。
1.6 数据处理及统计分析
试验数据以“平均值±标准差(mean±SD)”表示,采用SPSS 18.0统计软件中one⁃way ANOVA进行单因素方差分析,P<0.05为差异显著,若有显著差异再用Duncan氏法进行多重比较。以增重率为评价指标进行折线回归模型分析,确定中华绒螯蟹幼蟹苏氨酸的需求量。
2 结 果
2.1 苏氨酸对中华绒螯蟹幼蟹生长性能的影响
由表3可以看出,中华绒螯蟹幼蟹的终末体重、增重率与特定生长率均随饲料中苏氨酸含量的升高呈先升高后降低的趋势,在饲料中苏氨酸含量为饲料干物质的1.61%时终末体重、增重率与特定生长率均达到最大值,且均显著高于0.86%、1.24%、2.42%和2.81%组(P<0.05)。同时,在饲料中苏氨酸含量为饲料干物质的1.61%时饲料系数最小,蛋白质效率最高,但与其他试验组无显著差异(P>0.05)。饲料中苏氨酸含量对中华绒螯蟹幼蟹的成活率无显著影响(P>0.05)。
2.2 苏氨酸对中华绒螯蟹幼蟹体成分的影响
由表4可以看出,饲料中苏氨酸含量对中华绒螯蟹幼蟹全蟹水分、粗蛋白质、粗脂肪和粗灰分含量均无显著影响(P>0.05)。
2.3 苏氨酸对中华绒螯蟹幼蟹肝胰腺中消化酶活力的影响
由表5可以看出,中华绒螯蟹幼蟹肝胰腺中胰蛋白酶、胃蛋白酶、脂肪酶和淀粉酶活力均随饲料中苏氨酸含量的升高呈先升高后降低的趋势,饲料中苏氨酸含量为饲料干物质的1.61%时胰蛋白酶、胃蛋白酶、脂肪酶和淀粉酶活力均达到最大值,并显著高于其他各组(P<0.05)。
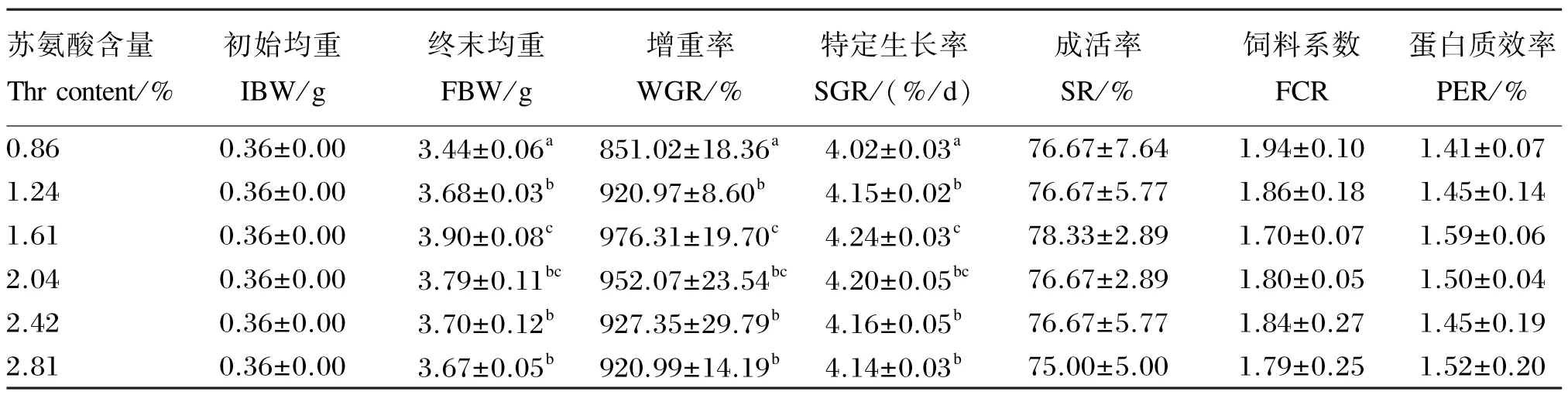
表3 苏氨酸对中华绒螯蟹幼蟹生长性能的影响Table 3 Effects of Thr on growth performance of juvenile Chinese mitten crab(n=3)
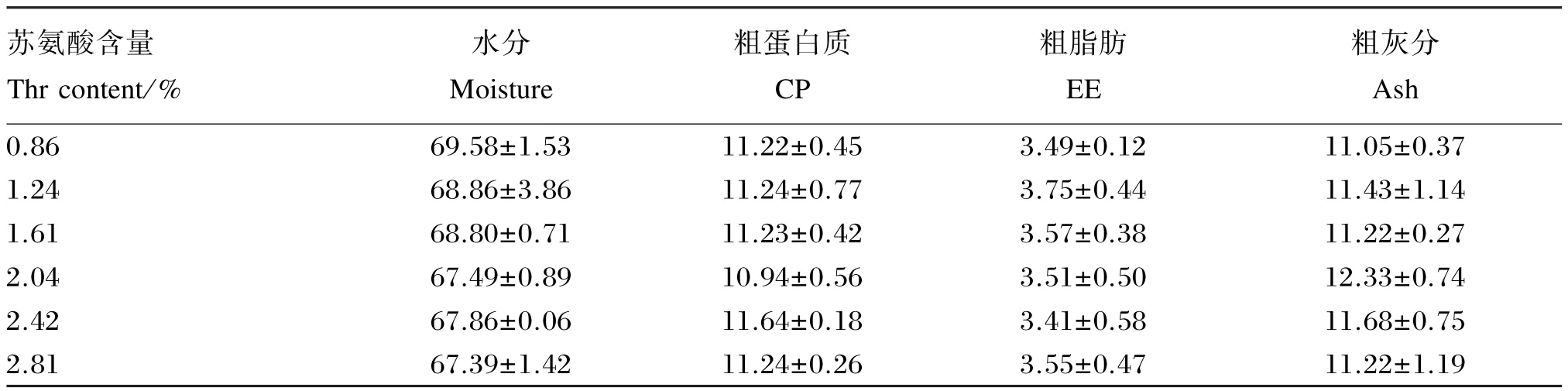
表4 苏氨酸对中华绒螯蟹幼蟹体成分的影响(湿重基础)Table 4 Effects of Thr on body composition of juvenile Chinese mitten crab(wet weight basis,n=3) %
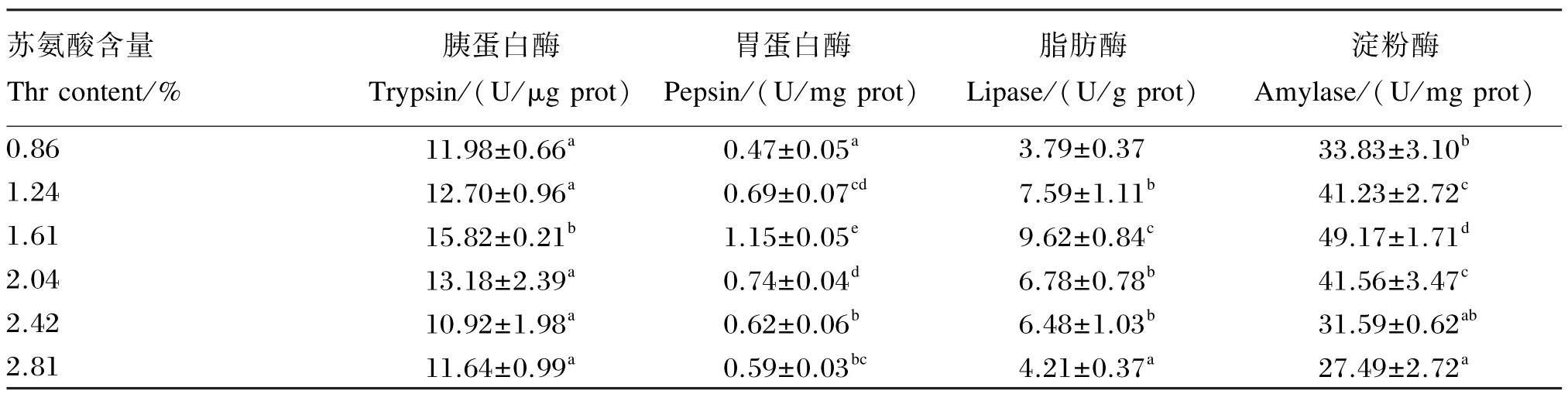
表5 苏氨酸对中华绒螯蟹幼蟹肝胰腺中消化酶活力的影响Table 5 Effects of Thr on digestive enzyme activities in hepatopancreas of juvenile Chinese mitten crab(n=3)
2.4 苏氨酸对中华绒螯蟹幼蟹肝胰腺中非特异性免疫指标的影响
由表6可以看出,中华绒螯蟹幼蟹肝胰腺中SOD、AKP活力均随饲料中苏氨酸含量的升高呈先升高后降低的趋势,在饲料苏氨酸含量为饲料干物质的1.61%时SOD、AKP活力达到最大值,且该组SOD活力显著高于其他各组(P<0.05),AKP活力显著高于0.86%和2.04%组(P<0.05);肝胰腺中ACP活力随饲料中苏氨酸含量的升高呈升高趋势,在饲料中苏氨酸含量为饲料干物质的2.42% 时ACP活力达最大值,显著高于其他各组(P<0.05)。
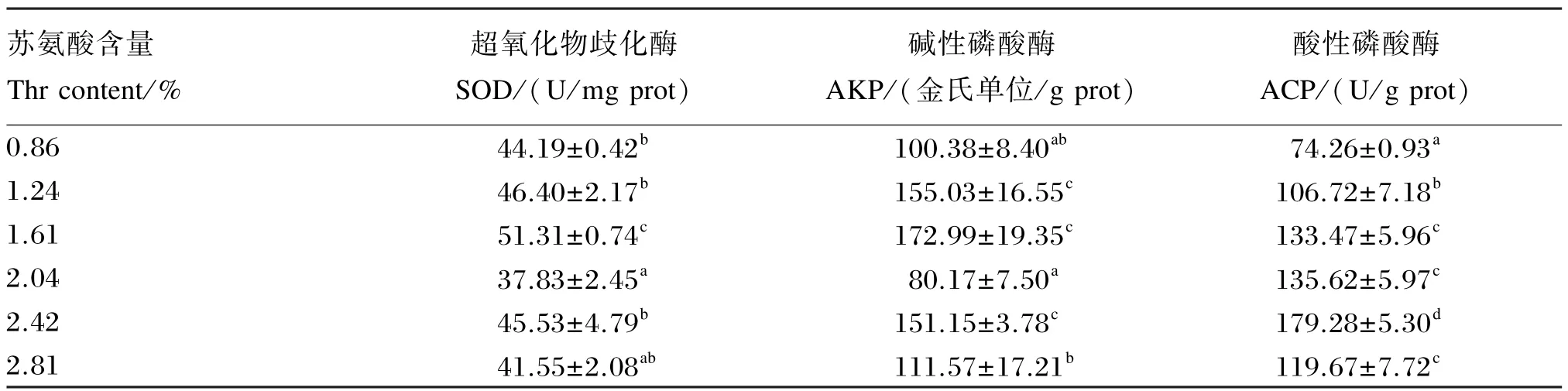
表6 苏氨酸对中华绒螯蟹幼蟹肝胰腺中非特异性免疫指标的影响Table 6 Effects of Thr on nonspecific immune indices in hepatopancreas of juvenile Chinese mitten crab(n=3)
2.5 中华绒螯蟹幼蟹对苏氨酸的需求量
根据饲料中苏氨酸含量与中华绒螯蟹幼蟹增重率的关系(图1),通过折线回归模型分析得到方程y=165.88x+710.69(R2=0.996 8)和y=-48.061x+1 050.9(R2=0.954 5),经计算得出中华绒螯蟹幼蟹对饲料中苏氨酸的需求量为饲料干物质的1.59%(饲料蛋白质的3.98%)。
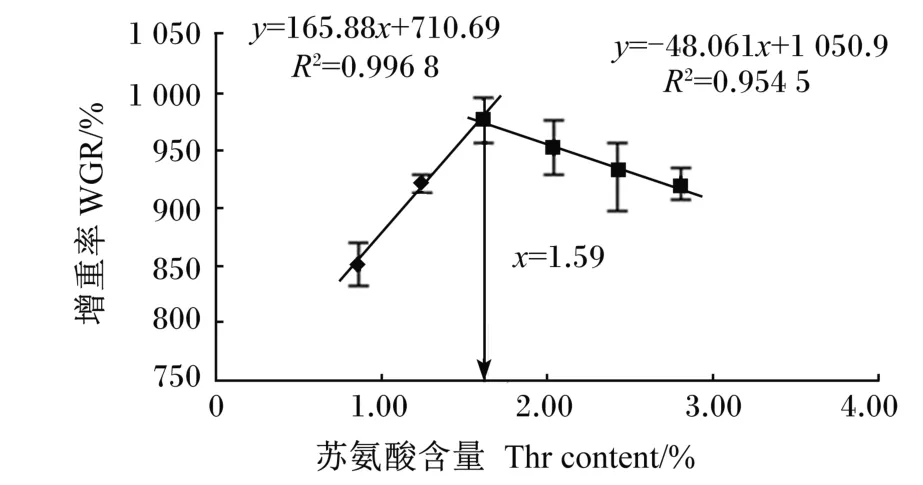
图1 饲料中苏氨酸含量与中华绒螯蟹幼蟹增重率的关系Fig.1 Relationship between dietary Thr content and WGR of juvenile Chinese mitten crab
3 讨 论
3.1 苏氨酸对中华绒螯蟹幼蟹生长性能的影响
本试验通过在纯化基础饲料中添加不同水平的晶体L-苏氨酸饲养中华绒螯蟹幼蟹8周,发现苏氨酸缺乏组(饲料中苏氨酸含量为饲料干物质的0.86%)的幼蟹表现出较低生长速度,随着饲料中苏氨酸含量的升高到饲料干物质的1.61%,其生长速度得到了显著的提高。由此证明,饲料中苏氨酸含量影响中华绒螯蟹幼蟹的生长,且中华绒螯蟹幼蟹有利用晶体苏氨酸的能力。
氨基酸平衡理论指出,必需氨基酸的平衡有助于提高饲料氨基酸的消化、吸收和利用,提高蛋白质的营养价值,促进动物的生长和饲料的利用。本试验结果表明,随着饲料中苏氨酸含量由饲料干物质的0.86%升高到1.61%,其增重率随之升高,饲料系数随之降低。这些结果可能就是氨基酸平衡效应的体现,当苏氨酸含量达到适宜水平时,增重率达到最大值,饲料系数此时最低。饲料中过量苏氨酸对水生动物生长的影响存在明显的种间差异。在尼罗罗非鱼(Oreochromis nilotic⁃ us)[16]、遮目鱼(Chanos chanos)[17]、斑点叉尾(Ictalurus punetaus)[5]、美国红鱼(Sciaenops ocel⁃latus)[18]、欧洲黑鲈(Dicentrarchus labrax)[19]上的研究结果显示饲料中苏氨酸过量时对生长并无显著影响。但本试验结果显示,当饲料中苏氨酸含量超过中华绒螯蟹幼蟹适宜需求量时会抑制其生长。这与在印度鲤鱼(Cirrhinus mrigala)[20]、日本牙鲆(Paralichthys olivaceus)[21]、斑节对虾[3]、凡纳滨对虾[9]等上的研究结果一致。关于饲料中过量苏氨酸抑制生长的机理有多种解释。Alam等[21]研究指出,苏氨酸过量抑制生长可能由氨基酸中毒引起,机体氨基酸库大量储存苏氨酸或其降解副产物会促使酶系统加速运转,导致氨基酸的大量储存并产生毒性。Shivananda等[22]研究认为,饲料氨基酸间的平衡对鱼类氨基酸的吸收有重要作用,过量摄入苏氨酸会破坏氨基酸间的平衡,影响鱼类吸收和利用其他氨基酸,从而影响其生长速度,这可能也是过量苏氨酸抑制生长的原因之一。
关于苏氨酸对试验动物成活率的影响,不同研究者的结果也不一致。如在遮目鱼[18]和低盐度下凡纳滨对虾[10]上的研究发现苏氨酸缺乏时死亡率升高。而对斑节对虾[3]、日本对虾[11]的研究结果则显示其成活率不受饲料中苏氨酸含量的影响。这可能与试验饲料组成、基础饲料中苏氨酸含量、试验动物种类以及试验条件等因素有关。本试验结果显示,中华绒螯蟹幼蟹的成活率不受饲料中苏氨酸含量的影响,这与斑节对虾[3]、日本对虾[11]的研究结果一致,推测原因可能是因为中华绒螯蟹幼蟹对苏氨酸具有较宽的耐受范围,也可能是因为基础饲料中苏氨酸基本满足了幼蟹的机体代谢需求。
本试验发现中华绒螯蟹幼蟹的体成分不受饲料中苏氨酸含量的影响,这与在鲈鱼(Lateolabrax japonicus)[23]上的研究结果一致,可能是因为中华绒螯蟹幼蟹维持体成分稳定的能力相对较强。另外,本试验的饲养周期(56 d)相对较短,可能在短时间内苏氨酸含量的变化不能显著影响到中华绒螯蟹幼蟹的体成分,因此,今后可通过延长饲养周期以对体成分进行进一步研究。
3.2 苏氨酸对中华绒螯蟹幼蟹肝胰腺中消化酶活力的影响
饲料质量是影响甲壳动物消化酶活力的关键因素之一,消化酶活力在一定程度上反映出机体对饲料营养成分的消化利用程度。当摄食不同营养成分的饲料时,甲壳动物会出现消化酶分泌量的差异,以便更好地消化、吸收和利用饲料中的营养物质,来适应饲料组成的变化[24]。本试验结果显示,饲料中苏氨酸含量显著影响了中华绒螯蟹幼蟹肝胰腺中胰蛋白酶、胃蛋白酶、脂肪酶和淀粉酶活力,均随饲料中苏氨酸含量的升高呈先升高后降低的趋势,且在饲料苏氨酸含量为饲料干物质的1.61%时达到最大值。这与在幼建鲤(Cypri⁃nus carpio var.Jian)[25]、生长中期草鱼(Cteno⁃pharynodon idellu)[26]、生长后期草鱼[27]上的研究结果基本一致。机体能为消化腺提供合适数量和配比的氨基酸这是消化酶能够顺利合成的关键,当机体所需的氨基酸不足时,外源补充适量的氨基酸能够促进消化酶的合成和分泌。这可能是中华绒螯蟹幼蟹肝胰腺消化酶活力随饲料中苏氨酸含量的升高先出现升高的原因。但当饲料中苏氨酸含量为饲料干物质的2.04%~2.81%时,中华绒螯蟹幼蟹肝胰腺消化酶活力逐渐降低。这可能是在苏氨酸过量的情况下,中华绒螯蟹幼蟹对饲料中氨基酸比例不平衡表现出不适应性,即过量的苏氨酸抑制了幼蟹肝胰腺消化酶的活力,这也可能是幼蟹生长速度降低的原因之一。
3.3 苏氨酸对中华绒螯蟹幼蟹肝胰腺中非特异性免疫指标的影响
SOD是机体关键的抗氧化酶之一,是超氧自由基的天然消除剂,可以清除体内多余的自由基,使自由基的形成与消除处于一种动态平衡中,从而免除其对生物分子的损伤等。已有研究发现,SOD的活力与生物的免疫水平呈密切相关[28]。因此,SOD可作为机体非特异性免疫指标,来评判免疫刺激剂对机体非特异性免疫力的影响[29-31]。本试验结果显示,中华绒螯蟹幼蟹肝胰腺中SOD活力随饲料中苏氨酸含量的升高呈先升高后降低的趋势,且在苏氨酸含量为饲料干物质的1.61% 时SOD活力达到最大值,这表明饲料中适量的苏氨酸可增强中华绒螯蟹幼蟹的抗氧化能力,保护机体免遭过氧化物的损伤。Wellen等[32]在人上的研究发现,营养物质摄入过量会诱导机体产生氧化应激。本试验中,饲料中苏氨酸含量超过饲料干物质的1.61%后,中华绒螯蟹幼蟹肝胰腺中SOD活力出现降低,因此推测可能是过量苏氧酸诱导了氧化损伤,致使SOD活力降低。
AKP是一种重要的代谢调控酶,可通过改变病原体的表面结构而增强被侵袭机体对病原体的识别和吞噬能力[33],有助于提高幼蟹的抗病力。本试验结果显示,饲料中适量的苏氨酸可以提高中华绒螯蟹幼蟹肝胰腺中AKP活力,促进幼蟹细胞中的物质代谢,从而促进幼蟹生长,也间接地提高了其非特异性免疫能力。ACP是巨噬细胞溶酶体的标志酶,与机体物质代谢关系密切。它通过催化磷蛋白中磷酯键的水解,直接参与磷酸基团的转移和代谢[34],在体内细胞调节过程中起重要作用。本试验结果表明,饲料中适量的苏氨酸可以提高肝胰腺中ACP活力,这有利于其机体细胞中的物质代谢,促进正常生长,并提高其非特异性免疫能力。
由此可见,饲料中适量的苏氨酸在促进中华绒螯蟹幼蟹健康生长的同时,也可在一定程度上有效地提高其非特异性免疫功能。
4 结 论
①饲料中适量的苏氨酸可以促进中华绒螯蟹幼蟹生长,提高其消化能力和非特异性免疫功能。
②以增重率为评价指标,通过折线回归模型得到中华绒螯蟹幼蟹对饲料中苏氨酸的需求量为饲料干物质的1.59%(饲料蛋白质的3.98%)。
参考文献:
[1] SMALL B C,SOARES J H,Jr.Quantitative dietary threonine requirement of juvenile striped bass Morone saxatilis[J].Journal of the World Aquaculture Socie⁃ty,1999,30(3):319-323.
[2] RAVI J,DEVARAJ K V.Quantitative essential amino acid requirements for growth of catla,Catla catla (Hamilton)[J].Aquaculture,1991,96(3/4):281-291.
[3] MILLAMENA O M,BAUTISTA M N,REYES O S,et al.Threonine requirement of juvenile marine shrimp Penaeus monodon[J].Aquaculture,1997,151(1/2/3/4):9-14.
[4] AHMED I,KHAN M A,JAFRI A K.Dietary threo⁃nine requirement of fingerling Indian major carp,Cir⁃rhinus mrigala(Hamilton)[J].Aquaculture Re⁃search,2004,35(2):162-170.
[5] WILSON R P,ALLEN O W,Jr,ROBINSON E H,et al.Tryptophan and threonine requirements of fingerling channel catfish[J].The Journal of Nutrition,1978,108(10):1595-1599.
[6] HELLAND S J,GRISDALE⁃HELLAND B.Dietary threonine requirement of Atlantic salmon smolts[J].Aquaculture,2011,321(3/4):230-236.
[7] THONG H T,LIEBERT F.Amino acid requirement of growing pigs depending on amino acid efficiency and level of protein deposition.2nd communication:threo⁃nine[J].Archives of Animal Nutrition,2004,58(2):157-168.
[8] YAMAMOTO T,UNUMA T,AKIYAMA T.The in⁃fluence of dietary protein and fat levels on tissue free amino acid levels of fingerling rainbow trout(On⁃corhynchus mykiss)[J].Aquaculture,2000,182(3/4):353-372.
[9] ZHOU Q C,WANG Y L,WANG H L,et al.Dietary threonine requirements of juvenile Pacific white shrimp,Litopenaeus vannamei[J].Aquaculture,2013,392-395:142-147.
[10] HUAI M Y,TIAN L X,LIU Y J,et al.Quantitative dietary threonine requirement of juvenile Pacific white shrimp,Litopenaeus vannamei(Boone)reared in low⁃salinity water[J].Aquaculture Research,2009,40 (8):904-914.
[11] TESHIMA S,ALAM M S,KOSHIO S,et al.Assess⁃ment of requirement values for essential amino acids in the prawn,Marsupenaeus japonicus(Bate)[J].Aquaculture Research,2002,33(6):395-402.
[12] 林仕梅,罗莉,叶元土.中华绒螯蟹的营养需求[J].科学养鱼,2001(4):41-42.
[13] 叶金云,王友慧,郭建林,等.中华绒螯蟹对赖氨酸、蛋氨酸和精氨酸的需要量[J].水产学报,2010,34 (10):1541-1548.
[14] 王树英,陈辉.中华绒螯蟹不同部位氨基酸的测定与分析[J].氨基酸和生物资源,1999,21(2):35-36.
[15] 张璐,陈立侨,洪美玲,等.中华绒螯蟹对11种饲料原料蛋白质和氨基酸的表观消化率[J].水产学报,2007,31(增刊):116-121.
[16] SANTIAGO C B,LOVELL R T.Amino acid require⁃ments for growth of Nile tilapia[J].The Journal of Nutrition,1988,118(12):1540-1546.
[17] BORLONGAN I G.Arginine and threonine require⁃ments of milkfish(Chanos chanos Forsskal)juveniles [J].Aquaculture,1991,93(4):313-322.
[18] BOREN R S,GATLIN D M.Dietary threonine re⁃quirement of juvenile red drum Sciaenops ocellatus [J].Journal of the World Aquaculture Society,1995,26(3):279-283.
[19] TIBALDI E,TULLI F.Dietary threonine requirement of juvenile european sea bass(Dicentrarchus labrax)[J].Aquaculture,1999,175(1/2):55-166.
[20] AHMED I,KHAN M A.Dietary lysine requirement of fingerling Indian major carp,Cirrhinus mrigala (Hamilton)[J].Aquaculture,2004,235(1/2/3/4):499-511.
[21] ALAM M S,TESHIMA S,KOSHIO S,et al.Opti⁃mum dietary threonine level for juvenile Japanese flounder Paralichthys olivaceus[J].Asian Fisheries Science,2003,16(1/2):175-184.
[22] SHIVANANDA M H,VARGHESE T J.Quantitative dietary requirement of threonine for the growth of the Indian major carp,Labeo rohita(Hamilton)[J].Jour⁃nal of Aquaculture in the Tropics,1996,11:1-7.
[23] 何志刚,艾庆辉,麦康森,等.鲈幼鱼对饲料中苏氨酸的需要量[J].水产学报,2012,36(1):124-131.
[24] 潘鲁青,刘泓宇,肖国强.甲壳动物幼体消化酶研究进展[J].中国水产科学,2006,13(3):492-501.
[25] 冯琳.苏氨酸对幼建鲤消化吸收能力和抗病力以及组织器官中蛋白质调控信号分子TOR表达的影响[D].博士学位论文.雅安:四川农业大学,2010:37-51.
[26] 胡晓霞.生长中期草鱼的苏氨酸需要量研究[D].硕士学位论文.雅安:四川农业大学,2012:21-49.
[27] 洪杨.苏氨酸对生长后期草鱼消化吸收功能和抗氧化能力影响的研究[D].硕士学位论文.雅安:四川农业大学,2012:11-41.
[28] 林林,丁美丽,孙舰军,等.有机污染提高对虾对病原菌易感性研究[J].海洋学报,1998,20(1):90-93.
[29] 丁美丽,林林,李光友,等.有机污染对中国对虾体内外环境影响的研究[J].海洋与湖沼,1997,28(1):7-12.
[30] 王雷,李光友,毛远兴,等.口服免疫型药物对养殖中国对虾病害防治作用的研究[J].海洋与湖沼,1994,25(5):486-492.
[31] 孙舰军,丁美丽.氨氮对中国对虾抗病力的影响[J].海洋与湖沼,1999,30(3):267-272.
[32] WELLEN K E,THOMPSON C B.Cellular metabolic stress:considering how cells respond to nutrient excess [J].Molecular Cell,2010,40(2):323-332.
[33] CHENG T C.The role of lysosomal hydrolases in mol⁃luscan cellular response to immunologic challenge [M]//BULLA L A,Jr,CHENG T C.Invertebrate models for biomedical research.New York:Springer,1978:59-71.
[34] 刘树青,江晓路,牟海津,等.免疫多糖对中国对虾血清溶菌酶、磷酸酶和过氧化物酶的作用[J].海洋与湖沼,1999,30(3):278-283.
(责任编辑 菅景颖)
Threonine Requirement of Juvenile Chinese Mitten Crab(Eriocheir sinensis)
WANG Wei1YE Jinyun1,2∗YANG Xia2ZHANG Yixiang2LIU Pei2,3
(1.School of Laboratory Medicine and Life Science,Wenzhou Medical University,Wenzhou 325035,China;2.Zhejiang Provincial Key Laboratory of Aquatic Resources Conservation and Development,Key Laboratory of Aquatic Animal Genetic Breeding&Nutrition of Chinese Academy of Fishery Science,Huzhou University,Huzhou 313000,China;3.Dalian Ocean University,Dalian 116023,China)
∗Corresponding author,professor,E⁃mail:ziff2006@163.com
Abstract:A 56⁃day growth trial was conducted to determine the threonine requirement of juvenile Chinese mit⁃ten crab(Eriocheir sinensis).Six isonitrogenous and isoenergetic purified diets were formulated using casein,gelatin and crystalline amino acids as protein sources,and the threonine content in those diets was 0.86%(con⁃trol,without extra threonine),1.24%,1.61%,2.04%,2.42%and 2.81%of dietary dry matter by adding crystalline L⁃threonine,respectively.A total of 360 juvenile Chinese mitten crab with the initial body weight of (0.36±0.00)g were chosen and randomly distributed into 6 groups with 3 replicates per group and 20 crabs per replicate.The results showed that with the increase of dietary threonine content,the weight gain rate (WGR),specific growth rate(SGR),and the activities of digestive enzymes(pepsin,trypsin,lipase and amylase)were firstly increased and then decreased,which reached their peaks in the 1.61%group,and the WGR and SGR in the 1.61%group were significantly higher than those in the 0.86%,1.24%,2.42%and 2.81%groups(P<0.05)and the activities of digestive enzymes in the 1.61%group were significantly higher than those in the other groups(P<0.05).Whereas,the feed conversion ratio(FCR)reached the lowest value in the 1.61%group,and the protein efficiency ratio(PER)reached the highest value in the same group.Diet⁃ary threonine content had no significant effects on survival rate(SR)and body composition(P>0.05).The activities of superoxide dismutase(SOD),alkaline phosphatase(AKP)and acid phosphatase(ACP)in hepa⁃topancreas were firstly increased and then decreased,which reached their peaks in the 1.61%,1.61%and 2.42%groups,respectively.Using WGR as the evaluation index,dietary threonine requirement of juvenile Chinese mitten crab is estimated to be 1.59%of dietary dry matter(3.98%of dietary protein)by broken⁃line regress model analysis.[Chinese Journal of Animal Nutrition,2015,27(2):476⁃484]
Key words:juvenile Chinese mitten crab;threonine;requirement;digestive enzymes;non⁃specific immune indices
通信作者:∗叶金云,研究员,博士生导师,E⁃mail:ziff2006@163.com
作者简介:王 伟(1989—),男,安徽阜阳人,硕士研究生,从事水产动物营养与饲料研究。E⁃mail:tiexuedaqinww@126.com
基金项目:公益性行业(农业)科研专项(201003020);浙江省淡水养殖重点科技创新团队项目(2010R50026⁃17)
收稿日期:2014-08-08
doi:10.3969/j.issn.1006⁃267x.2015.02.018
文章编号:1006⁃267X(2015)02⁃0476⁃09
文献标识码:A
中图分类号:S963.73+1
