免疫增强剂党参对仿刺参肠道菌群结构的影响
2016-01-19于晓清刘恩孚李天保许叶海斌山东省海洋生物研究院山东省海水养殖病害防治重点实验室青岛266002
樊 英 李 乐 于晓清 刘恩孚 李天保许 拉 叶海斌(山东省海洋生物研究院,山东省海水养殖病害防治重点实验室,青岛266002)
免疫增强剂党参对仿刺参肠道菌群结构的影响
樊 英 李 乐 于晓清 刘恩孚 李天保∗许 拉 叶海斌
(山东省海洋生物研究院,山东省海水养殖病害防治重点实验室,青岛266002)
摘 要:采用平板计数法和聚合酶链式反应(PCR)-变性梯度凝胶电泳(DGGE)技术分析免疫增强剂党参对仿刺参(Apostichopus japonicas)肠道菌群结构的影响。将初始体重为(18.00± 2.00)g的仿刺参随机分为2组(对照组、试验组),每组6个重复,每个重复12只。对照组投喂海泥、鼠尾藻粉按照1∶1的质量比配制的饵料,试验组饵料中以鼠尾藻粉质量的2%添加党参,连续投喂28 d。结果表明:应用免疫增强剂党参不仅能够显著提高仿刺参的特定生长率(P<0.05),降低其饵料系数(P<0.05),而且能够显著增加仿刺参肠道内容物中异养菌的数量(P<0.05);序列统计分析显示投喂党参后仿刺参肠道细菌优质序列比例显著增加(P<0.05),试验组达97.57%,对照组仅为80.22%;Beta多样性分析反映投喂党参后仿刺参肠道微生态环境发生了变化,其多样性系数范围在14.91%~15.47%、15.47%~16.21%、14.91%~16.21%;丰度分析显示投喂党参后仿刺参肠道内容物中变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)丰度提高,疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)和厚壁菌门(Firmiaites)丰度降低;聚类分析显示试验组与对照组肠道菌群结构相似性系数为0.97。由此可见,免疫增强剂党参可提高仿刺参的特定生长率,降低饵料系数,增加肠道异养菌数量和优势菌群丰度,优化肠道微生态环境。
关键词:免疫增强剂;党参;仿刺参;肠道;菌群;DGGE
肠道是病原微生物入侵机体的最主要部位,许多疾病的发生都始于肠道[1-2]。然而,肠道菌群是肠道微生态的主导者,这些细菌间以及细菌与动物机体之间都形成了一个相互依赖、协作共进的整体,在机体免疫、营养、吸收等方面都起到非常重要的作用[3]。细菌群落研究一直都是基于传统的微生物培养方法,操作费时费力,且不能反映它们在自然界的群落结构以及详细的丰度状况和多样性[4]。目前,自然环境中尚有高达85%~99%的微生物未能进行人工培养[5],现有研究对复杂的生态系统中细菌群落结构的了解更是十分有限[4]。仿刺参(Apostichopus japonicas)属无脊椎棘皮动物,非特异性免疫防御系统在机体中具有较为重要的作用,而肠道系统在整个机体防御中又具有举足轻重的作用。然而,目前对仿刺参肠道微生态环境内细菌群落结构及生态多样性的了解很少,免疫增强剂影响仿刺参肠道菌群方面的研究也未见报道。
聚合酶链式反应(polymerase chain reaction,PCR)-变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)是基于相同长度但不同碱基组成的DNA序列片段电泳分析的技术[6]。1993年Muyzer等[7]首次将其用于细菌群落分析;2007年Hovda等[8]利用该技术分析了大西洋鲑(Salmo salar L.)前肠、中肠和后肠的细菌群落组成及优势菌群;此外,Zhou等[9]利用该技术研究了网箱养殖的青石斑鱼(Epinephelus awoara)胃、幽门盲囊、前肠、中肠和后肠的细菌群落组成;罗鹏等[10]利用该技术对比研究了凡纳滨对虾(Litope⁃naeus vannamei)养殖环境以及消化道内细菌群落组成的多样性和相似性;高菲等[11]利用该技术研究了仿刺参前肠、中肠和后肠内含物的细菌群落组成,证实仿刺参消化道的细菌群落直接或间接来源于仿刺参的栖息地环境,有助于进一步揭示细菌群落在仿刺参免疫等生理生化过程中的作用。然而,在免疫增强剂作用的情况下通过PCR⁃DGGE技术对仿刺参消化道内容物细菌群落组成的研究还未见报道。本试验拟采用传统平板统计方法和PCR⁃DGGE技术比较分析仿刺参应用免疫增强剂党参后肠道细菌数量和群落结构变化,以揭示仿刺参在应用免疫增强剂后肠道细菌群落的动态变化,体现细菌群落在仿刺参消化吸收免疫增强剂过程中的作用和重要性,为进一步了解和应用免疫增强剂提供参考。
1 材料与方法
1.1 试验材料
党参购自西安宝鸡生物技术有限公司,其纯度达到85%以上。实验室内通过锐孔凝固浴方式制备微胶囊制剂,其包埋率达到85%。其他试剂均为化学分析纯。细菌基因组DNA提取试剂盒、PCR扩增试剂均购自TaKaRa公司;肠道内容物基因组提取采用的QUAGEN试剂盒购自青岛博康生物技术有限公司;细菌16S rDNA通用引物27f 和1492r、V3区扩增引物F357和R518均由上海生工生物工程技术服务有限公司合成。
1.2 试验方法
1.2.1 仿刺参饲养试验
挑选个体均匀、外观无疾病症状的健康仿刺参[体重(18.00±2.00)g]随机分配到6个试验水槽(长70 cm×宽30 cm×高40 cm)内,温度控制在(15.0±1.0)℃。仿刺参随机分为2组(对照组、试验组),每组6个重复(水槽),每个重复12只。试验期间按照体重的2%饱食投喂,对照组投喂海泥、鼠尾藻粉按照1∶1的质量比配制的饵料,试验组饵料中以基础饲料(鼠尾藻粉)质量的2%添加党参,连续投喂28 d,每天15:00投喂,吸除残饵和粪便,同时补充新鲜海水。试验期间连续充气,盐度32,pH 7.8~8.2,溶解氧浓度>5 mg/L。
1.2.2 肠道样品处理
投喂免疫增强剂党参后第28天分别从每个水槽中随机抽取3只仿刺参,在冰盘中取出肠道,称取0.5 g,加入10倍体积(质量体积比)的无菌预冷重蒸水,在冰浴中(0~4℃)用灭菌匀浆器充分研磨匀浆后,一部分样品以10倍递增稀释法进行稀释,取3个合适的稀释度涂布于2216e和硫代硫酸盐柠檬酸盐胆盐蔗糖(TCBS)琼脂培养基,分别用于培养肠道异养菌和弧菌。每个稀释度做3个平行,25℃培养1~2 d。另一部分样品于-80℃冷冻保存备用。
1.3 生长性能测定
摄食量是指仿刺参一次投喂摄食的饵料数量。在生产实际应用中,通常采用日摄食量(daily feed intake,DFI)来衡量水产动物的摄食情况。
饵料系数即饵料用量与养殖仿刺参增重量的比值。计算公式:
饵料系数(feed conversion ratio,FCR)=总投饵量/增重量。
28 d的饲喂试验结束后,对仿刺参进行称重(滤纸上静置30 s后进行称量),计算仿刺参的特定生长率。计算公式:
特定生长率(specific growth rate,SGR,%/d)=100×(ln终末体重-ln初始体重)/试验天数。
1.4 肠道细菌总DNA提取及16S rDNA V3区扩增
在无菌条件下利用QUAGEN试剂盒提取肠道细菌基因组总DNA作为模板,采用细菌16S rDNA V3区特异引物F357(5’-CCTACGGGAG⁃GCAGCAG-3’)和R518(5’-ATTACCGCG⁃GCTG CTGG-3’)分别进行扩增。
1.5 肠道细菌DGGE图谱分析
1.5.1 序列数目统计
本试验采用双端(pair⁃end)测序。首先对原始数据进行质量控制,舍弃低质量序列(50个连续碱基平均质量>0,不允许有模糊碱基)。舍弃无法连接的序列,对连接上的序列进行过滤(连续相同碱基数<6;模糊碱基数<1),获得最终用于分析的序列。
1.5.2 基于群落结构对物种丰度进行统计分析
在样品相似度为0.97的情况下进行多样品物种丰度的统计,可反映样品中物种分布的均匀度。
1.5.3 基于群落结构进行Beta多样性统计分析
Beta多样性是基于群落结构来比较多组样本之间的差别度量,是物种组成沿环境梯度或者在群落间的变化率,用来表示生物种类对环境异质性的反应,通过主坐标分析(principal coordinates a⁃nalysis,PCoA)来表现。
1.5.4 基于群落结构进行聚类分析
将属水平上的分类信息分别按照样品和分类进行聚类分析后作出heatmap图,反映出各样品的相似性。
1.6 数据统计分析
试验数据用平均值±标准误表示,采用SPSS 17.0软件中的单因素方差分析(one⁃way ANO⁃VA)进行统计,P<0.05为差异显著。
2 结果与分析
2.1 生长性能
饲养试验结束后对仿刺参的生长性能进行统计,结果(表1)显示,试验组仿刺参的饵料系数显著低于对照组(P<0.05),特定生长率显著高于对照组(P<0.05),表明党参提高了仿刺参的生长性能。
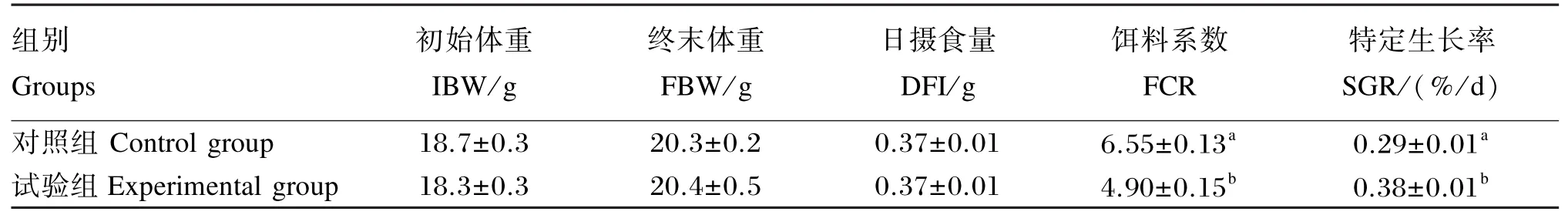
表1 免疫增强剂党参对仿刺参生长性能的影响Table 1 Effect of Codonopsis pilosula as an immunopotentiator on growth performance of Apostichopus japonicus
2.2 肠道内容物中异养菌及弧菌数量
如表2所示,投喂党参的试验组仿刺参肠道内容物中异养菌的数量达2.13×107CFU/mL,而对照组仅为1.61×107CFU/mL,试验组较对照组显著增加(P<0.05);试验组仿刺参肠道内容物中弧菌数量为2.06×107CFU/mL,与对照组无显著差异(P>0.05)。

表2 免疫增强剂党参对仿刺参肠道内容物异养菌及弧菌数量的影响Table 2 Effect of Codonopsis pilosula as an immunopotentiator on the counts of heterotroph and Vibrio in intestinal content of Apostichopus japonicas
2.3 肠道细菌16S rDNA及16S rDNA V3区PCR扩增产物
按照试剂盒方法提取对照组和试验组中仿刺参肠道内容物细菌总DNA,细菌16S rDNA V3区经特异性引物扩增后,试验组与对照组分别得到单一明显的扩增片断,大小在230 bp左右,而阴性对照组则无条带(图1)。
2.4 肠道细菌DGGE图谱分析
2.4.1 序列统计分析
从表3中可以看出,投喂党参后仿刺参肠道内容物细菌有效序列数变化不显著(P>0.05),基本保持在45 000~50 000;而优质序列数之间差异显著(P<0.05),优质序列比例显著增加(P<0.05),试验组优质序列比例达97.57%,而对照组仅为80.22%。
2.4.2 在门的层次下对物种丰度进行统计分析
投喂党参后仿刺参肠道内容物中菌群结构发生了改变,优势菌群归属于变形菌门(Proteobacte⁃ria)、拟杆菌门(Bacteroidetes)和疣微菌门(Verru⁃comicrobia);其中拟杆菌门(21.4%)和变形菌门(28.1%)的丰度提高较多,而对照组仅有8.8%和25.1%;放线菌门(Actinobacteria)(1.2%)和疣微菌门(Verrucomicrobia)(39.1%)丰度降低,对照组为1.8%和57.4%(表4)。
2.4.3 Beta多样性统计分析
投喂党参后仿刺参肠道微生态环境发生了改变,群落间物种变化不同。通过主坐标PCoA分析获知,物种在群落间的变化情况及变化率如图2所示,多样性系数范围在14.91%~15.47%、15.47%~16.21%、14.91%~16.21%。
2.4.4 聚类分析
电泳图谱经聚类分析后如图3所示,不同位置的条带表示不同的细菌菌属。从图中可看出,仿刺参肠道内存在丰富的物种菌群,与对照组样品相比较,试验组样品中嗜血杆菌属(Haemophi⁃lus)、厌氧细杆菌属(Anaerofilum)条带颜色发生明显变化,而放线菌属(Actinomyces)、肉杆菌属(Atopostipes)等的条带仅亮度加深,说明含量增多,衣原体属(Chlamydia)、微单胞菌属(Parvi⁃monas)等的条带则变化不明显,故认为党参可改变仿刺参肠道内菌群结构。聚类分析显示试验组与对照组样品肠道菌群结构相似性系数为0.97。
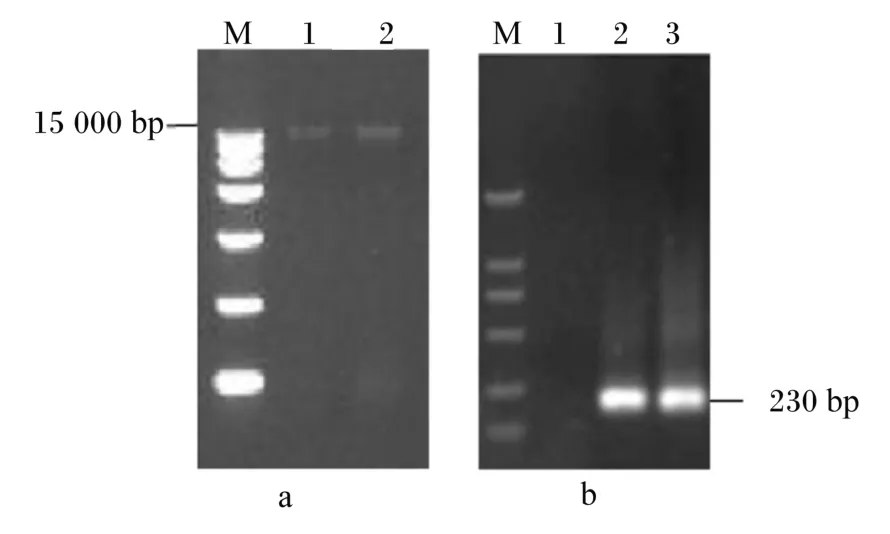
图1 PCR扩增产物琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of PCR amplification products
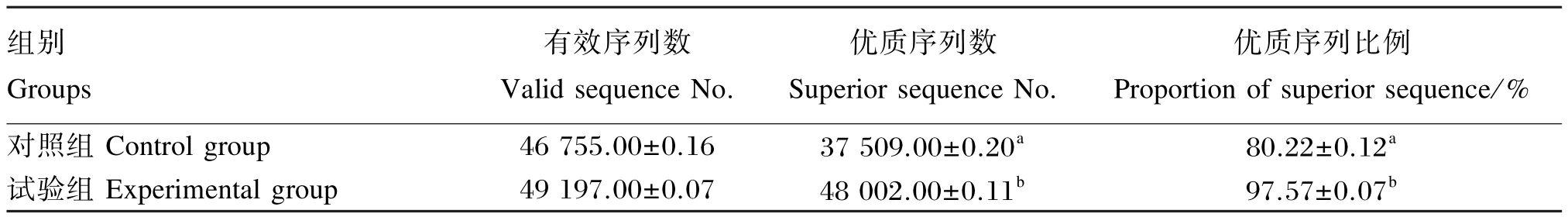
表3 序列数统计Table 3 Statistics of sequence No.
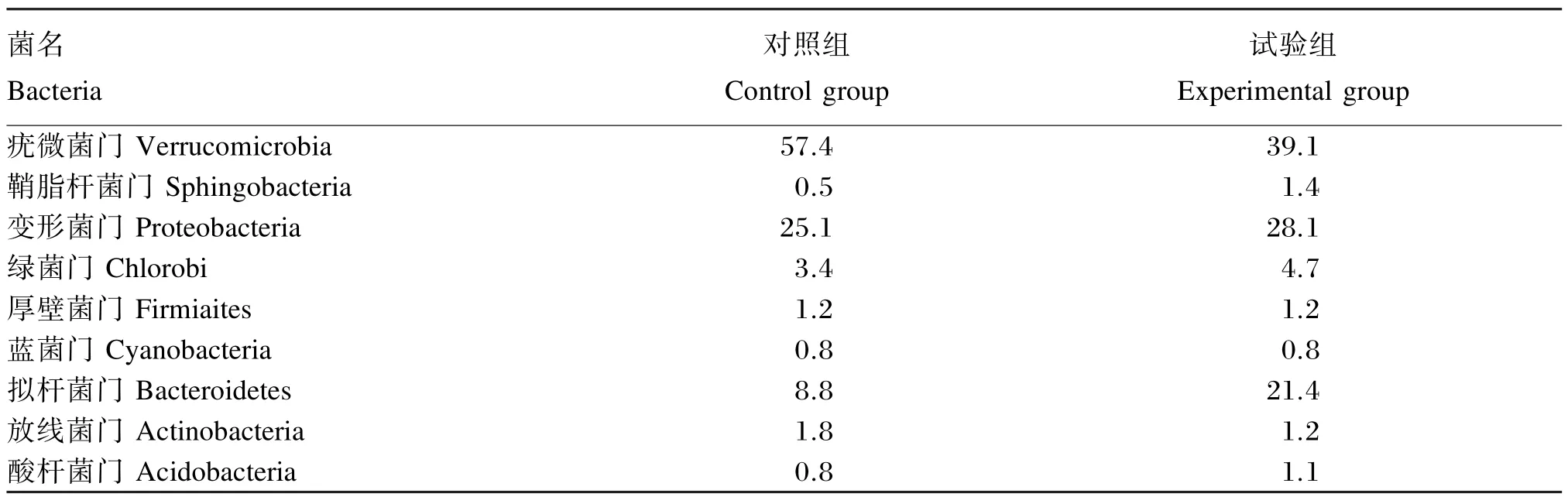
表4 丰度统计Table 4 Statistics of abundance %

图2 PCoA分析中2D PCoA图(多样性百分比)Fig.2 2D PcoA graph in PCoA anlysis(percentage of diversity)

图3 聚类分析heatmap图(左:对照组;右:试验组)Fig.3 Heatmap graph of cluster analysis (left:control group;right:experimental group)
3 讨 论
3.1 免疫增强剂党参对仿刺参肠道细菌数量的影响
机体各个部分、各个器官都是一个整体,肠道在这个整体中占有重要位置,不但是营养吸收的主要部位,还是抵御病原微生物的主要屏障。许多疾病的发生都是肠道功能紊乱所致,故将肠道功能维持在最佳水平是提高机体机能、降低动物疾病等的重要手段之一[12]。维持肠道功能涉及众多方面,如肠道相关淋巴样组织、肠道黏膜物质的分泌或表达、肠道抗氧化能力以及肠道菌群结构的变化等[2,12-13]。肠道菌群是肠道黏膜屏障的重要组成部分,在肠道免疫系统中发挥双重作用[14]。张红梅等[15]研究发现,甘露寡聚糖可显著抑制鲤鱼(Cyprinus carpio L.)肠道大肠杆菌的增殖,促进乳酸菌和双歧杆菌(Bifidobacterium)的增殖。杨世平等[16]发现,干酵母与活酵母均能显著减少对虾肠道内细菌总数、弧菌数量。Hoseinifar等[17]发现,啤酒酵母使得欧鳇(Huso huso)幼鱼肠道异养菌数量与空白组差异不显著,而乳酸菌数量则显著增加。宫魁等[18]投喂仿刺参全营养破壁酵母后发现,可培养菌群数量与对照组相较减少,并可显著抑制弧菌菌群的增殖,同时也对乳酸菌的增殖也表现出一定的抑制作用。这说明肠道内不同菌群对外源物质的应用表现出不同的反应,体现了研究的意义。本研究结果显示,养殖期间党参免疫增强剂有效地增强了仿刺参机体的免疫力,仿刺参成活率达到100%,并在提高特定生长率的同时降低了饵料系数,与对照组比较差异显著;而且,党参免疫增强剂能够显著增加仿刺参肠道内异养菌数量,而弧菌数量相对减少,呈现了抑制弧菌菌群繁殖的现象,这可能与党参的组成成分相关。党参中含有丰富的多糖、酚等营养成分和某些未知的促生长因子,为肠道内微生物提供了丰富的营养生存环境,参与机体菌群代谢,在有益菌有效增殖的同时增强了与有害菌的竞争力,主要控制了有害弧菌的繁殖,从而调控了机体菌群结构,呈现了有益的效果,促进了肠道对营养物质的吸收。鉴于肠道有益菌和有害菌的平衡对维护机体健康的重要性,党参免疫增强剂的投喂时间及投喂量还需进一步深入研究,以获得相关性及其周期变化规律。
3.2 用DGGE图谱分析免疫增强剂党参对仿刺参肠道菌群结构的影响
从肠道系统研究病害防治技术是解决实际应用问题的重要途径之一。仿刺参肠道系统除营养、免疫方面的重要性之外,夏眠期后的复苏也随着肠道系统的恢复而正常工作[19]。早期研究报道,通过传统培养法和16S rDNA技术获得了海参消化道内容物的细菌多样性和细菌群落组成[20-21],然而,传统培养法无法详细获取仿刺参消化道细菌群落的全面信息。PCR⁃DGGE技术是近年来国内外研究动物胃肠道微生物组成及结构变化最常用的方法[22-24]。本研究采用该技术,更加全面地揭示免疫增强剂对仿刺参消化道内容物的细菌群落组成的影响。结果分析发现,免疫增强剂党参能够在有效序列数未发生显著变化的情况下显著增加其中优质序列的比例,可能是因为党参的多营养成分能够有效促进仿刺参肠道内优势菌的繁殖,抑制有害菌的增长,对微生物序列的增殖表达呈现了一种积极的作用。
有关黑海参(Halodeima atra)肠道内容物菌群的16S rDNA序列分析表明,主要菌群包括α-变形菌、β-变形菌、γ-变形菌、噬纤维菌-黄杆菌-拟杆菌群(Cytophaga⁃Flavobacterium⁃Bacteriodes)以及放线菌[21]。变形菌门是表型和种系发生最为丰富多样的一个门。高菲等[11]研究发现,仿刺参前肠、中肠、后肠内容物的优势菌群均为γ-变形菌,且仿刺参消化道中可培养细菌中的92.7%也属于γ-变形菌[20]。有关的研究表明,凡纳滨对虾、日本囊对虾(Marsupenaeus japonicas)和中国明对虾(Fenneropenaeus chinensis)的肠道优势菌群也属于γ-变形菌[25-26]。一些海水养殖鱼类如青石斑鱼、虹鳟(Oncorhynchus mykiss)、大西洋鲑以及暗纹东方鲀(Takifugu obscures)消化道的优势菌属于变形菌门[12-13,22,27]。与这些报道结果相似,本研究中仿刺参肠道内容物优势菌群也包含有变形菌门(其中包括α-变形菌、γ-变形菌、δ-变形菌),这可能是党参的多重营养成分适合变形菌的繁殖代谢,为变形菌的加速生长提供了更好的生存环境。应用免疫增强剂党参对仿刺参肠道内容物中优势菌群种类的影响不显著,差异性主要体现在菌群的丰度变化上。与对照组比较,试验组仿刺参肠道内容物中变形菌门和拟杆菌门的丰度增高,而疣微菌门、放线菌门和厚壁菌门的丰度降低。对DGGE丰度信息的分析更能全面地获得仿刺参肠道细菌群落的组成,反映出应用党参后发生的有益影响。在仿刺参肠道系统菌群组成的研究中,共有菌种(尤其是丰度存在明显差异的菌种以及各自的特异菌种)可能是了解仿刺参养殖营养摄食、揭示仿刺参与环境菌群组成之间相互联系的关键点。本研究结果正是体现了免疫增强剂党参对仿刺参营养摄食的影响,从肠道菌群上寻找切入点,其深入探讨仍在进行中。
投喂免疫增强剂党参后,仿刺参肠道微生态环境发生了改变,细菌种类和数量发生了变化,有益菌数量的增加提高了肠道内的有益环境,有益于细菌的繁殖代谢。Beta多样性是基于群落结构比较多样本之间的差别,肠道中物种的组成沿肠道环境梯度在群落间发生变化,反映了物种对环境的异质性。本试验中采用的PCoA是一种对多维数据进行降维,从而提取出数据中最主要的元素和结构的方法。在本试验中对照组和试验组的不同条件即是党参免疫增强剂的给予,通过图2中横纵坐标的百分比即可以看出环境影响因素和样品之间的区别及相似性,从而反映免疫增强剂党参在改变肠道环境的情况下对仿刺参肠道菌群多样性的作用效力。免疫增强剂党参对仿刺参肠道微生态环境的改变体现了物种的异质性及多样性,多样性变化系数范围在14.91%~15.47%、15.47%~16.21%、14.91%~16.21%。多样性变化系数范围说明了样品中物种对环境产生的差异性,来自同一类环境样品的细菌群落结构也可能存在差距。PCoA分析结果说明,免疫增强剂党参未显著影响物种对环境变化产生的异质性,但是对物种群落结构丰度具有显著影响。本研究中DGGE电泳图谱在属水平上聚类后形成26个族(heatmap图),反映出试验组与对照组样品之间的相似性。如图3所示,对照组与试验组样品的相似性系数很高,达到0.97。此外,与本试验获得序列亲缘关系较近的细菌还有未培养细菌,如Aphingobium、Subdoligranulum等,尚难以分析其功能,这与高菲等[11]的结果相似。在今后的研究中应对优势菌群的单一序列需进行深入分析,发现免疫增强剂对仿刺参肠道细菌群落结构在时间或空间上的动态变化,结合大片段基因组文库等信息发现新的序列或功能基因,进而获得仿刺参肠道细菌群落在营养免疫方面的生理生化作用。
4 结 论
①免疫增强剂党参可增加仿刺参肠道内容物异养菌数量,降低弧菌数量,产生促进有益菌繁殖的效果。
②免疫增强剂党参可改变仿刺参肠道内容物细菌菌群丰度,增加优质序列比例,影响肠道菌群对环境改变产生的异质性。
③免疫增强剂党参未改变仿刺参肠道细菌亲缘关系,相似性仍达0.97。
致谢:
感谢山东省海水养殖病害防治重点实验室的刁菁博士对文稿提出的宝贵意见!
参考文献:
[1] 杨希山.肠道免疫学[J].国外医学:消化系疾病分册,1995,15(1):25-27.
[2] 武庆斌.肠道菌群与肠上皮细胞和肠道免疫系统的相互作用机制[C]//第六届全国儿科微生态学学术会议暨儿科微生态学新进展学习班资料汇编.北京:中华预防医学会,2008:15-18.
[3] 阳钢.几种微生态制剂对刺参(Apostichopus japoni⁃cus)养殖水体及刺参肠道菌群结构的影响[D].硕士学位论文.青岛:中国海洋大学,2012.
[4] SIMPSON J,MCCRACKEN V J,WHITE B A,et al.Application of denaturant gradient gel electrophoresis for the analysis of the porcine gastrointestinal microbi⁃ota[J].Journal of Microbiological Methods,1999,36 (3):167-169.
[5] AMANN R I,LUDWIG W,SCHLEIFER K H.Phylo⁃ genetic identification and in situ detection of individual microbial cells without cultivation[J].Microbiological Reviews,1995,59(1):143-169.
[6] VAN DER GAST C J,KNOWLES C J,WRIGHT M A,et al.Identification and characterisation of bacterial populations of an in⁃use metal⁃working fluid by phe⁃notypic and genotypic methodology[J].International Biodeterioration&Biodegradation,2001,47(2):113-123.
[7] MUYZER G,DE WAAL E C,UITTERLINDEN A G.Profiling of complex microbial populations by dena⁃turing gradient gel electrophoresis analysis of polymer⁃ase chain reaction⁃amplified genes coding for 16S rRNA[J].Applied and Environmental Microbiology,1993,59(3):695-700.
[8] HOVDA M B,LUNESTAD B T,FONTANILLAS R,et al.Molecular characterisation of the intestinal micro⁃biota of farmed Atlantic salmon(Salmo salar L.)[J].Aquaculture,2007,272(1/2/3/4):581-588.
[9] ZHOU Z G,LIU Y C,SHI P J,et al.Molecular char⁃acterization of the autochthonous microbiota in the gastrointestinal tract of adult yellow grouper(Epi⁃nephelus awoara)cultured in cages[J].Aquaculture,2009,286(3/4):184-189.
[10] 罗鹏,胡超群,张吕平,等.凡纳滨对虾海水养殖系统内细菌群落的PCR⁃DGGE分析[J].中国水产科学,2009,16(1):32-38.
[11] 高菲,孙慧玲,许强,等.刺参消化道内含物细菌群落组成的PCR⁃DGGE分析[J].中国水产科学,2010,17(4):671-680.
[12] 韩立丽,王建发,王凤龙,等.黄芪多糖对肠道免疫功能影响的研究进展[J].中国畜牧兽医,2009,36 (8):133-135.
[13] 黄玉章,林旋,王全溪,等.黄芪多糖对罗非鱼肠绒毛形态结构及肠道免疫细胞的影响[J].动物营养学报,2010,22(1):108-116.
[14] 汪婷婷,孙永欣,徐永平,等.多糖类免疫增强剂对海参肠道菌群的影响[J].饲料工业,2008,9(4):19-20.
[15] 张红梅,张磊,姜会民.甘露寡聚糖对生长期鲤鱼生长性能及肠道菌群的影响[J].中国饲料,2003(9):22-23.
[16] 杨世平,吴灶和,简纪常.饲料中添加沼泽生红冬孢酵母对凡纳滨对虾消化酶及肠道微生物的影响[J].水产科学,2011,30(7):391-394.
[17] HOSEINIFAR S H,MIRVAGHEFI A,MERRIFIELD D L.The effects of dietary inactive brewer’s yeastSaccharomyces cerevisiae var.ellipsoideus on the growth,physiological responses and gut microbiota of juvenile beluga(Huso huso)[J].Aquaculture,2011,318(1/2):90-94.
[18] 宫魁,王宝杰,刘梅,等.全营养破壁酵母对仿刺参非特异性免疫及肠道菌群的影响[J].中国水产科学,2012,19(4):641-646.
[19] 王天明.刺参Apostichopus japonicus(Selenka)夏眠分子机理的基础研究[D].博士学位论文.青岛:中国科学院研究生院,2011.
[20] 孙奕,陈騳.刺参体内外微生物组成及其生理特性的研究[J].海洋与湖沼,1989,20(4):300-307.
[21] WARD⁃RAINEY N,RAINEY F A,STACKE⁃BRANDT E.A study of the bacterial flora associated with Holothuria atra[J].Journal of Experimental Ma⁃rine Biology and Ecology,1996,203(1):11-26.
[22] KIM D H,BRUNT J,AUSTIN B.Microbial diversity of intestinal contents and mucus in rainbow trout(On⁃corhynchus mykiss)[J].Journal of Applied Microbiol⁃ogy,2007,102(6):1654-1664.
[23] KNAPP B A,SEEBER J,PODMIRSEG S M,et al.Molecular fingerprinting analysis of the gut microbiota of Cylindroiulus fulviceps(Diplopoda)[J].Pedobio⁃logia,2009,52(5):325-336.
[24] LIU H D,LIU M,WANG B J,et al.PCR⁃DGGE anal⁃ysis of intestinal bacteria and effect of Bacillus spp.on intestinal microbial diversity in kuruma shrimp(Mar⁃supenaeus japonicus)[J].Chinese Journal of Ocean⁃ology and Limnology,2010,28(4):808-814.
[25] 杨莺莺,李卓佳,林亮,等.人工饲料饲养的对虾肠道菌群和水体细菌区系的研究[J].热带海洋学报,2006,25(3):53-56.
[26] 李可.对虾养殖环境微生物多样性分析和微生态制剂的研究与应用[D].博士学位论文.厦门:厦门大学,2007:21-49.
(责任编辑 菅景颖)
[27] YANG G M,BAO B L,PEATMAN E,et al.Analysis of the composition of the bacterial community in puff⁃er fish Takifugu obscurus[J].Aquaculture,2007,262 (2/3/4):183-191.
Effect of Codonopsis pilosula as an Immunopotentiator on Intestinal Bacterial Community Composition of Apostichopus japonicus
FAN Ying LI Le YU Xiaoqing LIU Enfu LI Tianbao∗XU La YE Haibin
(Marine Biology Institute of Shandong Province,Key Laboratory for Disease Control in Mariculture of Shandong Province,Qingdao 266002,China)
∗Corresponding author,professor,E⁃mail:ltb1601@126.com
Abstract:By plate counting method and polymerase chain reaction(PCR)⁃denaturing gradient gel electropho⁃resis(DGGE)technology,the effect of Codonopsis pilosula as an immunopotentiator on intestinal bacterial community composition of Apostichopus japonicas was investigated.Apostichopus japonicas with the initial body weight of(18.00±2.00)g were randomly divided into 2 groups(control group and experimental group)with 6 replicates per group and 12 Apostichopus japonicas per replicate.Apostichopus japonicas in the control group were fed a diet which were formulated using sea mud and Sargassum thunbergii powder with the mass ra⁃tio of sea mud to Sargassum thunbergii ratio was 1∶1,while those in the experimental group were fed the diet adding Codonopsis pilosula with the quantity of 2%Sargassum thunbergii powder weight.The feeding trial las⁃ted for 28 days.The results showed that immunopotentiator⁃Codonopsis pilosula could significantly promote the special growth rate(P<0.05),reduce the feed conversion ratio(P<0.05),and increase the count of hetero⁃trophic in intestinal content of Apostichopus japonicas(P<0.05).Sequence statistics showed that the propor⁃tion of superior sequence was significantly increased after feeding Codonopsis pilosula(P<0.05),which in ex⁃perimental group was 97.57%and that in control group was only 80.22%.Beta⁃diversity analysis reported that the intestinal microenvironment of Apostichopus japonicas was changed after feeding Codonopsis pilosula,and the rages of coefficient variation were 14.91%to 15.47%,15.47%to 16.21%,and 14.91%to 16.21%.A⁃bundance analysis showed that the abundances of Proteobacteria and Bacteroidetes were increased,but the a⁃bundances of Verrucomicrobia,Actinobacteria and Firmiaites were decreased after feeding Codonopsis pilosula.The similarity coefficient of intestinal bacterial community composition between control group and experimental group was 0.97 by cluster analysis.It is concluded that Codonopsis pilosula as an immunopotentiator can im⁃prove the specific growth rate,reduce the feed conversion ratio,increase the count of heterotroph and the a⁃bundance of dominant bacteria in intestine,and optimize the intestinal microenvironment of Apostichopus ja⁃ponicus.[Chinese Journal of Animal Nutrition,2015,27(2):638⁃646]
Key words:immunopotentiator;Codonopsis pilosula;Apostichopus japonicus;intestine;bacterial communi⁃ty;DGGE
通信作者:∗李天保,研究员,E⁃mail:ltb1601@126.com
作者简介:樊 英(1980—),女,山东荣成人,助理研究员,硕士,研究方向为水产病害防治。E⁃mail:fy_fy123@126.com
基金项目:山东省现代农业产业技术体系刺参产业创新团队建设项目(SDAIT⁃08);山东省科技发展计划项目(2012YD10016);海洋公益性行业科研专项经费项目(201305005);“十二五”科技支撑计划项目(2011BAD13B03)
收稿日期:2014-09-16
doi:10.3969/j.issn.1006⁃267x.2015.02.037
文章编号:1006⁃267X(2015)02⁃0638⁃09
文献标识码:A
中图分类号:S917.1
