营养素对畜禽炎症表观遗传学的调控及其机制
2016-01-19刘艳利姚军虎杨小军西北农林科技大学动物科技学院杨凌712100
申 静 刘艳利 高 康 姚军虎 杨小军(西北农林科技大学动物科技学院,杨凌712100)
营养素对畜禽炎症表观遗传学的调控及其机制
申 静 刘艳利 高 康 姚军虎 杨小军∗
(西北农林科技大学动物科技学院,杨凌712100)
摘 要:炎症是动物机体对病原菌、损伤组织和刺激物等产生的有害刺激做出的一种生理性应答。炎症反应可通过调节多种炎症介质及信号通路最终影响炎症因子的表达。表观遗传学涉及非DNA序列改变引起的可遗传变化,主要包括DNA甲基化、组蛋白修饰和非编码RNA表达调控。表观遗传修饰可通过影响炎症反应中相关基因的表达来调节炎症反应,饲粮中能够影响表观遗传学修饰过程的营养素可调节炎症反应。本文主要综述了营养素调控炎症的表观遗传学机制———DNA甲基化和组蛋白修饰。
关键词:营养素;炎症;DNA甲基化;组蛋白修饰;抗炎
炎症是活体组织对损伤因子所发生的防御反应。炎症反应分为急性和慢性2种,急性炎症由血浆和白细胞渗出到损伤组织所引起,抗原的持续存在则引发为慢性炎症。研究表明,慢性炎症为癌症的发生创造微环境并参与其发展进程[1]。炎症反应通过复杂的信号通路和特异基因的表达来执行功能[2],激活的特异基因主要参与抗菌、免疫反应、组织修复和重塑等过程[3]。
表观遗传是由非DNA序列改变引起的表型的可遗传变化,其机制包括DNA甲基化、组蛋白修饰和非编码RNA表达调控等[4]。表观遗传学修饰参与了许多癌症发生发展过程中细胞分化相关基因的表达。自身免疫病与肿瘤疾病随年龄增长而高发的潜在机制可能是由表观遗传调节。CpG位点的不同甲基化状态、单等位基因的沉默及其他表观遗传调控机制与炎症反应关键基因的表达有密切联系[5]。核转录因子κB(NF⁃κB)、叉头型转录因子3(forkhead box P3,FOXP3)、干扰素调控因子(interferon regulatory factor,IRF)以及信号转导和转录活化蛋白(signal transduction and activator of transcription,STAT)家族的表观遗传学修饰包括DNA甲基化和组蛋白修饰,在调控炎症因子表达过程中起重要作用[2]。
营养表观遗传学主要研究营养物质在不改变DNA序列的情况下影响基因组表达模式变化,并在细胞传代、分化中进行信息传递的新兴交叉学科。研究表明,营养素可以通过调节表观遗传学修饰来影响基因表达,进而产生表型差异[6]。
本文重点从DNA甲基化和组蛋白修饰2个方面阐述炎症反应的表观遗传学调控以及在营养素调控炎症中的作用。
1 炎症反应
1.1 炎症介质
组织细胞的感染激活了炎症反应,首先识别感染的是模式识别受体(pattern recognition recep⁃tor,PRRs),包括Toll样受体(Toll⁃like receptors,TLRs)、RIG⁃Ⅰ样受体(RIG⁃Ⅰlike receptors,RLRs)、NOD样受体(NOD⁃like receptors,NLRs)和C型凝集素受体(C⁃type lectin receptors,CLRs)[7]。PRRs引起胞内信号级联放大效应,促使炎症介质转录表达,从而消除抗原和受感染细胞。但免疫系统的过度激活会引起免疫缺陷病、败血症和自身免疫病。参与炎症反应的介质主要包括趋化因子、细胞因子、血浆酶介质和脂质炎症介质等[8]。
具有促炎活性的细胞因子[如白细胞介素(IL)⁃1β、肿瘤坏死因子(TNF)⁃α和IL⁃6]主要在PRRs识别病原体关联的分子模式(pathogen⁃asso⁃ciated molecular patterns,PAMPs)后,通过NF⁃κB和丝裂原活化蛋白激酶(mitogen⁃activated protein kinases,MAPK)信号途径激活。这些因子能调节炎症组织的细胞凋亡,改变血管内皮渗透压,募集血细胞至发炎组织和促进急性期反应蛋白的产生。
1.2 炎症反应调节
炎症反应是一种包含多种炎症介质及信号通路的复杂过程,各功能机制协同作用又相互独立。这些机制在不同层面起作用,包括:组织免疫细胞的变化,信号通路的调节和基因表达水平的控制。故炎症调节机制可以分为:细胞特异、信号特异和基因特异。细胞特异机制作用于不同的细胞类型,包括对不同细胞的募集和活化;信号特异机制主要表现在不同的信号通路水平,比如关键转录因子NF⁃κB的活化;基因特异机制主要作用于单个基因及基因亚基,如IL⁃10和一些核受体可以负调控炎症基因特异亚基的转录。炎症反应很多是受基因特异机制调节的[2]。
在已知的PRRs中,最具特征的是TLRs。不同的TLRs可以引起不同的反应,如:TLR4通过识别脂多糖(LPS)来激活NF⁃κB、IRF3和MAPK的活性。TLR2通过识别革兰氏阳性菌的有效成分,如肽聚糖和脂磷壁酸,来激活NF⁃κB和MAPK的活性,但不能激活IRF3[9]。在多种促炎刺激下,NF⁃κB作为转录因子引起促炎基因的转录,包括:细胞因子、趋化因子和黏附分子等。
炎症因子的表达在转录水平主要通过转录因子和染色质的修饰来调节mRNA的表达,转录后水平通过对免疫基因转录本3′-非翻译区的修饰来调节其mRNA的稳定性及其翻译过程[10-12]。
2 炎症与表观遗传学调控
2.1 DNA甲基化与炎症
DNA甲基化是一种稳定且可逆的影响基因表达的表观遗传学调控机制。在DNA甲基转移酶(DNMT)1、DNMT3a、DNMT3b的作用下,CpG二联核苷酸中胞嘧啶的第5个碳原子上被选择性的添加甲基基团,形成5-甲基胞嘧啶(5mC),主要执行控制基因表达、细胞分化发育、染色质完整性、基因印记和X-染色体失活等功能[13]。甲基化的DNA通过募集甲基CpG结合蛋白2(MeCP2)或甲基连接蛋白(MBDs)识别5mC,参与基因的沉默。基因顺式作用元件的甲基化与基因表达的缺失相关,在基因沉默中起重要作用[14]。
DNA甲基化在炎症基因的表达中起重要调控作用。TLRs相关信号转导激活多种促炎细胞因子来介导炎症应答。在囊性纤维支气管上皮细胞应对细菌感染时,TLR2启动子区的低甲基化介导了前炎性细胞因子的高表达[15]。在低反应能力的人肠上皮细胞系中,LPS刺激下调的TLR4表达与其DNA的高甲基化相关[16]。TNF⁃α作为细胞因子引起黏附因子和趋化因子的产生来调节炎症。HL60和THP⁃1细胞受LPS刺激后,TNF⁃α的高表达与其去甲基化相关,但2种细胞的去甲基化程度不同[17]。在LPS刺激的巨噬细胞,TNF启动子区的2个特异CpG位点(-304和-245)的低甲基化与TNF mRNA高表达相关[5]。DNA甲基化可以通过调节转录因子和炎症因子的表达来调节炎症反应。
2.2 组蛋白修饰与炎症
真核细胞中,染色质是由DNA和组蛋白组成的,基础单位是核小体。核小体是由147 bp的DNA围绕核心组蛋白八聚体(各2分子的H2A、H2B、H3和H4)构成,另一种组蛋白(连接组蛋白H1)用来连接DNA和核小体。核小体的特殊结构决定了组蛋白修饰也参与调节基因的表达。核小体表面有多种修饰作用于染色质间的接触和非组蛋白的募集,这些修饰可通过调节染色质结构和DNA相关酶的募集来影响很多基本生物学进程(表1)[18]。
甲基化、乙酰化和磷酸化为最常见的核心组蛋白修饰。在机体受到刺激后,转录因子结合特异基因的启动子,起始组蛋白修饰,介导基因的表达或沉默。组蛋白乙酰化和磷酸化一般与基因激活相关,类泛素化、精氨酸瓜化和脯氨酸异构化一般与基因抑制相关,而甲基化和泛素化因修饰位置不同而表现基因抑制或激活,如:活跃的转录基因启动子区的特异位点和编码区域的5′末端富含组蛋白乙酰化;组蛋白H3K9的甲基化在启动子区是抑制基因转录的,但在编码区可促进基因表达[19]。
在严重的系统性炎症中,常染色质向异染色质的发展可逆地沉默了前炎性细胞因子的转录,此过程中NF⁃κB直接与H3K9甲基转移酶(G9a)作用引起异染色质化而沉默基因表达:异染色质相关蛋白1(heterochromatin protein 1,HP1)与G9a形成复合物与IL⁃1的启动子区结合;当敲除核转录因子RelB后,这种基因沉默现象被逆转[20]。TNF⁃α启动子区的DNA甲基化与H3K9甲基化相互作用使其表达沉默,低表达的TNF⁃α启动子区连接有G9a来甲基化H3K9,并为HP1的连接和募集DNMT3a或DNMT3b来提高启动子区CpG的甲基化水平提供平台[21]。

表1 组蛋白的修饰及其调节功能Table 1 Chromatin modifications and their regulated functions[18]
炎症反应中,一般炎症因子的激活表达与组蛋白乙酰化酶(HATs)活性的提高相关,而炎症基因的抑制表达与组蛋白去乙酰化酶(HDACs)活性的提高相关[22]。靶蛋白通过将HDACs募集到特异DNA序列来调控细胞因子的转录(表2)[23]。组蛋白乙酰化的增加与HDACs活性的降低相关,如:一些促炎性细胞因子(IL⁃1、IL⁃2、IL⁃8和 IL⁃12)的启动子区被迅速乙酰化而激活其转录,同时检测到HDACs活性的降低[23]。炎症反应中一些细胞因子和趋化因子的启动子区的H3乙酰化可以募集NF⁃κB到该区域,促进转录[24]。LPS引起的人肠上皮细胞的IL⁃8的激活与组蛋白H3的乙酰化和甲基化相关[25]。
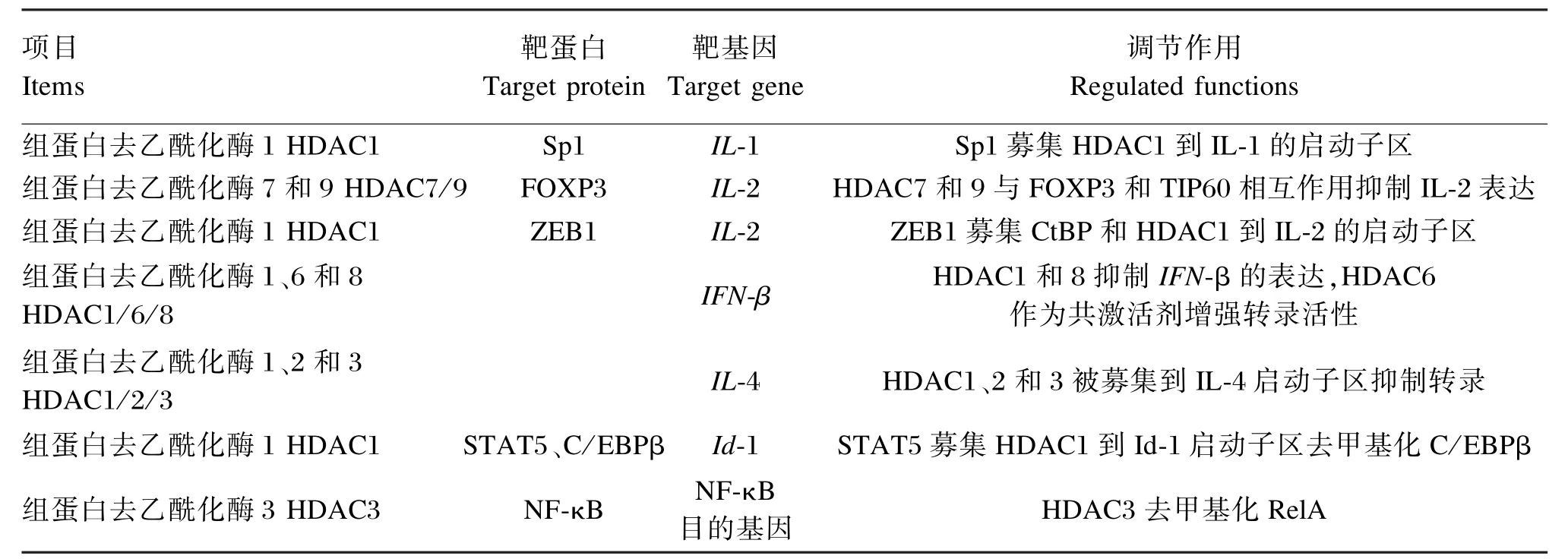
表2 HDACs参与细胞因子的转录调控Table 2 Participation of HDACs in the regulation of cytokines[23]
染色质结构可以动态调控炎症因子的表达,染色质重塑复合物通过改变核小体与DNA的接触改变与此染色质相关DNA的可接近程度来调节转录[26]。染色质重塑复合物通常认为在募集到靶基因启动子区的过程中被调控。但有研究表明,在LPS刺激的巨噬细胞,染色质修饰复合物(BAF)可以在被募集到TLR4靶基因后被钙调蛋白调节[27]。人早幼粒白血病细胞HL⁃60在分化成单核细胞过程中,受LPS刺激诱导的前炎性细胞因子IL⁃6的表达受其染色质结构的调节[28]。
3 抗炎与表观遗传学调控
炎症反应是机体应对感染的正常反应,但是过度炎症会引起自身免疫病、神经退行性疾病和癌症等。当前有效的抗炎药物包括阿莫西林和一些非类固醇的药物等。新的抗炎疗法包括抗细胞因子和阻碍酶活性的小分子。另外一些现行或正在发展的抗炎物质有:抑制素、组蛋白去乙酰化酶抑制剂(HDACi)和miRNAs等[29],抗炎的最终目标是降低炎症因子的表达。
HDACs可去除乙酰基,这与基因表达下降和沉默相关[30]。HDACi可抑制去乙酰基过程来促进转录,常用的HDACi有曲古抑菌素A(trichosta⁃tin A,TSA)和丁酸盐等。有研究表明,TSA可以增强NF⁃κB相关炎症基因的转录[31]。但有研究表明一些非组蛋白作为转录因子可通过可逆乙酰化来发挥作用,使HDACi抑制一些基因的表达[32]。
在全基因组基因表达分析中,有2%~9%的基因受HDACi的调控,激活基因与抑制基因的数量相等[33]。在LPS刺激的人外周血单核细胞中,激活HDACs抑制剂ITF2357可以减少IL⁃1、TNF⁃α和干扰素-γ(IFN⁃γ)的表达[34]。在结肠上皮细胞中,丁酸盐和TSA均可降低IL⁃8的表达并减少细胞分化[35]。
HDACi的不同作用反映了在不同的细胞内不同刺激下HDACs对特异基因选择性发挥作用,以及HDACi的非选择性发挥作用。
4 营养素调控炎症的表观遗传学修饰
饲粮营养素可以通过影响DNA甲基化和组蛋白修饰及相关酶的活性来调节基因表达。大量研究表明,多种营养素如氨基酸及其衍生物(蛋氨酸、丝氨酸、甜菜碱和视黄酸等)、维生素(叶酸、胆碱、维生素B2、维生素B6和维生素B12等)、矿物质元素(锌和硒等)和生物活性化合物(茶多酚、姜黄素、白藜芦醇、丁酸和乙醇等)参与表观遗传的调控[36]。研究表明,营养素可以通过改变表观遗传学修饰来调控炎症反应[37]。
4.1 通过DNA甲基化
饲粮营养因子中影响DNA甲基化的机制有2种:一是通过改变甲基供体的有效性,二是改变甲基化相关酶特别是DNMT的活性。DNA甲基化所需的甲基基团,动物机体不能合成,必须由饲粮提供。饲粮中S-腺苷-L-蛋氨酸(S⁃adenosyl⁃L⁃methionine,SAM)直接作为一种甲基反应供体。在DNMT的作用下将甲基基团转移至DNA,自身转化为S-腺苷-L-同型半胱氨酸(S⁃adenosyl⁃L⁃homocysteine,SAH)。DNA甲基化需DNMT1和SAM水平的维持,但可被SAH抑制。SAM的水平主要受饲粮叶酸和蛋氨酸水平影响,SAH水平受血清同型半胱氨酸(homocysteine,Hcy)浓度影响[38]。
饲粮供给的蛋氨酸,叶酸、胆碱和茶多酚作为循环过程中的底物影响DNA甲基化过程;维生素B2、维生素B6和维生素B12与矿物质元素锌和硒以及生物活性物质如染料木黄酮通过对循环过程的酶活性的调节来影响DNA甲基化过程[39]。
饲粮高蛋氨酸供给可以调节一碳单位代谢,引起CpG位点甲基化与特异基因表达的变化[40]。叶酸在体内以一碳基团转移酶辅酶-四氢叶酸(tetrahydrofolic,THF)的形式,携带一碳基团进行代谢和转运。在鸡脂肪细胞分化过程中,叶酸添加量为16 mg/L时,显著降低CCAAT/增强子结合蛋白-α(CCAAT/enhancer⁃binding protein α,C/EBPα)的基因表达,同时检测到其启动子区的甲基化水平比对照组高21.8%[41]。由于叶酸在动物体内的代谢过程受多种因素的影响,其作用具有基因和位点的特异性,且机体不同细胞、器官和组织,动物不同年龄以及叶酸的不同作用时间和剂量均会影响叶酸作用的发挥[42]。Hcy在体内不能合成只能通过饲粮提供的蛋氨酸转变而来。Hcy再甲基化过程的改变会影响DNA甲基化过程。小鼠中,添加硒降低了全基因组的甲基化水平,可能机制是Hcy转化为硒高半胱氨酸、胱硫醚等,从而降低转化为蛋氨酸的Hcy浓度[43]。
DNMT是DNA甲基化反应的关键酶。饲粮硒、染料木黄酮和绿茶多酚可以影响DNMT活性。DNMT1通常在DNA活化蛋白1(DNA⁃AP1)转录因子复合物上连接DNA,亚硒酸盐可以抑制AP1 与DNA的结合来降低DNMT1结合DNA的能力,进而降低DNA甲基化。茶多酚可以包裹DNMT1直接抑制DNMT1的活性,降低DNMT1甲基化DNA的能力。
在小鼠螺杆菌感染的胃癌模型中随胃癌的发展,组织叶酸与全基因组DNA甲基化水平降低,饲粮添加叶酸可以防止全基因组甲基化的降低,减少异常增生和黏膜炎症[44]。在小鼠的威尔森氏症模型中,青霉胺的螯合作用解除了铜对硫腺苷蛋氨酸水解酶的抑制作用,降低SAH水平,甜菜碱可提供甲基基团,两者共同作用可提高全基因组的甲基化水平,降低炎症反应[45]。
4.2 通过组蛋白修饰
饲粮营养素主要通过2种方式来影响组蛋白的修饰:一是改变组蛋白修饰相关酶的活性;二是改变酶反应中底物的浓度。组蛋白修饰相关酶中主要影响组蛋白乙酰化水平的是HATs和HDACs,主要影响组蛋白甲基化水平的是组蛋白甲基转移酶(histone methyltransferases,HMT)和组蛋白去甲基化酶(histone demethylases,HDM)[46]。
饲粮中的生物活性物质染料木黄酮和茶多酚是HMT的抑制剂[36],姜黄素是HATs的抑制剂[47],锌可以影响HDACs的活性。HDACs是锌结合蛋白,它们的活性依赖于锌离子,分为4个级别(classⅠ、Ⅱ、Ⅲ和Ⅳ),classⅢ是非锌离子依赖的,但是烟酰胺腺嘌呤二核苷酸(NAD+)依赖的,classⅠ、Ⅱ和Ⅳ的抑制剂都有锌离子螯合基团[37]。叶酸调节的一碳单位代谢不仅为DNA甲基化提供甲基基团,同时为组蛋白的甲基化提供甲基基团。有研究表明,肉鸡11胚龄注射叶酸150 μg可以显著提高21和42日龄肉仔鸡脾脏中IL⁃4和IL⁃6启动子区的H3K4甲基化水平,同时显著降低了IL⁃2启动子区的紧密结构[48]。SAM 是HMT的反应底物,能够影响SAM浓度的饲粮因子均能影响组蛋白的甲基化过程。
用高糖处理小鼠6 h,可以提高NF⁃κB亚基p56的启动子区的H3K4水平,进而提高了IL⁃6的表达量[49]。饲粮抗炎物质如大豆多酚、染料木黄酮和醉茄素A可以降低转录因子FRA1和NF⁃κB的活性,同时降低组蛋白H3的磷酸乙酰化水平和提高DNA的甲基化水平来改变IL⁃6启动子区的核小体构型,从而使其基因表达沉默[37]。
5 小 结
DNA甲基化通过调节炎症因子及其相关转录因子的甲基化水平来调节其基因表达,进而调节炎症反应。组蛋白修饰通过改变与其相连的DNA的可接近程度,来动态调节炎症因子的表达。近年来,众多研究运用表观遗传学作用机制来研发和发展抗炎制剂。饲粮营养素可影响表观遗传学修饰过程来调节炎症反应。虽然炎症反应可通过表观遗传学调控但具有细胞特异性和刺激特异性,故不同细胞应对不同刺激时产生的稳定表观遗传学标记及靶基因仍需进一步进行研究。由于营养素在体内代谢的复杂过程,其影响表观遗传学修饰进而发挥抗炎作用的机制仍需深入研究。
参考文献:
[1] LIN W W,KARIN M.A cytokine⁃mediated link be⁃tween innate immunity,inflammation,and cancer[J].The Journal of Clinical Investigation,2007,117(5):1175-1183.
[2] MEDZHITOV R,HORNG T.Transcriptional control of the inflammatory response[J].Nature Reviews Im⁃munology,2009,9(10):692-703.
[3] MEDZHITOV R.Origin and physiological roles of in⁃flammation[J].Nature,2008,454(7203):428-435.
[4] GIBNEY E R,NOLAN C M.Epigenetics and gene ex⁃pression[J].Heredity,2010,105(1):4-13.
[5] WILSON A G.Epigenetic regulation of gene expres⁃sion in the inflammatory response and relevance to common diseases[J].Journal of Periodontology,2008,79(8S):1514-1519.
[6] FRAGA M F,BALLESTAR E,PAZ M F,et al.Epige⁃netic differences arise during the lifetime of monozy⁃gotic twins[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102 (30):10604-10609.
[7] TAKEUCHI O,AKIRA S.Pattern recognition recep⁃tors and inflammation[J].Cell,2010,140(6):805-820.
[8] 周光炎.免疫学原理[M].上海:上海科学技术出版社,2007.
[9] AKIRA S,UEMATSU S,TAKEUCHI O.Pathogenrecognition and innate immunity[J].Cell,2006,124 (4):783-801.
[10] IVANOV P,ANDERSON P.Post⁃transcriptional regu⁃latory networks in immunity[J].Immunological Re⁃views,2013,253(1):253-272.
[11] ANDERSON P.Post⁃transcriptional regulons coordi⁃nate the initiation and resolution of inflammation[J].Nature Reviews Immunology,2010,10(1):24-35.
[12] MINO T,TAKEUCHI O.Post⁃transcriptional regula⁃tion of cytokine mRNA controls the initiation and res⁃olution of inflammation[J].Biotechnology and Genet⁃ic Engineering Reviews,2013,29(1):49-60.
[13] HERMANN A,GOWHER H,JELTSCH A.Biochem⁃istry and biology of mammalian DNA methyltrans⁃ferases[J].Cellular and Molecular Life Sciences CMLS,2004,61(19/20):2571-2587.
[14] HATADA I,FUKASAWA M,KIMURA M,et al.Ge⁃nome⁃wide profiling of promoter methylation in hu⁃man[J].Oncogene,2006,25(21):3059-3064.
[15] SHUTO T,FURUTA T,OBA M,et al.Promoter hy⁃pomethylation of toll⁃like receptor⁃2 gene is associated with increased proinflammatory response toward bac⁃terial peptidoglycan in cystic fibrosis bronchial epithe⁃lial cells[J].The FASEB Journal,2006,20(6):782-784.
[16] TAKAHASHI K,SUGI Y,HOSONO A,et al.Epige⁃netic regulation of TLR4 gene expression in intestinal epithelial cells for the maintenance of intestinal home⁃ostasis[J].The Journal of Immunology,2009,183 (10):6522-6529.
[17] SULLIVAN K E,REDDY A B M,DIETZMANN K,et al.Epigenetic regulation of tumor necrosis factor al⁃pha[J].Molecular and Cellular Biology,2007,27 (14):5147-5160.
[18] KOUZARIDES T.Chromatin modifications and their function[J].Cell,2007,128(4):693-705.
[19] VAKOC C R,MANDAT S A,OLENCHOCK B A,et al.Histone H3 lysine 9 methylation and HP1γ are as⁃sociated with transcription elongation through mamma⁃lian chromatin[J].Molecular Cell,2005,19(3):381-391.
[20] CHEN X P,EL GAZZAR M,YOZA B K,et al.The NF⁃κB factor RelB and histone H3 lysine methyltrans⁃ferase G9a directly interact to generate epigenetic si⁃lencing in endotoxin tolerance[J].The Journal of Bio⁃logical Chemistry,2009,284(41):27857-27865.
[21] EL GAZZAR M,YOZA B K,CHEN X P,et al.G9a and HP1 couple histone and DNA methylation to TNFα transcription silencing during endotoxin toler⁃ance[J].The Journal of Biological Chemistry,2008,283(47):32198-32208.
[22] BAYARSAIHAN D.Epigenetic mechanisms in in⁃flammation[J].Journal of Dental Research,2011,90 (1):9-17.
[23] VILLAGRA A,SOTOMAYOR E M,SETO E.His⁃tone deacetylases and the immunological network:im⁃plications in cancer and inflammation[J].Oncogene,2010,29(2):157-173.
[24] BARNES P J.Targeting the epigenome in the treat⁃ment of asthma and chronic obstructive pulmonary dis⁃ease[J].Proceedings of the American Thoracic Socie⁃ty,2009,6(8):693-696.
[25] ANGRISANO T,PERO R,PELUSO S,et al.LPS⁃in⁃duced IL⁃8 activation in human intestinal epithelial cells is accompanied by specific histone H3 acetylation and methylation changes[J].BMC Microbiology,2010,10:172.
[26] BECKER P B,HÖRZ W.ATP⁃dependent nucleosome remodeling[J].Annual Review of Biochemistry,2002,71(1):247-273.
[27] LAI D Z,WAN M M,WU J,et al.Induction of TLR4⁃target genes entails calcium/calmodulin⁃dependent regulation of chromatin remodeling[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(4):1169-1174.
[28] POPLUTZ M K,WESSELS I,RINK L,et al.Regula⁃tion of the interleukin⁃6 gene expression during mono⁃cytic differentiation of HL⁃60 cells by chromatin re⁃modeling and methylation[J].Immunobiology,2014,219(8):619-626.
[29] DINARELLO C A.Anti⁃inflammatory agents:present and future[J].Cell,2010,140(6):935-950.
[30] EGGER G,LIANG G G,APARICIO A,et al.Epige⁃netics in human disease and prospects for epigenetic therapy[J].Nature,2004,429(6990):457-463.
[31] ZHONG H H,MAY M J,JIMI E,et al.The phospho⁃rylation status of nuclear NF⁃κB determines its associ⁃ation with CBP/p300 or HDAC⁃1[J].Molecular Cell,2002,9(3):625-636.
[32] TONG X,YIN L,GIARDINA C.Butyrate suppresses Cox⁃2 activation in colon cancer cells through HDAC inhibition[J].Biochemical and Biophysical Research Communications,2004,317(2):463-471.
[33] CHAMBERS A E,BANERJEE S,CHAPLIN T,et al.Histone acetylation⁃mediated regulation of genes in leukaemic cells[J].European Journal of Cancer,2003,39(8):1165-1175.
[34] LEONI F,FOSSATI G,LEWIS E C,et al.The histone deacetylase inhibitor ITF2357 reduces production of pro⁃inflammatory cytokines in vitro and systemic in⁃flammation in vivo[J].Molecular Medicine,2005,11 (1/2/3/4/5/6/7/8/9/10/11/12):1-15.
[35] HUANG N,KATZ J P,MARTIN D R,et al.Inhibition of IL⁃8 gene expression in Caco⁃2 cells by compounds which induce histone hyperacetylation[J].Cytokine,1997,9(1):27-36.
[36] 喻小琼,赵桂苹,刘冉冉,等.家禽营养与表观遗传学[J].动物营养学报,2013,25(10):2192-2201.
[37] SZARC VEL SZIC K,NDLOVU M N,HAEGEMAN G,et al.Nature or nurture:let food be your epigenetic medicine in chronic inflammatory disorders[J].Bio⁃chemical Pharmacology,2010,80(12):1816-1832.
[38] LI Y P,LIU Y,STRICKLAND F M,et al.Age⁃de⁃pendent decreases in DNA methyltransferase levels and low transmethylation micronutrient levels syner⁃gize to promote overexpression of genes implicated in autoimmunity and acute coronary syndromes[J].Ex⁃perimental Gerontology,2010,45(4):312-322.
[39] MCKAY J A,MATHERS J C.Diet induced epigenetic changes and their implications for health[J].Acta Physiologica,2011,202(2):103-118.
[40] WATERLAND R A.Assessing the effects of high me⁃thionine intake on DNA methylation[J].The Journal of Nutrition,2006,136(6):1706S-1710S.
[41] YU X Q,LIU R R,ZHAO G P,et al.Folate supple⁃mentation modifies CCAAT/enhancer⁃binding protein α methylation to mediate differentiation of preadipo⁃cytes in chickens[J].Poultry Science,2014,93(10):2596-2603.
[42] 支丽慧,李世召,杨小军,等.叶酸与DNA甲基化[J].动物营养学报,2013,25(5):951-958.
[43] DAVIS C D,UTHUS E O.Dietary folate and selenium affect dimethylhydrazine⁃induced aberrant crypt for⁃mation,global DNA methylation and one-carbon me⁃tabolism in rats[J].The Journal of Nutrition,2003,133(9):2907-2914.
[44] GONDA T A,KIM Y I,SALAS M C,et al.Folic acid increases global DNA methylation and reduces inflam⁃mation to prevent helicobacter⁃associated gastric canc⁃er in mice[J].Gastroenterology,2012,142(4):824-833.e7.
[45] MEDICI V,SHIBATA N M,KHARBANDA K K,et al.Wilson’s disease:changes in methionine metabo⁃lism and inflammation affect global DNA methylation in early liver disease[J].Hepatology,2013,57(2):555-565.
[46] 王海超,张乐颖,刁其玉.营养素对动物表观遗传的影响及其机制[J].动物营养学报,2014,26(9):2463-2469.
[47] KANG J H,CHEN J,SHI Y F,et al.Curcumin⁃in⁃duced histone hypoacetylation:the role of reactive ox⁃ygen species[J].Biochemical Pharmacology,2005,69 (8):1205-1213.
[48] 支丽慧.胚期叶酸调控肉仔鸡免疫功能的营养表观遗传机制[D].硕士学位论文.杨凌:西北农林科技大学,2014.
(责任编辑 王智航)
[49] EL⁃OSTA A,BRASACCHIO D,YAO D C,et al.Transient high glucose causes persistent epigenetic changes and altered gene expression during subsequent normoglycemia[J].The Journal of Experimental Med⁃icine,2008,205(10):2409-2417.
Epigenetic Modulations of Nutrients on Inflammation in Animals and Its Mechanism
SHEN Jing LIU Yanli GAO Kang YAO Junhu YANG Xiaojun∗
(College of Animal Science and Technology,Northwest A&F University,Yangling 712100,China)
∗Corresponding author,associate professor,E⁃mail:yangxj@nwsuaf.edu.cn
Abstract:Inflammation is a physiological response of animal body to detrimental stimuli induced by patho⁃gens,damaged tissue and stimulus.The inflammatory response is orchestrated by inflammatory cytokines,which can be regulated through inflammatory mediators and related signaling pathways.Epigenetics is the study of heriTable changes which are not caused by changes in the DNA sequence,including DNA methylation,his⁃tone modification and non⁃coding RNAs,etc.Nutrients can regulate inflammatory response,through altering epigenetic modification of the key inflammatory cytokines.This paper reviewed the mechanism of epigenetic modulations of nutrients on inflammation in animals,which were DNA methylation and histone modification.[Chinese Journal of Animal Nutrition,2015,27(2):383⁃390]
Key words:nutrient;inflammation;DNA methylation;histone modification;anti⁃inflammation
通信作者:∗杨小军,副教授,硕士生导师,E⁃mail:yangxj@nwsuaf.edu.cn
作者简介:申 静(1990—),女,河北石家庄人,硕士研究生,从事家禽营养研究。E⁃mail:shenjing2013@163.com
收稿日期:2014-09-30
doi:10.3969/j.issn.1006⁃267x.2015.02.008
文章编号:1006⁃267X(2015)02⁃0383⁃08
文献标识码:A
中图分类号:S816;Q953
