PMA-qPCR定量检测畜禽肉类中沙门菌活菌的研究
2016-01-18王文静
於 颖, 王文静, 陆 晔
PMA-qPCR定量检测畜禽肉类中沙门菌活菌的研究
於颖1,王文静2,陆晔2
(1. 东华大学化学化工与生物工程学院,上海 201620; 2. 上海市疾病预防控制中心,上海 200336)
摘要:目的将叠氮溴化丙锭(PMA)与实时荧光定量聚合酶链反应(qPCR)相结合定量检测畜禽肉类中活的沙门菌。方法通过优化光反应时间、PMA浓度等PMA作用条件,建立PMA-qPCR方法,构建重组质粒建立标准曲线,考察该方法的灵敏性、特异性,并将该方法用于定量检测未经增菌培养的畜禽肉类样品中的沙门菌。结果在PMA浓度为15 μg/mL、曝光5 min的条件下可完全抑制样品中死菌DNA的扩增。建立的定量标准曲线循环阈值(Ct值)与质粒标准品模板的拷贝数呈良好线性关系(r2=0.997 9),最低可检出10 拷贝/反应体系。所建立的PMA-qPCR方法最低可检出21 拷贝/μL沙门菌。采用PMA-qPCR检测人工染菌鸡肉样品,最低可检出103CFU/mL沙门菌。结论用PMA-qPCR方法可实现定量检测畜禽肉类样品中活的沙门菌,从而达到快速检测的目的。
关键词:沙门菌;活菌;叠氮溴化丙啶;荧光定量聚合酶链反应;畜禽肉类
Research on a quantitative method to detect viableSalmonellaby PMA-qPCR in livestock and poultry meatYUYing1,WANGWenjing2,LUYe2
.(1.CollegeofChemistryandBiochemistry,DonghuaUniversity,Shanghai201620,China; 2.ShanghaiMunicipalCenterforDiseaseControlandPrevention,Shanghai200336,China)
Abstract:ObjectiveTo enumerate Salmonella in meat of livestock and poultry rapidly and accurately by using propidium monoazide(PMA) combined with real-time fluorescence quantitation polymerase chain reaction(qPCR). MethodsThe light exposure time and the concentration of PMA were optimized to establish PMA-qPCR. The standard curve was established by standard plasmid. The sensitivity and specificity were investigated. This method was used for the quantitation determination of Salmonella in livestock and poultry meat. ResultsThe amplification of DNA derived from Salmonella dead cells could be inhibited without affecting the viable cells when PMA was at a dose of 15 μg/mL and exposed for 5 min. The cycle threshold values(Ct) and standard plasmid model cell copy number presented the satisfactory linear, and the correlation coefficient r2approached 0.997 9. This method could detect as low as 10 copies/reaction. The minimum detection level was 21 copies/μL by PMA-qPCR. In artificial chicken samples, PMA-qPCR could detect as low as 103CFU/mL. ConclusionsIt was possible to quantify viable Salmonella in meat of livestock and poultry by PMA-qPCR.
Key words:Salmonella; Viable bacterium; Propidium monoazide; Real-time fluorescence quantitation polymerase chain reaction; Livestock and poultry meat
沙门菌是导致食源性疾病主要的致病菌之一。我国由微生物引起的食源性疾病中,沙门菌占总数的10.2%,是导致食源性疾病的第2位病原菌,且在食品分类中以畜禽肉类样品的污染最为严重[1-2]。面对不断出现的食品安全问题,对食品中特别是畜禽肉类中的沙门菌进行准确、有效地检测,是控制这类食源性疾病发生并进行有效预防和监测的重要条件。
目前,许多分子检测技术如实时荧光定量聚合酶链反应(real-time quantitation polymerase chain reaction,qPCR)、基因芯片、逆转录聚合酶链反应(polymerase chain reaction,PCR)等用于食品中目标微生物的定量检测,相较传统培养法检测时效高,花费人力、物力较少[3]。但是大部分分子检测方法同时检测样品中活菌和死菌的DNA,因此不能区分食品样品中活菌和死菌,导致出现“假阳性”的结果,对实际监测工作意义不大。逆转录PCR等虽可检测活菌,但mRNA极不稳定,且对mRNA提取技术的要求非常高,阻碍了在食品样品检测中的应用。因此,在实际工作中仍依赖传统培养法进行检测。此外,另一类处于活的非可培养(viable but non-culturable, VBNC)状态的细菌[4]与普通细菌一样具有毒性和致病性,使用传统的分离培养方法容易漏检,因而对食品安全构成的威胁也不容忽视,亟需改进检测方法,对其进行有效的检测。
叠氮溴化丙锭(propidium monoazide,PMA)是一种与核酸具有亲和性的光敏性染料。它可穿过死亡细胞的破损细胞膜,在强光的诱导下与DNA形成牢固的共价结合,从而抑制DNA扩增;同时,游离的PMA可在强光作用下与溶液中的水分交联失活[5]。活细胞具有完整的细胞膜,PMA不能透过细胞膜与DNA反应。我们利用PMA对活/死细胞具有选择性的特性,将PMA与qPCR相结合检测沙门菌,对PMA作用于沙门菌的最佳曝光时间以及作用浓度进行摸索,并应用于畜禽肉类样品。通过建立针对样品中活的沙门菌检测方法,规避原先检测方法中出现假阳性和漏检的情况,开发快速、准确的活菌定量检测技术。
材料和方法
一、材料和试剂
1. 试验菌株本研究使用的菌株见表1。ATCC菌株购自美国标准生物品收藏中心,其余菌株为本实验室收集、鉴定、编号并保存的菌株。
2. 主要试剂和仪器LB培养液(上海市疾病预防控制中心试剂供应研究中心)、PMA(美国Biotium公司)、TaqMan®Environmental Master Mix 2.0(美国Life Technologies公司);mericon DNA Bacteria Kit(Qiagen公司)、PCR Premix TaqTM试剂(日本TaKaRa公司)、pMDTM18-T Vector Cloning Kit(日本TaKaRa公司)、ABI 7900HT荧光定量PCR仪(美国Life Technologies公司)、650 W卤素灯(德国OSRAM公司)、NanoDrop2000核酸蛋白仪[赛默飞世尔科技(上海)有限公司]。
表1实验菌株

类别菌株来源沙门菌 鼠伤寒沙门菌ATCC14028肠炎沙门菌ATCC49214非沙门菌阪崎肠杆菌ATCC51329大肠埃希菌ATCC25922铜绿假单胞菌ATCC27853副溶血弧菌ATCC17802金黄色葡萄球菌ATCC6538宋内志贺菌ATCC11060小肠结肠耶尔森菌Y1单增李斯特菌总68-88大肠埃希菌O157总75-86创伤弧菌总18-85
二、菌液制备
1. 沙门菌培养取鼠伤寒沙门菌标准菌株ATCC 14028接种LB培养液,置37℃培养至对数生长期,稀释后用营养琼脂平皿培养计数,得到终浓度为6.8×108CFU/mL的纯菌液。
2. 死细胞菌液 将已调整浓度的纯菌液(菌液浓度为6.8×108CFU/mL)进行热处理(水浴95℃,10 min)致死,冷却到室温,制成死细胞菌液;取1 mL热处理后的菌液涂布在营养琼脂平皿37℃培养24 h,营养琼脂平皿上无菌生长。
三、引物设计和探针制备
以沙门菌invA基因(GenBank: M90846.1)为特异性基因,由生工生物工程(上海)有限公司合成引物和探针,所采用的引物及探针序列见表2。

表2 引物与探针序列
四、细菌DNA提取
取1 mL菌液,10 625×g离心5 min弃上清,加入1 mL灭菌去离子水重悬沉淀,按照细菌DNA提取试剂盒的说明书提取细菌DNA。DNA模板保存于-20℃备用。
五、常规PCR及荧光定量PCR检测
1. 常规PCR反应体系反应总积体为20 μL。基因组DNA 2 μL作为模板,PCR Premix TaqTMMaster mix 10 μL,引物IM832-F和引物IM832-R终浓度为0.5 μmol/L,ddH2O补足至反应总体积。反应条件为94℃ 5 min预变性,94℃ 1 min变性,62℃ 30 s退火,72℃ 30 s延伸,共进行35个循环。
2. qPCR反应体系反应总积体为20 μL。基因组DNA 2 μL作为模板,TaqMan®Environ-mental Master mix 10 μL,引物invA-F和引物invA-R终浓度为0.75 μmol/L,探针invA-P终浓度为0.2 μmol/L,ddH2O补足至反应总体积。反应条件为95℃ 5 s,60℃ 30 s,共进行40个循环。每个样品设3个平行。用SDS 2.4软件分析结果。
六、PMA处理的条件
1. PMA储存液及工作液配制将PMA染料溶于200 μL 20%二甲基亚砜(dimethyl sulfoxide,DMSO)中制成5 μg/μL的储存液,置-20℃避光长期保存。将PMA储存液10倍稀释后作为工作液。
2. 最适PMA的浓度(1)PMA作用的最小浓度:取死菌液500 μL各9份,分别加入PMA工作液,终浓度分别为0、5.0、7.5、10.0、12.5、15.0、17.5、20.0和25.0 μg/mL,充分混匀,避光孵育10 min后,按照最佳曝光时间进行光反应;提取菌液DNA,经PCR扩增后,研究PMA完全抑制死细胞DNA扩增的最小浓度;(2)不影响活菌扩增的PMA的最大浓度:取活菌液500 μL各6份,分别加入PMA工作液,终浓度为0、10、15、20、25和40 μg/mL,充分混匀,避光孵育10 min后置650 W卤素灯下按照最佳曝光时间进行光反应;经PMA处理的菌液提取基因组DNA后用定量荧光PCR进行检测,研究PMA不影响活菌DNA扩增的最大浓度。
3. 最适曝光时间取死菌液500 μL各5份,加入PMA工作液,终浓度为15 μg/mL,充分混匀,避光孵育10 min,使PMA与样品充分反应。然后将样品平放于冰上,避免受热过度。置650 W卤素灯下分别照射1、3、5、7和10 min,样品距光源20 cm。另将不加入PMA的样品作为阳性对照。PMA处理后提取DNA,经PCR扩增,研究PMA处理的最佳曝光时间。
4. PMA对不同比例活菌/死菌的样品的检测效果 将活菌和死菌两种菌悬液按表3的比例进行混合,各取500 μL作为测试样品,加入PMA处理后提取DNA进行PMA-qPCR反应,同时以不加PMA处理的样品作为对照组。

表3 死菌液中活菌的添加比例 (CFU/mL)
七、方法学评价
1.标准曲线的建立根据沙门菌invA基因完整序列用Oligo 7.0软件设计含有特异性序列的目的片段,采用局部序列排比检索基本工具(basic local alignment search tool, BLAST)检查特异性。引物序列见表2。将含有invA基因的特异性靶序列连接到pMD18-T载体后,转入大肠埃希菌DH5α感受肽细胞中,筛选阳性克隆菌落,经PCR及测序[由生工生物工程(上海)有限公司完成]来鉴定片段序列。提取质粒DNA,用核酸蛋白仪测定质粒DNA的浓度。根据公式换算成基因的拷贝数。质粒DNA拷贝数(拷贝/μL)=DNA浓度/(片段大小×660)×NA(NA为阿伏伽德罗常数:6.02×1023)。将制备的沙门菌qPCR反应质粒标准品进行10倍梯度稀释至10-3~10-10,作为标准模板溶液进行荧光定量PCR反应,并绘制标准曲线。
2. PMA-qPCR的灵敏度将菌液作10倍梯度稀释至100、10-1、10-2、10-3、10-4、10-5、10-6、10-7分别进行优化条件后的PMA处理,再进行PMA-qPCR的灵敏度分析实验。实验重复3次。
3. PMA-qPCR的特异性取沙门菌2株、非沙门菌10株(见表1),经培养后的菌液各1 mL进行PMA-qPCR检测,做特异性分析。
4. 人工染菌样品检测取25 g鸡肉样品(已检测不含沙门菌)加入含有225 mL 胰酶大豆肉汤培养基(tryptone soya broth yeast, TSBY)的无菌均质袋中,置拍打式均质器上均质2 min,作为鸡肉匀浆。分别加入浓度为101~108CFU/mL的鼠伤寒沙门菌菌液,作为人工污染的样品。染菌样品采用优化条件的PMA处理后提取DNA,进行荧光定量PCR检测,并在构建的标准曲线上判读结果,得到各浓度染菌样品的拷贝数。同时将其与平皿计数法结果做比较。
八、统计学方法
采用SPSS 19.0软件进行统计分析,进行独立样品t检验、配对t检验和多重方差分析Tukey′s检验。以P<0.05为差异有统计学意义。
结果
一、PMA处理的优化结果
1. PMA作用的最小浓度电泳图谱显示未加入PMA的样品出现明亮条带,随着PMA浓度的增大,PCR后的电泳条带逐渐减弱。在PMA浓度为10.0~12.5 μg/mL 时,样品仍有微弱条带,说明PMA并没有完全抑制样品中DNA的扩增。当PMA浓度增加到15 μg/mL后,电泳条带消失,样品中死菌的DNA完全被抑制,不能进行扩增。因此,15 μg/mL PMA可作为抑制样品中DNA扩增的最小浓度。见图1。

注:1为Marker(100 bp);2~9为不同浓度PMA(25.0、20.0、17.5、15.0、12.5、10.0、7.5、5.0 μg/mL)处理后的样品;10为不加PMA的对照;11为阴性对照
图1不同浓度PMA对死亡细菌的影响
2. 不影响活菌扩增的PMA的最大浓度在初始阶段(0~25 μg/mL),PMA浓度的增大对活菌影响较小,Ct值为18.05~18.72,ΔCT<1。Tukey′s检验显示在PMA≤25 μg/mL的条件下,各PMA浓度间Ct值无明显差异(P>0.05),活菌DNA扩增几乎不受影响。当PMA浓度增大至40 μg/mL时,Ct值明显增大(P<0.05)。说明在PMA浓度达到40 μg/mL时对活菌有一定毒性,可抑制活菌DNA的扩增。见表4。
3. PMA光照时间的优化经650 W卤素灯照射1、3、5、7和10 min后,经PMA处理后的死菌样品均没有阳性条带,而没有加入PMA的死菌样品可见明显条带,说明曝光1 min以上已可对死菌DNA造成抑制作用。见图2。
表4不同PMA浓度作对活菌的影响

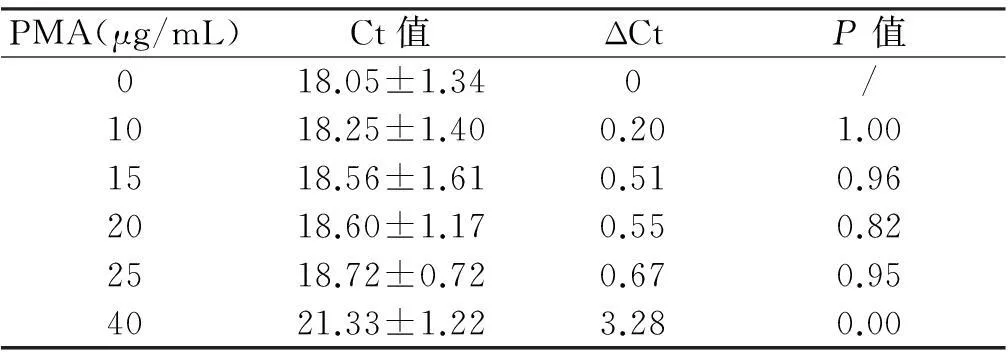
PMA(μg/mL)Ct值ΔCtP值018.05±1.340/1018.25±1.400.201.001518.56±1.610.510.962018.60±1.170.550.822518.72±0.720.670.954021.33±1.223.280.00
注:ΔCT=不同浓度PMA处理组的Ct值-0 μg/mL组的Ct值

注:1为 Marker(100 bp);2为未加PMA的死菌样品(对照);3~7为加PMA后经光反应1、3、5、7和10 min后的死菌样品
图2不同光照时间对经PMA处理的死菌样品的影响
4. PMA对与活/死菌的选择性当样品中全部是死菌时(活菌比例为0%),不经PMA处理的样品仍能测得Ct值(22.09±0.20),而经PMA处理的样品未测得荧光信号,说明样品中死菌的DNA完全被PMA抑制,不能进行扩增。当活菌比例为1%、10%、25%、50%时,经PMA处理的样品的CT值明显高于未经PMA处理的样品,即经PMA处理的样品中可扩增的DNA模板数量少于未经PMA处理的样品。PMA能明显抑制死菌DNA的扩增。当活菌比例达到100%时,未经PMA处理的样品的Ct值与经PMA处理样品的Ct值比较,差异无统计学意义(P>0.05)。说明经PMA处理后活菌DNA扩增未受影响。另外,活菌比例的上升趋势也与ΔCt值减小的趋势相对应。说明经PMA处理后,与不加PMA的对照组比较,PMA处理组的死菌DNA受PMA抑制而不能进行扩增,消除了因死菌DNA扩增造成的干扰,避免了假阳性的发生。见表5。

表5 不同活菌比例样品PMA-qPCR结果 值)
注:UD表示未测得;ΔCT=PMA处理组Ct均值-未经PMA处理组Ct均值
二、PMA-qPCR定量检测方法的建立
1. 质粒标准品的制备及标准曲线的建立将构建的重组质粒提取DNA得到沙门菌的质粒DNA。测序后,经BLAST比对Genbank中沙门菌invA基因序列符合率达100%。测得质粒DNA的浓度为78 ng/μL,根据公式得到质粒标准品的原始浓度为2.0×1010拷贝/μL。将重组质粒10倍梯度稀释,制成浓度范围为1×101~1×108拷贝/反应体系的标准品溶液。以质粒拷贝数的对数值为横坐标,Ct值为纵坐标建立标准曲线,见图3。从标准曲线可以看出重组质粒的拷贝数与Ct值之间存在对应线性关系,相关系数(r2)=0.997 9,斜率为-3.254 8,最低可以检出10拷贝/反应体系的沙门菌。
注:Y=-3.254 8X+43.006,R2=0.997 9
图3沙门菌qPCR标准曲线
2. PMA-qPCR的灵敏度将10倍稀释至100、10-1、10-2、10-3、10-4、10-5、10-6、10-7的菌液分别进行PMA-qPCR,经标准曲线判读得到定量结果,见表5(以标准品构建的标准曲线Y=-3.228 1X+43.107 9,r2=0.994 8)。PMA-qPCR最低可检出21拷贝/μL的沙门菌,见图4。
表6不同稀释比例菌液样品的PMA-qPCR结果
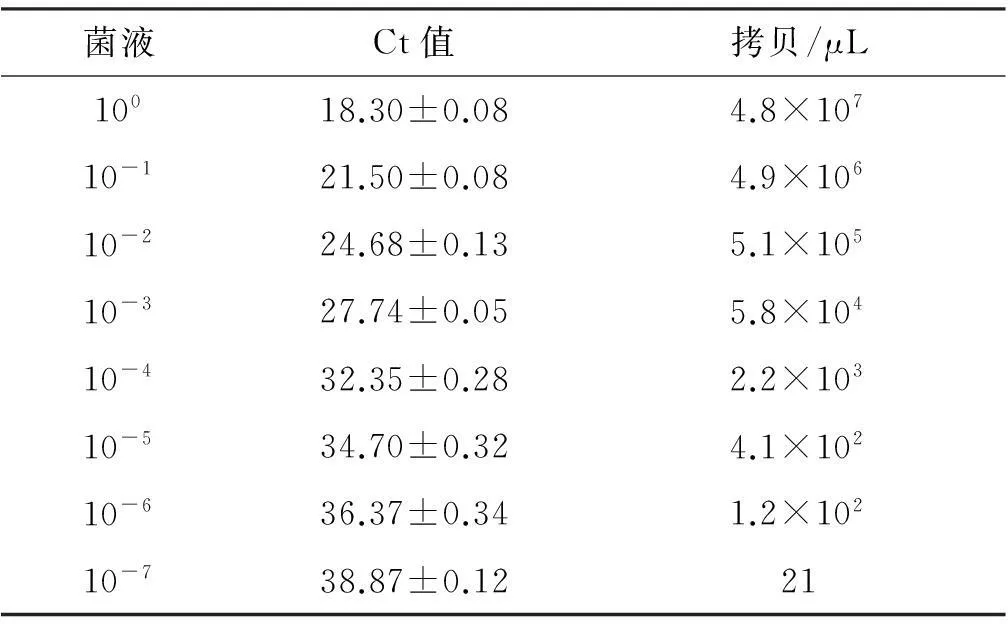
菌液Ct值拷贝/μL10018.30±0.084.8×10710-121.50±0.084.9×10610-224.68±0.135.1×10510-327.74±0.055.8×10410-432.35±0.282.2×10310-534.70±0.324.1×10210-636.37±0.341.2×10210-738.87±0.1221
3. PMA-qPCR的特异性鼠伤寒沙门菌和肠炎沙门菌的荧光扩增信号指数期明显,Ct值为15~25(17.91、21.06),而其他非沙门菌均未见有明显扩增,显示PMA-qPCR方法对沙门菌的检测特异性高。见图5。

注:1~8分别为4.8×107、4.9×106、5.1×105、5.8×104、2.2×103、4.1×102、1.2×102、21 拷贝/μL的菌液的扩增曲线
图4PMA-qPCR的灵敏度分析

图5 不同细菌PMA-qPCR的检测结果
三、人工染菌肉类样品的检测
对不同菌量人工染菌的鸡肉样品进行PMA-qPCR检测,并在质粒标准品所建立的标准曲线(Y=-3.148X+43.43,r2=0.995)上得到样品的拷贝数。当菌液浓度为101和102CFU/mL时均没有明显的扩增信号,记为“阴性”;当菌液浓度为103~108CFU/mL时可测得人工染菌样品的拷贝数。将PMA-qPCR与平皿计数法结果的对数值进行配对t检验,结果显示在103~108CFU/mL范围内两者结果差异无统计学意义(t=1.29,P>0.05)。

表7 人工染菌样品PMA-qPCR结果与平皿法计数比较
注:UD表示未测得
讨论
根据文献报道,PMA对细胞的作用效果与多种因素有关[8],包括细菌种属、PMA的曝光时间和浓度、样品的浊度[9]以及细胞的死亡方式等。本研究采用食品样品中较常用的高温灭菌方式处理死亡细菌[10],并选取了几个影响PMA作用的关键要素:曝光时间、PMA最适浓度等进行实验,研究PMA对沙门菌活/死菌的筛选作用。研究结果显示,当PMA浓度≥15 μg/mL时,PMA可完全抑制死菌的扩增;而当PMA>40 μg/mL时会对活菌产生毒性影响。综合考虑PMA对活菌和死菌的影响作用,选取15 μg/mL PMA作为筛选活菌和死菌的最适浓度,可避免样品中死菌DNA造成的假阳性干扰,同时也不影响活菌DNA的扩增。另外,在最佳曝光时间的选择实验中,PMA在光照1 min后即可抑制样品中死菌DNA的扩增,但考虑到本研究的实验对象为食物样品,其中常存在糖类、有机物质等微小可溶性颗粒物质,造成透光性不足,从而影响PMA与DNA的结合及反应,因此延长PMA光反应时间至5 min,同时也确保溶液中游离的PMA全部被钝化。通过将活菌和死菌的混合样品采用优化条件(PMA浓度为15 μg/mL、光照5 min)后的PMA进行处理,可排除样品中死菌DNA的扩增干扰,避免假阳性的发生,实现PMA对活/死菌的筛选作用。NOCKER等[5]的研究显示在采用50 μmol/L(25 μg/mL)PMA、光照2 min即可完全抑制DNA扩增,但其检测目标为纯菌。祝儒刚等[11]在PCR实验中推荐的PMA浓度只有4 μg/mL,远低于本研究的15 μg/mL,但其实验所需的光照时间较长(15 min)。另外,许多研究将50 μmol/L PMA作用、光反应5 min作为标准程序应用于食品中沙门菌的qPCR实验[12-13]。但由于qPCR对模板高度敏感,本研究中进一步讨论了可有效抑制死菌DNA扩增且对活菌qPCR不产生影响的最适浓度,最后确定15 μg/mL为PMA的作用浓度。
Taqman探针荧光定量PCR因其快速、灵敏的特点已成为食源性病原微生物检测和鉴定的重要手段。合适的靶基因是进行荧光定量PCR分析的重要前提。本研究选择invA基因作为检测沙门菌的特异性基因,invA基因是单拷贝基因,主要编码沙门菌侵袭蛋白A,与沙门菌的毒力密切相关,且与其他生物无同源关系[14],通过对invA基因进行qPCR检测可得到沙门菌基因组的定量数据。此外,qPCR实现对样品的准确定量需要稳定、可靠的标准品以及由其所建立的标准曲线。以克隆质粒作为标准品因其环状闭合结构相比基因组DNA更稳定,且容易保存,倍受研究者推崇。本研究成功构建了含有沙门菌invA基因特异性靶序列的重组质粒作为标准品,其Ct值和原始拷贝的对数值呈良好的线性关系,扩增斜率为-3.254 8,即扩增效率为102.88%,在可接受范围内(90%~105%),最低能检测10 拷贝/反应体系,说明所构建的沙门菌质粒可作为荧光定量PCR的标准品,且因其稳定性适合长期使用。本研究采用PMA-qPCR检测沙门菌纯菌样品,并在PMA的作用下消除了死菌DNA的扩增干扰,其灵敏度和特异性均良好,最低可检测到21 拷贝/μL。
为了评估PMA-qPCR对肉类样品的定量检测,本研究使用人工染菌的鸡肉样品作为模拟样品。通过在所建立的标准曲线上计算得到样品的拷贝数,并将结果与传统的平皿计数进行比较,两者在对数值水平的符合性较好,且PMA-qPCR检测人工染菌样品的最低浓度为103CFU/mL。
综上所述,应用PMA-qPCR可对肉类中活的沙门菌进行定量检测,避免了传统检测技术中假阳性和漏检的情况,实现真正意义上的定量检测,且操作简便、快速。通过对样品中活菌的准确估量可获得食品中沙门菌污染的实际数据,大大提高我国食源性致病菌监测和预警的能力,在食源性病原菌检测领域具有巨大的应用前景。
参考文献
[1]毛雪丹,胡俊峰,刘秀梅.2003-2007年中国1 060起细菌性食源性疾病流行病学特征分析[J].中国食品卫生杂志,2010,22(3):224-228.
[2]孙康德,李洁琼,陈福祥,等.食源性沙门菌感染的实验室诊断及鼠伤寒沙门菌同源性分析[J].检验医学,2012,27(11):913-916.
[3]田桢干,沈小明,方筠,等.实时荧光定量聚合酶链反应检测沙门菌(A~F群)方法的建立和应用[J].检验医学,2009,24(2):134-136.
[4]OLIVER JD. The viable but nonculturable state in bacteria[J].J Microbiol,2005, 43(1):93-100.
[5]NOCKER A,CHEUNG CY,CAMPER AK.Comparison of propidium monoazide with ethidium monoazide for differentiation of live vs. dead bacteria by selective removal of DNA from dead cells[J].J Microbiol Methods,2006,67(2):310-320.
[6]RAHN K,DE GRANDIS SA,CLARKE RC,et al.Amplification of aninvAgene sequence ofSalmonellatyphimuriumby polymerase chain reaction as a specific method of detection ofSalmonella[J].Mol Cell Probes,1992,6(4):271-279.
[7]贾俊涛,崔鹤,马云,等.应用Taqman荧光定量PCR快速检测宠物食品中的沙门氏菌[J].安徽农业科学,2012,52(30):14973-14975.
[8]FITTIPALDI M,NOCKER A,CODONY F.Progress in understanding preferential detection of live cells using viability dyes in combination with DNA amplification[J].J Microbiol Methods,2012,91(2):276-289.
[9]罗剑飞,林炜铁,郭勇.PMA与PCR结合的细菌活细胞检测方法[J].华南理工大学学报:自然科学版,2010,54(9):142-146.
[10]YANG X,BADONI M,GILL CO.Use of propidium monoazide and quantitative PCR for differentiation of viableEscherichiacolifromE.colikilled by mild or pasteurizing heat treatments[J].Food Microbiol,2011,28(8):1478-1482.
[11]祝儒刚,宋立峰.肉及肉制品中沙门氏菌活细胞的PCR检测研究[J].食品科学,2012,33(16):199-203.
[12]LI B,CHEN JQ. Development of a sensitive and specific qPCR assay in conjunction with propidium monoazide for enhanced detection of liveSalmonellaspp. in food[J]. BMC Microbiol,2013,13:273.
[13]LIANG N,DONG J,LUO L,et al.Detection of viableSalmonellain lettuce by propidium monoazide real-time PCR[J].J Food Sci,2011,76(4):M234-M237.
[14]黄冠军,刘天强,杨晓玲,等.沙门氏菌入侵基因研究进展[J].亚太传统医药,2013,9(11):65-67.
(本文编辑:范基农)

收稿日期:(2015-02-28)
中图分类号:
文章编号:1673-8640(2015)05-0500-07R378.2
文献标志码:ADOI:10.3969/j.issn.1673-8640.2015.05.021
通讯作者:王文静,联系电话:021-62758710-1336。
作者简介:於颖,女,1983年生,硕士,主管技师,主要从事食品微生物与分子生物学检测,现工作单位为上海市疾病预防控制中心。
基金项目:上海市卫生系统优秀学科带头人计划(新百人计划)资助项目(XBR2011051)
